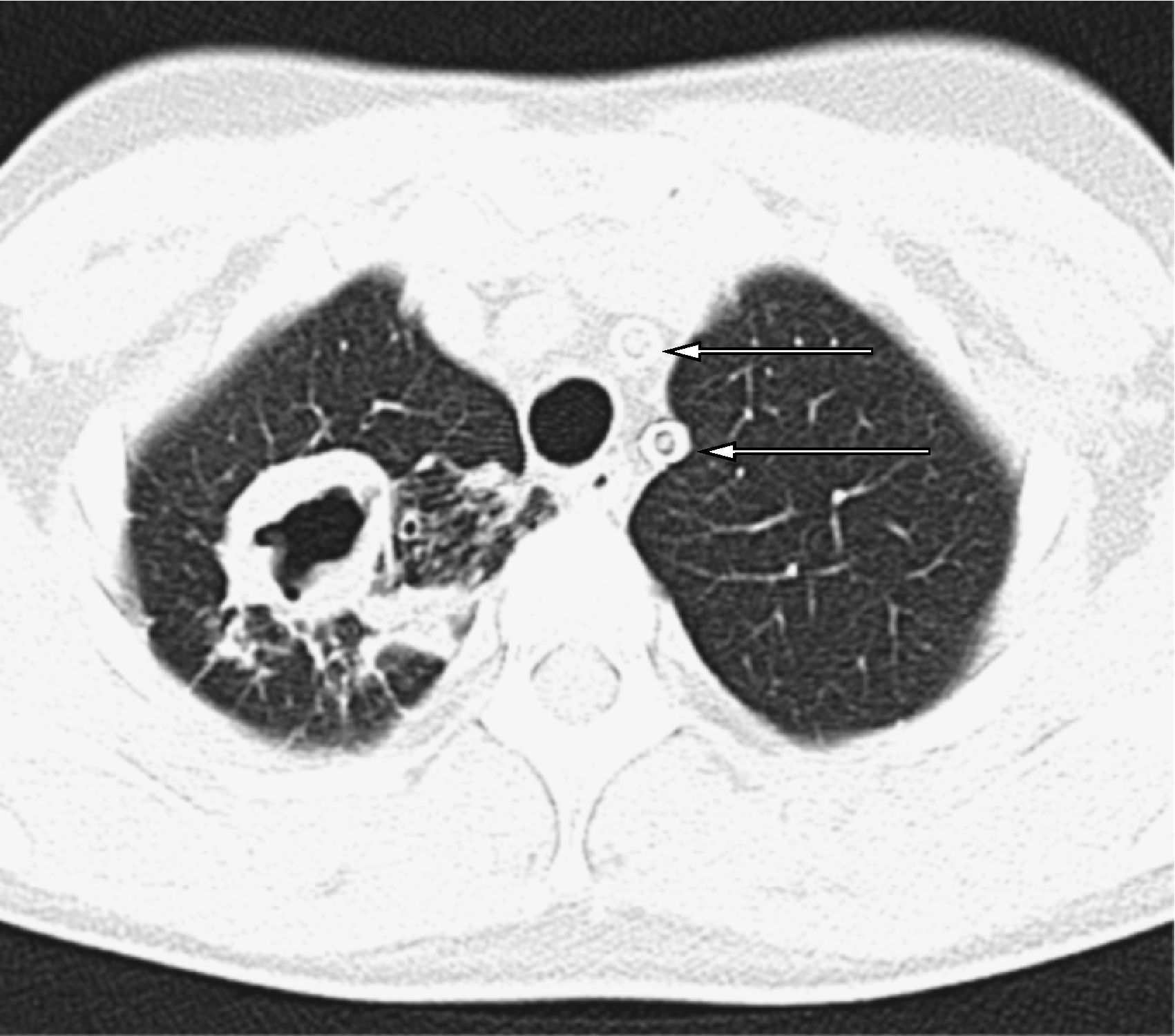
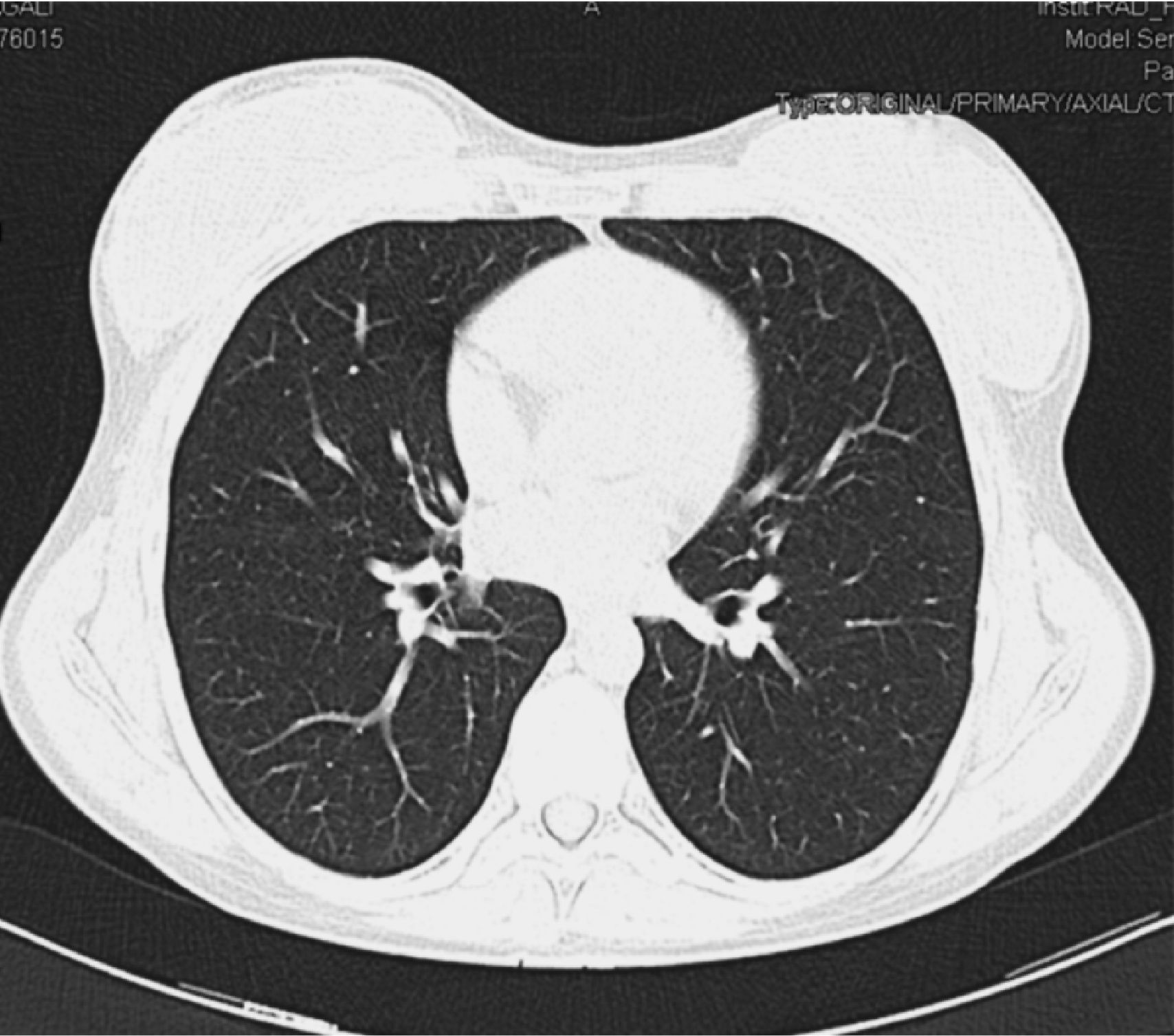
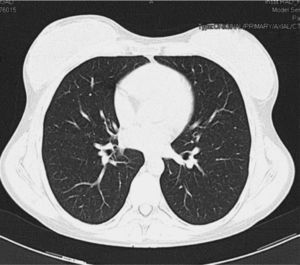
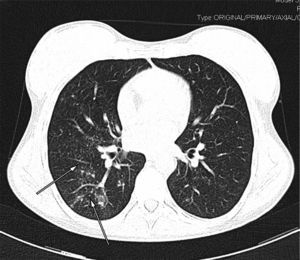
Mujer de 30 años natural de Brasil, fumadora de 8 cigarrillos/día, no bebedora, intervenida de prótesis bilateral de mama. Padecía enfermedad de Takayasu desde hacía 3 años con afectación de ambas carótidas comunes y subclavia izquierda que habían requerido la implantación de varias endoprótesis vasculares. Al inicio de la enfermedad la prueba de la tuberculina era negativa. La paciente comenzó tratamiento con prednisona y azatioprina (100mg/día), pero por persistencia de actividad de la enfermedad, y para disminuir el riesgo de nuevas estenosis arteriales, el tratamiento se cambió a infliximab 3mg/kg i.v. cada 8 semanas y metotrexato 15mg/semanal por vía oral. Cuando llevaba 14 meses con este tratamiento fue remitida a nuestro hospital para control médico de su embarazo (6 semanas). La paciente se encontraba asintomática y en la exploración física sólo se objetivaba un soplo sistólico sobre ambas carótidas. El hemograma era normal, la proteína C reactiva (PCR) de 6,7mg/l (normal<10 m/l) y la velocidad de sedimentación globular (VSG) de 38mm/primera hora. Se cambió el tratamiento a prednisona 15mg/24h en pauta descendente. A lo largo de los siguientes meses fue necesario incrementar de nuevo la dosis de prednisona en dos ocasiones hasta 60mg/día por malestar general, cefalea, mareo y aumento de PCR y VSG. No se realizó radiografía de tórax por ausencia de síntomas o signos respiratorios. El parto transcurrió sin incidencias, y se procedió a disminuir la dosis de prednisona hasta 10mg/día. Un mes después se realizó un control radiológico mediante angio-TC donde se observó una lesión cavitada con pared gruesa en el lóbulo superior derecho, tractos fibrosos que se dirigían hasta la pleura, bronquio de drenaje (fig. 1) y una lesión satélite. El resto del parénquima pulmonar era normal (fig. 2). La paciente refería haber perdido 4kg respecto a su peso habitual, pero no refería sensación febril, sudación ni sintomatología respiratoria. En la tinción de Ziehl-Neelsen se visualizaron abundantes bacilos ácido-alcohol resistentes. Con la sospecha de tuberculosis pulmonar posprimaria se prescribió tratamiento antituberculoso por vía oral con isoniazida 300mg/24h, rifampicina 600mg/24h, pirazinamida 1.500mg/24h y etambutol 900mg/24h.
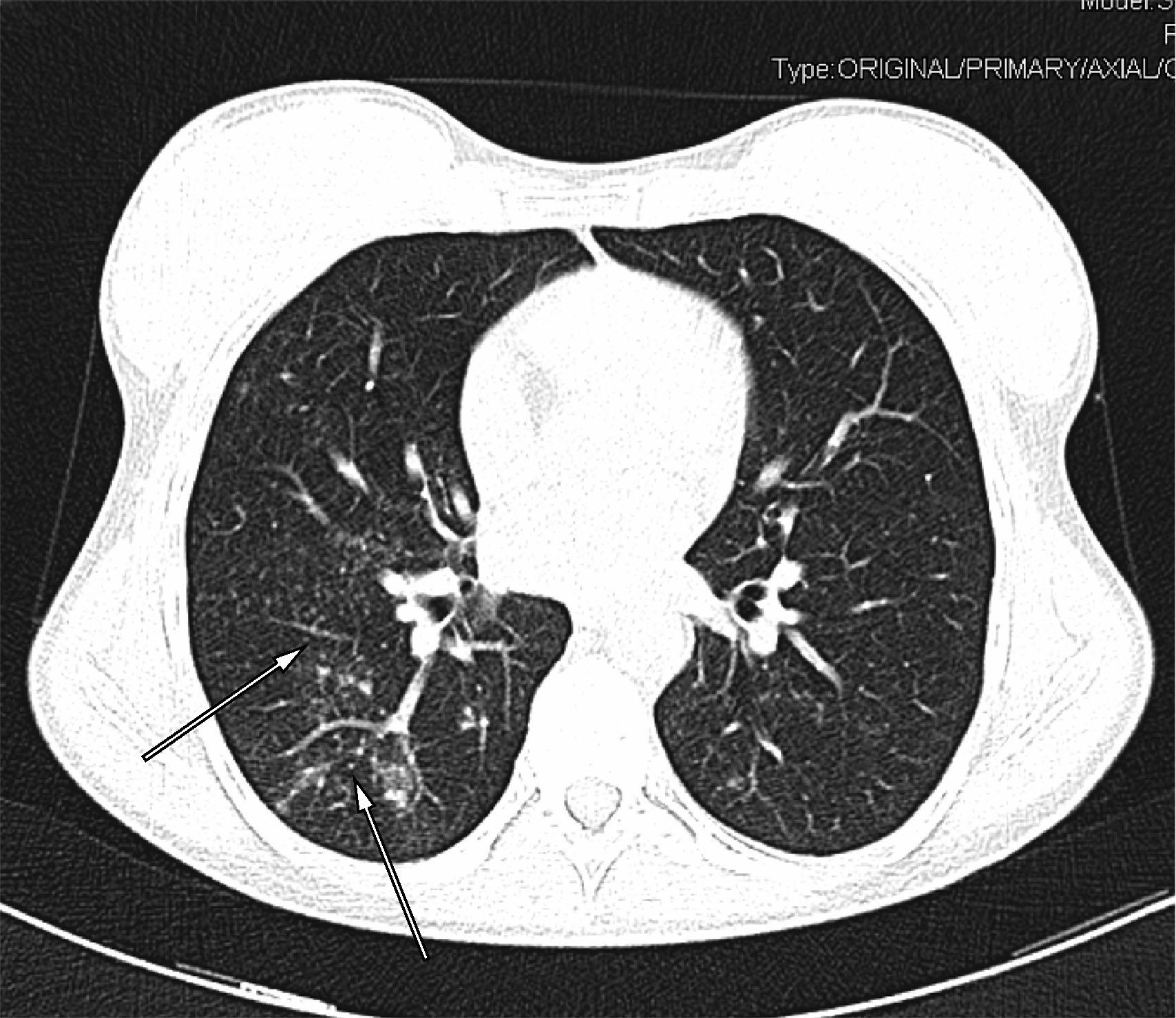
Cuatro semanas después de iniciar el tratamiento, apareció dolor infraescapular derecho continuo no pleurítico. Por dicho motivo se realizó una radiografía y TC de tórax que demostró múltiples nódulos centrolobulillares en los lóbulos superior derecho, inferior derecho e inferior izquierdo con patrón de árbol en brote que señalaban diseminación bronquial (fig. 3). La lesión cavitada presentaba unas características similares a la exploración previa. En el cultivo de esputo se aisló Mycobacterium avium complex tanto en los medios líquidos como en los tubos de Lowenstein-Jensen. La utilización de sondas comerciales para detectar secuencias especificas de ARNr confirmó que se trataba de Mycobacterium avium.
ComentarioLos inhibidores del factor de necrosis tumoral (TNF) han supuesto un avance muy importante en el tratamiento de las enfermedades de base autoinmunitaria1. Sin embargo, su utilización puede producir alteraciones en la formación y mantenimiento del granuloma, lo que condiciona un aumento del riesgo de infecciones por micobacterias1-3. Las micobacterias no tuberculosas (MNTB), entre las que se incluye Mycobacterium avium, se caracterizan porque se adquieren en el entorno ambiental y por su escasa virulencia4,5. El pulmón es el órgano más frecuentemente afectado6. En pacientes inmunodeficientes presentan una tendencia acusada a producir formas extrapulmonares, aunque su mortalidad global suele ser inferior al 10%2,3. En una serie de infecciones por MNTB en pacientes tratados con agente anti-TNF, el tiempo medio transcurrido entre el inicio del tratamiento y el diagnóstico fue de 43 semanas2. Esto señala que algunas de estas infecciones podrían deberse a infección primaria y no a reactivación de una infección latente2,7. La ausencia de sintomatología respiratoria y no haber realizado radiografía de tórax durante el embarazo impidieron determinar el tiempo de evolución de la enfermedad.
La afectación pulmonar por MNTB se caracteriza radiológicamente por la presencia de infiltrados, cavernas, bronquiectasias y nódulos centrolobulillares, que pueden adoptar una morfología de árbol en brote6, a veces con una rápida progresión7,8. Nuestra paciente presentó un empeoramiento secundario a diseminación broncógena que pudo tener relación con un tratamiento empírico inadecuado, que no incluía macrólidos9. No obstante, y habida cuenta del tiempo transcurrido entre la suspensión del agente anti-TNF y el diagnóstico de la infección, no se puede descartar que se haya producido un síndrome de reconstitución inmuno-like tras la suspensión de infliximab7.
A diferencia de lo que ocurre con la tuberculosis, no se dispone de ninguna prueba de cribado eficaz de la infección latente de MNTB, ni está indicada la realización sistemática de cultivos de esputo ni de exploraciones radiológicas encaminadas a detectar a los pacientes en riesgo2. Un resultado negativo de la técnica de reacción en cadena de la polimerasa para Mycobacterium tuberculosis complex en esputo podría haber permitido sospechar la infección por MNTB más precozmente10.
Como conclusión, se debe destacar que, en pacientes tratados con agentes anti-TNF que presenten un cuadro clínico y radiológico compatible, se debería considerar la existencia de una infección por MNTB que permitiera iniciar un tratamiento empírico correcto11.