Durante el año 2009 se produjo un brote de infecciones por Acinetobacter baumannii multirresistente (A. baumannii MR) en una unidad de cuidados intensivos, resultando 25 pacientes infectados.
MétodosSe realizó un estudio caso-control apareado para identificar los factores de riesgo de infección. Se estimó la presión de colonización o proporción de pacientes colonizados por A. baumannii MR. Se calcularon las puntuaciones TISS-28 y Omega en cada paciente para evaluar las necesidades de trabajo de enfermería. Se utilizaron análisis de regresión logística condicional.
ResultadosSe observaron fallos en el lavado de manos y en el uso de guantes. Los pacientes infectados presentaron mayor exposición a procedimientos invasivos y tratamiento antimicrobiano que sus controles apareados. El análisis multivariante identificó como factores de riesgo independientes: ser sometido a ventilación mecánica (odds ratio[OR]=1,03; intervalo de confianza [IC] 95%, 1,01-1,05; p=0,01) y la exposición a otro paciente infectado o colonizado (OR=1,7; IC95%, 1,1-2,6; p=0,02). Se realizó un seguimiento estricto de las precauciones de aislamiento, del agrupamiento de los pacientes, del reforzamiento de la limpieza y de la desinfección de superficies y la disminución de las cargas de trabajo. Como consecuencia, se produjo una disminución en la incidencia de infecciones por A. baumannii MR. Las puntuaciones de actividad terapéutica fueron superiores en los casos que en los controles.
ConclusiónLos resultados sugieren la transmisión de A. baumannii MR de paciente a paciente. El fortalecimiento de los procedimientos específicos de control y el ajuste de las cargas de trabajo fueron esenciales para erradicar este brote.
During 2009, an outbreak of multidrug-resistant Acinetobacter baumannii (MDR A. baumannii) infections was detected in a 27-bed intensive care unit, resulting in 25 cases being infected.
MethodsA matched case-control study was conducted to identify risk factors for infection. The colonization pressure, or the proportion of other patients colonized by MDR A. baumannii, was estimated. TISS-28 and Omega scores of each patient were calculated to evaluate nursing work requirements. Conditional logistic regression analyses were carried out.
ResultsBreakdowns in hand washing and glove use were observed. Infected patients (cases) were more likely than paired controls to have had longer exposure to invasive devices and antimicrobial treatment. The independent risk factors identified by the multivariate analysis were, mechanical ventilation [odds ratio (OR)=1.03; 95% confidence interval (CI), 1.01-1.05; P=.01], and exposure to an infected or colonized patient [OR=1.7; 95%CI, 1.1-2.6; P=.02). A combined infection control strategy was implemented, including strict compliance with isolation precautions, grouping of patients, reinforcing cleaning and disinfection of surfaces, and a decrease in work load. Subsequently, a sharp reduction in the incidence MDR A. baumannii infections was shown. Therapeutic activity scores were significantly higher for cases than for controls.
ConclusionThe results suggest patient-to-patient transmission of MDR A. baumannii. Reinforcement of specific procedures and work load adjustment were essential to eradicate this outbreak.
Acinetobacter baumannii multirresistente (A. baumannii MR) es un microorganismo importante relacionado con brotes epidémicos de infecciones nosocomiales en unidades de cuidados intensivos (UCI) debido a su capacidad de transmisión y los problemas que genera para su control. Estos brotes se han asociado a contaminación de las superficies ambientales, de los equipos y de los pacientes o del personal sanitario1.
Cuando un brote no tiene un único foco como origen la presión de colonización, es decir, la proporción de pacientes ya colonizados o infectados por A. baumannii MR, puede aumentar la probabilidad de transmisiones cruzadas entre pacientes2-4. Las estrategias para el control de los brotes de A. baumannii MR incluyen cribado de pacientes y/o personal, precauciones de aislamiento de contacto, agrupamiento de pacientes, disminución de las cargas de trabajo, cierre temporal de la unidad a nuevos ingresos y uso racional de antimicrobianos2,5-9.
En los meses de mayo a junio de 2009, 3 pacientes ingresados en la UCI del Hospital Universitario de La Ribera (Alzira, Valencia, España) fueron diagnosticados con una infección nosocomial por A. baumannii MR. En los siguientes 6 meses se detectaron casos adicionales, resultando finalmente 25 pacientes afectados.
Realizamos una investigación epidemiológica para verificar nuestra hipótesis inicial principal (la relación entre las infecciones nosocomiales por A. baumannii MR y la presión de colonización) y para identificar otros factores de riesgo que nos sirvieran para evitar otros brotes potenciales.
Material y métodoLocalizaciónEl Hospital Universitario de La Ribera es un hospital de referencia con 302 camas, 27 de las cuales están localizadas en la UCI. En 2009 se produjeron 1.547 ingresos en la UCI. La razón habitual de enfermeras/pacientes y auxiliares de enfermería/pacientes es de 1/3 a 4 pacientes por turno y de 1/6 a 8 pacientes por turno, respectivamente.
DefinicionesSe siguieron los criterios de los Centers for Disease Control and Prevention para la definición de las infecciones nosocomiales10,11. Se definió como caso a todo paciente con infección nosocomial por A. baumannii MR detectada desde el 21 de mayo hasta el 31 de octubre de 2009 tras estar ingresado 72h en la UCI o tras menos de 72h de haber sido dado de alta de la UCI. Se definió colonización por A. baumannii MR como la detección de este microorganismo en cualquier localización pero sin estar asociada a signos clínicos o síntomas de infección.
Investigación epidemiológicaEl epidemiólogo del hospital detectó los casos a partir de la historia clínica, los datos microbiológicos y las bases de datos de la unidad de control de infecciones.
Se realizó un estudio caso-control apareado con todos los pacientes intubados durante más de 48h durante el periodo de estudio. Los controles se seleccionaron a partir de los pacientes ingresados en la UCI que fueran sometidos a más de 48h de ventilación mecánica y no desarrollaran infección o colonización por A. baumannii MR durante el periodo de duración del brote epidémico. Se seleccionaron 2 controles por cada caso, utilizando como criterio de apareamiento haber coincidido ingresados en la UCI al menos los 5 días previos a la primera infección de cada caso producida por A. baumannii MR.
Las variables estudiadas fueron: edad, sexo, enfermedades de base, procedimientos quirúrgicos, fecha de ingreso, fecha de alta, duración de la ventilación mecánica, broncoscopia, traqueostomía, dispositivos invasivos, fecha de diagnóstico y localización de la infección por A. baumannii MR, colonización por A. baumannii MR, número de antimicrobianos recibidos, días de tratamiento antimicrobiano, datos microbiológicos y resultado de la infección. Se calculó la puntuación Acute Physiology and Chronic Health Evaluation II (APACHEII) en cada paciente12.
Dos enfermeras evaluaron las cargas de trabajo de enfermería que supuso cada paciente diariamente mediante la utilización de las escalas TISS-28 y Omega. Estas puntuaciones reflejan los cuidados que requiere cada paciente durante su estancia en la UCI mediante la suma de las intervenciones médicas y de enfermería13,14. Nuestro trabajo se basó en la comparación diaria de la actividad terapéutica de los casos frente a los controles durante su estancia en la UCI.
Se calculó la prevalencia media diaria de pacientes con infección o colonización por A. baumannii MR y se resumió semanalmente. Esta prevalencia refleja la presión de colonización por A. baumannii MR durante el periodo de ingreso en la UCI en el que el paciente no estaba infectado.
Métodos microbiológicosLa identificación y susceptibilidad de A. baumannii se hizo siguiendo los procedimientos estándar15. Se consideró A. baumannii MR si presentó resistencia frente a más de 3 de los siguientes: cefalosporinas de espectro extendido, combinaciones de beta-lactámicos/inhibidores de beta-lactamasas, carbapenems, aminoglucósidos o fluoroquinolonas.
Análisis estadísticoSe utilizó el test de McNemar's para comparar variables categóricas entre casos y controles, y el test de los rangos de Wilcoxon para la comparación de variables continuas. Se calcularon odds ratios (OR) apareadas para estimar la magnitud de la asociación entre cada exposición y resultados utilizando análisis de regresión logística condicional. Se utilizaron tests de desviación de tendencia lineal para decidir si el efecto lineal o categórico fue más apropiado. Todos los test de significación se plantearon de forma bilateral y el nivel de significación estadística se estableció cuando el valor de p fue inferior a 0,05. El análisis estadístico se realizó con STATA sofware version 9.0 (Stata, College Station, Texas, EE.UU.).
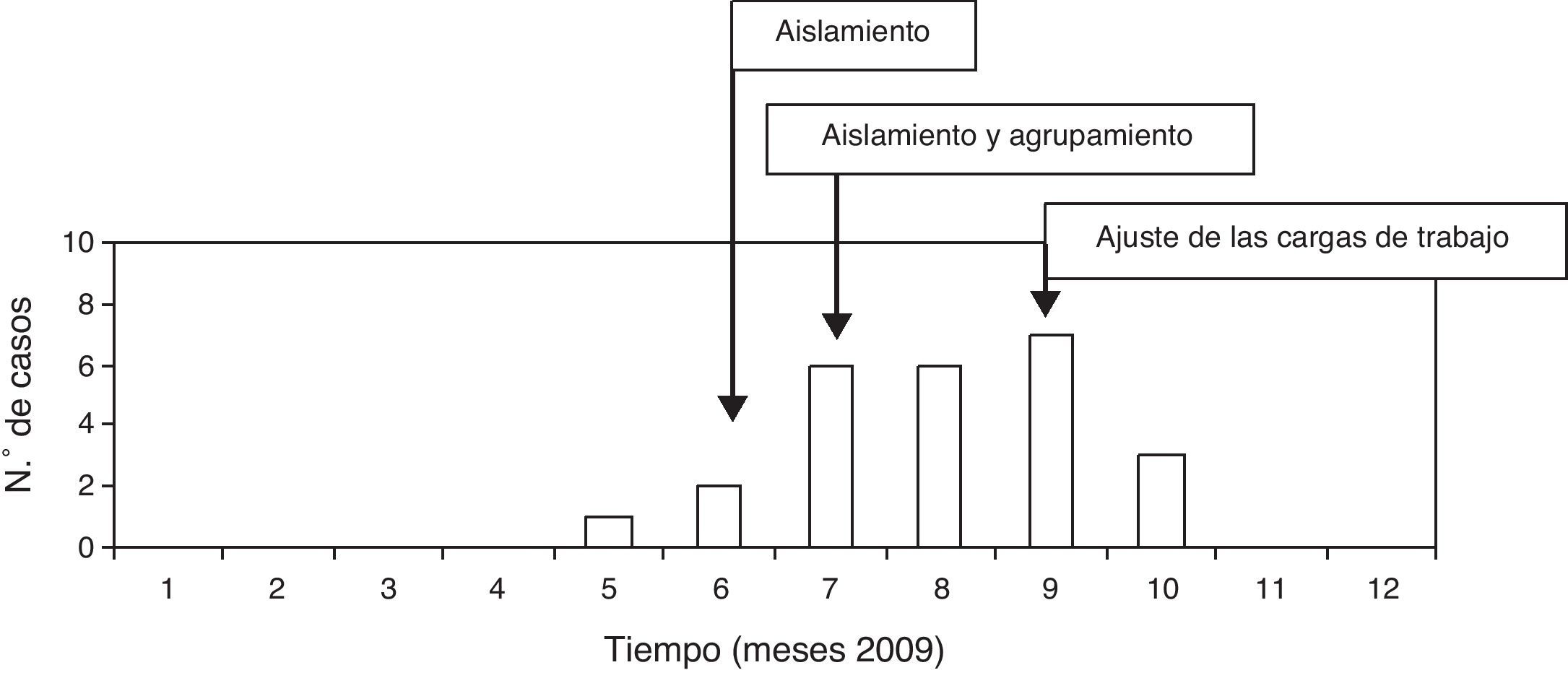
ResultadosCaracterísticas del broteDesde enero del 2009 hasta mayo del mismo año, la incidencia de infecciones nosocomiales por A. baumannii MR en la UCI fue 1,5 por 100 pacientes por mes. Desde el 1 de junio hasta octubre de 2009, la incidencia aumentó hasta 5,5 por 100 pacientes por mes, con un total de 25 pacientes afectados con infecciones nosocomiales por A. baumannii MR. La incidencia de infecciones nosocomiales por A. baumannii MR en ese momento fue significativamente mayor que la observada en los primeros 6 meses del año. Por tanto, se constató la detección de un brote epidémico y se inició su investigación.
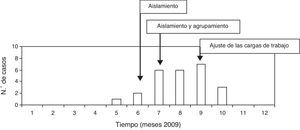
El 21 de mayo se recomendó el establecimiento de precauciones de aislamiento de contacto para evitar infecciones cruzadas y se realizaron cultivos de vigilancia a los pacientes. Desde el 6 de julio hasta el 29 de octubre, los pacientes infectados o colonizados se agruparon en un área de la UCI. A partir del 21 de septiembre, como la razón enfermería/pacientes podía afectar negativamente los resultados del brote, se reforzó la UCI con una enfermera, 2 auxiliares de enfermería y un celador por turno. Así, las razones cambiaron a una enfermera por 2-3 pacientes por turno y un auxiliar de enfermería por 4-5 pacientes por turno (fig. 1).
La limpieza rutinaria de superficies (suelos, repisas, etc.) se realizó con detergente sanitario aniónico y agua caliente, y la desinfección, con lejía a una concentración de 1.000ppm con una frecuencia de 2 veces al día. Con la ayuda del auxiliar de enfermería de refuerzo, se realizó desinfección de las superficies del entorno del paciente (superficies de monitores, carros de curas, barandillas de las camas y otros equipos en contacto directo con el entorno del paciente) y del control de enfermería con alcohol de 70° 2 veces al día y siempre que el paciente se trasladaba. Se hizo más hincapié en las habitaciones donde había un paciente colonizado o infectado por A. baumannii y tras procedimientos invasivos que pudiesen producir dispersión de secreciones o fluidos que pudieran contaminar el entorno del paciente. Adicionalmente, tras el traslado o el fallecimiento de un paciente infectado o colonizado, el personal de mantenimiento limpió las áreas inaccesibles a la limpieza habitual, como rejillas de conductos de ventilación, cortinas y paredes.
En total, se produjeron 44 infecciones por A. baumannii MR en los 25 casos, incluyendo infecciones del tracto respiratorio (15 neumonías y 12 traqueobronquitis), bacteriemias relacionadas con catéter venoso central (5 episodios), de úlceras por presión (6 episodios) y de heridas quirúrgicas (6 episodios). Todas las infecciones por A. baumannii MR fueron solo susceptibles a tigeciclina y colistina. De los 25 pacientes infectados por A. baumannii MR, 12 presentaron durante algún periodo de su ingreso en la UCI colonización por el mismo microorganismo. El tiempo medio entre el ingreso en la UCI y la primera infección nosocomial por A. baumannii MR fue de 18 días, con un rango de 5 a 60 días.
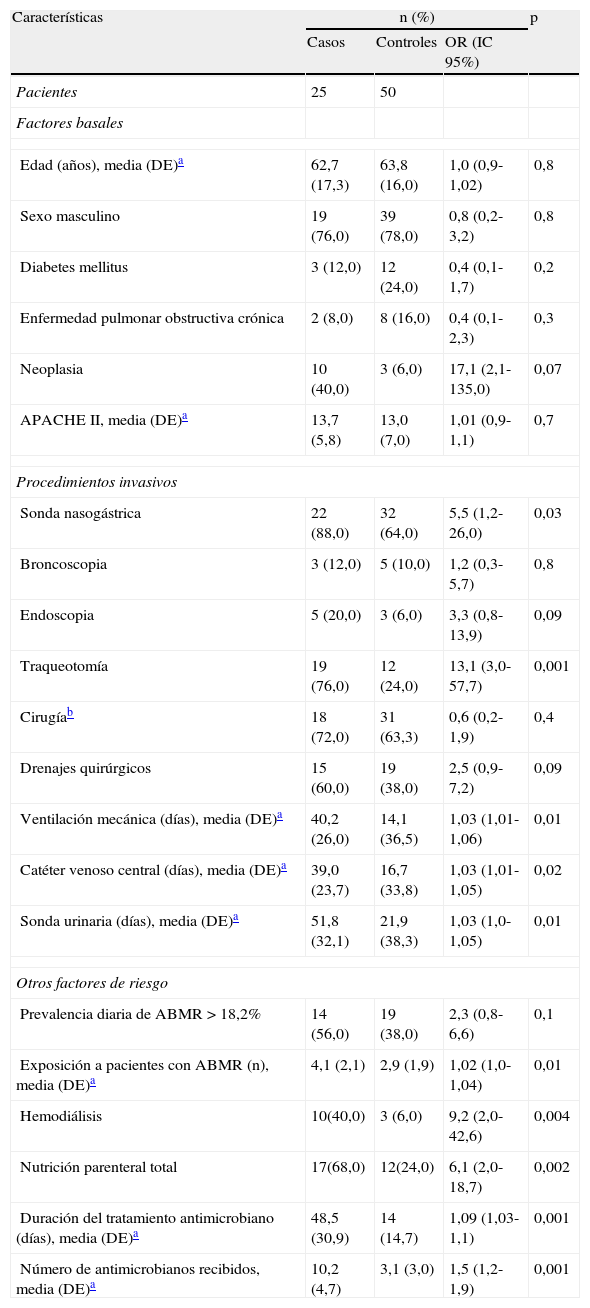
Factores de riesgo asociados a la infección por A. baumannii multirresistenteEn el análisis descriptivo, los casos presentaron mayor probabilidad de recibir procedimientos invasivos, antimicrobianos (p=0,001) y de estar más tiempo ingresados en la UCI (p=0,02) que los controles.
Los casos estuvieron expuestos a una media de 4,1 (DE: 2,1) pacientes con infección o colonización por A. baumannii MR. En cambio, los controles contactaron con una media de 2,9 (DE: 1,9) pacientes portadores de A. baumannii MR (p=0,01) (tabla 1).
Factores asociados a la infección por Acinetobacter baumannii multirresistente
| Características | n (%) | p | ||
| Casos | Controles | OR (IC 95%) | ||
| Pacientes | 25 | 50 | ||
| Factores basales | ||||
| Edad (años), media (DE)a | 62,7 (17,3) | 63,8 (16,0) | 1,0 (0,9-1,02) | 0,8 |
| Sexo masculino | 19 (76,0) | 39 (78,0) | 0,8 (0,2-3,2) | 0,8 |
| Diabetes mellitus | 3 (12,0) | 12 (24,0) | 0,4 (0,1-1,7) | 0,2 |
| Enfermedad pulmonar obstructiva crónica | 2 (8,0) | 8 (16,0) | 0,4 (0,1-2,3) | 0,3 |
| Neoplasia | 10 (40,0) | 3 (6,0) | 17,1 (2,1-135,0) | 0,07 |
| APACHEII, media (DE)a | 13,7 (5,8) | 13,0 (7,0) | 1,01 (0,9-1,1) | 0,7 |
| Procedimientos invasivos | ||||
| Sonda nasogástrica | 22 (88,0) | 32 (64,0) | 5,5 (1,2-26,0) | 0,03 |
| Broncoscopia | 3 (12,0) | 5 (10,0) | 1,2 (0,3-5,7) | 0,8 |
| Endoscopia | 5 (20,0) | 3 (6,0) | 3,3 (0,8-13,9) | 0,09 |
| Traqueotomía | 19 (76,0) | 12 (24,0) | 13,1 (3,0-57,7) | 0,001 |
| Cirugíab | 18 (72,0) | 31 (63,3) | 0,6 (0,2-1,9) | 0,4 |
| Drenajes quirúrgicos | 15 (60,0) | 19 (38,0) | 2,5 (0,9-7,2) | 0,09 |
| Ventilación mecánica (días), media (DE)a | 40,2 (26,0) | 14,1 (36,5) | 1,03 (1,01-1,06) | 0,01 |
| Catéter venoso central (días), media (DE)a | 39,0 (23,7) | 16,7 (33,8) | 1,03 (1,01-1,05) | 0,02 |
| Sonda urinaria (días), media (DE)a | 51,8 (32,1) | 21,9 (38,3) | 1,03 (1,0-1,05) | 0,01 |
| Otros factores de riesgo | ||||
| Prevalencia diaria de ABMR>18,2% | 14 (56,0) | 19 (38,0) | 2,3 (0,8-6,6) | 0,1 |
| Exposición a pacientes con ABMR (n), media (DE)a | 4,1 (2,1) | 2,9 (1,9) | 1,02 (1,0-1,04) | 0,01 |
| Hemodiálisis | 10(40,0) | 3 (6,0) | 9,2 (2,0-42,6) | 0,004 |
| Nutrición parenteral total | 17(68,0) | 12(24,0) | 6,1 (2,0-18,7) | 0,002 |
| Duración del tratamiento antimicrobiano (días), media (DE)a | 48,5 (30,9) | 14 (14,7) | 1,09 (1,03-1,1) | 0,001 |
| Número de antimicrobianos recibidos, media (DE)a | 10,2 (4,7) | 3,1 (3,0) | 1,5 (1,2-1,9) | 0,001 |
ABMR: Acinetobacter baumannii multirresistente; APACHE: Acute Physiologic and Chronic Health Evaluation; DE: desviacion estándar; IC: intervalo de confianza; OR: odds ratio apareada y no ajustada.
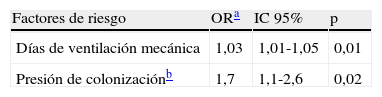
Mediante regresión logística condicional, los únicos factores de riesgo independientes para el desarrollo de la infección por A. baumannii MR fueron la ventilación mecánica (OR=1,03; IC95%, 1,01-1,05; p=0,01) y la exposición a pacientes ya infectados o colonizados por A. baumannii MR (OR=1,7; IC95%, 1,1-2,6; p=0,02) (tabla 2).
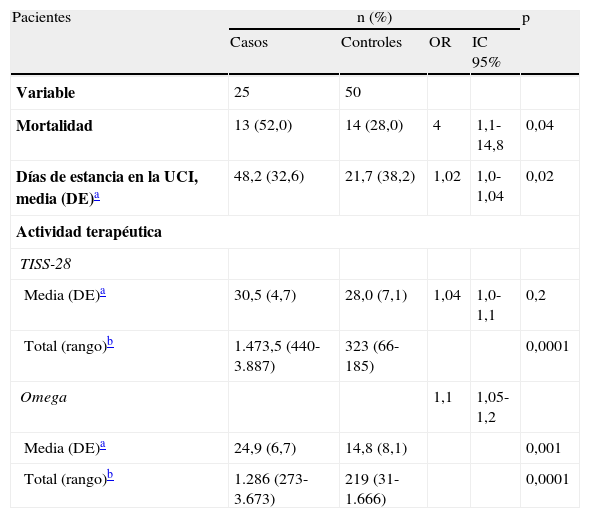
El cálculo de las escalas de actividad terapéutica mostró que la puntuación total TISS-28 y Omega fue muy superior para los casos en comparación con los controles. La puntuación media TISS-28 fue 30,5 para los casos y 28,0 para los controles (p=0,2) y la puntuación media de la escala Omega fue de 24,9 versus 14,8, respectivamente (p=0,001) (tabla 3).
Evolución y escalas de actividad terapéutica de los pacientes
| Pacientes | n (%) | p | |||
| Casos | Controles | OR | IC 95% | ||
| Variable | 25 | 50 | |||
| Mortalidad | 13 (52,0) | 14 (28,0) | 4 | 1,1-14,8 | 0,04 |
| Días de estancia en la UCI, media (DE)a | 48,2 (32,6) | 21,7 (38,2) | 1,02 | 1,0-1,04 | 0,02 |
| Actividad terapéutica | |||||
| TISS-28 | |||||
| Media (DE)a | 30,5 (4,7) | 28,0 (7,1) | 1,04 | 1,0-1,1 | 0,2 |
| Total (rango)b | 1.473,5 (440-3.887) | 323 (66-185) | 0,0001 | ||
| Omega | 1,1 | 1,05-1,2 | |||
| Media (DE)a | 24,9 (6,7) | 14,8 (8,1) | 0,001 | ||
| Total (rango)b | 1.286 (273-3.673) | 219 (31-1.666) | 0,0001 | ||
DE: desviación estándar; IC: intervalo de confianza; OR: odds ratio apareada; UCI: unidad de cuidados intensivos.
El brote afectó a pacientes sometidos a ventilación mecánica, los cuales desarrollaron infecciones respiratorias de forma predominante. Sin embargo, no se observaron fallos importantes durante el manejo de los equipos de ventilación. A veces sí se observaron fallos en el mantenimiento de las precauciones de aislamiento: lavado de manos y uso adecuado de guantes. Por ello, se reforzaron las medidas de aislamiento de contacto de los pacientes portadores de A. baumannii MR mediante un programa específico. Se realizaron mejoras en la limpieza y en la desinfección de las superficies horizontales del entorno de los pacientes y control de enfermería y se redujo la carga de trabajo de enfermería. A partir de entonces, la incidencia de infecciones nosocomiales por A. baumannii MR disminuyó hasta 1,5 por 100 pacientes por mes, y posteriormente no se detectaron más pacientes con infección o colonización por A. baumannii MR.
Estancias y letalidadLa estancia media en la UCI para los casos fue de 40 días, mientras que en los controles fue de 10 días (p<0,0001).
La mortalidad fue elevada: el 52% de los casos murieron, frente al 28% de los controles. Cuatro de los 25 murieron debido a la infección nosocomial por A. baumannii MR, representando una letalidad del 16%. El riesgo de muerte fue casi 3 veces superior en los casos respecto a los controles (OR=2,8; IC95%, 1,02-7,5; p=0,04).
DiscusiónEste estudio muestra el impacto de la presión de colonización y la ventilación mecánica en la adquisición de infecciones nosocomiales por A. baumannii MR, ambos factores ya conocidos. Sin embargo, demuestra la importancia que tiene el ajuste de las cargas de trabajo para mejorar el efecto combinado de todas las medidas adoptadas para controlar el brote, especialmente el refuerzo en los procedimientos estándar para controlar las infecciones y el énfasis en la limpieza y en la desinfección de superficies. Hay que recalcar que la UCI no se cerró temporalmente a nuevos ingresos.
La media de la escala APACHEII fue similar para casos y controles, probablemente porque se registró durante las primeras 24h del ingreso. Sin embargo, los procedimientos invasivos que suelen estar asociados a puntuaciones APACHEII elevadas podrían reflejar de forma más exacta el riesgo de infección. De hecho, en el análisis multivariante se observó que el riesgo de adquirir una infección nosocomial por A. baumannii MR aumentó cada día que los pacientes requirieron ventilación mecánica.
Los casos recibieron más antimicrobianos que sus controles apareados. Sin embargo, no se observaron diferencias en la duración del tratamiento antimicrobiano recibido en los días previos a la infección por A. baumannii MR.
Otro factor de riesgo importante fue la presión de colonización. Se eligió una prevalencia del 18% como punto de corte debido a que, en la práctica diaria, las dificultades en el manejo de estos pacientes aparecen cuando el número de pacientes con infección por A. baumannii MR es de 4. Esta situación nos fuerza a agrupar los pacientes fuera de las habitaciones de aislamiento, y entonces el riesgo de transmisiones cruzadas puede aumentar. Este estudio caso-control muestra que el riesgo de adquirir una infección por A. baumannii MR aumentó con cada día que los pacientes se expusieron a otro paciente infectado o colonizado por A. baumannii MR. Bonten et al.3, en un trabajo sobre la presión de colonización por Enterococcus resistente a la vancomicina, también observaron que era un factor de riesgo importante para el desarrollo de infección.
D’Agata et al.2 estudiaron un brote de infecciones por A. baumannii MR que afectó a 18 pacientes y observaron que el único factor de riesgo asociado al desarrollo de infección nosocomial por A. baumannii MR fue la prevalencia de pacientes con infecciones por A. baumannii MR. Playford et al.4 también mostraron que la prevalencia de pacientes colonizados es un factor determinante para la adquisición de infecciones por A. baumannii resistente a carbapenems.
En nuestro trabajo, la presión de colonización disminuyó cuando se logró la disminución de las cargas de trabajo. Una de las principales formas de transmisión de este microorganismo es a través de las manos del personal sanitario, y es la que de forma más plausible explica estos resultados. La razón enfermera/paciente en la mayor parte de UCI es de una enfermera por 2 pacientes. Sin embargo, en nuestro centro era muy superior, por lo que se ajustaron unas cargas de trabajo que eran de por sí mucho más altas que las recomendadas en las UCI, hecho que explica la importancia de las medidas adoptadas.
De forma semejante, varios autores han comprobado que la falta de personal en una UCI es fundamental para que un paciente colonizado o infectado pueda causar problemas debido al contacto entre pacientes y trabajadores sanitarios5,14. La identificación de la ventilación mecánica como factor de riesgo de infección nosocomial y el control del brote tras la reducción de las cargas de trabajo infiere que, en nuestra unidad, debe tenerse en cuenta la actividad terapéutica. El nivel de actividad terapéutica objetivado diariamente con las escalas TISS-28 y Omega presentó puntuaciones totales mayores en el grupo de los casos con respecto a sus controles apareados. Sin embargo, la comparación de las medias solo presentó diferencias estadísticamente significativas entre ambos grupos con la escala Omega. Esta diferencia es probablemente consecuencia de las características de cada escala de puntuación. La escala Omega da gran importancia al trabajo relacionado con las precauciones de aislamiento, mientras que la escala TISS-28 no tiene en cuenta esta actividad asistencial.
Con respecto al impacto de la infección nosocomial por A. baumannii MR, observamos un aumento de la mortalidad, de las estancias en la UCI, del consumo de antimicrobianos y de la actividad terapéutica. Valencia et al.16, en un brote que afectó a 12 pacientes en otro hospital de nuestro país, observaron resultados similares pero no analizaron las cargas de trabajo.
En un área como la de una UCI, donde a veces se observan prevalencias elevadas de infecciones o colonizaciones por A. baumannii MR, un error puntual, difícil de reconocer, puede ser suficiente para que este microorganismo se transmita de paciente a paciente. Los fallos observados en las rutinas de control de infección, la asociación entre los pacientes infectados y la exposición a otros pacientes ya colonizados o infectados y la asociación entre la infección y el número de días sometidos a ventilación mecánica son factores que refuerzan la hipótesis de la transmisión durante la aplicación de cuidados o tratamientos. Las importantes diferencias observadas en las escalas de actividad terapéutica entre casos y controles y la erradicación del brote tras la reducción de las cargas de trabajo reafirma esta hipótesis. En UCI en las que se han observado infecciones por A. baumannii MR transmitidas entre pacientes, la falta de lavado de manos y de cambio de guantes entre un paciente y otro son fallos detectados frecuentemente1.
Consideramos que nuestro trabajo puede tener las siguientes limitaciones. No se realizaron muestras ambientales ni se buscó personal sanitario colonizado. Solo se realizaron cultivos de vigilancia a los pacientes, aunque, pese a que está claro que la contaminación ambiental podría haber contribuido como reservorio en el desarrollo del brote, los cultivos ambientales no reflejarían la contaminación de superficies en el inicio del brote. El equipo de control de infecciones responsable asumió que la contaminación de las superficies se había producido y decidió reforzar directamente la limpieza y la desinfección de superficies en lugar de realizar cultivos de reservorios potenciales. Como última limitación, es necesario comentar que no se realizaron estudios moleculares de tipificación para tratar de identificar la cepa epidémica.
En conclusión, la aplicación de métodos epidemiológicos analíticos contribuyó a la identificación de los factores de riesgo relevantes, y la utilización de 2 escalas de actividad terapéutica aportó una evidencia consistente al estudio epidemiológico.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.