Introducción
En los últimos años hemos asistido a un aumento en la frecuencia de la infección fúngica invasora (IFI). Este incremento se ha originado fundamentalmente como consecuencia de los cambios y avances desarrollados en la práctica médica a lo largo de este período, los cuales han posibilitado la existencia de un número cada vez mayor de pacientes trasplantados, la aparición de nuevas modalidades de trasplante, de nuevos inmunosupresores y una mayor longevidad de la población general con un consiguiente aumento de neoplasias que requieren tratamiento quimioterápico1-5 (tabla 1).
Aunque tradicionalmente los hongos levaduriformes y en especial Candida albicans eran los agentes etiológicos más frecuentes de IFI, en los últimos años y coincidiendo con la instauración de prácticas de profilaxis con fluconazol en los pacientes trasplantados, hemos asistido en estos pacientes a un descenso en la frecuencia de infecciones invasoras por Candida spp. a favor de las infecciones producidas por Aspergillus spp. y otros hongos filamentosos, lo cual igualmente se ha visto reflejado en las causas de mortalidad por IFI6. En este sentido en un análisis publicado por los Centers for Disease Control and Prevention (CDC) de Estados Unidos6 se comprobó cómo a pesar de que la mortalidad por IFI experimentó un aumento global en las últimas 2 décadas, la mortalidad debida a Candida spp. disminuyó notablemente, probablemente debido a un mejor reconocimiento de estas infecciones en el hospital y a un inicio más precoz del tratamiento7. Por el contrario, la mortalidad debida a Aspergillus spp. se incrementó progresivamente a lo largo de este período. Además de las infecciones por Candida spp. y Aspergillus spp., las micosis producidas por otros hongos menos conocidos están constituyendo un motivo de preocupación creciente, debido a un aumento de los casos comunicados y a las limitadas opciones terapéuticas disponibles. Entre estos hongos se encuentran otras levaduras como Trichosporon spp., Geotrichum capitatum y Rhodotorula spp., así como los hongos dematiáceos y otros hongos filamentosos como Fusarium spp., Scedosporium spp. y Zigomicetos.
Infecciones invasoras por Candida spp.
Las infecciones por Candida spp. constituyen una de las causas más frecuentes de infecciones nosocomiales del torrente circulatorio, representando el cuarto microorganismo más frecuente causante de hemocultivos positivos en Estados Unidos8-10 y el quinto en España11. En Estados Unidos, la incidencia hospitalaria anual de candidemia se ha incrementado entre 2 y 5 veces durante la década de 198012,13, y aunque en Europa, los datos disponibles son aún escasos, en la mayoría de estudios realizados en diferentes países se muestra igualmente un incremento de esta incidencia. Entre estos países se encuentra Holanda donde en un estudio multicéntrico se ha evidenciado como la incidencia de candidemia se multiplicó por dos entre los años 1987 y 199514. Igualmente se han documentado incrementos en esta incidencia en Islandia y Finlandia, aunque en otros países como Suiza y Noruega el número de candidemias ha permanecido estable durante la década de 199015-18. Así mismo, en un estudio longitudinal de vigilancia activa basada en la población realizado en el año 2003 en Dinamarca, y que incluía a la mitad de la población de ese país, se ha evidenciado una elevada incidencia anual de candidemia (11 casos por cada 100.000 habitantes), lo que supone un incremento significativo de la misma desde el año 199219.
En España, la mayoría de datos epidemiológicos disponibles sobre candidemias han procedido de estudios retrospectivos y transversales, sin embargo, recientemente Almirante et al20 han comunicado el primer estudio epidemiológico sobre candidemias en el que se ha realizado una vigilancia activa basada en la población. Ello permite identificar todos los casos de candidemia a pesar de la unidad de asistencia sanitaria donde se presenten, así como minimizar los sesgos de selección. En dicho estudio se evidenció una incidencia media anual de candidemia de 4,3 casos por cada 100.000 habitantes20, lo cual resulta inferior a lo observado en Estados Unidos (6-10 casos por cada 100.000 habitantes)21, aunque similar a lo comunicado en países del norte de Europa (1,7-4,9 casos por cada 100.000 habitantes). En este estudio20, los casos producidos en régimen ambulatorio representaron el 11% del total, y únicamente el 33% de los pacientes se encontraba en la unidad de cuidados intensivos (UCI) cuando se diagnosticó el episodio de candidemia, lo que resalta el hecho de que esta infección no es exclusiva de pacientes críticos. Al igual que en otros estudios de vigilancia realizados en Estados Unidos21, la incidencia de candidemia fue mayor en la población de niños menores de un año y en los mayores de 65 años.
Aunque como hemos observado las infecciones por Candida spp. representan un problema importante e incluso creciente en algunos países y grupos de población, resulta necesario destacar que la frecuencia de candidemia en otros grupos de pacientes ha experimentado un descenso significativo, como en el caso de los pacientes trasplantados de progenitores hematopoyéticos, donde la administración generalizada de pautas de profilaxis antifúngica con fluconazol ha determinado un descenso en la incidencia y en la mortalidad por candidiasis invasora22. De la misma forma, en los pacientes sometidos a trasplante hepático, la incidencia de esta infección ha disminuido notablemente, aunque en este caso además de la profilaxis con fluconazol ha influido de manera decisiva la mejora en determinados factores relacionados con la técnica quirúrgica que son conocidos factores de riesgo de candidiasis invasora en estos pacientes, como el tiempo empleado durante la intervención, el tiempo de isquemia, los requerimientos de hemoderivados o la realización de anastomosis en "Y" de Roux23.
Además del aumento en su incidencia, otra fuente de preocupación respecto a estas infecciones es el aumento de especies de Candida no albicans como causantes de episodios de candidiasis invasora, lo que podría ser debido sobre todo al extendido empleo de antifúngicos y en particular fluconazol. En España, los datos procedentes de la vigilancia activa basada en la población realizada durante 2 años en el área de Barcelona20, han mostrado, sobre un total de 345 casos de candidemia cómo C. albicans continúa siendo la especie más frecuente (51%), seguida de C. parapsilosis (23%), C. tropicalis (10%), C. glabrata (9%) y C. krusei (4%), existiendo situaciones diferenciadas de mayor riesgo para cada especie (tabla 2). De esta forma, la candidemia por C. albicans se asoció con más frecuencia con la colonización previa cuando se comparó frente a las especies no albicans. Candida parapsilosis se asoció con mayor frecuencia a los pacientes pediátricos, a la presencia de catéter venoso central y a una menor mortalidad a los 30 días del episodio de candidemia, y C. krusei se asoció más frecuentemente a los pacientes neutropénicos y neoplásicos cuando se comparó con las especies no krusei. Cuando se estudió el foco de origen de la candemia se encontró que el 57% de los catéteres vasculares evaluados fueron probablemente la fuente de infección lo que traduce la importancia de la retirada de estos catéteres siempre que sea posible. En otro estudio de vigilancia basada en la población, de diseño y duración similares al anterior, y realizado en dos áreas de Estados Unidos21 se recogieron 1.143 episodios de candidemia de los cuales el 45% se debieron a C. albicans, el 24% a C. glabrata, 13% a C. parapsilosis y 12% C. tropicalis. Estos datos apoyan los resultados de otros estudios epidemiológicos retrospectivos, pasivos y transversales en los que se han descrito diferencias en función de la región geográfica en cuanto a la prevalencia de las diferentes especies de Candida no albicans24,25. De esta forma, en Europa y en España existe una mayor tendencia a que en general C. parapsilosis represente la segunda especie de Candida más frecuente, aunque en países como Francia, Alemania o el Reino Unido, al igual que ocurre en Estados Unidos, C. glabrata sigue a C. albicans en frecuencia24,25. A pesar de que las causas para estas variaciones en el espectro de la candidiasis invasora no son bien conocidas, probablemente sean el reflejo de las diferencias existentes entre los pacientes que son atendidos en cada centro, así como de su diferente manejo clínico. En este sentido y dada la asociación entre candidemia por C. parapsilosis con la presencia de catéteres intravasculares y de nutrición parenteral26-28, junto con la posibilidad de su transmisión nosocomial a través de las manos del personal sanitario29, podemos pensar que probablemente los centros que presentan mayor incidencia de C. parapsilosis son aquellos que atienden a pacientes más graves, realizan manejos clínicos más agresivos y presentan insuficientes medidas de control de la infección nosocomial.
Uno de los aspectos de la candidiasis invasora que constituye un motivo de mayor preocupación es la alta mortalidad de estas infecciones. Los datos más recientes procedentes de estudios longitudinales realizados en Estados Unidos y en España confirman que la mortalidad de la candidiasis invasora continúa siendo elevada, oscilando entre el 36 y el 44%20,21. En estos estudios se resalta la importancia de la instauración de tratamiento antifúngico precoz y adecuado así como la retirada de los catéteres vasculares como factores decisivos en la mejora del pronóstico de estos pacientes.
Aunque teóricamente la resistencia a un antifúngico ampliamente utilizado como fluconazol podría influir en esta alta mortalidad, los resultados de los diferentes estudios evidencian que la resistencia a fluconazol es en la práctica un hecho infrecuente, tanto para C. albicans como para el resto de las especies a excepción de C. krusei, habiéndose documentado en los estudios de vigilancia activa, tasas globales de resistencia de entre 5,6 a 7%. Especial atención merece C. glabrata debido a que aunque sólo de un 3 a un 7 % de los aislamientos presentaron resistencia a fluconazol (concentración inhibitoria mínima [CIM], ≥ 64 μg/ml), el porcentaje de aislamientos con sensibilidad dosis-dependiente alcanzó hasta el 20%, lo que cuestiona la utilidad de fluconazol como tratamiento de primera elección tanto para estas infecciones como para el tratamiento de la candidemia en pacientes gravemente enfermos.
Por otro lado, las bajas tasas de resistencia global a fluconazol, sobre todo entre C. albicans, sugieren que no sería necesario la realización rutinaria de test de susceptibilidad antifúngica, y especialmente en los casos de candidemia por esta especie. La realización de estos tests podría reservarse para aquellos casos de pacientes que no responden al tratamiento inicial o en aquellos que desarrollan candidemia "de brecha" mientras reciben profilaxis con fluconazol.
Infecciones invasoras por otros hongos levaduriformes
Además de Candida spp. existen otras especies de levaduras que pueden ser responsables de micosis invasoras. Entre estas especies se encuentran fundamentalmente Trichosporon spp., Geotrichum capitatum y Rhodotorula spp., las cuales a pesar de ser aún poco frecuentes, se presentan habitualmente como IFI en pacientes inmunosuprimidos.
A pesar de que la taxonomía del género Trichosporon ha sido objeto de revisión a lo largo de los años, en la actualidad se acepta que este género incluye 17 especies30, entre las que se incluyen las seis que anteriormente eran consideradas como una única especie bajo la denominación de T. beigelii. Aunque estas 6 especies (T. asahii, T. asteroides, T. cutaneum, T. inkin, T. mucoides y T. ovoides) son reconocidos patógenos para el hombre, la mayoría de infecciones invasoras se han relacionado con T. asahii y T. mucoides31 las cuales se han asociado con la presencia de fungemia e infecciones diseminadas al igual que Candida spp., con la que comparten igualmente sus principales factores de riesgo32. La importancia de estas infecciones radica más que en su incidencia global, que continúa siendo baja, en el mal pronóstico que conllevan en los principales grupos de pacientes afectados, sobre todo aquellos con neoplasias hematológicas y especialmente leucemia aguda, donde se han documentado tasas de mortalidad de hasta el 77%33. Este mal pronóstico, incluso peor que el asociado a las infecciones invasoras por Candida spp., podría explicarse por que, a diferencia de lo que ocurre en la candidemia, hasta dos tercios de las fungemias por Trichosporon spp. se asocian a invasión tisular33.
En la actualidad los datos disponibles sobre el manejo terapéutico de estas infecciones son escasos, por lo que carecemos de pautas óptimas de tratamiento. La mayoría de casos publicados en la literatura especializada han sido tratados con distintas formulaciones de anfotericina B o con fluconazol bien en monoterapia o asociados con distintas combinaciones de antifúngicos33. Sin embargo, la susceptibilidad de Trichosporon spp. a la anfotericina B es variable, habiéndose documentado infecciones "de brecha" en pacientes con neutropenia febril tratados con este antifúngico34. De la misma forma la presencia de casos con ausencia de respuesta clínica a fluconazol ha motivado la investigación de los nuevos triazoles, voriconazol, posaconazol y ravuconazol, los cuales han mostrado potente actividad in vitro contra aislamientos de T. asahii y otras especies de Trichosporon35. La escasa actividad in vitro de las equinocandinas frente a Trichosporon spp.36,37 aleja la posibilidad de su empleo como terapia para estas infecciones38.
Al igual que para Trichosporon spp., la nomenclatura de Geotrichum capitatum, originariamente denominado Trichosporon capitatum, ha sido sometida a una extensa revisión39,40, sin que se haya alcanzado un consenso sobre la nomenclatura definitiva para esta levadura, la cual es denominada por algunos autores como Blastoschizomyces capitatus41,42. En la actualidad, los conocimientos sobre la epidemiología de las micosis invasoras por G. capitatum son limitados. La mayoría de casos documentados se han producido en pacientes inmunosuprimidos, principalmente por neoplasias hematológicas como leucemia aguda en tratamiento quimioterápico33. En este grupo de pacientes, la incidencia comunicada oscila entre el 0,3-0,5%33,43 lo que supone una incidencia muy baja si la comparamos con la incidencia de infecciones invasoras por otras levaduras como Candida spp. Esta baja incidencia parece confirmarse mediante los resultados de un estudio multicéntrico de vigilancia sobre fungemia en pacientes con cáncer llevado a cabo durante 2 años, en el cual de 269 casos de fungemia, únicamente 2 fueron debidos a G. capitatum44. A pesar de esta escasa incidencia global, los datos procedentes de una reciente revisión retrospectiva33 donde se incluyeron 99 casos de IFI probada y probable por G. capitatum, evidenciaron una distribución no homogénea de los episodios de infección, con una mayor frecuencia de casos en Europa (85%) y especialmente en España, Italia y Francia, lo que podría sugerir que existen factores climáticos que podrían desempeñar un papel importante en la epidemiología de las infecciones por G. capitatum.
Los datos publicados sobre la susceptibilidad antifúngica de G. capitatum son limitados, aunque en general coinciden en la actividad in vitro de anfotericina B y la reducida susceptibilidad de ciertas cepas de G. capitatum a flucitosina, fluconazol e itraconazol45-48. Por el contrario, voriconazol presenta una gran actividad frente a esta levadura46, para la cual la eficacia de las equinocandinas no ha sido valorada.
Por último, otra levadura como Rhodotorula spp. está emergiendo como patógeno humano en pacientes inmunocomprometidos o en aquellos con dispositivos intravasculares, habiéndose descrito casos de fungemia, infecciones oculares, peritonitis y meningitis49-52. Entre las especies de Rhodotorula que han sido identificadas, R. mucilaginosa (anteriormente conocida como Rhodotorula rubra) es la de mayor prevalencia53. El grupo de pacientes con mayor riesgo de fungemia por Rhodotorula spp. son los pacientes con neoplasias sólidas y hematológicas que reciben esteroides y citotóxicos y que son portadores de catéteres intravasculares. Existen muy pocos estudios en la literatura médica que hayan evaluado la susceptibilidad antifúngica de Rhodotorula spp.54-56. Cuando se han estudiado aislamientos clínicos de esta levadura según los métodos del National Committee for Clinical Laboratory Standards (NCCLS)57, se ha comprobado que la mayoría son susceptibles a la anfotericina B y a la flucitosina, presentando altas concentraciones inhibitorias mínimas a fluconazol, itraconazol, voriconazol, caspofungina y micafungina54,58. Ravuconazol, entre los modernos triazoles es el antifúngico de mayor potencia, lo cual ha sido evidenciado en un estudio de susceptibilidad antifúngica realizado en España sobre 29 aislamientos de Rhodotorula spp.58, por lo que podría suponer una alternativa para el tratamiento de estas infecciones.
Feohifomicosis
Las feohifomicosis son infecciones producidas por hongos de paredes gruesas y pigmentadas, conocidos como hongos dematiáceos, que no se incluyen en entidades clínicas bien definidas. Por este motivo, infecciones fúngicas bien caracterizadas clínica e histológicamente como el micetoma, la cromoblastomicosis o la piedra negra, aunque son producidas por hongos dematiáceos no se consideran dentro de este grupo de infecciones59.
Entre las especies de hongos dematiáceos que con mayor frecuencia producen feohifomicosis se encuentran Bipolaris, Curvularia, Exserohilum, Drechslera, Exophiala, Cladosporium, Phialophora, Wangiella y Alternaria, aunque el número de hongos dematiáceos descritos aumenta progresivamente. A pesar de que Scedosporium prolificans se incluye dentro de los hongos dematiáceos será comentado posteriormente en otro apartado de esta revisión.
En individuos inmunocompetentes, estos hongos pueden causar infecciones cutáneas y subcutáneas relacionadas con traumatismos, aunque se han descrito casos de infecciones invasoras sin claros factores de riesgo que afectan fundamentalmente al sistema nervioso central, y que probablemente se adquieren por inhalación del hongo60-62. Entre las especies que presentan un especial tropismo por el sistema nervioso central se encuentran Cladophialophora bantiana, Bipolaris spicifera, Exophiala spp., Wangiella dermatitidis, Ramichloridium obovoideum y Chaetomium atrobrunneum59.
En pacientes inmunosuprimidos pueden producirse infecciones sistémicas, aunque en receptores de trasplante la mayoría de casos descritos se corresponden con infecciones de piel y tejidos blandos63-65. En una revisión que incluyó a 34 pacientes trasplantados con infección por hongos dematiáceos63, el 79% presentó afectación de piel y tejidos blandos o hueso, mientras que el 21% restante presentó afectación sistémica con predominio de las infecciones del sistema nervioso central, siendo el tiempo medio de comienzo de la infección de 22 meses tras el trasplante.
La resección quirúrgica y el tratamiento prolongado con itraconazol durante 2 o 3 meses ha sido eficaz en la mayoría de pacientes sin enfermedad diseminada66. Sin embargo, en los pacientes inmunosuprimidos que presentan afectación sistémica, la mortalidad alcanza hasta el 79% a pesar de la cirugía y el tratamiento con anfotericina B59. Las actividades in vitro de los triazoles (itraconazol, voriconazol y posaconazol) son superiores a las de anfotericina B para muchos de los hongos dematiáceos67-69. Otros antifúngicos como caspofungina, no parecen ser tan activos in vitro como los azoles y su papel en el tratamiento de estas infecciones no está bien establecido70.
Infecciones invasoras por Aspergillus spp.
Desde el comienzo de la década de 1990, se ha evidenciado un aumento en la frecuencia de aspergilosis invasora71,72. Aunque este incremento se ha documentado de forma global en los receptores de trasplante de órganos, son los pacientes sometidos a trasplante de progenitores hematopoyéticos (TPH) en los cuales este aumento ha sido más notable, pasando del 7,9% en 1992 al 16,9% en 19984. Ello implica una gran importancia si tenemos en cuenta la mortalidad de la aspergilosis invasora en estos pacientes se eleva hasta el 90%2. Aunque no existen razones concluyentes para este hecho, el aumento en la frecuencia de aislamientos de Aspergillus spp. se ha producido de forma paralela al uso de pautas de profilaxis con fluconazol, un antifúngico sin actividad contra este hongo. De hecho, el uso de fluconazol resultó ser un factor predictor independiente de infecciones invasoras por hongos filamentosos en un estudio realizado en pacientes con TPH73. El hecho de que no sea bien conocido el mecanismo definitivo por el cual el empleo de fluconazol puede favorecer la aparición de infecciones por hongos filamentosos, ha motivado que algunos autores planteen dudas a este respecto74. Estos interrogantes, además se apoyan en el hecho de que en general, las infecciones invasoras por Candida spp. se originan a partir de la propia flora endógena del individuo, a diferencia de las infecciones por hongos filamentosos que son básicamente exógenas. No obstante, se han postulado diversos mecanismos que podrían explicar esta asociación, como un aumento en la supervivencia de los pacientes motivado por la profilaxis con fluconazol, una mayor tendencia a la colonización por hongos resistentes a este antifúngico e incluso que fluconazol pudiera activar la expresión de ciertos genes de Aspergillus spp. lo que se traduciría en un aumento de su virulencia75.
Además de los pacientes trasplantados, los enfermos críticos constituyen otro grupo de pacientes donde las infecciones por Aspergillus spp. constituyen un problema cada vez más frecuente, aun en ausencia de inmunosupresión o enfermedad neoplásica. Aunque carecemos de estudios prospectivos para determinar los factores de riesgo de aspergilosis en estos pacientes, datos de estudios retrospectivos indican que las reagudizaciones de la enfermedad pulmonar obstructiva crónica y el tratamiento esteroideo son situaciones de especial riesgo de aspergilosis invasora en esta población76,77.
Por otro lado, el aislamiento de otras especies de Aspergillus diferentes a A. fumigatus es cada vez más frecuente. En un estudio que incluyó a 5.500 pacientes receptores de TPH desde 1996 hasta 1998, el 33,7% de los cultivos positivos procedentes de lavado broncoalveolar o de biopsia fueron debidos a especies de Aspergillus no fumigatus en contraste con el 18,3% recogido entre los años 1993 y 199578. Entre las especies de Aspergillus no fumigatus se encuentra A. terreus, un hongo cuyo reservorio principal es el suelo y que presenta altas tasas de resistencia a anfotericina B lo que ha condicionado una mayor mortalidad de estas infecciones, motivo por el cual ha constituido una fuente de especial preocupación79-81. Aunque las infecciones por este hongo continúan siendo infrecuentes, en algunos estudios realizados en TPH, A. terreus ha representado el 20% de las infecciones por hongos filamentosos72, habiéndose evidenciado como A. terreus en comparación con otras especies de Aspergillus presenta una mayor tendencia a presentar enfermedad rápidamente progresiva así como diseminación82.
Además de la emergencia de especies de Aspergillus no fumigatus, en los últimos años se han desarrollado otros cambios en cuanto a la epidemiología de la aspergilosis invasora. Entre ellos la aparición cada vez más tardía de esta infección en los pacientes trasplantados. Tradicionalmente en los receptores de TPH las infecciones por Aspergillus spp. han ocurrido en períodos precoces tras el trasplante fundamentalmente en relación con los períodos de neutropenia83. Sin embargo, la aparición de factores estimuladores de colonias, y de nuevas modalidades de trasplante como el trasplante de progenitores procedentes de la sangre periférica o el trasplante no mieloablativo, todos ellos procedimientos que acortan la duración de la neutropenia, han posibilitado el que la mayoría de las infecciones ocurran en la actualidad después del prendimiento y fundamentalmente en relación con la aparición de enfermedad injerto contra huésped y su tratamiento84. Igualmente las actuales prácticas de profilaxis antimicrobiana han podido influir en el momento del comienzo de la aspergilosis invasiva. En este sentido, la prolongada duración de la profilaxis frente a citomegalovirus con ganciclovir se ha evidenciado no sólo como un factor de riesgo de enfermedad tardía por citomegalovirus sino también de aspergilosis invasora de comienzo tardío, aumentando el riesgo de esta infección 1,4 veces por semana a partir de la cuarta semana de administración de ganciclovir85.
Al igual que en el caso del TPH, en los receptores de trasplante hepático existe una tendencia al comienzo cada vez más tardío de la aspergilosis invasora. En un estudio86 que comparó una cohorte de pacientes con aspergilosis invasora desde 1990 hasta 1995 con otra cohorte comprendida entre los años 1998 y 2001, se comprobó como el 55% de los episodios de aspergilosis en esta última cohorte se produjeron posteriormente a los primeros 90 días tras el trasplante, en comparación con el 23% acontecidos en la primera cohorte. Posteriormente en otro estudio realizado en el marco de la Red Española para el Estudio de las Infecciones en el Trasplante (RESITRA)87 se evidenció como al igual que en el TPH, en el trasplante de órgano sólido existen factores de riesgo de aspergilosis invasora diferenciados en función del tiempo transcurrido tras el trasplante. De esta forma en períodos postoperatorios precoces (primeros 90 días tras el trasplante) los factores de riesgo implicados se corresponden globalmente con un curso postoperatorio más complicado (necesidad de empleo de fármacos vasoactivos, estancias prolongadas en UCI, insuficiencia renal y necesidad de hemodiálisis tras el trasplante, infecciones bacterianas concomitantes y enfermedad por citomegalovirus), por el contrario en períodos más tardíos, los factores de riesgo implicados reflejaban un estado de mayor inmunosupresión en pacientes de más edad y con disfunción crónica del injerto (edad, niveles plasmáticos elevados de tacrolimus o ciclosporina, empleo concomitante de ambos en un mismo paciente, neoplasias relacionadas con la inmunosupresion y rechazo crónico del injerto).
Todos estos hallazgos ponen de manifiesto la importancia de considerar la posibilidad de la aspergilosis invasora en estos pacientes aunque nos encontremos en períodos tardíos tras el trasplante y que además debemos atender a factores de riesgo diferenciados según el período postrasplante en el que nos encontremos, lo que podría ser útil para establecer a los grupos de pacientes de alto riesgo a la hora de establecer estrategias de profilaxis y seleccionar a aquellos pacientes que podrían beneficiarse de tratamiento anticipado.
Infecciones invasoras por hongos filamentosos no Aspergillus
Agentes productores de hialohifomicosis
Por hialohifomicosis se entienden aquellas infecciones debidas a hongos filamentosos hialinos que presentan hifas septadas. Dentro de este grupo (en el cual se incluye a Aspergillus spp.) se engloban hongos, que aunque todavía poco frecuentes, pueden presentar infecciones muy graves en los pacientes inmunocomprometidos. De todos ellos los más importantes en la actualidad son Fusarium spp. y Scedosporium apiospermum, los cuales presentan características histológicas semejantes a la aspergilosis, por lo que el diagnóstico definitivo únicamente puede realizarse mediante el cultivo. Las infecciones por Fusarium spp. han experimentado un aumento significativo a partir de la segunda mitad de la década de 1990, lo cual ha posibilitado que actualmente constituya el segundo hongo filamentoso más frecuente causante de enfermedad invasora en los pacientes hematológicos y trasplantados de órgano sólido88,89. Aunque los principales factores de riesgo de fusariosis son bien conocidos como la neutropenia, la enfermedad injerto contra huésped y los tratamientos inmunosupresores90, otras circunstancias pueden favorecer las infecciones por Fusarium spp. En este sentido, se ha encontrado a este hongo en los sistemas de distribución de agua de los hospitales, lo que sugiere que estos sistemas podrían comportarse como una posible fuente de transmisión91 motivando por tanto, la necesidad de una especial vigilancia de estas instalaciones. Para el tratamiento de estas infecciones debemos tener en cuenta que tanto la sintomatología, como los hallazgos radiológicos de la fusariosis son indistinguibles de la infección invasora por Aspergillus spp. Sin embargo, a diferencia de ésta, la infección diseminada por Fusarium spp. presenta habitualmente afectación cutánea así como una mayor frecuencia de aislamiento del hongo en los hemocultivos que llega a ser del 60%92, por lo que estas situaciones deben ser consideradas para un diagnóstico precoz de fusariosis. Este hongo presenta elevadas tasas de resistencia a numerosos antifúngicos, lo que condiciona una tasa de mortalidad de hasta el 80%. Aunque los resultados obtenidos con voriconazol han sido prometedores en algunos estudios93, en España los datos disponibles indican que tanto F. solani como F. oxysporum presentan altas tasas de resistencia a voriconazol, por lo que probablemente la anfotericina B a dosis elevadas sea el tratamiento más adecuado para estas infecciones.
Scedosporium apiospermum es la forma asexuada de Pseudallescheria boydii, y constituye una de las principales causas de micetoma en pacientes inmunocompetentes. En los últimos años, las infecciones por este hongo se han incrementado como consecuencia de un aumento del número de pacientes sometidos a tratamiento inmunosupresor y a una mayor supervivencia de los pacientes con fibrosis quística, en los cuales, se ha descrito a S. apiospermum como el segundo hongo filamentoso colonizador del tracto respiratorio más frecuente tras A. fumigatus94. Igualmente, los casos de afectación cerebral por S. apiospermum tras la aspiración de agua contaminada constituyen otra categoría emergente que ha contribuido al aumento de infecciones por este hongo94. En los pacientes inmunosuprimidos (fundamentalmente en pacientes sometidos a TPH), S. apiospermum puede causar infecciones diseminadas con especial predilección por la afectación del sistema nervioso central95,96. En estos pacientes el mayor número de episodios de infección se producía en períodos precoces tras el trasplante, resaltando la importancia de la neutropenia como factor de riesgo de infección por S. apiospermum4. Sin embargo, en los últimos años el acortamiento de los períodos de neutropenia motivado por la aparición de los factores estimuladores de colonias y el desarrollo de nuevas modalidades de TPH, no se ha traducido en un descenso de estas infecciones, observándose un comienzo cada vez más tardío de los episodios de infección por por este hongo tras el trasplante96. Además, el empleo de profilaxis antifúngica podría haber contribuido a la selección de Scedosporium spp. lo que se fundamenta en la mayor aparición de estas infecciones en pacientes que reciben anfotericina B, fluconazol o itraconazol97,98. Los nuevos triazoles constituyen probablemente la alternativa terapéutica más adecuada en la actualidad para estas infecciones, debido a que este hongo presenta habitualmente resistencia a la anfotericina B99,100. Entre los modernos triazoles, posaconazol es el que ha demostrado una mayor actividad in vitro por lo que probablemente pueda aportar beneficios en el tratamiento de estas infecciones101.
Scedosporium prolificans es la segunda especie del género Scedosporium aunque, a diferencia de S. apiospermum, se engloba dentro de las feohifomicosis (hongos filamentosos pigmentados con hifas septadas). Las infecciones por este hongo comparten los mismos factores de riesgo que las producidas por S. apiospermum, aunque son mucho menos frecuentes, pudiendo presentarse como colonización asintomática, infección localizada o bien como infección diseminada fundamentalmente en pacientes neutropénicos los cuales presentan una tasa de mortalidad del 90%102. Sin embargo, su importancia radica en que este hongo presenta altas tasas de resistencia a todos los antifúngicos disponibles incluyendo los nuevos triazoles, por lo que las infecciones por S. prolificans presentan en la actualidad unas altas tasas de mortalidad94,100,103,.
Zigomicosis
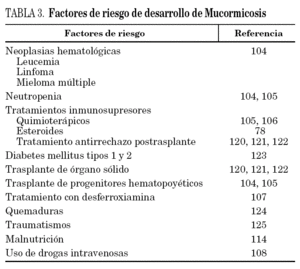
Bajo el término zigomicosis se engloban las infecciones producidas por los géneros Mucor, Rhizopus, Rhizomucor, Absidia, Apophysomyces, Cunninghamella y Saksenaea. Estas infecciones presentan factores de riesgo bien conocidos como las neoplasias hematológicas o la neutropenia104,105 (tabla 3) y se caracterizan por producir invasión vascular con trombosis y necrosis tisular, típicamente a nivel rinoorbitocerebral, aunque también pueden producir afectación pulmonar o infecciones diseminadas. A diferencia de otros hongos filamentosos que actúan como patógenos oportunistas en pacientes inmunosuprimidos, la zigomicosis puede producir enfermedad potencialmente fatal en pacientes con mayor inmunocompetencia como aquellos con diabetes mellitus106, tratamiento con desferrioxamina107, usuarios de drogas por vía parenteral108 e incluso en pacientes sin ninguna patología de base109. En un metaanálisis donde se analizaron 929 casos de zigomicosis los tipos más frecuentes de infección fueron rinosinusal (39%), pulmonar (24%) y cutánea (19%), desarrollándose enfermedad diseminada en un 23% de casos. Los pacientes diabéticos presentaron con mayor frecuencia afectación rinosinusal a diferencia de los pacientes con neoplasias de base los cuales presentaron afectación predominantemente pulmonar. La mortalidad global en esta serie fue del 54% siendo la afectación diseminada y la infección por Cunninghamella spp. los factores de riesgo de mortalidad110. Aunque en nuestro país son aún poco frecuentes111, el interés por estas infecciones ha aumentado tras la descripción de casos de zigomicosis en pacientes severamente inmunodeprimidos y sobre todo de zigomicosis "de brecha" en pacientes que reciben profilaxis con voriconazol (un antifúngico sin actividad frente a los zigomicetos) durante largos períodos de tiempo. Debido a que las infecciones fúngicas se presentan frecuentemente en estos pacientes de alto riesgo, algunos centros han comenzado a emplear voriconazol como profilaxis de infección fúngica invasora debido a su amplio espectro antifúngico y a su biodisponibilidad por vía oral. Aunque esta estrategia puede reducir la incidencia de aspergilosis, se han comunicado infecciones "de brecha" por zigomicetos en estos centros en donde, anteriormente, las zigomicosis eran muy poco frecuentes112-118. Aunque esta relación entre la administración de voriconazol y la aparición de zigomicosis debe ser probada en estudios prospectivos, es razonable pensar que la aparición de una infección fúngica "de brecha" en pacientes sometidos a profilaxis o tratamiento con voriconazol debería aumentar la sospecha de una zigomicosis y especialmente cuando si esa infección afecta a los senos paranasales43,119.
Conclusión
La evolución de la epidemiología de la IFI supone que debe replantearse la utilidad del manejo tradicional de estas infecciones en los pacientes inmunosuprimidos. Las IFI actuales difieren con respecto a las infecciones presentes hace una década en el espectro, los factores de riesgo, el tiempo de comienzo, la presentación clínica y la susceptibilidad antimicrobiana (tabla 4). El reconocimiento de esta nueva situación en pacientes que además reciben nuevos regímenes de inmunosupresión debe conducirnos a diseñar estrategias de profilaxis que minimicen la emergencia de hongos resistentes y de efectos adversos. Para ello, los esquemas de profilaxis "universal" deberán sustituirse probablemente por regímenes de profilaxis administrada únicamente a los pacientes seleccionados de alto riesgo y además, con una duración limitada a los períodos de mayor riesgo de infección. En este sentido, la identificación de períodos de alto riesgo de IFI en etapas tardías tras el TPH y el trasplante hepático puede resultar de gran utilidad en el diagnóstico precoz de las infecciones en estos pacientes mediante la intensificación de la vigilancia de los pacientes susceptibles durante períodos más prolongados de tiempo. Por último, el cambio en el espectro de las IFI producidas tanto por levaduras (aumento de especies de Candida resistentes a fluconazol) como por hongos filamentosos (incremento de especies de Aspergillus no fumigatus y zigomicetos), junto con la demora en la obtención del diagnóstico microbiológico de certeza, implican que el clínico debe poseer un amplio conocimiento de la epidemiología fúngica existente en su centro con el objeto de administrar el tratamiento empírico más apropiado para las especies fúngicas predominantes.
Correspondencia: Dr. J.J. Castón Osorio.
Hospital Universitario Reina Sofía.
Avda. Menéndez Pidal, s/n. 14004 Córdoba. España.
Correo electrónico: juanjoco2005@yahoo.es
Manuscrito recibido el 20-5-2006; aceptado el 16-9-2006.