La hepatitis aguda C (HAC) representa un problema sanitario en auge. A pesar del descenso de la transmisión del VHC por vía hematológica gracias a los programas de detección de donantes y el menor consumo de drogas por vía intravenosa, actualmente existe un aumento de su incidencia debido al contagio por vía sexual, sobretodo en pacientes homosexuales infectados por el VIH. La presentación de forma paucisintomática es frecuente, lo cual dificulta su diagnóstico. La eliminación espontánea del virus ocurre en el 25% de los casos y, habitualmente, durante los primeros tres meses tras el inicio de la clínica y en pacientes sintomáticos. Si el ARN del VHC persiste detectable pasado este tiempo debe iniciarse sin demora tratamiento antiviral, ya que en la fase aguda el porcentaje de respuesta viral sostenida es mayor al que se obtiene después en la hepatopatía crónica. La pauta de tratamiento óptima (interferón sólo o asociado a ribavirina), así como la duración de la misma no están claramente establecidas en el momento actual.
Acute hepatitis C (AHC) is an increasing health issue. Despite the decline of blood-to-blood transmission of hepatitis C virus (HCV) through donor screening programs and a decline in intravenous drug use, the incidence of sexual transmission has now increased, particularly in HIV-infected homosexual patients. The presentation is almost always asymptomatic, which complicates diagnosis. Spontaneous clearance of the virus occurs in 25% of cases and usually, within the first three months after onset of symptoms and in symptomatic patients. If serum HCV-RNA remains detectable after this period, antiviral treatment should be started without delay, since sustained viral response rate in the acute phase is higher than that achieved with chronic liver disease. The optimal treatment regimen (interferon alone or combined with ribavirin) and its duration are not clearly established at the present time.
El virus de la hepatitis C (VHC) es la principal causa de hepatitis crónica en el mundo. Se conoce bien su prevalencia, pero resulta difícil evaluar la tasa real de nuevos casos. El hecho de que la fase aguda de la infección por el VHC muchas veces pase desapercibida, por presentarse de forma asintomática o paucisintomática, unido a que no existe un marcador serológico específico para el diagnóstico de la hepatitis aguda, justifica el que no se conozca con certeza la incidencia de hepatitis aguda C (HAC).
En esta revisión, tratamos de sintetizar la información existente sobre la HAC: describir su historia natural, la epidemiología de la infección y discutir las recomendaciones de tratamiento.
EpidemiologíaSegún la Organización Mundial de la Salud (OMS), el 2,5% de la población mundial está infectada por VHC. Los diferentes estudios epidemiológicos realizados en España muestran que la prevalencia es parecida y varía entre el 1 y el 2,6%, lo que supone que existen entre 480.000 y 760.000 personas infectadas1.
Las estimaciones de incidencia de infección aguda por el VHC varían ampliamente dependiendo de los métodos de evaluación y la institución que los informa. Ejemplo de ello, son los datos reportados en Italia, donde la incidencia varía desde 1 hasta 14 infecciones por cada 100.000 de acuerdo a la agencia nacional de vigilancia2, el programa de donante de sangre italiano3 o la evaluación en la población general4.
A pesar de la dificultad existente para conocer la tasa real de nuevos casos de infección por el VHC, se ha señalado una gran disminución de su incidencia en los últimos años. Este descenso se ha conseguido, en gran parte, gracias a las medidas preventivas establecidas: la introducción del test de cribado para el VHC en los bancos de sangre, la extensión entre los drogadictos de los programas de intercambio de jeringuillas y la generalización en el uso de material médico desechable en muchos países.
Es necesario un alto índice de sospecha clínica y un seguimiento serológico y virológico estrecho para detectar nuevos casos de HAC5,6. En un elevado porcentaje de casos, se diagnostica en el contexto de la vigilancia post-exposición y en grupos de riesgo7–9.
Se repasan a continuación las diferentes vías de trasmisión del VHC.
La transmisión por vía parenteral, y en particular el consumo de drogas endovenosas, ha representado la principal causa de contagio para el VHC en los países desarrollados10. Recientemente, sin embargo, se ha descrito un creciente número de HAC en varones homosexuales infectados por el virus de la inmunodeficiencia humana (VIH), lo que sugiere que la epidemiología de la transmisión del VHC está cambiando9,11–16.
La transmisión por transfusión de sangre casi ha desaparecido en los países desarrollados tras la instauración del despistaje en los bancos de sangre con la aplicación de la PCR (reacción en cadena de la polimerasa) automática para el ARN (ácido ribonucleico) de VHC en los donantes16.
La transmisión por el consumo de drogas sigue siendo el modo predominante (38%) de infección en algunas áreas, sobre todo en los países de Europa oriental17; pero es prácticamente inexistente en los países occidentales dado el descenso del consumo de drogas por vía endovenosa, la implantación de los programas de intercambio de jeringuillas y de mantenimiento con metadona. En el colectivo de usuarios de drogas por vía endovenosa, debemos tener presente que la reinfección no es infrecuente17,18.
La transmisión nosocomial representa entre el 15-25% de los casos19–21. Este modo de contagio habitualmente acontece en forma de pequeña epidemia19,22 y, en la mayoría de casos, es debida a una falta en el cumplimiento de las normas estándar de higiene23. Los factores de riesgo relacionados con mayor frecuencia al contagio nosocomial son la cirugía y los procedimientos diagnósticos invasivos19–21.
La transmisión ocupacional, el contagio por exposición a sangre, representaría entre un 10-20% de los casos de HAC según se muestran en algunas cohortes retrospectivas24,25. Los resultados de estudios recientemente publicados muestran un menor riesgo de transmisión tras el pinchazo accidental (0,3-2,8%)26.
La transmisión vertical es poco eficaz y representa el 5% de los casos27. La infección no se transmite por lactancia materna28. La hepatitis C vertical cursa de forma asintomática en la mayoría de casos. El 20% de los niños negativizan el ARN del VHC en los tres primeros años de vida29.
El riesgo de transmisión sexual en parejas serodiscordantes heterosexuales se considera muy bajo, < 1%30–32; y por tanto, no se recomiendan métodos de barrera preventivos en estos casos. En los pacientes coinfectados por el VIH, parece que el riego de transmisión sexual es mayor33. En los últimos 10 años, un creciente número de casos de HAC se han notificado en grandes centros urbanos en Europa9,11,12, los Estados Unidos13,14,34 y Australia15. Estudios de cohortes longitudinales han confirmado un aumento en la incidencia del VHC entre pacientes homosexuales VIH-positivos en Inglaterra35 y los Países Bajos36. Un estudio internacional reciente ha demostrado, tras realizar un análisis filogenético, un alto grado de relación de las muestras del VHC de diferentes países, lo que sugiere una propagación de la hepatitis C a través de una red sexual internacional37.
El aumento de la incidencia de HAC en el colectivo homosexual VIH seropositivo se ha atribuido a diferentes factores: una mayor carga viral del VHC en los pacientes coinfectados por el VIH a nivel de sangre y semen38–40, determinadas prácticas sexuales en las que existe un riesgo mayor de daño de la mucosa, la presencia de otras ETS ulcerativas como el linfogranuloma venéreo o la sífilis de forma concomitante41, un mayor número de parejas sexuales42 y el uso de drogas recreativas como la gamma hidroxibutirato (GHB)37.
Se ha propuesto que la coinfección por el VIH podría facilitar la transmisión del VHC. Por un lado, aumentaría la infectividad viral al presentarse con una mayor carga viral del VHC en el suero y semen y por otro lado, estaría incrementada la susceptibilidad viral debido a un control inmunológico deficiente del VHC43,44. No obstante, existen datos contradictorios en este campo, ya que es frecuente el diagnóstico de la infección aguda por el VHC en pacientes con recuentos de CD4 relativamente preservados o bien realizar un diagnóstico concomitante de primoinfección VIH y de HAC. Parece pues que las conductas sexuales tendrían un papel más importante que el propio VIH como factor de riesgo en la presentación de HAC en estos pacientes45.
ClínicaLa hepatitis aguda ocurre después de un período de incubación variable de 15 a 160 días (media de 7 semanas).
Sólo el 20-30% de todos los pacientes que contrae una hepatitis aguda por el VHC presentarán clínica. Los síntomas prodrómicos son sistémicos y variables. La aparición de la ictericia puede estar precedida por 1 o 2 semanas de anorexia, náuseas y vómitos, astenia, artralgias, mialgias, dolor de cabeza, fotofobia y faringitis, así como alteraciones del gusto y olfato. Se puede apreciar coluria e hipocolia de uno a cinco días antes de la aparición de la ictericia clínica. El hígado aumenta de tamaño y puede haber dolor en hipocondrio derecho. Un 10-20% de los pacientes tienen esplenomegalia y adenopatías cervicales.
La fase de recuperación, fase post-ictérica, se prolonga de 2 a 12 semanas.
La presentación clínica de la HAC en el paciente VIH seropositivo es muy similar a la de la población monoinfectada. Algunos autores sugieren que podría manifestarse con menos signos o síntomas clínicos de hepatitis y con elevaciones más discretas de la ALT sérica en comparación con los pacientes no infectados por el VIH46.
EvoluciónLa HAC evoluciona a infección crónica hasta en el 85% de los casos.
La eliminación espontánea se produce en el 23-44% de los pacientes, según el estudio analizado47,48–51, y suele ocurrir dentro de las 12 semanas después del diagnóstico; no obstante, se han descrito casos aislados de seroconversión tardía, hasta 12 meses48,51.
En general, los pacientes con enfermedad sintomática, ictericia o síntomas pseudogripales, parecen experimentar una mayor eliminación viral espontánea47–50,52. También se ha observado un porcentaje muy elevado de curación espontánea en los pacientes que presentan una disminución rápida de la carga viral53,54.
Varios trabajos han demostrado que una respuesta inmune celular fuerte y multiespecífica sería un factor importante para la erradicación viral espontánea55–57.
Existe en la actualidad gran interés en los estudios genéticos; se ha descrito que la presencia de un polimorfismo en el gen que codifica para la interleukina (IL28B) en el cromosoma 19 predice la eliminación viral espontánea58, así como un mayor porcentaje de respuesta viral al tratamiento anti-VHC en el paciente monoinfectado59. En el paciente coinfectado por el VIH, este polimorfismo también se ha relacionado con la RVS al tratamiento60,61, pero no con una mayor eliminación viral espontánea en la HAC61.
Estudios recientes sobre el diagnóstico y el curso natural de la infección aguda por el VHC en personas VIH-positivas han reportado porcentajes de eliminación espontánea de entre 13 y 16%62,63, valores menores en comparación con los individuos mono-infectados. Desafortunadamente no existen datos sobre el tiempo necesario de espera para valorar la eliminación viral espontánea en el paciente coinfectado.
Debemos tener en cuenta que los pacientes VIH con HAC, tienen mayor riesgo de progresión de la enfermedad hepática relacionada64 y menor respuesta a la terapia antiviral para el VHC.
DiagnósticoDatos de laboratorioLa elevación de aminotransferasas se inicia en la fase prodrómica de la hepatitis antes del aumento de bilirrubina.
Se puede observar de forma transitoria, neutropenia y linfopenia, seguidas de linfocitosis relativa. Son frecuentes los linfocitos atípicos durante la fase aguda. También durante esta fase, se pueden detectar anticuerpos anti músculo liso, antinucleares y otros componentes celulares, factor reumatoide y anticuerpos heterófilos a título bajo. Es común una ligera elevación de gammaglobulinas.
El diagnóstico de la infección aguda por el VHC se basa en la detección de ARN del VHC por PCR junto a documentación de la existencia de una seroconversión de los anticuerpos del VHC (anti VHC). En aquellos casos que la seroconversión anti VHC no se puede probar, existen unos criterios adicionales que pueden apoyar el diagnóstico de sospecha: los niveles de ALT > 10-20 veces el límite superior de lo normal, la sospecha de un contacto de riesgo con el VHC los 6 meses previo y haberse descartado cualquier otra causa de daño hepático (tabla 1).
Criterios propuestos para el diagnóstico de hepatitis aguda C.
| Criterios mayores | Detección de ARN del VHC en suero en un paciente con un VHC negativo previamente. |
| Seroconversión de antiVHC negativo a antiVHC positivo. | |
| Criterios secundarios | Niveles de ALT > 10-20 veces el límite superior de lo normal |
| Sospecha de un contacto de riesgo con el VHC los 6 meses previos. | |
| Se haya descartado cualquier otra causa de daño hepático. | |
| Consideraciones adicionales | Aparición repentina de enfermedad hepática. |
| Repetición de pruebas RIBA (ensayo de inmunoblot recombinante) que demuestren un aumento en el número de proteínas reactivas. |
ALT: alaninaminotransferasa; ARN del VHC: ácido ribonucleico del virus de la hepatitis C; antiVHC: anticuerpos contra el VHC.
El screening serológico de anti VHC no es fiable durante la infección temprana, ya que estos anticuerpos pueden tardar hasta 12 semanas tras la exposición en detectarse. Asimismo pueden existir falsos anti VHC positivos en pacientes con factor reumatoide. En estos casos, es posible realizar un ensayo de inmunoblot recombinante (RIBA) de confirmación, para establecer las proteínas específicas a las que se dirige el anti VHC.
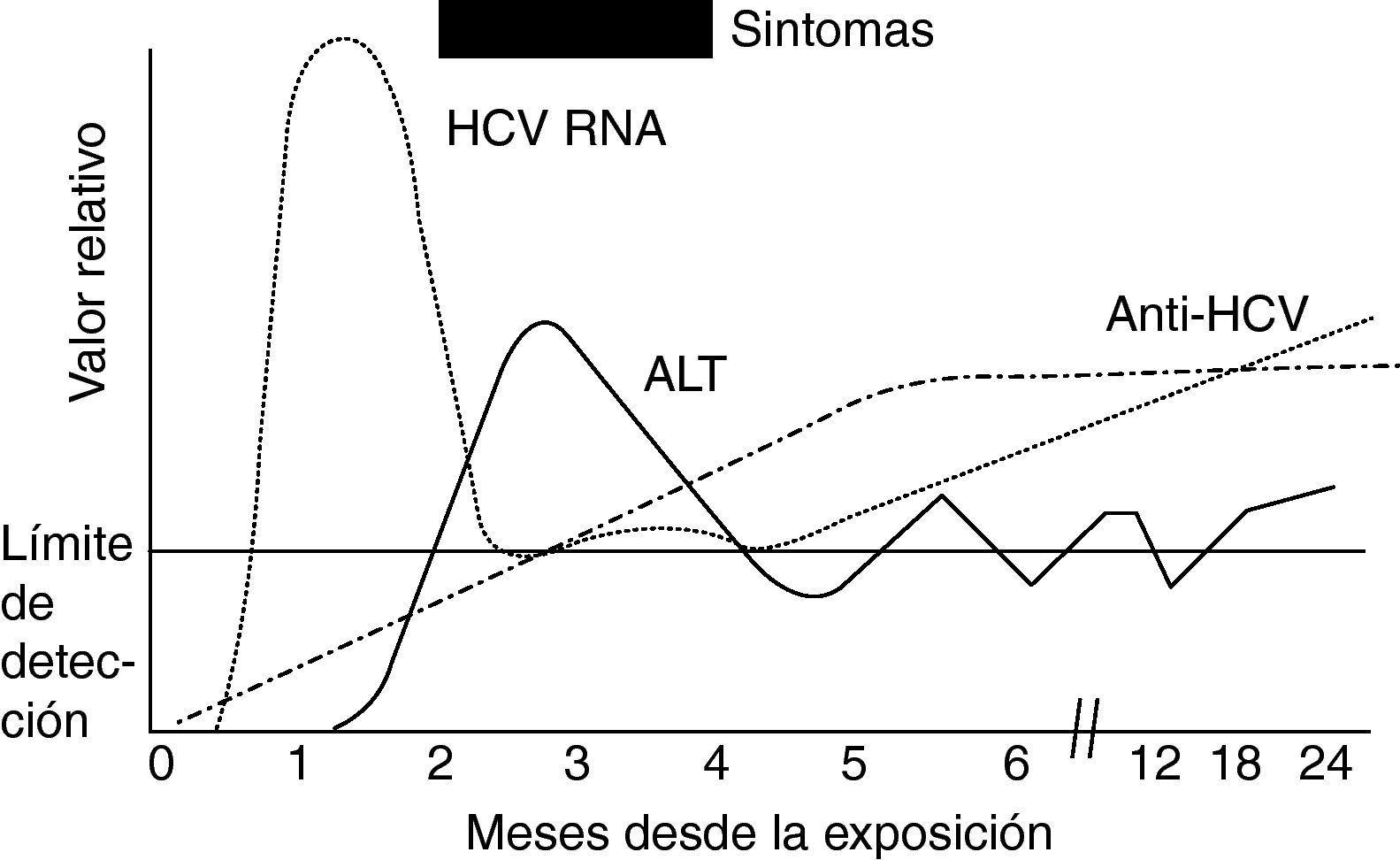
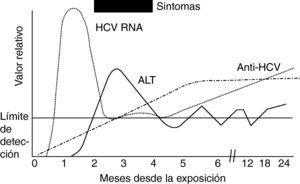
La determinación de ARN de VHC por PCR es el método más sensible para el diagnóstico de infección por VHC y aparece antes de los anti VHC y de la elevación de transaminasas; hasta en un 30% de los pacientes el análisis de ARN del VHC por PCR será la única posibilidad de diagnosticar la infección aguda por el VHC65 (fig. 1).
TratamientoNo es necesario el reposo en cama para la recuperación, pero algunos pacientes con astenia importante se encuentran mejor restringiendo su actividad física. Es aconsejable una dieta elevada en calorías y no muy grasa para evitar la sensación de plenitud.
El ingreso para administración de líquidos intravenosos puede estar indicado si existe un cuadro de vómitos importante. Se debe evitar medicación metabolizada en el hígado y hepatotóxica. Si es muy llamativo el prurito, se puede utilizar resincolestiramina.
A diferencia de la hepatitis C crónica, no ha sido establecida hasta el momento cual debe ser la pauta de terapia antiviral estándar en la fase aguda de la enfermedad y muchos aspectos importantes del tratamiento están actualmente bajo investigación. Los ensayos clínicos centrados en el tratamiento de la HAC se ven obstaculizados por las dificultades en su diagnóstico. Así, la mayoría de los estudios que existen son abiertos, no comparativos e incluyen pocos pacientes. Cómo difieren ampliamente entre ellos en cuanto a diseño, población de pacientes y los regímenes de tratamiento, no es posible discernir de forma rotunda cual es la intervención más eficaz.
Los datos obtenidos hasta la fecha en diferentes estudios realizados en pacientes monoinfectados muestran que tanto el interferón convencional como el pegilado son útiles en el tratamiento de la HAC y que la terapia combinada con ribavirina no mejora los resultados52,61,66-69. Además se ha valorado que el porcentaje de respuesta viral sostenida (RVS) a la terapia en la HAC es independiente del genotipo del VHC. En cuanto a la duración óptima del tratamiento se establece en 24 semanas. Pequeños estudios con pocos pacientes han analizado la posibilidad de reducir el tratamiento a 12 semanas pero, hasta el momento, los resultados obtenidos son insuficientes para poder establecer una guía67,70.
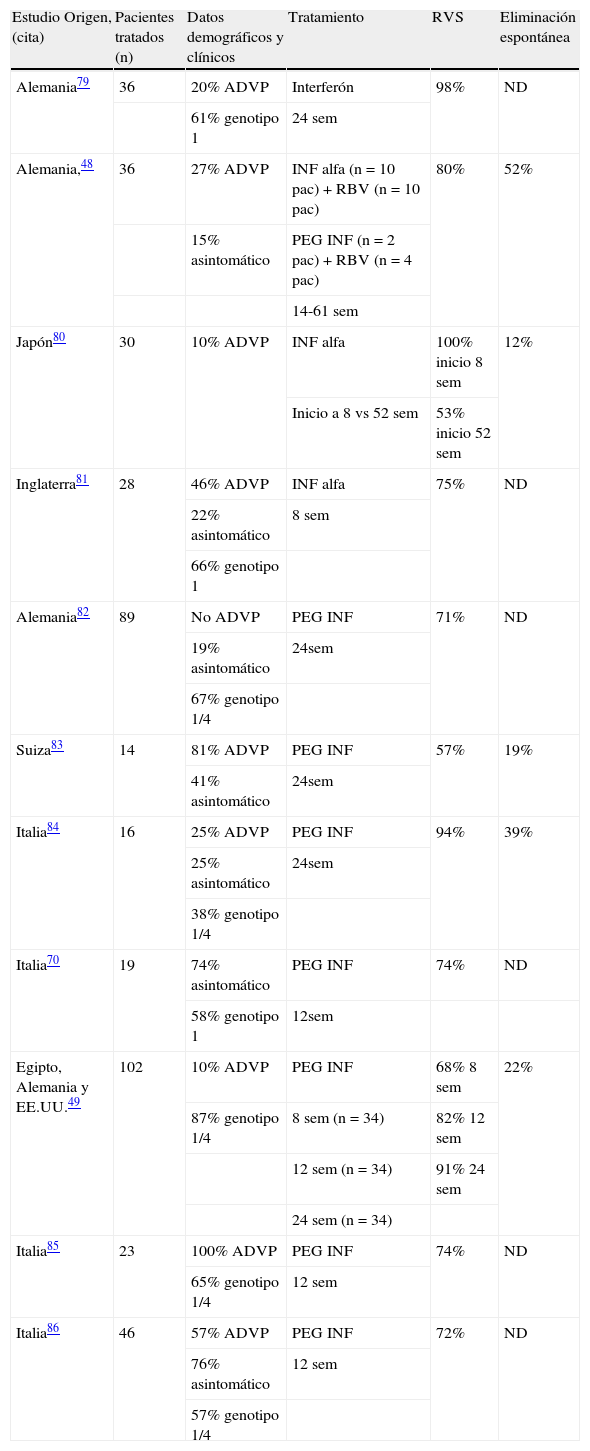
El tratamiento se debe iniciar entre la 8a y 12a semanas tras el diagnóstico, si no se ha resuelto espontáneamente la infección. Empezar el tratamiento inmediatamente tras el diagnóstico del paciente, puede significar que algunos pacientes que podrían aclarar de forma espontánea el virus sean expuestos a la terapia antiviral sin necesidad de ella; pero retrasarlo disminuiría su eficacia. La terapia generalmente es bien tolerada y se alcanza una RVS del 71-98% en los ensayos en pacientes monoinfectados tratados durante 24 semanas (tabla 2).
Tratamiento de la hepatitis aguda C en paciente monoinfectado.
| Estudio Origen, (cita) | Pacientes tratados (n) | Datos demográficos y clínicos | Tratamiento | RVS | Eliminación espontánea |
| Alemania79 | 36 | 20% ADVP | Interferón | 98% | ND |
| 61% genotipo 1 | 24 sem | ||||
| Alemania,48 | 36 | 27% ADVP | INF alfa (n=10 pac)+RBV (n=10 pac) | 80% | 52% |
| 15% asintomático | PEG INF (n=2 pac)+RBV (n=4 pac) | ||||
| 14-61 sem | |||||
| Japón80 | 30 | 10% ADVP | INF alfa | 100% inicio 8 sem | 12% |
| Inicio a 8 vs 52 sem | 53% inicio 52 sem | ||||
| Inglaterra81 | 28 | 46% ADVP | INF alfa | 75% | ND |
| 22% asintomático | 8 sem | ||||
| 66% genotipo 1 | |||||
| Alemania82 | 89 | No ADVP | PEG INF | 71% | ND |
| 19% asintomático | 24sem | ||||
| 67% genotipo 1/4 | |||||
| Suiza83 | 14 | 81% ADVP | PEG INF | 57% | 19% |
| 41% asintomático | 24sem | ||||
| Italia84 | 16 | 25% ADVP | PEG INF | 94% | 39% |
| 25% asintomático | 24sem | ||||
| 38% genotipo 1/4 | |||||
| Italia70 | 19 | 74% asintomático | PEG INF | 74% | ND |
| 58% genotipo 1 | 12sem | ||||
| Egipto, Alemania y EE.UU.49 | 102 | 10% ADVP | PEG INF | 68% 8 sem | 22% |
| 87% genotipo 1/4 | 8 sem (n=34) | 82% 12 sem | |||
| 12 sem (n=34) | 91% 24 sem | ||||
| 24 sem (n=34) | |||||
| Italia85 | 23 | 100% ADVP | PEG INF | 74% | ND |
| 65% genotipo 1/4 | 12 sem | ||||
| Italia86 | 46 | 57% ADVP | PEG INF | 72% | ND |
| 76% asintomático | 12 sem | ||||
| 57% genotipo 1/4 |
ADVP: adicción a drogas por vía parenteral; INF alfa: interferón alfa; pac: pacientes; PEG INF: interferón pegilado; RBV: ribavirina; sem: semanas; RVS: respuesta viral sostenida.
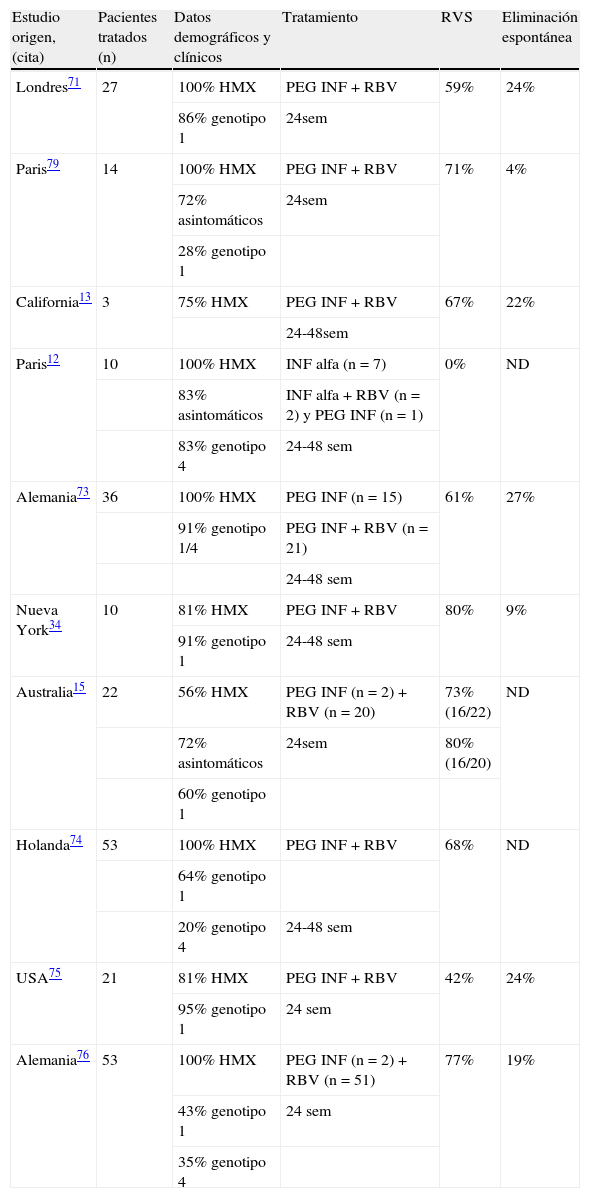
La mayoría de los datos disponibles de respuesta al tratamiento de la HAC en individuos infectados por el VIH son estudios realizados con pautas de 24 semanas de duración con terapia combinada con interferón pegilado más ribavirina. Estos estudios muestran un porcentaje muy variable de RVS del 0-80%12,13,15,33,71–76 (tabla 3), y menor a la observada en los individuos monoinfectados con HAC. Teniendo en cuenta el curso clínico de la HAC, la European AIDS Clinical Society (EACS)77 recomienda la intervención terapéutica temprana a partir de la semana 12 y evitar cualquier demora de tratamiento posterior que podría dar lugar a una disminución de la respuesta al tratamiento.
Tratamiento de la hepatitis aguda C en pacientes coinfectados por el VIH.
| Estudio origen, (cita) | Pacientes tratados (n) | Datos demográficos y clínicos | Tratamiento | RVS | Eliminación espontánea |
| Londres71 | 27 | 100% HMX | PEG INF+RBV | 59% | 24% |
| 86% genotipo 1 | 24sem | ||||
| Paris79 | 14 | 100% HMX | PEG INF+RBV | 71% | 4% |
| 72% asintomáticos | 24sem | ||||
| 28% genotipo 1 | |||||
| California13 | 3 | 75% HMX | PEG INF+RBV | 67% | 22% |
| 24-48sem | |||||
| Paris12 | 10 | 100% HMX | INF alfa (n=7) | 0% | ND |
| 83% asintomáticos | INF alfa+RBV (n=2) y PEG INF (n=1) | ||||
| 83% genotipo 4 | 24-48 sem | ||||
| Alemania73 | 36 | 100% HMX | PEG INF (n=15) | 61% | 27% |
| 91% genotipo 1/4 | PEG INF+RBV (n=21) | ||||
| 24-48 sem | |||||
| Nueva York34 | 10 | 81% HMX | PEG INF+RBV | 80% | 9% |
| 91% genotipo 1 | 24-48 sem | ||||
| Australia15 | 22 | 56% HMX | PEG INF (n=2)+RBV (n=20) | 73% (16/22) | ND |
| 72% asintomáticos | 24sem | 80% (16/20) | |||
| 60% genotipo 1 | |||||
| Holanda74 | 53 | 100% HMX | PEG INF+RBV | 68% | ND |
| 64% genotipo 1 | |||||
| 20% genotipo 4 | 24-48 sem | ||||
| USA75 | 21 | 81% HMX | PEG INF+RBV | 42% | 24% |
| 95% genotipo 1 | 24 sem | ||||
| Alemania76 | 53 | 100% HMX | PEG INF (n=2)+RBV (n=51) | 77% | 19% |
| 43% genotipo 1 | 24 sem | ||||
| 35% genotipo 4 |
HMX: varón homosexual; INF alfa: interferón alfa; pac: pacientes; PEG INF: interferón pegilado; RBV: ribavirina; sem: semanas; RVS: respuesta viral sostenida.
La discusión actual de la individualización del tratamiento en la hepatitis crónica C también influye en el debate de la HAC. Se han descrito varios factores predictivos de RVS en la literatura: la ictericia33,48, la importancia de la respuesta inmunológica78, la transmisión nosocomial, una carga viral baja, la edad menor de 30 años y la rápida reducción de la carga viral en las primera semanas15,49,50,72. En el paciente coinfectado, el presentar niveles altos basales de ALT así como un recuento elevado de CD471 y la negativización de ARN del VHC de forma precoz15,72 son los factores que se ha relacionado con la RVS.
ProfilaxisLa respuesta inmunitaria humoral que se produce ante el VHC no es efectiva. Los anticuerpos anti VHC no son bloqueantes del virus; de esta forma, el contagio por el VHC no produce inmunidad permanente frente a la reinfección por el mismo u otro genotipo de VHC. Así se han descrito casos de superinfección y reinfección por el VHC17,18.
El desarrollo de vacunas está limitado por la heterogeneidad del virus (genotipos, cuasiespecies) y la fácil evasión del virus a anticuerpos neutralizantes por su rapidez para mutar.
Es necesario destinar recursos para promover campañas educativas dirigidas a pacientes y médicos, insistir en la prevención específica en los grupos de riesgo, mejorar la detección y facilitar el tratamiento del VHC. La detección de anti VHC debe ser parte de la atención habitual de todos los pacientes homosexuales VIH y debemos tener un alto grado de alerta clínico ante la posibilidad de una infección concomitante por VHC para cualquier paciente que se presente con una enfermedad de transmisión sexual o que informe de haber presentado una exposición de alto riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.