Se han evaluado ensayos de fluorescencia ligada a enzima (VIDAS EBV VCA IgM, VIDAS EBV VCA/EA IgG y VIDAS EBV EBNA IgG (Biomérieux, Francia) para la determinación de marcadores de infección por el virus Epstein Barr, así como para el establecimiento de perfiles de anticuerpos, comparándolos con ensayos de inmunofluorescencia como referencia. Los ensayos evaluados han mostrado buenas características de sensibilidad, especificidad y coincidencia porcentual de resultados, lo que les hace adecuados para su aplicación en laboratorios de diagnóstico clínico.
Enzyme linked fluorescent assays (VIDAS EBV VCA IgM, VIDAS EBV VCA/EA IgG and VIDAS EBV EBNA IgG (Biomérieux, France) were evaluated to determine markers for infection of Epstein Barr virus, as well as to establish antibody profiles, compared with immunofluorescence assays as reference. The assays evaluated showed good values for sensitivity, specificity and agreement, making them useful for their application in clinical laboratories.
La mononucleosis infecciosa (MI) es un síndrome producido fundamentalmente por el virus Epstein Barr (VEB), aunque otros agentes también pueden causarlo, y entre estos el más importante es el citomegalovirus (CMV)1. Clásicamente el diagnóstico serológico de la MI se realiza mediante la detección de anticuerpos heterófilos. Sin embargo, la sensibilidad de este marcador es baja, especialmente en niños pequeños, grupo en el que son más frecuentes las infecciones por VEB. La determinación de IgM, marcador de elección en la mayoría de las infecciones virales, se complica en las infecciones por VEB debido a la reacción cruzada con CMV2, así como por la estimulación policlonal de linfocitos de memoria, que sucede frecuentemente en los casos de MI, y que puede dar lugar a una amplia reactividad IgM3. Por estas razones, es muy útil establecer perfiles de anticuerpos, combinando el estudio de IgG e IgM frente al antígeno de la cápside del virus (VCA) y anticuerpos frente al antígeno nuclear (EBNA), mediante técnicas de inmunofluorescencia. Estas técnicas son laboriosas, de difícil automatización, y su interpretación es subjetiva. En los últimos años se han desarrollado métodos automatizados para la determinación de marcadores serológicos de infección por el VEB, de ELISA, y de inmunoquimioluminiscencia (IQL), que han sido recientemente comparados4,5. El objetivo de este estudio fue la evaluación del sistema VIDAS, basado en ensayo fluorescente ligado a enzima, para la determinación de anticuerpos frente a diferentes antígenos del VEB.
Material y métodoMuestrasSe han estudiado 50 muestras de suero pertenecientes a otros tantos casos de MI. Estas muestras procedían de una colección previamente utilizada en la evaluación de métodos serológicos para el diagnóstico de infección por el VEB5. Empleando como criterios de referencia ensayos serológicos de inmunofluorescencia indirecta (IFI) para IgG e IgM anti-VCA e inmunofluorescencia anti-complemento (IFAC) para anticuerpos frente a EBNA, como se describe más adelante, 43 casos fueron clasificados en relación con el EBV como infección reciente (25 casos), como infección pasada (10 casos) o como negativos (ausencia de infección previa) (8 casos). Los casos de infección reciente mostraron presencia de IgM e IgG anti-VCA en ausencia de anticuerpos anti-EBNA (18 casos), o presencia de los 3 marcadores simultáneamente (5 casos) en ausencia de IgM anti-CMV, o presencia exclusiva de IgG anti-VCA (2 casos). Los casos de infección pasada mostraron resultado positivo de IgG anti-VCA y de anticuerpos anti-EBNA, y se definieron los casos como negativos, indicando por tanto ausencia de infección previa, cuando los 3 marcadores fueron negativos. Estos casos fueron utilizados para la evaluación de los ensayos para determinación de IgM anti-VCA, de IgG anti-VCA/EA y de IgG anti-EBNA, así como para establecer los diferentes perfiles en el sistema VIDAS.
Los 7 casos restantes procedían de infecciones primarias por CMV, documentados por detección de IgM específica y por presencia de IgG de baja avidez, y fueron empleados para valorar aspectos de especificidad en los ensayos para determinación de IgM, como marcador de infección reciente por VEB.
Métodos serológicosLas determinaciones de IgM e IgG frente a VCA se realizaron por IFI, empleando reactivos comerciales (Merifluor EBV VCA IgM IFA y Merifluor EBV VCA IgG IFA, Meridian Bioscience Inc., EE.UU.). La IgM se ensayó después de eliminar la IgG de la muestra, mediante un antisuero anti-IgG humana (RF Absorbens, Siemens, Alemania). El estudio de anticuerpos anti-EBNA se llevó a cabo mediante IFAC (Merifluor EBV NA test, Meridian Bioscience Inc.).
La IgM frente a CMV se determinó por ELISA indirecto (Enzygnost anti-CMV IgM, Siemens) y ELISA de captura (CMV-IgM-ELA Test PKS, Medac, Alemania), y la caracterización de la avidez de IgG específica se ha realizado por ELISA (Citomegalovirus IgG Avidity EIA Well, Radim, Italia).
Se han evaluado los métodos VIDAS EBV VCA IgM, VIDAS EBV VCA/EA IgG y VIDAS EBV EBNA IgG (Biomérieux, Francia). El ensayo de IgM utiliza el antígeno p18 del antígeno VCA; el ensayo de IgG emplea el antígeno p18 de VCA y el antígeno p54 del antígeno temprano (EA), y el de EBNA emplea el antígeno p72. Las determinaciones se han llevado a cabo en la plataforma Mini VIDAS (Biomérieux). Para los cálculos de coincidencia porcentual de resultados, sensibilidad, especificidad y coeficiente de probabilidad positivo y negativo los resultados indeterminados han sido considerados en las condiciones más adversas: si el resultado en el ensayo de referencia era positivo se consideraron negativos, y viceversa.
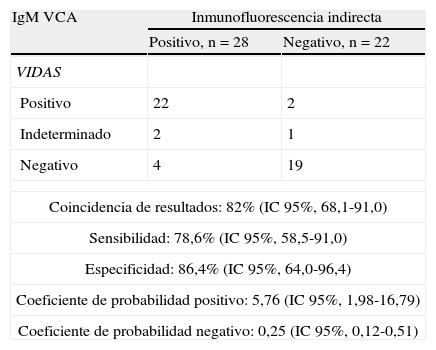
Resultados y discusiónLos resultados obtenidos por los ensayos en evaluación se han comparado con los de la técnica de referencia (IFI para IgM e IgG, e IFAC para anticuerpos anti-EBNA). Los valores de coincidencia porcentual de resultados, sensibilidad y especificidad de las determinaciones de IgM anti-VCA, IgG anti-VCA/EA e IgG anti-EBNA fueron del 82, del 78,6 y del 86,4%; del 93, del 91,4 y del 100%; y del 86, del 85,7 y del 86,7%, respectivamente (tabla 1).
Comparación de los ensayos VIDAS para la determinación de IgM anti-VCA, IgG anti VCA/EA e IgG anti-EBNA con ensayos de referencia
| IgM VCA | Inmunofluorescencia indirecta | |
| Positivo, n=28 | Negativo, n=22 | |
| VIDAS | ||
| Positivo | 22 | 2 |
| Indeterminado | 2 | 1 |
| Negativo | 4 | 19 |
| Coincidencia de resultados: 82% (IC95%, 68,1-91,0) | ||
| Sensibilidad: 78,6% (IC95%, 58,5-91,0) | ||
| Especificidad: 86,4% (IC95%, 64,0-96,4) | ||
| Coeficiente de probabilidad positivo: 5,76 (IC95%, 1,98-16,79) | ||
| Coeficiente de probabilidad negativo: 0,25 (IC95%, 0,12-0,51) | ||
| IgG VCA/EA | Inmunofluorescencia indirecta | |
| Positivo, n=35 | Negativo, n=8 | |
| VIDAS | ||
| Positivo | 32 | 0 |
| Indeterminado | 2 | 0 |
| Negativo | 1 | 8 |
| Coincidencia de resultados: 93% (IC95%, 79,9-98,2) | ||
| Sensibilidad: 91,4% (IC95%, 75,8-97,8) | ||
| Especificidad: 100% (IC95%, 59,8-100) | ||
| Coeficiente de probabilidad positivo: No aplicable | ||
| Coeficiente de probabilidad negativo: 0,09 (IC95%, 0,03-0,25) | ||
| IgG EBNA | Inmunofluorescencia anti-complemento | |
| Positivo, n=15 | Negativo, n=28 | |
| VIDAS | ||
| Positivo | 13 | 2 |
| Indeterminado | 1 | 2 |
| Negativo | 1 | 24 |
| Coincidencia de resultados: 86% (IC95%, 71,4-94,2) | ||
| Sensibilidad: 86,7% (IC95%, 58,4-97,7) | ||
| Especificidad: 85,7% (IC95%, 66,4-95,3) | ||
| Coeficiente de probabilidad positivo: 6,07 (IC95%, 2,40-15,36) | ||
| Coeficiente de probabilidad negativo: 0,16 (IC95%, 0,04-0,57) | ||
IC95%: intervalo de confianza del 95%.
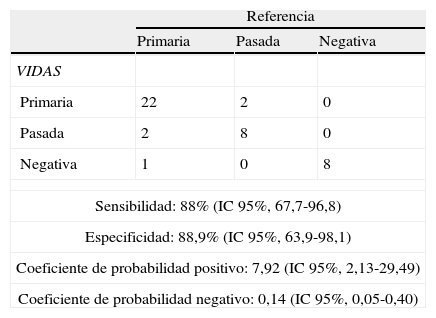
En lo que se refiere a los perfiles de anticuerpos, la combinación de los 3 métodos evaluados ha permitido identificar como infecciones primarias 22 de las 25 analizadas, excluyéndose la infección primaria en 16/18 estudiadas (tabla 2). Dos casos de infección pasada, de acuerdo con los criterios de referencia, mostraron en el sistema VIDAS perfil indicativo de infección primaria. Así la sensibilidad y la especificidad del sistema para el establecimiento de perfiles de anticuerpos han sido del 88 y del 88,9%, respectivamente.
Evaluación de perfiles de anticuerpos obtenidos por el sistema VIDAS
| Referencia | |||
| Primaria | Pasada | Negativa | |
| VIDAS | |||
| Primaria | 22 | 2 | 0 |
| Pasada | 2 | 8 | 0 |
| Negativa | 1 | 0 | 8 |
| Sensibilidad: 88% (IC95%, 67,7-96,8) | |||
| Especificidad: 88,9% (IC95%, 63,9-98,1) | |||
| Coeficiente de probabilidad positivo: 7,92 (IC95%, 2,13-29,49) | |||
| Coeficiente de probabilidad negativo: 0,14 (IC95%, 0,05-0,40) | |||
IC95%: intervalo de confianza del 95%.
Recientemente se ha documentado que el sistema VIDAS es una alternativa adecuada a los ensayos de inmunofluorescencia para el diagnóstico de infecciones por el VEB6. En el presente estudio la sensibilidad del ensayo para IgM ha sido mayor que la obtenida en ensayos de ELISA y de IQL que emplean igualmente el antígeno p18, aunque la especificidad ha sido menor5. En lo que se refiere al ensayo de IgG VCA/EA, el método evaluado mejora la sensibilidad de ensayos que emplean el antígeno p18 (inmunofiltración, IQL y ELISA), manteniendo una buena especificidad5. Este aumento en la sensibilidad puede ser debido a que el ensayo VIDAS incorpora un recombinante del EA. En tercer lugar, el ensayo para anti-EBNA muestra similares características de funcionamiento cuando se compara a otros ensayos automatizados5. Una posible causa que justifique las discrepancias en los ensayos para detectar respuestas frente a EBNA pueden ser que IFAC detecta anticuerpos frente a los distintos tipos de antígeno EBNA, en tanto que el VIDAS solo frente a EBNA-1. Es conocido que la positividad frente a EBNA-2 es más temprana que frente a EBNA-1, aunque se ha documentado que la respuesta anti-EBNA-2 solo es detectable a partir de los 2 meses7. Por último, en lo que respecta a los perfiles de anticuerpos que definen presencia de infección primaria, infección pasada o ausencia de infección, los valores de sensibilidad y especificidad de los métodos evaluados han sido similares a los obtenidos previamente en otros ensayos, tanto automatizados como manuales5. Independientemente del tipo de ensayo empleado, con cierta frecuencia se obtienen perfiles «indeterminados», basados bien en la presencia única de IgM específica (situación inusual en la práctica clínica, en el caso de las infecciones por VEB), bien en la presencia única de IgG (por fallo en la producción de IgM o en su detección), o bien por presencia de los 3 marcadores8, debido a la presencia de anticuerpos anti-EBNA-2, de emergencia más temprana7, que son detectables por IFAC pero no por las técnicas que emplean antígeno EBNA-1. En los 2 últimos supuestos resulta de gran utilidad la identificación de la IgG de baja avidez8, que permite la confirmación de los casos como infección primaria.
De acuerdo con esto, se procesaron con un ensayo previamente descrito para la caracterización de la avidez de IgG anti-VCA9 las 2 muestras de infección pasada de acuerdo con el criterio de referencia que mostraban perfil de infección reciente en VIDAS (tabla 2); ambas mostraron IgG de alta avidez, confirmándose de esta manera la infección pasada.
Aunque el reducido número de muestras estudiadas constituye una limitación de este estudio, los ensayos evaluados parecen ser aceptables para la determinación de marcadores serológicos de infección por EBV, así como para el establecimiento de perfiles serológicos del virus, haciéndose evidente la necesidad de mantener ensayos de referencia que permitan la correcta identificación de perfiles atípicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.