Introducción
Habitualmente, tendemos a comparar los virus en general, y el virus de la inmunodeficiencia humana (VIH) en particular, con otros microorganismos en cuanto a los abordajes y estrategias que permitan instaurar el tratamiento antimicrobiano más adecuado. En este contexto los datos más importantes son los tests de resistencia y las concentraciones de fármaco en sangre como parámetros intermedios del éxito o fracaso terapéutico.
Los mecanismos de adaptación biológica de los virus al hospedador son muy diferentes a los de otros agentes microbianos como las bacterias: la cinética de replicación, la plasticidad enzimática y los mecanismos de escape de los virus son mucho más sofisticados, potentes y desconocidos que en el caso de las bacterias. Los fármacos de los que se dispone, y especialmente sus parámetros farmacocinéticos y farmacodinámicos, son también diferentes. Por este motivo, la individualización del tratamiento en la infección por el VIH es un problema extremadamente complejo, sobre todo en el paciente en el que fracasa el tratamiento antirretroviral (TARV).
En este capítulo se analiza críticamente la evidencia científica referente a la sensibilidad del VIH a los distintos fármacos y los niveles de antirretrovirales como herramientas potencialmente útiles en pacientes que se encuentran ya en tratamiento.
Pruebas de resistencias
A pesar de que en la actualidad se dispone de tratamientos altamente eficaces, un número importante de los pacientes en tratamiento presentan cargas virales que son detectables en plasma, lo cual traduce la existencia de fracaso terapéutico. A pesar de que existen varias posibles explicaciones para el fracaso como la mala adherencia del paciente, la inadecuada potencia del régimen seleccionado, la pobre absorción de alguno de los fármacos y las interacciones medicamentosas, la resistencia a antirretrovirales sigue siendo uno de los inconvenientes fundamentales en el tratamiento clínico del paciente con infección por VIH. El problema de las resistencias cruzadas conlleva, además, a una limitación mayor de las medicaciones existentes, lo que obliga a que debamos usar estos fármacos de la manera más efectiva posible. Los tests de resistencia han pasado de ser una prueba utilizada en la investigación básica a convertirse en una herramienta clínica que ayuda a conseguir el objetivo final de todo el TARV, que es alcanzar la carga viral indetectable.
En la revisión que va a llevarse a cabo nos referiremos fundamentalmente al uso de la determinación de resistencias en el paciente que fracasa al TARV para individualizar su tratamiento. En los últimos años han sido numerosos los trabajos retrospectivos que mostraban que el uso de los tests de resistencia predecían la respuesta a las terapias de rescate, y también estudios aleatorizados han mostrado beneficios a corto plazo en la respuesta en los regímenes basados en los estudios de resistencias. Así, todas las guías de TARV, tanto generales como específicas de resistencias, que se han publicado en los últimos 2 años recomiendan la incorporación de los tests de resistencia en los pacientes que experimentan fracaso a un determinado TARV1-6.
Ninguna de las técnicas que se analizan en esta revisión, en especial los tests de resistencia sustituyen a la historia de los antirretrovirales que haya tomado previamente el paciente, y ésta resulta además básica a la hora de interpretarlos.
Métodos de laboratorio para la determinación de resistencias
Los ensayos de resistencias utilizan diferentes tecnologías que aportan información complementaria acerca de la sensibilidad de los antirretrovirales. Los dos métodos disponibles estudian el genotipo y el fenotipo7. El estudio del genotipo aporta información sobre mutaciones virales que resultan en cambios de la susceptibilidad viral a una droga en particular o a una determinada familia. El fenotípico mide directamente el nivel de susceptibilidad del virus del paciente a una medicación determinada in vitro. Los valores medidos en la muestra del paciente son comparados con un aislado "silvestre" (también conocido como salvaje) viral de referencia. El grado de resistencia fenotípica se calcula como el cociente entre la concentración de fármaco necesaria para inhibir el 50% de la replicación viral en cultivo del virus del paciente respecto al virus de referencia (fold o número de veces). En la actualidad, todos los métodos utilizan la reacción en cadena de la polimerasa (PCR) para amplificar los genes de interés (transcriptasa inversa y proteasa) a partir del ARN viral plasmático del paciente y secuenciarlo y/o generar virus recombinantes.
Métodos genotípicos
Se basan en el análisis de secuencias específicas del genoma del VIH con el fin de comprobar si existen mutaciones asociadas a la resistencia antirretrovirales. Existen varias técnicas diferentes de análisis tras la amplificación, siendo dos las más comúnmente utilizadas:
1. Secuenciación. Es el método de referencia. Obtiene una información completa acerca de la secuencia de ADN de la región del genoma viral amplificada previamente por PCR, a partir de ella se deduce la secuencia de aminoácidos, la cual se compara con la de una cepa de referencia del VIH (también llamada de consenso). El último paso, y quizás el más complejo, es la interpretación de resultados, desde el punto de vista de su relevancia clínica, y como elemento de toma de decisiones terapéuticas en el paciente en fracaso.
Existen los siguientes métodos comerciales además de otros métodos caseros o in home:
a)HIV Genotyping System® (Perkin Elmer/Applied Biosystems).
b)Trugene HIV-1 Genotyping System® (Visible Genetics). Es el único aprobado por la Food and Drug Administration (FDA), a principios de septiembre de 2001.
2. Detección de mutaciones puntuales. Basado en la hibridación mediante sondas específicas (LiPA), identifica mutaciones selectivas ya predeterminadas. Aquellas mutaciones que la prueba no incluye no podrán ser observadas ni ser descartada su presencia.
Los tests genotípicos miden la resistencia de una forma indirecta y además son difíciles de interpretar. El número de mutaciones conocidas, así como el significado de éstas, es grande y continúa creciendo. Además, hay mutaciones que pueden interactuar con otras afectando la resistencia viral, lo cual complica más su interpretación. El uso de algoritmos computarizados (rule-based) parece que va a ser de ayuda en un futuro cercano, aunque todavía estén en sus inicios, lo que hace que no estén convenientemente desarrollados, lo cual conlleva a que las variaciones en la interpretación de los genotipos sea muy heterogénea entre los diferentes centros que han elaborado estos programas8.
Otra limitación es que no detectan variantes cuando constituyen menos del 20% de la población viral total (excepto los métodos de detecciones puntuales que, en este sentido, son más sensibles, y pueden detectar subpoblaciones virales que constituyan el 5-10%).
Los métodos genotípicos presentan como ventaja que son relativamente sencillos desde el punto de vista técnico en su realización, por lo que pueden realizarse en bastantes laboratorios, y que los resultados, aunque dependen de cada centro, suelen estar disponibles en 2 semanas.
Parece existir un grado de correlación razonable en la comparación LiPA/secuenciación, grado de concordancia del 73-98%9.
Métodos fenotípicos
Definen la concentración de fármaco que inhibe el crecimiento en cultivo de una determinada cepa viral, dando una medida directa de la sensibilidad frente a los diferentes antirretrovirales. El resultado se expresa como la IC50 o IC90. Existen fundamentalmente dos métodos semiautomatizados, que se basan en la utilización de virus recombinantes que determinan la sensibilidad del VIH a todos los antirretrovirales disponibles de forma eficaz. Existen tres métodos comerciales:
1. Phenosense® (ViroLogic): una IC50 mayor de 2,5 veces superior en la cepa viral estudiada con respecto a la que se usa como control (NL4-3), se considera resistente.
2. Antivirogram® (Virco): en este método, los virus con IC50 mayor de 4 veces la de la cepa que se usa como control en esta técnica (HXB-2) se consideran resistentes.
3. Viralliance®: se basa en virus recombinantes y la infección de una célula con un gen indicador que se activa con la infección viral. Las "veces" que considera están por definir.
Los métodos fenotípicos presentan la ventaja de informar de manera directa de la sensibilidad a los diferentes fármacos, y resultan para el clínico de más fácil la interpretación que los genotípicos. Informa además acerca de las resistencias cruzadas. Sin embargo, presentan en la actualidad una serie de inconvenientes que impiden su utilización clínica: además de no detectar poblaciones virales minoritarias, aportan información a nivel de un antirretroviral de forma individual pero no de la respuesta que se obtendrá si se usan en combinación, son muy laboriosos en su realización y sus resultados están aún menos estandarizados y validados clínicamente (como comentaremos posteriormente las IC50 de algunos antirretrovirales ha debido ser modificada basándose en los resultados obtenidos en la práctica clínica), lo que hace que se disponga de ellos en un número muy limitado de laboratorios (sólo comerciales y/o de investigación).
Evidencias en el uso de los tests de resistencias
La evidencia científica de la utilidad de los tests de resistencia se ha ido acumulando a lo largo de estos últimos años. Hasta la fecha han sido numerosos los estudios retrospectivos y también los prospectivos, aleatorizados10-17 que demuestran la utilidad clínica de los tests de resistencia.
En el año 1999 se constituyó el Resistance Collaborative Group que estableció una metodología estándar, que consiguiera la mayor homogeneidad, y reanalizó los resultados de los estudios que evaluaban la correlación entre resistencia genotípica o fenotípica y fracaso virológico18. De los trabajos que evaluaron, en la mayoría de ellos el estudio de resistencias fue retrospectivo y sólo en dos el diseño era prospectivo y además aleatorizado10,12. La conclusión fundamental fue que tanto el genotipo como el fenotipo son capaces de predecir el fracaso virológico, con independencia de que estas variables se ajusten por otros factores de confusión (carga viral basal, número de nuevos fármacos en el régimen). En la mayoría de los estudios, la odds ratio (OR) del fallo virológico se redujo en aproximadamente 2 veces para cada fármaco adicional al que el paciente fuera susceptible en el nuevo régimen de acuerdo al genotipo, y en aproximadamente 2-3 veces para cada fármaco adicional al que el virus fuera susceptible en función del fenotipo.
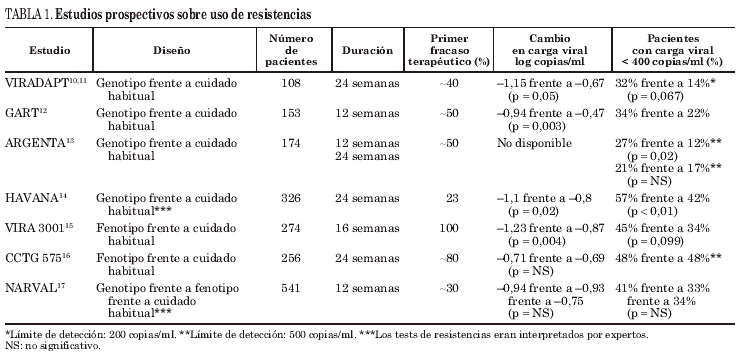
A estos estudios retrospectivos hay que añadir que se han realizado varios estudios prospectivos, aleatorizados y controlados para valorar la eficacia de los tests de resistencia en la respuesta virológica. Se desea destacar los representados en la tabla 1. Cuatro de estos estudios10,12,14,15 demostraron un beneficio en la respuesta virológica, en aquellos pacientes en los cuales los cambios de medicaciones fueron guiados por tests de resistencia en comparación con los que el cambio se realizó exclusivamente sobre la base de los cuidados habituales del médico responsable. El seguimiento en el GART y VIRA 3001 fue corto, de 12 y 16 semanas, respectivamente, pero en el HAVANA y VIRADAPT fue de 24 semanas. En este último destacó que el beneficio persistía a las 48 semanas en el grupo de tratamiento dirigido por genotipo (30% con carga viral indetectable), y se hacía patente también en el grupo control, en los que tras la finalización del ensayo a los 6 meses, de una forma abierta se ofrecía tratamiento guiado por genotipo, pasando el porcentaje de pacientes con carga viral indetectable del 14 al 30,5% al año11.
Más recientemente, en el estudio HAVANA, 326 pacientes, de los cuales más del 75% tenían dos o más fracasos, se aleatorizaron en un estudio de 4 brazos: genotipo con consejo de expertos, genotipo sin consejo de expertos, cuidado habitual con consejo de expertos y cuidado habitual sin consejo de expertos. Los resultados en "el análisis por protocolo" (no hacemos referencia a los de intención de tratar, por basarse en los datos de la última observación efectuada y no hacer referencia en la publicación al número de pacientes en cada momento del seguimiento), a los 12 meses, el grupo de genotipo obtuvo una reducción significativamente superior de la carga viral que el grupo de cuidado habitual (tabla 1). Cuando se compararon los grupos en función del consejo de expertos se observó que el 59% de los que lo tuvieron, alcanzó carga viral indetectable (< 400 copias/ml) frente al 41% de los que no lo recibían (p = 0,027)14,19. En el análisis multivariante, el uso del genotipo y el consejo de expertos (sólo en el segundo fracaso) se relacionaron con la presencia de carga viral indetectable. El estudio GART12 también incluía en su diseño el consejo de expertos, pero la respuesta al mismo nunca podrá ser valorada, ya que el 42% de los clínicos no siguieron el consejo que los expertos les habían dado.
Pero no todos los estudios de resistencias han demostrado una mejoría en la respuesta virológica, así en el CCTG 57516, 256 pacientes en los que el tratamiento había fracasado, de los cuales en el 80% era su primer fracaso y el 76% eran vírgenes para inhibidores de la transcriptasa inversa no nucleósidos (ITINN) se aleatorizaron a realizar fenotipo o cuidado habitual. A las 24 y 48 semanas no se observaron diferencias, ni clínica ni estadística, en la reducción de la carga viral ni en el porcentaje de pacientes que presentaban carga viral indetectable (48% en los 2 brazos a los 6 meses). Hay varias razones que explican estos resultados. La primera de ellas es que la respuesta virológica en el grupo de cuidado habitual es claramente superior a la de cualquier otro estudio, la segunda es que la mayoría de estos pacientes venían de un estudio de tratamiento con nelfinavir (NFV) como primer TARV, es conocido que el rescate de este tipo de pacientes es más sencillo que en otras situaciones. Por último, los grupos estaban mal balanceados en la aleatorización cuando se investigó posteriormente, ya que se observó que los pacientes que tenían resistencia a tres o más inhibidores de la proteasa (IP) eran claramente superiores en el grupo asignado a fenotipo.
El estudio NARVAL17 tampoco demostró beneficio del uso de los tests de resistencia en términos de respuesta virológica, pero presenta varios aspectos que hacen que resulte de interés el análisis posterior de este trabajo. En primer lugar, se trata de un estudio con paciente muy pretratados (media de antirretrovirales tomados por los pacientes, 7). Aproximadamente el 50% de los pacientes del grupo de cuidado habitual recibieron fármacos nuevos en el tratamiento de rescate instaurado comparando con el 20% en el grupo de fenotipo y 28% en el del genotipo, los investigadores informaban a los clínicos en el estudio fenotípico con una lista de posibles regímenes basados en el grado de resistencia de una forma que no está validada que sea efectiva (así, si un aislado era resistente a didanosina [ddI] por 2 y a estavudina [d4T] por 4 se recomendaba el uso de ddI) y, por último y quizá más importante, el grado de resistencia cruzada existente entre los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) no estaba reconocido en aquel momento, y así, se informaban como sensibles a d4T aislados con alto nivel de resistencia a zidovudina (AZT) (los pacientes del grupo genotipo y fenotipo tomaron de forma significativamente superior d4T que los del grupo de cuidado habitual, que tomaron de forma mayor abacavir (ABC) que en el aquel momento acababa de estar disponible en Francia).
Por último, recientemente se ha publicado un metaanálisis20, que incluye 6 ensayos clínicos10,12-15,17, las características de los pacientes pueden observarse en la tabla 1, pues en ella se incluyen los 7 estudios que analizan estos autores. Al analizar en conjunto la validez del genotipo (1.471 pacientes), el porcentaje con carga viral indetectable a los 3 meses (era el objetivo primario del metaanálisis pues todos los estudios que analizaban el genotipo disponían de esta información) fue del 42,6% frente al 33,2% de los pacientes tratados según el cuidado habitual (OR, 1,7; intervalo de confianza [IC] del 95%, 1,3-2,2; test de heterogeneidad, 0,60). El mismo análisis a los 6 meses (cuatro de los estudios aportaban esta información) dio como resultado que el 38,8% del grupo genotipo frente al 28,7% del grupo de cuidado habitual (OR, 1,6; IC 95%, 1,2-2,2; test de heterogeneidad, 0,65) presentaban carga viral indetectable. El fenotipo (sólo dos estudios lo evaluaban) no mostró diferencias significativas frente al cuidado habitual (OR, 1,1; IC 95%, 0,8-1,6). Analizando el consejo de expertos (subgrupo limitado a 2 estudios), el 50,7 frente al 35,8 alcanzaron la indetectabilidad según dispusieran o no de ellos, respectivamente (OR, 2,4; IC 95%, 1,5-3,7; test de heterogeneidad 0,30).
Interpretación de los tests de resistencias
Genotipo
Tal y como demostró el estudio HAVANA la interpretación de los resultados es un aspecto que debe tenerse muy en cuenta a la hora de evaluar los tests de resistencia.
Un aspecto fundamental en la interpretación de los resultados por parte del clínico exige el conocimiento de la historia de los antirretrovirales previamente utilizados y que han fracasado, dado que puede haber cuasi especies virales minoritarias no detectadas con los tests de resistencia, como por ejemplo sucede en pacientes que llevaron en un momento determinado lamivudina (3TC) y que cambiaron a otro régimen sin 3TC. La realización de un test de resistencia tras el fracaso de este último podría no evidenciar la mutación M184V/I, que está escondida y que rápidamente aparecerá en cuanto se reintroduzca la medicación. Otro ejemplo lo constituyen los pacientes que abandonan el TARV tras un fracaso: al cabo de aproximadamente un mes la población viral predominante que presentará el paciente es wild type y poco tiene que ver el genotipo de este momento con el del fracaso.
El problema de no clasificar de manera adecuada un virus como sensible o resistente, haría variar totalmente los resultados de los estudios comentados en el apartado anterior. Dependiendo del informe que recibamos, el facultativo debe decidir, en función de las mutaciones que se observen, el régimen más adecuado, o fiarnos de la transformación que hacen de las mutaciones presentes al informe, en que señalan que el virus es resistente o sensible a un antirretroviral determinado o a una familia de éstos.
A la hora de interpretar las mutaciones asociadas a resistencia cabe destacar que la IAS ha actualizado la lista en diciembre de 200121 (tablas 2 y 3). Hay aspectos muy relevantes para determinar en qué situaciones va a fracasar un tratamiento determinado, aunque recogido con más detalle en las citadas tablas, destacan los siguientes:
1. Inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN):
a)Multi-ITIAN (NAM). Acumulación de mutaciones M41L, D67N, K70R, L210W, T215Y/F, K219Q/E que producen resistencia a todos los análogos comercializados hasta la fecha, salvo la 3TC, a pesar de que no afectan de igual manera a todos los ITIAN (AZT > d4T > ABC > ddI). El concepto multi-ITIAN (NAM) parece poder aplicarse cuando estén presentes todas o al menos cinco de las mutaciones comentadas.
b)Multi-ITIAN complejo 151. Resistencia a todos los ITIAN.
c)Multi-ITIAN complejo 69. Resistencia a todos los ITIAN (salvo al DAPD [análogo de la guanosina], no comercializado todavía).
2. Inhibidores de la transcriptasa inversa análogos de nucleótidos (ITIANT):
a)Multi-ITIAN complejo 69. Resistencia al tenofovir (TDF).
b)Multi-ITIAN complejo 151. El TDF mantiene la sensibilidad.
c)Multi-ITIAN (NAM). Datos in vitro parecen mostrar que la presencia de cuatro o más NAM conlleva aumento significativo de la resistencia a TDF, aunque parece ser que la presencia de la M41L o, sobre todo, la L210W, es imprescindible para que esto se produzca.
3. Inhibidores de la transcriptasa inversa no nucleósidos (ITINN):
a)Multi-ITINN. La presencia de cualquiera de las siguientes mutaciones por sí sola ya reduce la utilidad clínica de todos los ITINN disponibles en la actualidad. K103N y Y188L.
b)Multi-ITINN por acumulación de mutaciones. La asociación de dos o más de las siguientes prácticamente invalida todos los ITINN comercializados. L100I, V106A, Y181C/I, G190S/A y M230L.
4. Inhibidores de la proteasa:
a)Resistencia multiproteasa. La acumulación de las siguientes mutaciones en número de 4-5 (L10F/R/I/V, M46I/L, I54V/M/L, V82/A/F/T/S, I84V, L90V) conlleva una resistencia multiproteasa.
b)Para mutaciones puntuales de cada IP, consultar las tablas 2 y 3.
c)Con lopinavir (LPV) no están definidas las mutaciones primarias y secundarias. La acumulación de 6 o más de las mutaciones que le confieren resistencia conlleva disminución de la respuesta. La acumulación de 8 o más lleva posiblemente al fracaso de tratamiento. Las mutaciones en las posiciones 10, 20, 54 y 82 se han asociado a reducción de la respuesta22.
La manera más común de interpretar el genotipo está basada en algoritmos informáticos (rules-based). Este método se basa en la identificación de mutaciones "clave" para cada medicación según un panel de expertos, basándose en su consejo se establece un algoritmo que interpreta los resultados de las mutaciones que aparecen en el estudio genotípico. Estos algoritmos se generan de forma automática a través de programas informáticos (VGI TrueGene software, ABI HIV-GT, RetroGram, Base de datos Stanford, ANRS/CREST/JAMA guidelines, etc.), siendo TrueGene el aprobado recientemente por la FDA.
El principal problema que presenta esta interpretación radica en la heterogeneidad que se observa en la valoración de un mismo genotipo por diferentes centros tal y como demuestran varios estudios8,23,24; sin embargo, la variabilidad intracentro es escasa. Quizás una novedad a este respecto la introduce Shafer et al25 en el estudio de secuencias genotípicas de 2.237 pacientes (no están incluidos LPV ni TNF), utilizando 3 algoritmos diferentes realizan 31.318 interpretaciones (2.237 secuencias x 14 drogas). Obtienen una concordancia del 81%. Aproximadamente tres cuartas partes de las discordancias implicaban a ABC, ddI, d4T, zalcitabina (ddC) y amprenavir (APV). Es conocida que la interpretación precisa a estos antirretrovirales no está claramente determinada. En el caso de la ddI y la d4T, se detectan resistencias fenotípicas claras en muy raras ocasiones, lo que conlleva que la correlación con el genotipo sea difícil de establecer. En el caso de ABC posiblemente aplicando los nuevos cutoffs26, los resultados de concordancia que los correlacionen con el genotipo mejoren, dato que parece confirmarse con el trabajo de Benn-Tiktak et al27 que observan niveles de concordancia del 85-96% para IP, del 89-94% ITINN y sólo del 71-90% para ITIAN, y atribuyen la falta de correlación exclusivamente a ddC, ddI y d4T.
Estos algoritmos requieren actualizaciones frecuentes y rápidas en consonancia con los avances en la información disponible. Alternativamente, los clínicos pueden trabajar on-line, con algunas de las bases de datos que en la actualidad ofrecen interpretación de los genotipos de los que nosotros dispongamos (nosotros introducimos las mutaciones de que disponemos en nuestros informes y ofrecen la interpretación, algunos de forma gratuita), lo cual obliga a los que opten por esta forma a conocer que el sitio en el que trabajamos on-line sea actualizado de forma aceptable (cabe destacar la Stanford HIV RT and Protease Sequence Database, http://hivdb.stanford.edu/hiv y Los Alamos HIV Sequence Database http://hiv-web.lanl.gov).
Otro problema en la interpretación de genotipos viene determinado por la predicción del efecto que pueda tener la interacción que pueda producirse entre las diferentes mutaciones según aparezcan solas, o asociadas varias de ellas entre sí. Así, datos recientes28 (L. Romano, G. Venturi, S. Bloor. Manuscrito pendiente de publicación en AIDS) demuestran que la presencia de las mutaciones E44D y V118I en el gen de la TI, disminuyen la susceptibilidad no sólo a 3TC, sino también a la mayoría de los ITIAN principalmente a ABC y d4T. Por lo tanto, las mutaciones 44 y 118 en presencia de mutaciones a AZT puede tener implicaciones importantes provocando multirresistencia a esta familia de antirretrovirales. Se han comunicado asimismo interacciones entre cambios genotípicos que se producen después de un fracaso virológico con ITIAN e ITINN. Algunos individuos portadores de las mutaciones 41L y 215Y, asociadas al tratamiento con AZT, muestran una sensibilidad disminuida a los ITINN. Con frecuencia se asocian a cambios en las posiciones 98 y 108, que, cuando coexisten con las mencionadas mutaciones a AZT, comportan un notable incremento de la resistencia a nevirapina (NVP)29,30. Estos trabajos deberán ser confirmados por distintos laboratorios.
Fenotipo virtual
Otra aproximación para interpretar el genotipo está basado en identificar genotipos similares en otros aislados de VIH, para los cuales el fenotipo es conocido. Este método ha sido desarrollado por Virco, creando una base de datos de 20.000 aislados clínicos en los cuales se conoce el genotipo y fenotipo. La respuesta se basa en la probabilidad de que pueda emparejarse la muestra de nuestro paciente con las de la base de datos obteniendo un resultado "virtual" para nuestro paciente. Hasta ahora, los resultados, recogidos por la empresa propietaria del software, son buenos con correlaciones superiores al 80% para la mayoría de las medicaciones31 e, incluso, en el análisis de 191 muestras del estudio VIRA 3001 mostró que el fenotipo virtual predecía la respuesta mejor que la interpretación del genotipo32. De todos modos, cabe señalar que este estudio fue diseñado para comparar fenotipo con cuidado habitual, incluyendo 274 pacientes (v. tabla 1).
Presenta como ventaja que reduciría la interpretación compleja del genotipo a un fenotipo sencillo basado en el análisis de numerosos genotipos similares al que se desea estudiar. Como inconvenientes, la fiabilidad del resultado dependerá del número de emparejamientos que puedan producirse entre los codones de la muestra real y los de la base de datos, y por otro lado, su correlación con el fenotipo real va a ser muy baja para los nuevos fármacos que van saliendo, ya que los genotipos que presenten los pacientes tratados con ellas no van a poder emparejarse con los de la base de datos, pues serán escasos o no existirán.
La utilidad clínica del fenotipo virtual todavía debe ser validada por estudios prospectivos, que se están realizando en la actualidad.
Fenotipo
Se han utilizado diferentes criterios para definir la resistencia fenotípica. El más habitual, el incremento en 2,5-4 y 10 veces en la IC50 o IC90, se ha considerado como indicativo de resistencia a un determinado fármaco33. Sin embargo estos valores han sido, muchas veces, empíricos basados en la variabilidad intraensayo. Además, los valores considerados como normales pueden variar desde 2,5 veces para saquinavir (SQV) y APV hasta 10 veces para delavirdina (DLV)34. Estos rangos normales están definiendo los puntos de corte biológicos para cada antirretroviral. Pero, aunque esto es ya un avance, se necesitan puntos de corte clínicos, que definan a partir de qué nivel de resistencia un paciente no va a responder al tratamiento. Hasta la fecha se han definido puntos de corte clínicos para pocos antirretrovirales, ABC, d4T, ddI y LPV.
Lanier et al26 observaron en pacientes a los que añadió ABC al régimen que llevaban de base, que el punto de corte clínico que definía la respuesta variaba del previamente establecido como biológico, situándose en 4,5 veces el límite que separaba la actividad total de la parcial (74% de respuesta por debajo del 4,5; 50% entre 4,5-6,5 y 14% por encima de 6,5). Del mismo modo, ViroLogic ha redefinido la resistencia a d4T y ddI como un incremento mayor de 1,7 veces en la IC50 de estos fármacos con respecto al control, basado en que la respuesta clínica de los pacientes (tratados previamente con AZT) con IC50 superiores a esta cifra no obtenían respuesta a la d4T en monoterapia o ésta era muy limitada (además se correlacionó con las mutaciones presentes a AZT en el momento del cambio)35. La definición de resistencia a un fármaco con un número de veces inferior a tres es muy discutible, teniendo en cuenta que la variabilidad intramuestra de las distintas técnicas varía entre uno y dos fold. Aunque a nivel del estudio con gran número de muestras sea válido que 1,7 veces es significativamente diferente de 1, la dispersión de los resultados no permite concluir en estos rangos si un paciente concreto es resistente o no a un fármaco determinado. La modificación del número de veces probablemente refleja más nuestro desconocimiento de los mecanismos de resistencia a determinados fármacos y las limitaciones técnicas de las pruebas actualmente utilizadas, por lo que un número inferior a 2,5-3 debe interpretarse con precaución, cuando se busca la individualización del tratamiento en un paciente determinado, debido a la variabilidad del ensayo.
En cuanto a LPV, el 87% de los pacientes con una IC50 menor de 20 veces (PhenoSense), alcanzaron carga viral indetectable36, aunque todos ellos llevaban efavirenz (EFV) asociado en la terapia de rescate, siendo previamente vírgenes de ITINN. Estos datos contrastan con los de Harrigan et al37 que concluyen que en los pacientes con alto nivel de resistencia a otros IP (principalmente indinavir [IDV] y ritonavir [RTV]) presentan una susceptibilidad disminuida a LPV, aunque no ofrecen datos de IC50, observan una resistencia cruzada de LPV con RTV e IDV que presenta un coeficiente de determinación del 0,8 y 0,7 respectivamente.
Posiblememte ViroLogic, en los próximos meses añada a la lista de antirretrovirales con cut-off clínicos el TNF. El punto de corte biológico se ha establecido en 3,0 utilizando aislados de pacientes vírgenes. Representa que el 97,5% de los sujetos con la cepa silvestre, tiene un fenotipo de menos de 3 veces. Harrigan et al38, estudiando 5.000 aislados de pacientes previamente tratados (pero que no habían tomado TNF), observó que el 88% tenían una IC50 menor de 3 veces, con sólo el 4% mayor de 5 veces. Además, investigadores de Gilead39 han demostrado que pacientes con un fenotipo de hasta 4 veces responden al tratamiento cuando el TNF se añade a un tratamiento establecido. Por lo tanto, aunque todavía no sea definitivo, parece ser que el punto de corte clínico de TNF se va a situar en 4 veces.
Por último, debe tenerse en cuenta, además, que un punto de corte para un antirretroviral, que se deriva de un estudio determinado, tiene pocas probabilidades de poder ser aplicado a todos los pacientes y en todas las situaciones.
Subtipos no B de VIH y test de resistencias
La epidemia de VIH-1 en los países occidentales ha sido predominantemente debida al subtipo B. En España, un estudio reciente ha mostrado que el 4,4% de los pacientes eran portadores de subtipos no B40. Aunque todavía queda mucho por conocer a este respecto, los datos iniciales parecen indicar que las mutaciones primarias son similares en los subtipos B y no B, observándose mayor número de mutaciones secundarias en los subtipos no B41.
La elevada prevalencia de mutaciones secundarias, en algunos subtipos no B, puede que tenga implicaciones en los tratamientos de segunda línea y en las terapias de rescate.
Datos preliminares sugieren que los ensayos de resistencias genotípicas comercializados son capaces de detectar mutaciones que sean clínicamente relevantes42. Asimismo, parece que no hay una reducción significativa de la sensibilidad fenotípica, en subtipos no B con mutaciones secundarias43.
Monitorización de niveles terapéuticos
A pesar de que se disponga de datos genotípicos y fenotípicos, todavía no existe una definición clara entre la resistencia del VIH a determinados antirretrovirales y la respuesta terapéutica. Para ello, es necesario considerar las bases biológicas de la resistencia, su valor de medida y los factores farmacológicos que influyen en la eficacia virológica de los fármacos considerados. En este sentido, cada vez es mayor la importancia de los estudios farmacocinéticos, siendo los valores de fármaco un importante factor que debe tenerse en cuenta entre los muchos que afectan el éxito de un TARV. Deben considerarse diferentes parámetros, como las concentraciones plasmáticas, los niveles intracelulares y su papel en el fracaso terapéutico, el porcentaje de unión a las proteínas plasmáticas y las diferencias entre los niveles de α -glicoproteína en voluntarios sanos y pacientes VIH+.
De las tres familias de antirretrovirales disponibles, ITIAN, ITINN e IP sólo en estas dos últimas puede correlacionarse el compuesto que se mide con la actividad farmacológica. Los ITIAN son profármacos que requieren activación intracelular para trasformarse en el metabolito trifosfato activo. Se ha observado que las concentraciones plasmáticas de AZT y 3TC se correlacionan poco con la forma trifosfato intracelular, por lo que no pueden utilizarse para predecir los valores del metabolito activo44. La medición del trifosfato activo intracelular presenta una variabilidad interpaciente e intrapaciente tan amplia que la invalida para el uso clínico45, aunque el desarrollo de un nuevo ensayo enzimático para medir el nivel de 3TC trifosfato parece que puede cambiar este panorama en un futuro próximo46.
Por ello, nos referiremos a la monitorización de niveles plasmáticos de los ITIAN e IP.
Evidentemente, la capacidad de que una cepa viral específica comprometa la eficacia terapéutica de un tratamiento está estrechamente ligada a la eficacia de la droga in vivo. Esto está influido por numerosos aspectos, incluyendo variables farmacológicas como potencia intrínseca de la droga, absorción, aclaramiento, metabolismo (variabilidad en las isoformas del citocromo P-450, que tiene tanta importancia en medicaciones que se comportan como sustratos para el citado citocromo como son los ITINN e IP), unión a proteínas, distribución de la droga, excreción y fijación a proteínas (ITINN e IP son altamente fijados a proteínas); factores virológicos (susceptibilidad del virus a la droga, cinética de replicación y distribución) y factores ligados al paciente (adherencia al tratamiento). Todo ello sin contar con las interacciones entre medicaciones o entre comida y medicaciones que contribuyen a aumentar aún más la ya de por sí amplia variabilidad.
Respecto a la unión a proteínas, cabe destacar que los IP se unen de forma muy importante a la a1-glicoproteína, cuyos niveles son muy variables en función de que haya o no infecciones intercurrentes, por lo que no deberán realizarse monitorizaciones de los niveles terapéuticos durante procesos agudos infecciosos.
Esta variabilidad ha sido estudiada y se ha observado que no es infrecuente observar variabilidades interindividuales de 100 veces en la concentración valle (Cvalle) de SQV, RTV, IDV, NFV, APV e ITINN. Dado este grado de variabilidad, es imposible predecir las concentraciones plasmáticas de una dosis determinada en un paciente dado47.
Correlación niveles plasmáticos-eficacia
Los estudios de desarrollo de los IP, de dosis ascendentes progresivas, han demostrado la relación entre IP administrado y respuesta, y son considerables los datos de que el fracaso del tratamiento se asocia con niveles plasmáticos bajos de IP. Con respecto a SQV, RTV y APV son principalmente los datos de los estudios de desarrollo los que predominan48,49.
IDV presenta un área bajo la curva y una concentración mínima (Cmín) asociadas de forma significativa al descenso de la carga viral. Cabe destacar, entre otros, dos trabajos realizados en pacientes pretratados que demuestran que el fracaso viral se asocia a los 6 meses de forma significativa a una baja Cvalle, destacando además, en uno de ellos, que en el análisis multivariante se mantenía como variable que predecía el fracaso virológico con independencia de la carga viral inicial o del tratamiento con IP previo. Estos datos, aunque provienen de estudios observacionales, son una esperanza de que en las terapias de rescate la monitorización de los niveles terapéuticos pueda ser una prueba que ayude a conseguir el objetivo50,51.
El NFV se diferencia de otros IP en dos aspectos, que han de ser tenidos en cuenta a la hora de la monitorización de los valores terapéuticos: primero presenta una absorción intestinal retardada, lo cual conlleva a que la Cmín sea inferior a la Cvalle. Segundo, la presencia de un metabolito activo (M8), que tiene una actividad similar al NFV, pero que puede complicar la interpretación, ya que un tercio del NFV absorbido es metabolizado a M8 por el citocromo P-450. A pesar de todo, se ha encontrado correlación entre dosis-respuesta, pero siempre y cuando la extracción se haga 2 h después de la toma52.
En cuanto al tratamiento asociando 2 IP los datos son escasos y sólo referentes a la combinación de SAQ + NFV y SAQ + RTV presentando además resultados contradictorios53-55.
La asociación de RTV como fármaco que aumente las concentraciones de otros IP es un terreno en el que las monitorizaciones de los niveles terapéuticos van a aportar información de gran interés tanto en la eficacia como en la toxicidad. Sobre todo, cuando se combinan 2 IP. Así, en la actualidad, un rescate atractivo en pacientes que han presentado multifracaso es la combinación de LPV/RTV y APV; sin embargo, los estudios de monitorización de los niveles terapéuticos demuestran que la interacción que se produce entre ambos IP hace que puedan disminuir los niveles tanto de LPV como de APV, haciéndola muy útil en esta situación56,57.
En relación con los ITINN, tienen la característica de tener una semivida mayor que los IP y alcanzar concentraciones plasmáticas elevadas, que están muy por encima de la concentración mínima efectiva (CME), pero el hecho de presentar una barrera genética de resistencia baja lleve a que cuando haya niveles subterapéuticos se desarrolle resistencia con facilidad.
En cuanto a NVP, los datos son contradictorios. En los pacientes vírgenes de tratamiento (subestudio del INCAS58) hubo correlación entre los niveles de NVP y las respuestas a corto y largo plazo. Sin embargo, en pacientes pretratados no se ha encontrado relación entre respuesta y niveles de NVP.
El área bajo la curva de EFV tras 2 semanas de tratamiento se ha mostrado como un factor independiente de la supresión virológica. Además, en un estudio de 419 pacientes, para valorar la correlación entre la Cvalle y la supresión viral encontraron que el fracaso se produjo de forma 3 veces más frecuente en los pacientes con Cvalle menor de 3,5 : M con respecto a los que tenían más de 3,5 : M, considerando los autores que los niveles debían estar siempre por encima de esta cifra59.
Correlación entre niveles plasmáticos elevados y toxicidad
Son escasos los datos que correlacionan estos dos aspectos; así, no hay relación demostrada entre disfunción hepática, lipodistrofia, alteraciones lipídicas y concentraciones plasmáticas elevadas de IP o ITINN. Otro tipo de reacciones adversas como el exantema parecen más relacionadas con la idiosincrasia del individuo que con los niveles.
Sin embargo, hay algunos datos que relacionan toxicidad con niveles elevados, como son:
1. Las alteraciones gastrointestinales, la hipertrigliceridemia y las parestesias circumorales relacionadas con la Cmáx de RTV.
2. El aumento de la incidencia de cólicos nefríticos, hematuria y disuria en los pacientes en tratamiento con IDV, 2 veces al día (asociado a RTV 100 mg/12 h) parece relacionado con el incremento en la Cmáx. Hasta el 80% de los pacientes que se presentaron con síntomas urológicos, tomando IDV (800 mg/8 h) presentaron concentraciones plasmáticas elevadas de IDV60.
3. En pacientes en tratamiento con EFV la toxicidad de sistema nervioso central se correlacionó con los niveles, observándose que por encima de 4.000 mg/l presentaban 3 veces más alteraciones que con cifras entre 1.000 y 4.00061.
4. Niveles altos de NVP (superiores a 6 mg/ml) han mostrado un riesgo aumentado de alteración hepática, definida como cualquier grado de hepatotoxicidad (OR, 1,7; IC 95%, 1,2-2,6), aunque en el estudio no se informa del número de pacientes que debieron abandonar la medicación62.
Disfunción hepática y renal
En pacientes con disfunción hepática en tratamiento con NFV se ha demostrado una disminución del aclaramiento y un aumento de la semivida con respecto a una población sin enfermedad hepática47. En pacientes en tratamiento con EFV se observa una alteración de los parámetros farmacocinéticos, pero que no alteran el área bajo la curva, ya que por un lado parece haber una disminución de la absorción, pero por otro hay también una disminución del aclaramiento63.
En cuanto a la disfunción renal, ni los IP ni los ITINN suelen precisar modificación, la única excepción pudiera ser IDV cuando se usa en asociación con RTV, ya que aumenta la proporción de IDV excretado por orina en la forma libre. La monitorización de los niveles terapéuticos podría facilitar la reducción de dosis o el aumento del intervalo de dosificación.
Evidencias en el uso de la monitorización de los niveles terapéuticos
Al tratarse de una prueba que está todavía dando sus primeros pasos hay una serie de factores que deben tenerse en cuenta en la interpretación de los datos que se van generando. Muchos de los datos generados proceden de subestudios de ensayos clínicos desarrollados para determinar otros objetivos, hay estudios en los que la medición se ha realizado utilizando el fármaco medido en monoterapia, extrapolándose los datos posteriormente a terapias de combinación. El sesgo de publicación puede ser importante en el contexto de la monitorización de los niveles terapéuticos (no se publican los estudios con resultados negativos). Los resultados pueden ser dependientes de otros factores; así, puede no detectarse relación entre concentraciones adecuadas o incluso elevadas, y respuesta clínica en pacientes que se encuentren en terapias de rescate (la misma concentración puede tener efectos diferentes en el paciente virgen de tratamiento y aquel que inicie su segundo rescate). Además, el uso de RTV, como fármaco que sirve para aumentar los niveles de otros IP, puede actuar como variable de confusión al interpretar los resultados.
Dentro del estudio VIRADAPT10, se realizó un subestudio que incluyó a 81 pacientes, de los que se obtuvieron muestras plasmáticas seriadas para determinación de niveles de IP. El análisis de regresión lineal demostró una correlación significativa entre los niveles de cada uno de los IP y la carga viral VIH. Así, en los pacientes con concentraciones "definidas como óptimas" la correlación con la disminución de la carga viral fue del 68% (55/81) en relación con los que tenían concentraciones subóptimas 32% (26/81). El análisis multivariante demostró que las concentraciones de IP eran un predictor independiente de la evolución de la carga viral del VIH64.
En el estudio ATHENA, los pacientes naive que empezaban un tratamiento con IDV o NFV eran aleatorizados en 2 grupos: un grupo recibía el resultado de la medición de niveles plasmáticos y el otro no. Al año de seguimiento, los pacientes tratados con NFV que pertenecían al grupo con monitorización de niveles terapéuticos presentaban un menor índice de fracaso terapéutico que el grupo que no disponía de la monitorización y por lo tanto no podía ajustar niveles de fármaco (17,4% frente a 39,7%). De los pacientes tratados con IDV solo o IDV + RTV, aquellos aleatorizados al grupo con monitorización presentaban un menor grado de efectos adversos y toxicidad que aquellos pacientes que no disponían de los resultados de ésta (9,5% frente a 40%). En relación a la eficacia virológica, la medición de niveles de NFV e IDV es efectiva, presentando los pacientes con monitorización de los niveles terapéuticos al año de seguimiento una carga viral de 500 copias/ml en el 78,2% frente al 55,1% en el grupo control (p = 0,003)65.
El estudio Pharma Adapt, en 256 pacientes pretratados, aleatorizados a cambio basándose en el genotipo (131) o genotipo más medición de niveles (la medición se efectuó en la semana 4 del tratamiento, recibiendo el clínico el informe a la semana 8, tras lo cual hacía las modificaciones, y a la semana 12 se evaluaba la eficacia en función de la carga viral), los resultados no mostraron diferencias entre los grupos en reducción de la carga viral ni tampoco en la proporción de pacientes con carga viral indetectable a los 3 meses66.
Un aspecto reseñable, de los datos correspondientes al estudio ATHENA65 y del grupo de Liverpool47, es que las bajas concentraciones afectaron principalmente a NFV, SQV, IDV y NVP.
Problemática de la recogida de muestras
No existe un acuerdo generalizado en la estrategia de recogida de muestras (valle, valle más muestra posterior a la toma, etc.), aunque todo el mundo parece aceptar que el patrón de oro, que sería el área bajo la curva no es asumible en la práctica clínica. Cada vez está adquiriendo mayor auge el uso de modelos farmacocinéticos bayesianos, utilizando estos métodos, la Cmín, Cmáx y Cvalle pueden predecirse tomando una muestra en cualquier momento del día, con la única condición de conocer el momento de la toma de la dosis previa. Los resultados obtenidos por algunos autores son excelentes67. Estos modelos que pueden suponer el futuro de la monitorización de los niveles terapéuticos, que presenta todavía ciertas limitaciones como son: falta de estandarización, la más que posible necesidad de modelos diferentes para tratamientos que conlleven 2 IP o 1 IP y 1 ITINN. Por último, la edad de los pacientes también parece poder modificar el modelo. Estas limitaciones están intentando resolverse gracias a la formación de un programa de control de calidad internacional que intenta estudiar las variaciones en la medición de niveles entre los diferentes laboratorios adscritos al programa. Los últimos datos presentados por este grupo (13 laboratorios diferentes de Estados Unidos, Australia y Europa) observan mediciones satisfactorias en las proporciones siguientes: IDV, 72%; NFV, 77%; RTV, 83%; SQV, 92%; EFV, 74% y NVP, 62%68.
Cociente inhibitorio: herramienta que integra resistencia y niveles plasmáticos
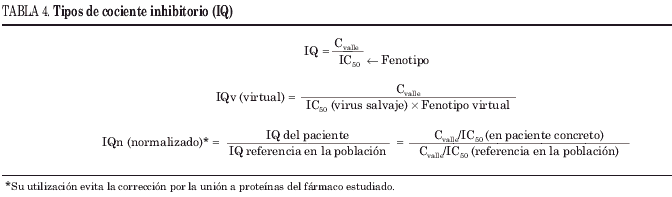
Una de las aproximaciones más recientes en la búsqueda de parámetros que ayuden a predecir el éxito terapéutico de un TARV es la combinación de estudios de resistencias y estudios farmacocinéticos. Hemos visto hasta ahora cómo tanto los tests de resistencia como los niveles plasmáticos de determinados antirretrovirales ofrecen información cada uno de forma independiente, que aunque con limitaciones, ayuda a conseguir el éxito del tratamiento. El cociente inhibitorio (IQ) es la variable que relaciona la exposición del fármaco (Cmín) con la susceptibilidad viral. El objetivo teórico del IQ es integrar ambas informaciones en un parámetro único que ayude a predecir una respuesta adecuada. Puede expresarse de diferentes maneras, pero la más habitual es el cociente de la Cvalle/IC50 (corregida por la unión a proteínas del fármaco estudiado) del aislado del propio paciente. El IQ requiere la realización del estudio fenotípico. Presenta la ventaja de un tratamiento mucho más individualizado y el inconveniente de que requiere técnicas laboriosas y caras. Otras formas de utilizarlo son el IQ virtual y el IQ normalizado, cuyas características se explican en la tabla 4.
El IQ se ha mostrado útil principalmente en algunos IP. Así, en 56 pacientes con varios tratamientos previos con IP que iniciaban un rescate con regímenes basados en LPV y EFV, la presencia de carga viral indetectable (< 400 copias/ml) se alcanzó en el 70, 80 y 100% de los pacientes con IQ menor de 4, entre 4-15, y más de 15, respectivamente. El uso aislado de la Cvalle de LPV no se correlacionó con la indetectabilidad69. Lo mismo ha sucedido con APV, en un estudio de 22 pacientes, en los cuales el IQ fue el mejor predictor de respuesta, siendo también en este estudio superior a la Cvalle70.
El conocimiento de hasta qué punto el VIH-1 compromete la eficacia terapéutica está directamente relacionado con la potencia intrínseca del fármaco y el tiempo de exposición a la misma. La mayoría de IP mantienen in vivo niveles valle muy por encima de los valores IC50 de cepas salvajes de VIH (corregidas en función de la unión de cada IP a proteínas plasmáticas). Sin embargo, estos niveles valle están por debajo de los valores corregidos de la IC50 de virus de pacientes que presentan fracaso virológico a algún IP. Ello sugiere que ningún IP de forma aislada sería efectivo después de varios fracasos terapéuticos previos con IP.
Probablemente, uno de los aspectos donde va a tener mayor interés el IQ es en la evaluación del efecto del RTV en aumentar las concentraciones de otros IP, tal y como los demostraron Condra et al71, alcanzando de este modo niveles más elevados que superen la IC50 del HIV. Así, se ha presentado un estudio de 37 pacientes que estaban en tratamiento con IDV (800 mg/8 h) (carga viral < 50.000 copias/ml) se cambiaron a IDV 400-RTV 400 manteniendo los análogos de base. Se midieron niveles y se utilizó el fenotipo virtual. Se observó una asociación significativa entre el IQ virtual de IDV y respuesta virológica. Desarrollaron fracaso virológico todos los que tenían IQ menor de 2, frente al 20% de los que tenían IQ > 272. Datos similares se han producido recientemente para APV en terapia de rescate, observándose que añadir RTV a APV mejora de manera significativa el IQ y éste se correlaciona con la indetectabilidad73.
En cuanto al IQ de los ITIAN e ITINN no presentan la utilidad de los IP, en el caso de los primeros porque el numerador debiera ser la concentración intracelular, con la problemática que ello conlleva, ya comentada previamente. En el caso de los ITINN su utilidad no se plantea en la práctica dada la resistencia fenotípica absoluta conferida por sus mutaciones asociadas.
Por lo tanto, el IQ, a pesar de los problemas que plantea, parece que puede ser a medio plazo una herramienta muy importante en el manejo del paciente en TARV, ya que predice la respuesta virológica de un forma mejor que los tests de resistencia o los niveles de forma aislada en los IP74. Sería importante que las diferentes sociedades o grupos de trabajo internacionales establecieran unas normas a la hora de realizar estos estudios (tanto en la determinación de resistencias, como en su interpretación y en la monitorización de valores) de tal manera que se homogeneizara su realización e interpretación, lo cual llevaría a que fueran más fácilmente implementables en la práctica clínica del futuro.
Recomendaciones
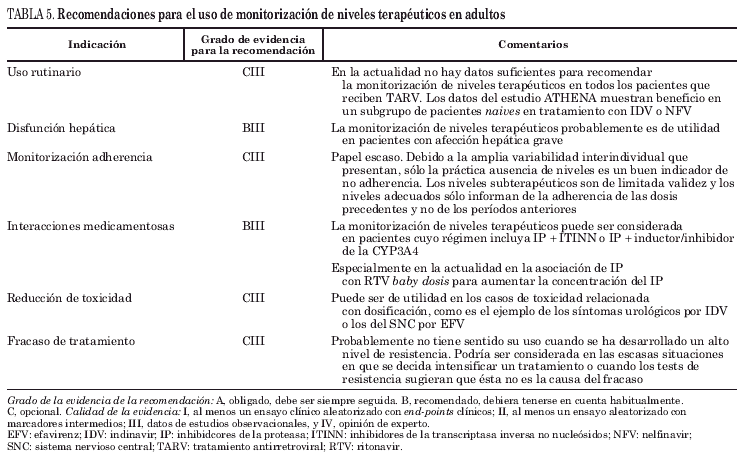
En la actualidad sólo las guías británicas han desglosado, basándose en la poca evidencia existente, unas recomendaciones para el uso de la monitorización de niveles plasmáticos de antirretrovirales, cuya información se recoge en la tabla 5. Como puede observarse dispone de poca información sobre su utilidad, siendo quizás el campo de las interacciones el que parezca más atractivo desde el punto de vista teórico, principalmente porque se está generalizando el uso de RTV como fármaco que aumenta los niveles de otros IP, y ahora es el momento de cuantificar el aumento de concentración que se produce y su correlación con el beneficio virológico.
En resumen, podríamos concluir que, el uso de resistencias y la monitorización de niveles de fármacos son dos herramientas que todavía están en desarrollo, que precisan todavía mejoras en cuanto a la realización técnica como a la interpretación, pero que deben ser tenidas en cuenta pues, a pesar de las limitaciones que presentan puede estimarse que alrededor del 15-25% de los pacientes pueden beneficiarse de ellas en algún momento de su TARV. Por ello, los retos con estas dos técnicas han de ser: por un lado, aplicarlas en las situaciones que realmente beneficien a los pacientes y, por otro, realizar estudios que mejoren los porcentajes en los que podamos beneficiarles. La ley del todo o nada no es aplicable a estas dos técnicas de laboratorio.