La coinfección/sobreinfección bacteriana/fúngica contribuye al incremento de la morbimortalidad de las infecciones respiratorias (IRs) virales. El objetivo de este trabajo es conocer la incidencia de estas infecciones en los pacientes hospitalizados por COVID-19.
MétodoEstudio retrospectivo observacional de todos los pacientes ingresados por COVID-19 e infección bacteriana/fúngica en el Hospital Clínico de Valladolid (1 marzo-31 mayo, 2020). Comparación de datos demográficos, clínicos y microbiológicos en función del ingreso en UCI e identificación de los factores predictores de mortalidad mediante regresión logística multivariante.
ResultadosDe 712 pacientes con COVID-19, 113 (16%) presentaron coinfección/ sobreinfección bacteriana/fúngica. Mediana de edad 73 años (RIQ 57-89), 59% de ellos hombres. Perfil del paciente de UCI (44%): hombre con neumonía por SARS-CoV-2, leucocitosis, interleucina-6 elevada, con interferón β-1b y tocilizumab y sobreinfección (p < 0,05). El 5% (39/712) de los pacientes presentaron una coinfección. Streptococcus pneumoniae (6) y Staphylococcus aureus (6) fueron los principales patógenos de las coinfecciones respiratorias (18). El 11% (80/712) se sobreinfectaron. Las infecciones más frecuentes fueron las urinarias (53) e IRs (39). Acinetobacter baumannii multirresistente fue el principal agente de la IR y la bacteriemia. Un brote por A. baumannii contribuyó a este resultado. Tres pacientes se diagnosticaron como probable aspergilosis pulmonar. La mortalidad fue superior en los pacientes de UCI (50 vs. 29%; p = 0,028). Factores predictores de mortalidad: hombre con varias comorbilidades, neumonía por SARS-CoV-2, bacteriemia y sobreinfectado por A. baumannii.
ConclusiónEl brote por A. baumannii fue determinante en la incidencia de la infección y en la morbimortalidad de los pacientes de UCI.
Bacterial/fungal coinfection and superinfections contribute to the increased morbi-mortality of viral respiratory infections (RIs). The main objective of this study was to determine the incidence of these infections in hospitalized patients with COVID-19.
MethodRetrospective observational study of all patients admitted for COVID-19 and bacterial/fungal infections at the Hospital Clínico Universitario of Valladolid, Spain (March 1-May 31, 2020). Demographic, clinical and microbiological data were compared based on Intensive Care Unit (ICU) admission and predictors of mortality by were identified using multivariate logistic regression analyses.
ResultsOf the 712 COVID-19 patients, 113 (16%) presented bacterial/fungal coinfections or superinfections. Their median age was 73 years (IQR 57-89) and 59% were men. The profiles of ICU patients (44%) included male, SARS-CoV-2 pneumonia, leukocytosis, elevated inteleukin-6, with interferon β-1b and tocilizumab and superinfection (p < 0.05). Coinfections were diagnosed in 5% (39/712) patients. Most common pathogens of respiratory coinfection (18) were Streptococcus pneumoniae (6) and Staphylococcus aureus (6). Superinfections were detected in 11% (80/712) patients. Urinary (53) and RIs (39) constituted the majority of superinfections Acinetobacter baumannii multidrug-resistant was the main agent of IR and bacteremia. An outbreak of A. baumannii contributed to this result. Three patients were considered to have probable pulmonary aspergillosis. Mortality was higher in UCI patients (50 vs. 29%; p = 0.028). The predictive factors of mortality included being a male with various comorbidities, SARS-CoV-2 pneumonia, bacteremia and superinfections from A. baumannii.
ConclusionThe outbreak of A. baumannii was a determining factor in the increases of the incidence of infection and the morbi-mortality of ICU patients.
La pandemia por COVID-19 constituye un reto sin precedentes en la atención sanitaria a nivel mundial, con 45.942.902 casos confirmados y 1.192.644 muertos, al 1̊ de noviembre de 2020 (https://covid19.who.int/). Varios factores son determinantes en el pronóstico de la COVID-19: edad1-3, riesgo de fallo multiorgánico1, comorbilidades (hipertensión, dislipemia, enfermedad cardiovascular, enfermedad pulmonar obstructiva crónica [EPOC], etc.)1-4, valor del dímero-D1,5 y de la proteína C reactiva2. La coinfección y sobreinfección bacteriana y fúngica podría ser otro marcador de la evolución de la COVID-191,4-6, por similitud con otros procesos respiratorios virales. Así, en la pandemia del virus SARS-CoV-1 la coinfección bacteriana fue del 22%7 y en las pandemias del virus de la gripe la coinfección bacteriana osciló entre 2-65%8,9 y la fúngica entre el 15-25%10. En pacientes hospitalizados por COVID-19, la coinfección y sobreinfección varía ampliamente en función de la población estudiada: del 2-27% en pacientes adultos hospitalizados4,11,12, del 14-58% en severos o críticos5,12-14 y el 50% en fallecidos por COVID-191.
Los pacientes ingresados por COVID-19 presentan varios factores, no excluyentes entre sí, que predisponen a la infección bacteriana y fúngica. Primero, debido a la acción del virus SARS-CoV-2: destrucción tisular6, infección de los enterocitos y alteración la hemostasia intestinal15. Segundo, por la elevada liberación de citocinas y desregulación del sistema inmune1,2,6. Tercero, por las características del paciente1-3,6,16 y sus comorbilidades (EPOC, diabetes, insuficiencia renal crónica [IRC], inmunosupresión), dispositivos médicos invasivos, estancias prolongadas, etc. A todo ello se le añade la situación de urgencia provocada por la pandemia: saturación de servicios médicos, falta de personal entrenado, estrés laboral, etc., que dificultan la aplicación de las medidas de control de las infecciones del periodo prepandémico y favorecen la aparición de brotes nosocomiales.
En la provincia de Valladolid (España), en la primera ola de la pandemia la incidencia acumulada de COVID-19 fue de 780 casos/100.000 habitantes con una letalidad global de 10,42% y del 22,21% en mayores de 8017. El Hospital Clínico Universitario de Valladolid (HCUV) atiende a una población de las más envejecidas de España. Los objetivos de este estudio son: conocer la incidencia de la coinfección/sobreinfección bacteriana/fúngica en los pacientes ingresados por COVID-19 en el HCUV, analizar las características demográficas, clínicas y microbiológicas de estos pacientes en función de su ingreso en la Unidad de Cuidados Intensivos (UCI) e identificar los factores predictores de mortalidad.
Material y métodosDiseño del estudioEstudio retrospectivo observacional de todos los pacientes ingresados por COVID-19 y coinfección/sobreinfección bacteriana o fúngica en el HCUV, entre el 8 de marzo y el 31 de mayo de 2020. La información los pacientes se obtuvieron del conjunto mínimo de datos (CMBD) del informe de alta hospitalario, según la clasificación internacional de enfermedades CIE-10 y del Sistema de Información de Microbiología. El HCUV es un centro universitario de 777 camas que atiende a una población de 235.000 habitantes.
El estudio fue aprobado por el Comité de Ética del HCUV con el número PI 20-1806. La identificación de los pacientes permaneció anónima y se renunció al consentimiento informado debido a la naturaleza observacional del estudio no intervencionista.
Procedimientos de laboratorioLa confirmación de la COVID-19 se realizó mediante la detección de ARN del virus SARS-CoV-2 por la prueba de reacción en cadena de la polimerasa de transcripción inversa en tiempo real (RT-PCR) en muestras respiratorias o mediante la detección de anticuerpos IgG e IgM (Elecsys Anti-SARS-CoV-2®, Roche®, Mannheim, EEUU) en pacientes con criterios clínicos de COVID-1918.
El diagnóstico de la infección bacteriana o fúngica se realizó siguiendo procedimientos habituales del laboratorio19. Los microorganismos se identificaron por espectrometría de masas MALDI-TOF® (Bruker Daltonik®, Bremen, Alemania). El estudio de sensibilidad antibiótica se realizó mediante el sistema PHOENIX M50® (Becton-Dickinson®, Sparks, EEUU) y/o por las tiras de difusión en gradiente E-test (BioMérieux®, Marcy ĹEtoile, Francia). El fungigrama de levaduras se realizó por microdilución mediante Sensititre YO10® (ThermoFisher Scientific®, Altricham, Reino Unido). La sensibilidad antibiótica se interpretó según los criterios del European Committee on Antimicrobial Susceptibility Testing v.10.020.
Recolección de datosLos datos fueron anonimizados y recogidos en una base de datos diseñada para este estudio. Las variables se agruparon en: datos demográficos, comorbilidades, factores de riesgo, número y tipo de infección, datos microbiológicos y analíticos, pruebas de diagnóstico por imagen, tratamiento antibiótico (empírico y dirigido) y evolución durante el ingreso hospitalario. Las variables se obtuvieron de la historia clínica del paciente. Se recopilaron los valores de leucocitos, procalcitonina y proteína C reactiva de cada proceso infeccioso. En los pacientes con varias infecciones, los valores de interleucina-6, ferritina y dímero-D registrados fueron los del primer proceso infeccioso diagnosticado.
Los pacientes se agruparon en dos categorías en función de su ingreso en la UCI (normal o ampliada). Se excluyeron del estudio los pacientes con aislados microbiológicos considerados contaminantes.
DefinicionesEl diagnóstico de infección se fundamentó en los síntomas clínicos, el aislamiento de un agente etiológico y la valoración del grupo de clínicos responsables del paciente. Se definió bacteriemia/fungemia como el aislamiento de un patógeno en uno o más hemocultivos y para microorganismos de la flora cutánea se valoró el crecimiento del mismo en dos o más hemocultivos extraídos por diferente vía. Para bacteriemia asociada a catéter (BAC) se valoró el aislamiento del mismo microorganismo en sangre y en la punta catéter (recuento ≥ 103 UFC) de muestras obtenidas en paralelo o bien en dos hemocultivos extraídos de forma simultánea del catéter y por venopunción. Se consideró infección respiratoria (IR) el aislamiento significativo de un microorganismo potencialmente patogénico en un lavado broncoalveolar (BAL), en un broncoaspirado (BAS) o en un esputo valorable (> 25 PMN y < 10 células epiteliales × 100) o bien la detección en orina del antígeno de Streptococcus pneumoniae por inmunocromatografía mediante BinaxNOW® (Abbot Diagnostics Scarbourg®, Maine, EEUU). Para el diagnóstico de la aspergilosis pulmonar invasiva se siguió el algoritmo de Armstrong-James et al.21. La infeccion del tracto urinario (ITU) se definió como el aislamiento significativo19 de un microorganismo en la muestra de orina de un paciente con signos y/o síntomas de infección. El diagnóstico de la infección de piel y partes blandas (IPPB) se basó en la tinción de Gram (PMN y presencia de bacterias u hongos) y la concordancia con el resultado del cultivo.
Las infecciones se clasificaron como coinfecciones o sobreinfecciones. Se definió coinfección a la infección adquirida en la comunidad diagnosticada en las primeras 48 h del ingreso hospitalario por COVID-19. Se consideró sobreinfección a la infección adquirida a partir de las 48 h del ingreso hospitalario.
Análisis estadísticoLos resultados fueron analizados usando SPSS versión 20.0® (SPSS®, Chicago, EEUU). La comparación de las variables cualitativas se realizó por el χ2 y las cuantitativas mediante la prueba t de Student. Las diferencias fueron consideradas significativas si p < 0,05. Las variables que mostraron un resultado significativo de forma univariante se incluyeron en el modelo de regresión logística multivariante por pasos hacia atrás para determinar cuáles de ellas estaban relacionadas de forma independiente con el ingreso en la UCI y la mortalidad.
ResultadosDurante el periodo de estudio, 712 pacientes ingresaron en el HCUV por COVID-19 con una mortalidad durante la hospitalización del 25% (178/712). Del total de pacientes, 113 (16%) presentaron infección bacteriana o fúngica y 17 (2%) se desestimaron por no cumplir los criterios de infección. La COVID-19 se confirmó por PCR en 108 pacientes y mediante la detección de anticuerpos IgG e IgM en cinco pacientes.
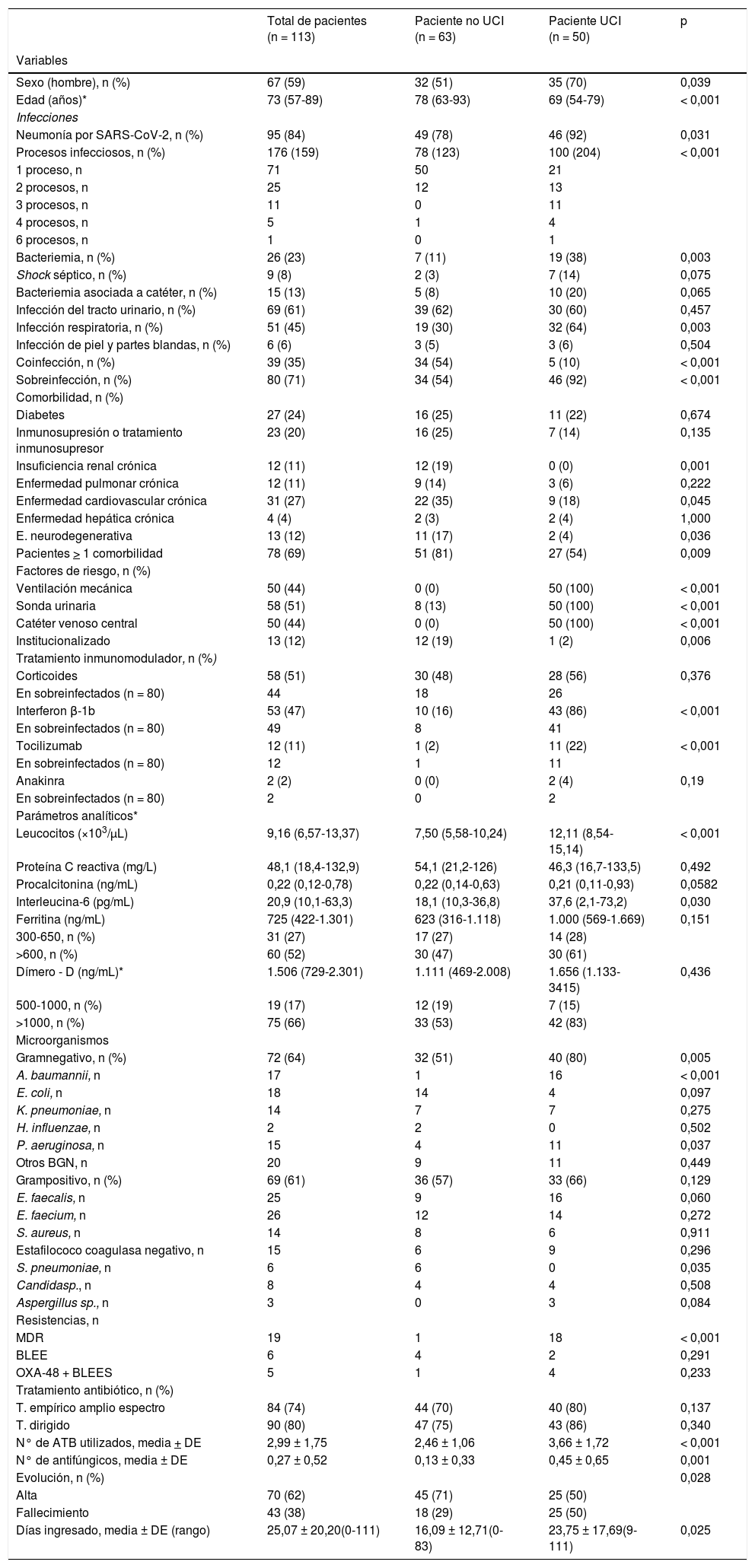
Las principales características demográficas, clínicas y microbiológicas y significación estadística del análisis univariante se detallan en la tabla 1. La mediana de edad fue de 73 años (rango intercuartil [RIQ] 57-89) y 59% eran hombres. Cincuenta pacientes (44%) requirieron ingreso en la UCI, con una mediana estancia de 20 días (RIQ 1-41). En 95 pacientes (84%) el diagnóstico principal fue neumonía por SARS-CoV-2, significativamente superior en los pacientes de la UCI (92 vs. 78%; p = 0,031). Los pacientes de la UCI presentaron más procesos infecciosos, mayoritariamente sobreinfecciones y mayor proporción de bacteriemias e IRs (p < 0,05). El 69% de los pacientes tenían una o más comorbilidades, siendo la enfermedad cardiaca crónica (27%) y la diabetes (24%) las más frecuentes. Los principales factores de riesgo de infección en los pacientes ingresados en la UCI fueron la ventilación mecánica, el catéter venoso central, la sonda urinaria y los inmunomoduladores interferón beta -1b (IFN-β) y tocilizumab (p < 0,05). El 51% de los pacientes con sobreinfección habían recibido uno o varios tratamientos inmunomoduladores.
Características demográficas, clínicas y microbiológicas de los pacientes con COVID-19 e infección bacteriana o fúngica
| Total de pacientes (n = 113) | Paciente no UCI (n = 63) | Paciente UCI (n = 50) | p | |
|---|---|---|---|---|
| Variables | ||||
| Sexo (hombre), n (%) | 67 (59) | 32 (51) | 35 (70) | 0,039 |
| Edad (años)* | 73 (57-89) | 78 (63-93) | 69 (54-79) | < 0,001 |
| Infecciones | ||||
| Neumonía por SARS-CoV-2, n (%) | 95 (84) | 49 (78) | 46 (92) | 0,031 |
| Procesos infecciosos, n (%) | 176 (159) | 78 (123) | 100 (204) | < 0,001 |
| 1 proceso, n | 71 | 50 | 21 | |
| 2 procesos, n | 25 | 12 | 13 | |
| 3 procesos, n | 11 | 0 | 11 | |
| 4 procesos, n | 5 | 1 | 4 | |
| 6 procesos, n | 1 | 0 | 1 | |
| Bacteriemia, n (%) | 26 (23) | 7 (11) | 19 (38) | 0,003 |
| Shock séptico, n (%) | 9 (8) | 2 (3) | 7 (14) | 0,075 |
| Bacteriemia asociada a catéter, n (%) | 15 (13) | 5 (8) | 10 (20) | 0,065 |
| Infección del tracto urinario, n (%) | 69 (61) | 39 (62) | 30 (60) | 0,457 |
| Infección respiratoria, n (%) | 51 (45) | 19 (30) | 32 (64) | 0,003 |
| Infección de piel y partes blandas, n (%) | 6 (6) | 3 (5) | 3 (6) | 0,504 |
| Coinfección, n (%) | 39 (35) | 34 (54) | 5 (10) | < 0,001 |
| Sobreinfección, n (%) | 80 (71) | 34 (54) | 46 (92) | < 0,001 |
| Comorbilidad, n (%) | ||||
| Diabetes | 27 (24) | 16 (25) | 11 (22) | 0,674 |
| Inmunosupresión o tratamiento inmunosupresor | 23 (20) | 16 (25) | 7 (14) | 0,135 |
| Insuficiencia renal crónica | 12 (11) | 12 (19) | 0 (0) | 0,001 |
| Enfermedad pulmonar crónica | 12 (11) | 9 (14) | 3 (6) | 0,222 |
| Enfermedad cardiovascular crónica | 31 (27) | 22 (35) | 9 (18) | 0,045 |
| Enfermedad hepática crónica | 4 (4) | 2 (3) | 2 (4) | 1,000 |
| E. neurodegenerativa | 13 (12) | 11 (17) | 2 (4) | 0,036 |
| Pacientes > 1 comorbilidad | 78 (69) | 51 (81) | 27 (54) | 0,009 |
| Factores de riesgo, n (%) | ||||
| Ventilación mecánica | 50 (44) | 0 (0) | 50 (100) | < 0,001 |
| Sonda urinaria | 58 (51) | 8 (13) | 50 (100) | < 0,001 |
| Catéter venoso central | 50 (44) | 0 (0) | 50 (100) | < 0,001 |
| Institucionalizado | 13 (12) | 12 (19) | 1 (2) | 0,006 |
| Tratamiento inmunomodulador, n (%) | ||||
| Corticoides | 58 (51) | 30 (48) | 28 (56) | 0,376 |
| En sobreinfectados (n = 80) | 44 | 18 | 26 | |
| Interferon β-1b | 53 (47) | 10 (16) | 43 (86) | < 0,001 |
| En sobreinfectados (n = 80) | 49 | 8 | 41 | |
| Tocilizumab | 12 (11) | 1 (2) | 11 (22) | < 0,001 |
| En sobreinfectados (n = 80) | 12 | 1 | 11 | |
| Anakinra | 2 (2) | 0 (0) | 2 (4) | 0,19 |
| En sobreinfectados (n = 80) | 2 | 0 | 2 | |
| Parámetros analíticos* | ||||
| Leucocitos (×103/μL) | 9,16 (6,57-13,37) | 7,50 (5,58-10,24) | 12,11 (8,54-15,14) | < 0,001 |
| Proteína C reactiva (mg/L) | 48,1 (18,4-132,9) | 54,1 (21,2-126) | 46,3 (16,7-133,5) | 0,492 |
| Procalcitonina (ng/mL) | 0,22 (0,12-0,78) | 0,22 (0,14-0,63) | 0,21 (0,11-0,93) | 0,0582 |
| Interleucina-6 (pg/mL) | 20,9 (10,1-63,3) | 18,1 (10,3-36,8) | 37,6 (2,1-73,2) | 0,030 |
| Ferritina (ng/mL) | 725 (422-1.301) | 623 (316-1.118) | 1.000 (569-1.669) | 0,151 |
| 300-650, n (%) | 31 (27) | 17 (27) | 14 (28) | |
| >600, n (%) | 60 (52) | 30 (47) | 30 (61) | |
| Dímero - D (ng/mL)* | 1.506 (729-2.301) | 1.111 (469-2.008) | 1.656 (1.133-3415) | 0,436 |
| 500-1000, n (%) | 19 (17) | 12 (19) | 7 (15) | |
| >1000, n (%) | 75 (66) | 33 (53) | 42 (83) | |
| Microorganismos | ||||
| Gramnegativo, n (%) | 72 (64) | 32 (51) | 40 (80) | 0,005 |
| A. baumannii, n | 17 | 1 | 16 | < 0,001 |
| E. coli, n | 18 | 14 | 4 | 0,097 |
| K. pneumoniae, n | 14 | 7 | 7 | 0,275 |
| H. influenzae, n | 2 | 2 | 0 | 0,502 |
| P. aeruginosa, n | 15 | 4 | 11 | 0,037 |
| Otros BGN, n | 20 | 9 | 11 | 0,449 |
| Grampositivo, n (%) | 69 (61) | 36 (57) | 33 (66) | 0,129 |
| E. faecalis, n | 25 | 9 | 16 | 0,060 |
| E. faecium, n | 26 | 12 | 14 | 0,272 |
| S. aureus, n | 14 | 8 | 6 | 0,911 |
| Estafilococo coagulasa negativo, n | 15 | 6 | 9 | 0,296 |
| S. pneumoniae, n | 6 | 6 | 0 | 0,035 |
| Candidasp., n | 8 | 4 | 4 | 0,508 |
| Aspergillus sp., n | 3 | 0 | 3 | 0,084 |
| Resistencias, n | ||||
| MDR | 19 | 1 | 18 | < 0,001 |
| BLEE | 6 | 4 | 2 | 0,291 |
| OXA-48 + BLEES | 5 | 1 | 4 | 0,233 |
| Tratamiento antibiótico, n (%) | ||||
| T. empírico amplio espectro | 84 (74) | 44 (70) | 40 (80) | 0,137 |
| T. dirigido | 90 (80) | 47 (75) | 43 (86) | 0,340 |
| N° de ATB utilizados, media + DE | 2,99 ± 1,75 | 2,46 ± 1,06 | 3,66 ± 1,72 | < 0,001 |
| N° de antifúngicos, media ± DE | 0,27 ± 0,52 | 0,13 ± 0,33 | 0,45 ± 0,65 | 0,001 |
| Evolución, n (%) | 0,028 | |||
| Alta | 70 (62) | 45 (71) | 25 (50) | |
| Fallecimiento | 43 (38) | 18 (29) | 25 (50) | |
| Días ingresado, media ± DE (rango) | 25,07 ± 20,20(0-111) | 16,09 ± 12,71(0- 83) | 23,75 ± 17,69(9- 111) | 0,025 |
La mediana y RIQ de los marcadores inflamatorios interleucina-6, ferritina y proteína C reactiva estaba elevada en todos los pacientes, aunque únicamente la interleucina-6 fue significativamente más alta en los pacientes de la UCI.
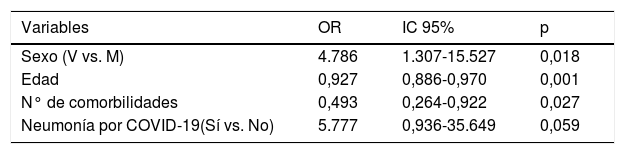
Los factores predictivos de ingreso en la UCI fueron: el sexo-hombre (OR 4,32; IC 95% 0,96-19,48) y la neumonía por SARS-CoV-2 (OR 5,77; IC 95% 0,936-35,649) (tabla 2).
Factores predictores de ingreso en la UCI de los pacientes con COVID-19 e infección bacteriana/fúngica. Modelo de regresión multivariante
| Variables | OR | IC 95% | p |
|---|---|---|---|
| Sexo (V vs. M) | 4.786 | 1.307-15.527 | 0,018 |
| Edad | 0,927 | 0,886-0,970 | 0,001 |
| N° de comorbilidades | 0,493 | 0,264-0,922 | 0,027 |
| Neumonía por COVID-19(Sí vs. No) | 5.777 | 0,936-35.649 | 0,059 |
Variables especificadas en el paso 1: sexo, edad, bacteriemia asociada a catéter, shock séptico, infección respiratoria, n° de comorbilidades, institucionalizado, neumonía por COVID-19, n° de antibióticos.
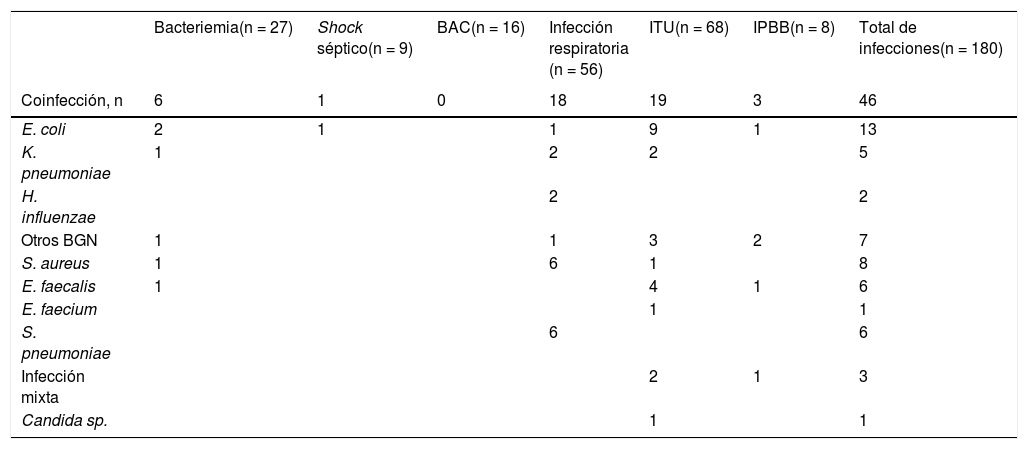
El 5% (39/712) de los pacientes presentaron una coinfección bacteriana/fúngica. Se documentaron 46 coinfecciones, predominando las ITUs (19) y las IRs (18). Los principales agentes etiológicos fueron los bacilos gramnegativos (BGN) (27/46, 59%). E. coli (9/19, 47%) y E. faecalis (4/19, 21%) fueron los principales agentes etiológicos de la ITU y S. pneumoniae (6/18, 33%) y S. aureus (6/18, 33%) de la IR. Cinco los BGN de estas coinfecciones eran productores de betalactamasa de espectro extendido (BLEE).
SobreinfeccionesUn 11% (80/712) de los pacientes se sobreinfectaron, diagnosticándose 134 infecciones: 94% bacterianas y 6% fúngicas (tabla 3). Predominaron las ITUs (49), seguido de las IRs (39) y las bacteriemias (21). Ocho pacientes presentaron shock séptico (7%). El 54% de las sobreinfecciones fueron por BGN. Los patógenos más frecuentes fueron E. faecium y A. baumannii. Solo hubo un caso de candidemia por C. glabrata. Todas las cepas de A. baumannii eran multirresistentes (MDR), únicamente sensibles a colistina. En 34 BGN se detectó uno o varios mecanismos de resistencia de especial interés epidemiológico.
Agentes etiológicos, mecanismos de resistencia y valores analíticos en las coinfecciones y sobreinfecciones bacterianas o fúngicas de los pacientes con COVID-19
| Bacteriemia(n = 27) | Shock séptico(n = 9) | BAC(n = 16) | Infección respiratoria (n = 56) | ITU(n = 68) | IPBB(n = 8) | Total de infecciones(n = 180) | |
|---|---|---|---|---|---|---|---|
| Coinfección, n | 6 | 1 | 0 | 18 | 19 | 3 | 46 |
| E. coli | 2 | 1 | 1 | 9 | 1 | 13 | |
| K. pneumoniae | 1 | 2 | 2 | 5 | |||
| H. influenzae | 2 | 2 | |||||
| Otros BGN | 1 | 1 | 3 | 2 | 7 | ||
| S. aureus | 1 | 6 | 1 | 8 | |||
| E. faecalis | 1 | 4 | 1 | 6 | |||
| E. faecium | 1 | 1 | |||||
| S. pneumoniae | 6 | 6 | |||||
| Infección mixta | 2 | 1 | 3 | ||||
| Candida sp. | 1 | 1 |
| Sobreinfección, n | 21 | 8 | 16 | 39 | 53 | 5 | 134 |
|---|---|---|---|---|---|---|---|
| E. coli | 0 | 1 | 1 | 6 | 0 | 7 | |
| K. pneumoniae | 3 | 1 | 2 | 4 | 1 | 9 | |
| A. baumanni | 6 | 3 | 1 | 13 | 2 | 22 | |
| P. aeruginosa | 1 | 1 | 10 | 5 | 1 | 17 | |
| S. maltophilia | 1 | 1 | 2 | ||||
| Otros BGN | 3 | 8 | 3 | 1 | 15 | ||
| S. aureus | 1 | 2 | 1 | 5 | 1 | 9 | |
| E. faecalis | 3 | 13 | 2 | 19 | |||
| E. faecium | 6 | 16 | 1 | 24 | |||
| Estafilococo coagulasa negativo | 14 | 14 | |||||
| Infección mixta | 4 | 4 | 3 | 2 | 21 | ||
| Aspergillus sp. | 3 | 3 | |||||
| Candidasp. | 1 | 6 | 1 | 8 |
| Mecanismo de resistencia, n | |||||
|---|---|---|---|---|---|
| BLEE | 2 | 1 | 5 | 1 | 9 |
| OXA-48 + BLEE | 2 | 2 | 2 | 6 | |
| MDR | 7 | 15 | 2 | 24 | |
| SARM | 2 | 2 |
| Datos analíticos* | |||||||
|---|---|---|---|---|---|---|---|
| Leucocitos (×109/L) | 12,63(8,35-15,10) | 8,300(3,77-17,46) | 9,72(6,5-12,21) | 13,4 ± 7,9(1,9-15,66) | 8,46(6,85-10,71) | 8,44(5,72-10,74) | |
| Procalcitonina (ng/mL) | 0,78(0,24-1,11) | 0,78(0,5-1,08) | 0,16(0,11-1,43) | 0,35(0,12-18,6) | 0,18(0,11-0,35) | 0,15(0,14-0,61) | |
| PCR (μg/mL) | 91,8(26,5-188,2) | 187,5(92,3-330) | 76,6(38,8-134,3) | 67,4(32,1-173,1) | 50,1(15,5-112,5) | 25,8(5,7-168,5) |
BAC: bacteriemia asociada a catéter; BLEE: betalactamasa de espectro extendido; IPPB: infección de piel y partes blandas; ITU: infección del tracto urinario; OXA-48: carbapenemasa clase D OXA-48; MDR: multirresistente; SARM: S. aureus resistente a meticilina.
Únicamente tres pacientes ingresados en la UCI cumplían criterios de probable aspergilosis invasiva. Todos presentaban comorbilidades (linfoma no Hodgkin estadio iv, obesidad, hipertensión, cardiopatía, isquemia crónica y dislipemia, esclerosis múltiple), habían recibido tratamiento con corticoides y llevaban con ventilación mecánica más de 10 días. Ante el empeoramiento clínico y radiológico se les solicitó estudio de hongos. En dos de los pacientes se aisló en repetidos BAS Aspergillus fumigatus y en el tercero Aspergillus niger. En el primer paciente se trató con voriconazol, siendo sustituido por isavuconazol por hepatopatía, falleciendo a los 28 días de su ingreso. El segundo recibió tratamiento con voriconazol y fue dado de alta tras 42 días de hospitalización, y el tercero recibió isavuconazol, pero falleció a los 10 días.
La mediana de los valores de leucocitos, proteína C reactiva y procalcitonina fue elevada en la bacteriemia, el shock séptico y la infección respiratoria, aunque con una gran dispersión de los resultados (tabla 3).
Tratamiento antibiótico y evoluciónEl 75% de los pacientes recibieron tratamiento antibiótico empírico de amplio espectro al ingreso, principalmente ceftriaxona, y el 80% tratamiento dirigido (tabla 1). Los antibióticos más utilizados fueron piperacilina/tazobactam (26), carbapenémicos (21), linezolida (20) y levofloxacino (15). Todos los pacientes fueron tratados al ingreso con hidroxicloroquina, azitromicina, ritonavir/lopinavir. No se constató ninguna diarrea por Clostridium difficile.
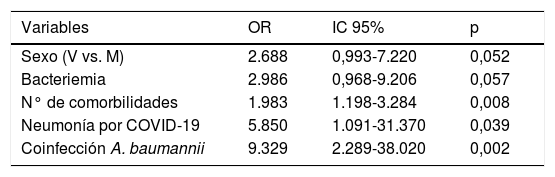
La estancia media fue significativamente mayor en los pacientes ingresados en la UCI (23,75 ± 17,7 vs. 16,09 ± 12,71; p = 0,025). La mortalidad global fue del 37%, significativamente superior en los pacientes críticos (50% vs. 29%; p = 0,028). Los predictores independientes de mortalidad fueron: ser hombre, con bacteriemia, varias comorbilidades, neumonía por SARS-CoV-2 y sobreinfectado con A. baumannii (tabla 4).
Factores predictores de mortalidad en pacientes con COVID-19 e infección bacteriana/fúngica. Modelo de regresión multivariante
| Variables | OR | IC 95% | p |
|---|---|---|---|
| Sexo (V vs. M) | 2.688 | 0,993-7.220 | 0,052 |
| Bacteriemia | 2.986 | 0,968-9.206 | 0,057 |
| N° de comorbilidades | 1.983 | 1.198-3.284 | 0,008 |
| Neumonía por COVID-19 | 5.850 | 1.091-31.370 | 0,039 |
| Coinfección A. baumannii | 9.329 | 2.289-38.020 | 0,002 |
Variables especificadas en el paso 1: sexo, bacteriemia, shock séptico, infección del tracto urinario, n° de comorbilidades, ventilación mecánica, sonda urinaria, catéter venoso central, intubación orotraqueal, neumonía por COVID-19, A. baumannii, tratamiento con interferón β-1b.
La incidencia de la coinfección y/o sobreinfección bacteriana/fúngica en los pacientes con COVID-19 del HCUV fue del 16%, similar a la de hospitales de Wuhan (China) (151-16%13) y superior a la del Hospital Clínico de Barcelona (España) (7,3%)4 o a la reflejada en los metaanálisis de Rawson et al. (8%)11 y de Lansbury et al. (7%, IC 95% 3-12)12. Un hecho diferencial con respecto a estos estudios fue la detección de un brote de A. baumannii MDR en la UCI, contribuyendo al incrementó de la incidencia en un 2%. No obstante, es difícil hacer una comparación entre los diferentes trabajos debido a la heterogeneidad de las poblaciones estudiadas y a que varios autores solo analizaron la coinfección respiratoria.
En concordancia con otros estudios1,2,5,16,22, los hombres con COVID-19 e infección bacteriana presentaron mayor gravedad y mortalidad. La menor susceptibilidad de las mujeres al virus SARS-CoV-2 podría deberse al papel del cromosoma X y las hormonas sexuales en la inmunidad innata y adaptativa23. Sin embargo, nuestro trabajo discrepa con respecto a la edad y la comorbilidad como factores predictores de gravedad1,2,13, los pacientes ingresados en la UCI tenían de media 10 años menos que los pacientes de planta y menor comorbilidad. Las características de la población estudiada, con una mediana de edad superior a la mayoría de las series (mediana de 56-70 años)1,2,4,22, así como diferencias en los criterios de ingreso en el hospital y en la UCI (servicios saturados y colapsados) podrían haber influido en estos resultados.
Al igual que en estudios precedentes4,11,12, la incidencia de coinfección en nuestra población fue baja (5%) y no justificaría el elevado número de antibióticos de amplio espectro utilizados de forma empírica al ingreso hospitalario. En el metaanálisis de Rawson et al.11 el 72% de los pacientes fueron tratados con antibióticos, elevándose al 80-100% en los pacientes con COVID-19 en estado crítico en las UCI1,5,13. Ante estos datos, varios autores4,6,24 abogaron por implantar protocolos de tratamiento antibióticos basados en la evidencia científica, haciendo un uso racional de los mismos, sopesando el riesgo/beneficio en función de la gravedad y la comorbilidad del paciente y adaptando el tratamiento a la epidemiologia y sensibilidad antibiótica de cada área de salud.
La sobreinfección bacteriana/fúngica (11%) predominó en los pacientes de la UCI, resultado similar a la de Lansbury et al.12 (14%; IC 95% 5-26 vs. 4%, IC 95% IC 1-9) y Ripa et al.22 (9,3%). La elevada utilización de dispositivos médicos invasivos en los pacientes de la UCI predispone a una mayor tasa de infecciones nosocomiales, principalmente respiratorias, urinarias y BAC22. Otro factor que podría haber influido en la sobreinfección sería la tasa de inmunomoduladores utilizados, superior a la de los pacientes con COVID-19 hospitalizados en España2,3. No obstante, en el estudio de Ripa et al.22, los pacientes con sobreinfecciones habían recibido mayor tratamiento con inmunomoduladores biológicos (p = 0,045), pero no encontraron que fuese un factor predictor de sobreinfección. La epidemiología de estas infecciones está estrechamente relacionada con la flora hospitalaria predominante. Sin embargo, el brote por un microorganismo poco habitual en nuestro hospital hizo de A. baumannii el primer agente de las sobreinfecciones respiratorias y el segundo de las bacteriemias. Las medidas de aislamiento implantadas por la COVID-19 para evitar la transmisión horizontal no fueron suficientes para contener el brote. La escasez de equipos de protección individual y de personal experimentado, junto con el stress, pudieron contribuir a la aparición y extensión del brote.
Las tasas de bacteriemia y de shock sépticos recogidos en la literatura varían entre el 1 al 36%4,25-27 y del 4 al 33%1,27, respectivamente. Nuestros datos de shock (8%) son similares a estos estudios, aunque las cifras de bacteriemia totales (23%) y en pacientes críticos (38%) están por encima de la media. Los datos de coinfección/sobreinfección respiratoria son los más estudiados por todos los autores, arrojando también cifras muy variables entre el 5-29%5,24,27. Nuestras cifras, muy superiores globalmente (51/113, 45%) y en UCI (32/50, 64%), están muy probablemente influenciadas por el brote por A. baumannii MDR, junto con la complejidad de los pacientes, algunos de ellos derivados a UCI procedentes de otros centros hospitalarios de la región.
Los patógenos más frecuentes de la coinfección respiratoria fueron S. pneumoniae y S. aureus, similar a otras series4 y a la mayoría de las neumonías víricas coinfectadas8. Existe poca documentación en la bibliografía sobre las ITU en los pacientes con COVID-19, a excepción de la cohorte de García-Vidal et al.4, con un 23,3% de coinfecciones y un 27,3% de sobreinfecciones y predominio de los BGN en ambas infecciones. A diferencia de ese trabajo, en nuestra serie predominaron los cocos grampositivos.
El 45% de los BGN presentaron resistencia de especial interés epidemiológico (BLEE y/o OXA 48 o MDR) reflejando una selección de la flora por la presión antibiótica. En la mayoría de las series predominan BGN fundamentalmente y es frecuente encontrar hongos, sobre todo del género Aspergillus spp. y Candida spp.5,11,12,21,26. El papel que desempeñan estos aislamientos es en muchas ocasiones dudoso ya que, aún siguiendo las guías de diagnóstico con apoyo de las técnicas de imagen y otros marcadores microbiológicos, es difícil establecer si se trata de una mera colonización o de una verdadera infección. En nuestra serie, únicamente tres pacientes cumplían criterios de probable aspergilosis invasiva, los tres fueron tratados con antifúngico y dos fallecieron.
Los marcadores serológicos inflamatorios que generalmente están elevados en la infección bacteriana, como la procalcitonina y la proteína C reactiva, presentan una baja sensibilidad y especificidad28-30 y pueden aparecer en pacientes con COVID-19 sin que se produzca una coinfección bacteriana31. Aunque para Lv et al.5 sí que resultaron de utilidad. En este estudio el valor medio de la proteína C reactiva y la procalcitonina fueron elevados en todos los procesos infecciosos, pero su gran variabilidad no los hace un marcador fiable. En nuestra opinión se necesitan más estudios para conocer su verdadera utilidad en el diagnóstico de coinfección, así como la realización de investigaciones a la búsqueda de nuevos biomarcadores.
La mortalidad de los pacientes ingresados en la UCI con COVID-19 y coinfección o sobreinfección bacteriana fue extremadamente alta (50%) en comparación con la mortalidad de los pacientes ingresado por COVID-19 en varios hospitales de España (213-28%2) o de los pacientes de ingresados en las UCI del Reino Unido (32%)16. Y al igual que en otras pandemias por gripe, la coinfección/sobreinfección contribuyó a empeorar el pronóstico de la enfermedad8,9.
Este estudio retrospectivo tiene varios factores limitantes. Primero, se informa de las infecciones clínicamente significativas con documentación microbiológica. Sin embargo, no siempre es fácil la distinción entre infección y colonización, especialmente en pacientes sondados e intubados, por lo que la ITU e IR pueden estar sobrestimadas. Segundo, no se recogieron sistemáticamente muestras para estudio microbiológico en los pacientes con sospecha de infección, tanto por falta de la toma de muestras invasivas (bien por temor o por la sobresaturación de los servicios) como por el uso generalizado de antibióticos de amplio espectro al ingreso, por lo que podría haber cierto infradiagnóstico.
ConclusiónLa coinfección y sobreinfección bacteriana/fúngica en los pacientes COVID-19 es inferior a la de otras infecciones por virus respiratorios, pero incrementa significativamente la gravedad y mortalidad de estos pacientes. El brote por A. baumannii fue uno de los principales determinantes de gravedad y mortalidad de los pacientes de la UCI. El diagnóstico de la coinfección es complejo pero su reconocimiento es vital. Se necesitan algoritmos diagnósticos para la detección y tratamiento precoz y adecuado de las complicaciones bacterianas. Una revisión permanente de los protocolos hospitalarios permitirá que, a pesar de la urgencia del trabajo, la dificultad añadida por utilización de los equipos de protección individual, la posibilidad de personal poco entrenado y otros factores desfavorables influyan lo menos posible en la aparición de brotes nosocomiales. Así mismo se deberá prestar atención a coinfecciones más tardías que se puedan de desarrollar posteriormente derivados del uso de corticoides y otros inmunomoduladores.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Isabel Antolín Ayala y la Dra. Milagros Cuervo Abarquero por su colaboración en el estudio microbiológico de estos pacientes. A María Fe Muñoz Moreno por la realización del estudio estadístico. Al personal de todos los Servicios del HCUV, especialmente a Medicina Interna y a la Unidad de Cuidados Intensivos, por el gran e intenso trabajo realizado con los pacientes con COVID-19.