La hepatitis C es un importante problema de salud pública a nivel mundial. Esta enfermedad está causada por el virus de la hepatitis C (VHC), virus que se caracteriza por su diversidad genética. La infección es generalmente asintomática, pero entre el 60 y el 80% de los infectados por el VHC evolucionarán a hepatitis crónica; el 20%, a medio-largo plazo, a cirrosis hepática, y entre el 1 y el 4% de estos pacientes con cirrosis van a desarrollar anualmente un carcinoma hepatocelular (CHC). Recientemente se ha elaborado un documento de consenso español para diagnosticar la hepatitis C en un solo paso que consiste en la investigación activa (anticuerpos y viremia) en una sola muestra, con lo que, a juicio de los expertos, disminuiría el tiem-po de acceso al tratamiento y evitaría pérdidas de seguimiento. Con el objetivo de cambiar de forma definitiva el paradigma de tratamiento de la hepatitis C se han aprobado fármacos antivirales de acción directa (AAD) cuyo desarrollo se ha basado en lograr tasas de curación cercanas al 100%, independientemente del genotipo del virus, es decir, pangenotípicos, con buena tolerancia y biodisponibilidad. Estos fármacos representan una verdadera revolución terapéutica. Información sobre el suplemento: este artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. y Sociedad Española de Enfermedades Infecciosasy Microbiología Clínica. Todos los derechos reservados.
Hepatitis C is a major public health problem worldwide. This disease is caused by the hepatitis C virus, which is characterised by its genetic diversity. The infection is usually asymptomatic. However, between 60% and 80% of HCV-infected individuals will progress to chronic hepatitis, 20% to liver cirrhosis in the medium-to long-term and, each year, between 1% and 4% of these patients with cirrhosis will develop hepatocellular carcinoma (HCC). A Spanish consensus document has recently been drafted to diagnose hepatitis C in a single step, consisting of active investigation (antibodies and viremia) in a single sample, which according to the experts, would reduce the time to access treatment and avoid tracking losses. To definitively change the hepatitis C treatment paradigm, direct-acting antiviral drugs (DAAs) have been approved, whose development has been based on achieving cure rates close to 100% regardless of the genotype of the virus, ie, pangenotypes, with good tolerance and bioavailability. These drugs have constituted a real therapeutic revolution. Supplement information: This article is part of a supplement entitled «SEIMC External Quality Control Programme. Year 2016», which is sponsored by Roche, Vircell Microbiologists, Abbott Molecular and Francisco Soria Melguizo, S.A.
© 2019 Elsevier España, S.L.U. and Sociedad Española de Enfermedades Infecciosasy Microbiología Clínica. All rights reserved.
La infección por el virus de la hepatitis C (VHC) se considera un importante problema de salud pública. Se estima que más de 185 millones de personas en el mundo tienen anticuerpos frente al VHC, con una prevalencia global del 2,8% y más de 350.000 muertes al año1. En Europa, su prevalencia oscila entre el 1 y el 1,5%2. Las regiones más afectadas, según la Organización Mundial de la Salud (OMS), son las del Mediterráneo Oriental, con una prevalencia del 2,3%3.
En España, las cifras estimadas de infectados se han rebajado considerablemente a la luz de los datos aportados por los últimos estudios epidemiológicos y se sitúan en, aproximadamente, el 1,2% de la población global. Llama la atención el bajo número de pacientes virémicos, no superior en ningún caso al 50% de los que poseen anticuerpos frente al VHC4.
El conocimiento del ciclo viral del VHC y la interacción de virus-huésped ha sido crucial para el desarrollo de antivirales de acción directa (AAD) que han cambiado la historia natural de la enfermedad. Sin embargo, el acceso al tratamiento dista mucho de ser una realidad para todos y así, en 2015, el 7,4% de los diagnosticados con infección por el VHC (1,1 millones de personas) estaban en tratamiento, pero de ellos solo unas 500.000 personas habían recibido AAD.
En nuestro país y gracias al Plan Estratégico Nacional, el número de pacientes con VHC tratados desde el 1 de enero de 2015 hasta el 30 de junio de 2017 con AAD ha ascendido a un total de 81.643. De ellos, se ha logrado respuesta viral sostenida en el 95,52%. En el primer semestre de 2017, los tratamientos iniciados oscilaron entre los 2.249 de abril y los 2.768 registrados en mayo5.
Entre el 60 y el 80% de los infectados por el VHC evolucionarán a hepatitis crónica6 y el 20%, a medio-largo plazo, a cirrosis hepática, que se descompensará en el 18-22% de los pacientes en el plazo de 5 años7. Entre el 1 y el 4% de estos pacientes con cirrosis van a desarrollar anualmente un carcinoma hepatocelular (CHC)8,3.
Es también bien conocido que la infección crónica por el VHC puede causar múltiples manifestaciones extrahepáticas, como glomerulonefritis, diabetes mellitus, trastornos tiroideos, porfiria cutánea tardía, crioglobulinemia mixta, liquen plano y trastornos linfoproliferativos de células B.
En países desarrollados, la forma más frecuente de transmisión del VHC históricamente ha sido el uso de drogas por vía parenteral (UDVP). Sin embargo, en los países de escasos recursos la transmisión se produce por procedimientos invasivos o inyecciones con instrumentación contaminada9. Aparte de los UDVP, se han identificado múltiples factores de riesgo para la transmisión del VHC: transfusiones de sangre, sexo con UDVP, consumo de drogas por vía nasal, estancia de más de 3 días en la cárcel, escarificación religiosa, haber sido golpeado o cortado con un objeto sangriento, piercings en orejas perforadas u otras partes del cuerpo, inyecciones de inmunoglobulinas, etc.
La transmisión sexual del VHC es menos común y se observa con mayor frecuencia en hombres que practican sexo con hombres (HSH) y en pacientes infectados por el virus de la inmunodeficiencia humana (VIH)10,11. Recientemente se ha comunicado en un estudio holandés que, tras el tratamiento de la infección por el VHC en una población de HSH, también coinfectados por el VIH, disminuye la incidencia de nuevos casos el 51% en tan solo 2 años12.
Características del VHCEl VHC pertenece al género Hepacivirus de la familia Flaviviridae. La variabilidad genética es una de las características biológicas más relevantes del VHC. Hasta ahora se han podido identificar 7 genotipos diferentes, distintos entre sí en el 30-35% de los nucleótidos de cada genotipo. A su vez, cada genotipo se divide en subtipos, que difieren entre el 20 y el 25% en la secuencia de nucleótidos. Debido a esta heterogeneidad genómica, desde los 7 genotipos principales, existen más de 67 subtipos de VHC13 que van a influir en la respuesta y duración de la terapia antiviral.
En cuanto a su estructura, se trata de un virus pequeño de unos 50 nm de diámetro. Presenta una membrana lipídica derivada del retículo endotelial de la célula huésped con las glucoproteínas E1 y E2 incrustadas en la membrana. Bajo la membrana lipídica se encuentra la nucleocápside compuesta por múltiples copias de la proteína central que rodea el ácido ribonucleico (ARN) genómico. El genoma del VHC está compuesto por una única molécula de ARN de polaridad positiva.
Los genotipos 1-3 muestran una amplia distribución en casi todo el mundo. El genotipo 4 del VHC es más prevalente en Arabia Saudí, Baréin, Jordania, Egipto y Etiopía. Los genotipos 5-7 se han comunicado en Sudáfrica, el Sudeste asiático y África central, respectivamente14-16.
El genotipo 1 es más frecuente entre los pacientes con antecedentes de transfusión de sangre y hemoderivados, así como cirugía y procedimientos bucodentales17. La infección por el genotipo 2 del VHC se ha asociado, principalmente, con la transmisión nosocomial y también con instrumentaciones estomatológicas. El genotipo 3, por su parte, se encuentra con frecuencia en las comunidades de UDVP y en aquellos con antecedentes de tatuajes y piercings18,19. Finalmente, el genotipo 4 se transmite, sobre todo, a través de prácticas sexuales de alto riesgo, especialmente entre hombres homosexuales y también en UDVP20.
Ciclo vital del VHCEl VHC se replica, sobre todo, en el citoplasma de los hepatocitos aunque también lo hace en células mononucleares, células dendríticas y del sistema nervioso central.
La partícula viral puede circular libre o unida a lipoproteínas de baja y muy baja densidad. La unión del virus a la superficie de la membrana celular y su entrada en la célula implican la interacción con varios factores: el receptor de la lipoproteína de baja densidad (LDLR), glucosaminoglucanos (GAG) y los genes SRB1, CD81 y CLDN1, que expresan proteínas/receptores con el mismo nombre. El VHC utiliza proteínas presentes en su capa lipídica protectora para unirse a estos receptores y entra en el hepatocito por endocitosis. Tras la entrada, se produce la descapsidación y el ARN vírico circula libremente por el citoplasma.
Descripción general de la entrada en la célula del VHCEn el retículo endotelial de la célula huésped se produce el proceso de traducción, procesamiento y replicación. Puesto que el VHC almacena su información en una cadena de un único sentido de ARN, el propio ARN vírico puede ser leído directamente por los ribosomas de la célula huésped y funcionar como si fuera el ARN normal presente en la célula.
En el citoplasma, el genoma se traduce generando una poliproteína vírica que por proteólisis produce 3 proteínas estructurales (E1, E2 y central) y 6 proteínas no estructurales (NS2, NS3, NS4A, NS4B, NS5A y NS5B), cuya función se centra básicamente en el procesamiento de la poliproteína y en la replicación vírica. Las proteínas no estructurales son importantes como diana en el tratamiento con los nuevos AAD. El papel más importante lo tienen NS3 y NS5. NS3 se une a NS4A para formar una proteasa implicada en el procesamiento del resto de proteínas no estructurales, esencial para el ciclo del VHC. Por este motivo es una diana interesante en la terapia contra el VHC. Parece que NS5A regula diversas vías de señalización aunque no se conoce bien su función. NS5B es la polimerasa vírica, una ARN-polimerasa, capaz de sintetizar ARN de novo21.
Proteínas del virus de la hepatitis CLos virus recién formados viajan a la parte interior de la membrana plasmática y se unen a ella. La membrana plasmática rodea el virus y luego lo libera, lo que proporciona al virus su capa lipídica protectora, la cual va a ser utilizada más adelante por el virus para unirse a otra célula hepática. Este proceso de liberación de nuevos virus se mantiene durante horas en la superficie celular hasta que la célula muere de agotamiento.
En un mismo paciente pueden coexistir numerosos genomas (cuasiespecies) debido a la elevada cinética de replicación del VHC y la falta de actividad correctora de la ARN-polimerasa. Dentro de estas cuasiespecies se seleccionan, en mayor o menor proporción, variantes víricas con sustituciones asociadas con resistencias a fármacos antivirales.
DiagnósticoLa infección por VHC se describe por la existencia de anticuerpos anti-VHC y ARN-VHC en plasma o suero con niveles elevados o normales de enzimas hepáticas. Los anticuerpos anti-VHC se detectan mediante el uso de pruebas serológicas: el ensayo inmunoabsorbente ligado a enzimas (ELISA, enzyme-linked immunosorbent assay) y el ensayo de inmunotransferencia recombinante (RIBA, recombinant immunoblot assay). La detección de anticuerpos anti-VHC indica infección actual o pasada por VHC. Se necesita una determinación del ARN del VHC o prueba de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) para determinar si una persona está actualmente infectada por el VHC.
Recientemente se ha elaborado un documento de consenso español para diagnosticar la hepatitis C en un solo paso que consiste en la investigación activa (anticuerpos y viremia) en una sola muestra, con lo que, a juicio de los expertos, disminuiría el tiempo de acceso al tratamiento y evitaría perdidas de seguimiento22.
La detección y cuantificación del antígeno central del VHC mediante ELISA, aunque es menos sensible que la carga viral, tiene la ventaja de agilizar el diagnóstico en un solo paso sin necesidad de agrupar muestras y con menor coste que el ARN-VHC.
En algunos pacientes con ARN del VHC en suero o plasma con niveles indetectables, el ARN del virus puede detectarse en muestras de células mononucleares de sangre periférica (PBMC, peripheral blood mononuclear cells), biopsias hepáticas y muestras de suero ultracentrifugado. A ello se le ha denominado infección oculta23.
La determinación del grado de fibrosis hepática se realiza principalmente por elastografía transitoria (Fibroscan) ya que es la técnica mejor evaluada y que se considera de referencia. Se correlaciona de forma razonable con la gravedad de la hipertensión portal y pronostica el riesgo de descompensación.
Un estudio realizado con más de 1.200 pacientes con hepatitis C evaluados con biopsia y Fibroscan mostró que una rigidez hepática > 9,1 kPa presenta un valor predictivo positivo (VPP) superior al 84% para identificar fibrosis avanzada (F3-4) y una cifra > 13,2 kPa con un VPP superior al 86% para identificar cirrosis (F4). Se ha podido constatar que, cuanto más elevado es el valor elastográfico, mayor es el riesgo de descompensación hepática, de CHC y de mortalidad. Sin embargo, los puntos de corte de cada uno de estos escenarios no están totalmente confirmados. Recientemente se ha sugerido que la variación a lo largo del tiempo del valor de la elastografía tiene valor pronóstico24.
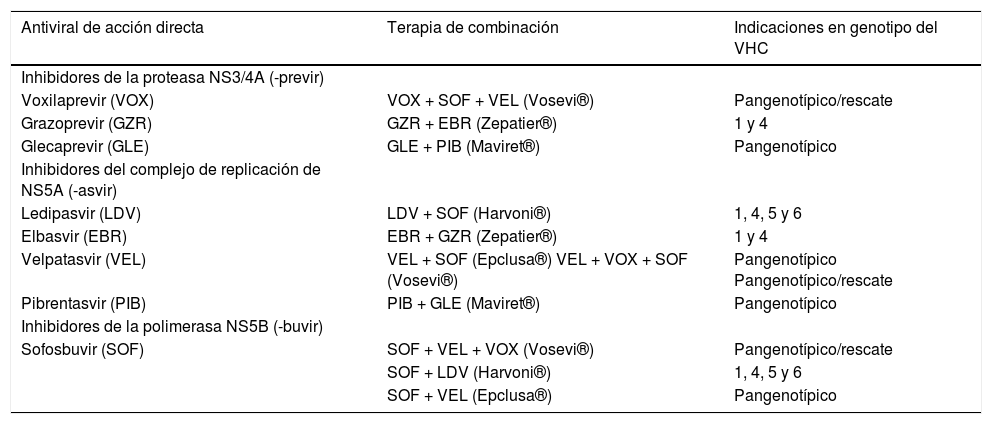
TratamientoGracias a una mejor comprensión del ciclo vital del VHC se han podido desarrollar fármacos antivirales de acción directa: inhibidores de la proteasa NS3/4A, inhibidores de complejos de replicación NS5A, inhibidores de la polimerasa NS5B nucleósidos e inhibidores de la polimerasa NS5B no nucleósidos que han revolucionado el tratamiento de la hepatitis C crónica.
El principal objetivo del tratamiento antiviral es erradicar el virus, definido como un ARN viral que es indetectable mediante métodos altamente sensibles (límite de detección más bajo de 15 UI/ml). Se considera que hay una respuesta viral sostenida (RVS) si este ARN permanece indetectable 12 semanas (RVS12) después de la finalización del tratamiento.
Conseguir la RVS12 es un proceso multifactorial, que va a depender no solo del virus sino también de factores relacionados con el huésped (fundamentalmente, del grado de fibrosis) y de la experiencia previa con tratamientos. Desde el punto de vista virológico, hay que conseguir que, durante el tiempo en que el virus se expone a los fármacos, estos sean capaces de eliminar todas las variantes que infectan al paciente.
Una RVS12 corresponde a una cura de la infección por el VHC con muy pocas posibilidades de recaída posterior y se asocia con normalización de transaminasas y mejora o desaparición de la necroinflamación y la fibrosis hepática en pacientes sin cirrosis. En pacientes con fibrosis avanzada (METAVIR F3) o cirrosis (F4), el riesgo de complicaciones, como la insuficiencia hepática y la hipertensión portal, se reduce después de una RVS; aunque el riesgo de CHC y la mortalidad también se reduce, no se elimina. Asimismo, la mayoría de las complicaciones extrahepáticas pueden desaparecer o mitigarse con la eliminación del virus.
Hasta hace unos años, la única estrategia de tratamiento se basaba en la combinación de interferón pegilado y ribavirina (PEG/RBV) durante 24 o 48 semanas según el genotipo. Sin embargo, en los genotipos 1 y 4, las tasas de respuesta viral no superaban el 50% y solo eran ligeramente superiores en los otros genotipos.
En la actualidad, existen 3 familias de AAD en función de la proteína estructural del VHC que bloquean. En el año 2011 se comercializaron los primeros inhibidores de la proteasa del VHC (NS3), boceprevir y telaprevir, que se administraban con PEG/RBV, con los cuales se logró una mayor tasa de RVS, pero con un alto grado de toxicidad e interacciones farmacológicas que motivaban poca seguridad, sobre todo en pacientes con enfermedad avanzada25.
En España, desde la aprobación del Plan Estratégico Nacional en abril de 2015, se han ido incorporando de forma progresiva nuevos esquemas de tratamiento con AAD, por lo que nuestro país es uno de los que más pacientes por millón de habitantes ha tratado del mundo. Los AAD se caracterizan por una eficacia superior al 90%, buena seguridad tanto en ensayos clínicos como en la vida real, algunos de ellos son pangenotípicos y, además, combinados entre ellos hacen posible que por fin se haya podido prescindir del uso del PEG y, en la mayoría de los pacientes, también de la RBV.
Fármacos de acción directa aprobados en Europa en 2018 y recomendados por las guías españolas (AEEH/GEHEP) y europeas (EASL)En España26,27 y en Europa28 han cambiado de forma radical las estrategias de tratamiento gracias a la reciente disponibilidad de fármacos pangenotípicos29-34, que alcanzan tasas de curación cercanas al 100% y son muy bien tolerados. De esta manera, ha dejado de usarse la pauta ombitasvir/paritaprevir/ritonavir con dasabuvir o sin él por haber sido superada en eficacia, y combinaciones como sofosbuvir (SOF) más daclatasvir35, e incluso SOF más ledipasvir (LDP) durante 12 semanas, porque su coste es mayor a otras cuyos resultados son iguales o mejores. No obstante, se continúa utilizando la pauta de SOF + LDP durante 8 semanas36.
Nos centraremos, por tanto, en los fármacos y combinaciones que se recomiendan en la actualidad (tabla 1).
Tratamiento actual del virus de la hepatitis C (VHC): fármacos, combinaciones e indicaciones
| Antiviral de acción directa | Terapia de combinación | Indicaciones en genotipo del VHC |
|---|---|---|
| Inhibidores de la proteasa NS3/4A (-previr) | ||
| Voxilaprevir (VOX) | VOX + SOF + VEL (Vosevi®) | Pangenotípico/rescate |
| Grazoprevir (GZR) | GZR + EBR (Zepatier®) | 1 y 4 |
| Glecaprevir (GLE) | GLE + PIB (Maviret®) | Pangenotípico |
| Inhibidores del complejo de replicación de NS5A (-asvir) | ||
| Ledipasvir (LDV) | LDV + SOF (Harvoni®) | 1, 4, 5 y 6 |
| Elbasvir (EBR) | EBR + GZR (Zepatier®) | 1 y 4 |
| Velpatasvir (VEL) | VEL + SOF (Epclusa®) VEL + VOX + SOF (Vosevi®) | Pangenotípico Pangenotípico/rescate |
| Pibrentasvir (PIB) | PIB + GLE (Maviret®) | Pangenotípico |
| Inhibidores de la polimerasa NS5B (-buvir) | ||
| Sofosbuvir (SOF) | SOF + VEL + VOX (Vosevi®) | Pangenotípico/rescate |
| SOF + LDV (Harvoni®) | 1, 4, 5 y 6 | |
| SOF + VEL (Epclusa®) | Pangenotípico |
En las tablas 2 y 3 se muestran los regímenes de tratamiento de los distintos genotipos en pacientes no expuestos a AAD sin cirrosis o bien con cirrosis compensada (Child-Pugh A), basados en los últimos estudios publicados29-34.
Regímenes de tratamiento en genotipos 1a, 1b y 2 en pacientes no expuestos a antivirales de acción directa, sin cirrosis o bien con cirrosis compensada (Child-Pugh A)
| Genotipo | Tratamiento/nivel de evidencia | Estudios clínicos |
|---|---|---|
| 1a y 1b | • Sofosbuvir/velpatasvir (AI) 12 semanas | Astral-1 y 5 |
| • Glecaprevir/pibrentasvir (AI) 8 semanas en pacientes sin cirrosis 12 semanas en cirróticos | Endurance-1, Expedition-1 | |
| • Sofosbuvir/ledipasvir (BI) 8 semanas- Si la carga vírica del VHC es < 6.000.000 copias/ml, puede utilizarse una pauta de 8 semanas excepto:• Raza negra• Coinfectados por el VIH• Experiencia previa con AAD- No recomendado en cirróticos | lon-1, 3 y 4 | |
| • Grazoprevir/elbasvir (AI) 12 semanasEn 1b en todos los pacientes En 1a no se recomienda si la carga vírica del VHC es > 800.000 copias/ml, excepto en el caso de que haya constancia de no resistencias a elbasvir | C-edge-TN, C-edge-coinfection | |
| 2 | • Glecaprevir/pibrentasvir 8 semanas en pacientes sin cirrosis (AI) 12 semanas en cirróticos (AII) | Expedition-1 y 2 |
| • Sofosbuvir/velpatasvir (AI) 12 semanas | Astral-1, 2 y 5 |
AAD: antiviral de acción directa; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
Regímenes de tratamiento en genotipos 3, 4, 5 y 6 en pacientes no expuestos a antivirales de acción directa, sin cirrosis o bien con cirrosis compensada (Child-Pugh A)
| Genotipo | Tratamiento/nivel de evidencia | Estudios clínicos |
|---|---|---|
| 3 | • Sofosbuvir/velpatasvir (A1) 12 semanasEn cirróticos se recomienda añadir ribavirina si hay resistencia en NS5A o no se dispone de esta información | Astral-3 |
| • Glecaprevir/pibrentasvir (A1)- No cirróticos y sin factores de mala respuesta: 8 semanas- En cirróticos o si hay factores de mala respuesta: 12 semanas- En cirróticos ya tratados con pegilado-ribavirina: 16 semanas | Endurance-3, Expedition-2, Surveyor-2 | |
| 4 | • Sofosbuvir/velpatasvir (AI) 12 semanas | Astral-1 y 5 |
| • Glecaprevir/pibrentasvir (AI) 8 semanas (no cirrosis) o 12 semanas (cirrosis) | Endurance-4, Expedition-1 y 2, Surveyor-2 | |
| • Grazoprevir/elbasvir (AI) 12 semanas y solo en pacientes sin tratamiento previo | C-edge-TN, C-edge-coinfection, C-edge-co star | |
| 5 y 6 | • Sofosbuvir/velpatasvir (BI) 12 semanas | Pocos pacientes en los ensayos conjuntos ya |
| • Glecaprevir/pibrentasvir (BI) 8 semanas (no cirrosis) o 12 semanas (cirrosis) | comentados para otros genotipos que no permiten realizar una recomendación fuerte |
En pacientes con experiencia previa de tratamiento con AAD se recomienda siempre el rescate guiado por un estudio de resistencias.
Si no se dispone de estudio de resistencias, se recomienda37:
- •
Genotipo 1: SOF/velpatasvir (VEL)/voxilaprevir (VOX) durante 12 semanas (AI) tanto en no cirróticos como en cirrosis compensada. Con menos evidencia (BIII), se pueden utilizar pautas con glecaprevir (GLE)/pibrentasvir (PIB) y SOF/VEL en no cirróticos.
- •
Genotipo 2: SOF/VEL/VOX durante 12 semanas (AII) y SOF/VEL o GLE/PIB durante 12 semanas (AIII) tanto en no cirróticos como en cirrosis compensada.
- •
Genotipo 3: SOF/VEL/VOX durante 12 semanas (AI) en no cirróticos y cirrosis compensada.
- •
Genotipos 4-6: la misma pauta SOF/VEL/VOX que para el genotipo 3 (AII).
- •
En todos los casos se recomienda remitir a un centro con posibilidad de trasplante hepático.
- •
La pauta recomendada es SOF/VEL más RBV durante 12 semanas.
- •
Si la RBV está contraindicada, se prolongará el tratamiento a 24 semanas.
- •
Si hay fracaso previo a una combinación que contenga SOF o un inhibidor de la NS5A, se recomienda para cualquier genotipo la combinación SOF/VEL más RBV durante 24 semanas38.
Todavía quedan por controlar múltiples factores para conseguir el objetivo de eliminar la infección: no todos los casos están diagnosticados, no todos reciben atención especializada, se detectan nuevos casos, sobre todo en jóvenes y UDVP, así como entre HSH y, además, cada vez aparecen nuevos casos de reinfección tras la curación.
Conflicto de interesesEl Dr. Miguel García Deltoro y la Dra. Carmen Ricart Olmos declaran que han recibido aportaciones de Janssen, ViiV, MSD, Gilead y AbbVie en concepto de ponencias y moderaciones en reuniones, simposios y cursos no relacionadas con la realización del trabajo.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Programa de Control de Calidad Externo SEIMC. Año 2016», que ha sido patrocinado por Roche, Vircell Microbiologists, Abbott Molecular y Francisco Soria Melguizo, S.A.