Describir el espectro de las infecciones causadas por Rothia mucilaginosa.
MétodosEstudio retrospectivo de 20casos de infección por R.mucilaginosa entre los años 2009 y 2012.
ResultadosLa infección pulmonar fue la forma clínica más frecuente (n=14; 70%): bronquiectasias sobreinfectadas (10), empiema pleural (2), neumonía (1) y bronquitis aguda (1). Dos episodios fueron digestivos: colangitis bacteriémica y peritonitis secundaria. Dos bacteriemias afectaron a pacientes con neoplasia hematológica. Hubo una infección bacteriémica de herida quirúrgica y otra infección urinaria bacteriémica en portador de nefrostomía.
DiscusiónR.mucilaginosa puede ser responsable de infecciones de vías respiratorias bajas en pacientes con bronquiectasias pulmonares.
To describe the spectrum of infections caused by Rothia mucilaginosa.
MethodsRetrospective study of 20cases diagnosed with R.mucilaginosa from 2009 to 2012.
ResultsPulmonary infection was the most frequent clinical presentation (n=14, 70%): bronchiectasis infected (10), followed by pleural empyema (2), pneumonia (1) and acute bronchitis (1). Two episodes were of gastrointestinal origin: cholangitis secondary to biliary drainage and secondary peritonitis. Two episodes included bacteremia in patients with hematological malignancy. One patient had a surgical wound infection with bacteremia, and another had a bacteremic urinary tract infection in a patient with nephrostomy.
DiscussionR.mucilaginosa may be responsible for infections of the lower respiratory tract in predisposed patients.
Rothia mucilaginosa, antiguamente Stomatococcus mucilaginosus, es un coco grampositivo coagulasa negativo capsulado de la familia Micrococcaceae. Forma parte de la flora orofaríngea normal1 y es responsable de distintas patologías infecciosas en humanos, principalmente bacteriemia, sobre todo en inmunodeprimidos1. Aunque es un microorganismo de la microbiota de la boca, se ha visto implicado en neumonías tras identificarse en muestras de esputo o lavado bronquioalveolar2–4 y en otras formas de infección de vías respiratorias bajas como absceso pulmonar y empiema pleural2–8. Existen pocas series de pacientes de infección por R.mucilaginosa2,9, ya que la mayoría son casos aislados publicados en la literatura3–7. El objetivo de nuestro estudio fue describir el espectro de las infecciones causadas por R.mucilaginosa diagnosticadas en un periodo de 4años en un hospital general y analizar su papel etiopatogénico en infecciones del tracto respiratorio inferior.
Material y métodosSe revisaron retrospectivamente todos los casos clínicos en los que se aisló R.mucilaginosa en el laboratorio de Microbiología del Hospital General Universitario de Alicante en el periodo comprendido entre enero del 2009 y diciembre del 2012. Las historias clínicas fueron revisadas independientemente por 2investigadores. El hospital es un centro de tercer nivel con 845camas con todas las especialidades médico-quirúrgicas y es referencia de hematología clínica, cirugía torácica, cardiaca y plástica para la provincia de Alicante. Los pacientes en el diagnóstico etiológico de una infección respiratoria de vías bajas/neumonía se solicita un cultivo de esputo, antigenuria de neumococo y Legionella en orina, antígenos frente a virus de la influenza en invierno y broncoaspirado, lavado bronquioalveolar en caso de realizarse una broncoscopia. El microorganismo se identificó como patógeno cuando se aisló en muestras biológicas, incluyendo esputos, pero solo en aquellos con más de 25leucocitos polimorfonucleares y menos de 10células epiteliales por campo. Durante el año 2009 los aislamientos de R.mucilaginosa fueron identificados mediante el sistema VITEK2® (bioMérieux, Marcy l’Etoile, Francia) y desde el año 2010 mediante espectrometría de masas MALDI-TOF (BRUKER®, F.Soria, España). El estudio de sensibilidad de los microorganismos aislados de muestras respiratorias se realizó mediante la determinación de la concentración mínima inhibitoria por Etest® (bioMérieux, Marcy l’Etoile, Francia) incubado en placas de agar sangre a 37°C durante 24h. El estudio de sensibilidad de los aislados de hemocultivos, urocultivos y líquidos estériles se llevó a cabo mediante dilución en placa mediante paneles de Microscan® (WalkAway 96 Plus, Siemens, Health Care Diagnstics, S.L., Alemania)
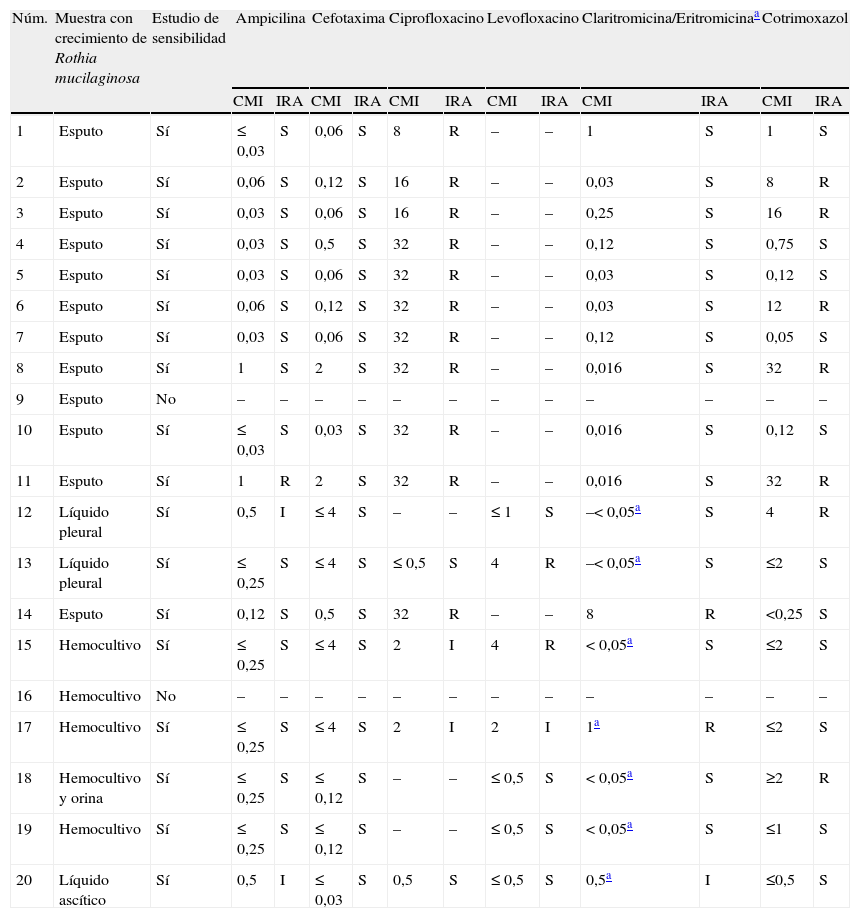
ResultadosDurante el periodo del estudio se identificó R.mucilaginosa en 21muestras de 20pacientes (un paciente tenía 2aislamientos). La tasa de infección por R.mucilaginosa fue de 1,49 por 10.000ingresos. Las muestras de aislamiento fueron: esputo (n=12), hemocultivo (n=5), líquido pleural (n=2), líquido ascítico (n=1) y orina (n=1). Se disponía de sensibilidad en 18aislamientos (tabla 1); el 100% fueron sensibles a cefuroxima (18/18), cefotaxima (18/18), vancomicina (9/9) y rifampicina (9/9), el 89% a claritromicina/eritromicina (16/18), el 83% lo fueron a ampicilina (15/18), el 57,% lo fueron a levofloxacino (4/7), el 50% fueron sensibles a cotrimoxazol (9/18) y el 13% fueron sensibles a ciprofloxacino (2/15). En 3 (14,3%) aislamientos existía otra flora acompañante (Streptococcus grupo viridans, S.mitis, S.salivarius).
Estudio de sensibilidad de los aislados de Rothia mucilaginosa
| Núm. | Muestra con crecimiento de Rothia mucilaginosa | Estudio de sensibilidad | Ampicilina | Cefotaxima | Ciprofloxacino | Levofloxacino | Claritromicina/Eritromicinaa | Cotrimoxazol | ||||||
| CMI | IRA | CMI | IRA | CMI | IRA | CMI | IRA | CMI | IRA | CMI | IRA | |||
| 1 | Esputo | Sí | ≤ 0,03 | S | 0,06 | S | 8 | R | – | – | 1 | S | 1 | S |
| 2 | Esputo | Sí | 0,06 | S | 0,12 | S | 16 | R | – | – | 0,03 | S | 8 | R |
| 3 | Esputo | Sí | 0,03 | S | 0,06 | S | 16 | R | – | – | 0,25 | S | 16 | R |
| 4 | Esputo | Sí | 0,03 | S | 0,5 | S | 32 | R | – | – | 0,12 | S | 0,75 | S |
| 5 | Esputo | Sí | 0,03 | S | 0,06 | S | 32 | R | – | – | 0,03 | S | 0,12 | S |
| 6 | Esputo | Sí | 0,06 | S | 0,12 | S | 32 | R | – | – | 0,03 | S | 12 | R |
| 7 | Esputo | Sí | 0,03 | S | 0,06 | S | 32 | R | – | – | 0,12 | S | 0,05 | S |
| 8 | Esputo | Sí | 1 | S | 2 | S | 32 | R | – | – | 0,016 | S | 32 | R |
| 9 | Esputo | No | – | – | – | – | – | – | – | – | – | – | – | – |
| 10 | Esputo | Sí | ≤ 0,03 | S | 0,03 | S | 32 | R | – | – | 0,016 | S | 0,12 | S |
| 11 | Esputo | Sí | 1 | R | 2 | S | 32 | R | – | – | 0,016 | S | 32 | R |
| 12 | Líquido pleural | Sí | 0,5 | I | ≤ 4 | S | – | – | ≤ 1 | S | –<0,05a | S | 4 | R |
| 13 | Líquido pleural | Sí | ≤ 0,25 | S | ≤ 4 | S | ≤ 0,5 | S | 4 | R | –<0,05a | S | ≤2 | S |
| 14 | Esputo | Sí | 0,12 | S | 0,5 | S | 32 | R | – | – | 8 | R | <0,25 | S |
| 15 | Hemocultivo | Sí | ≤ 0,25 | S | ≤ 4 | S | 2 | I | 4 | R | <0,05a | S | ≤2 | S |
| 16 | Hemocultivo | No | – | – | – | – | – | – | – | – | – | – | – | – |
| 17 | Hemocultivo | Sí | ≤ 0,25 | S | ≤ 4 | S | 2 | I | 2 | I | 1a | R | ≤2 | S |
| 18 | Hemocultivo y orina | Sí | ≤ 0,25 | S | ≤ 0,12 | S | – | – | ≤ 0,5 | S | <0,05a | S | ≥2 | R |
| 19 | Hemocultivo | Sí | ≤ 0,25 | S | ≤ 0,12 | S | – | – | ≤ 0,5 | S | <0,05a | S | ≤1 | S |
| 20 | Líquido ascítico | Sí | 0,5 | I | ≤ 0,03 | S | 0,5 | S | ≤ 0,5 | S | 0,5a | I | ≤0,5 | S |
CMI: concentración mínima inhibitoria en mg/l; IRA: interpretación de los resultados del antibiograma.
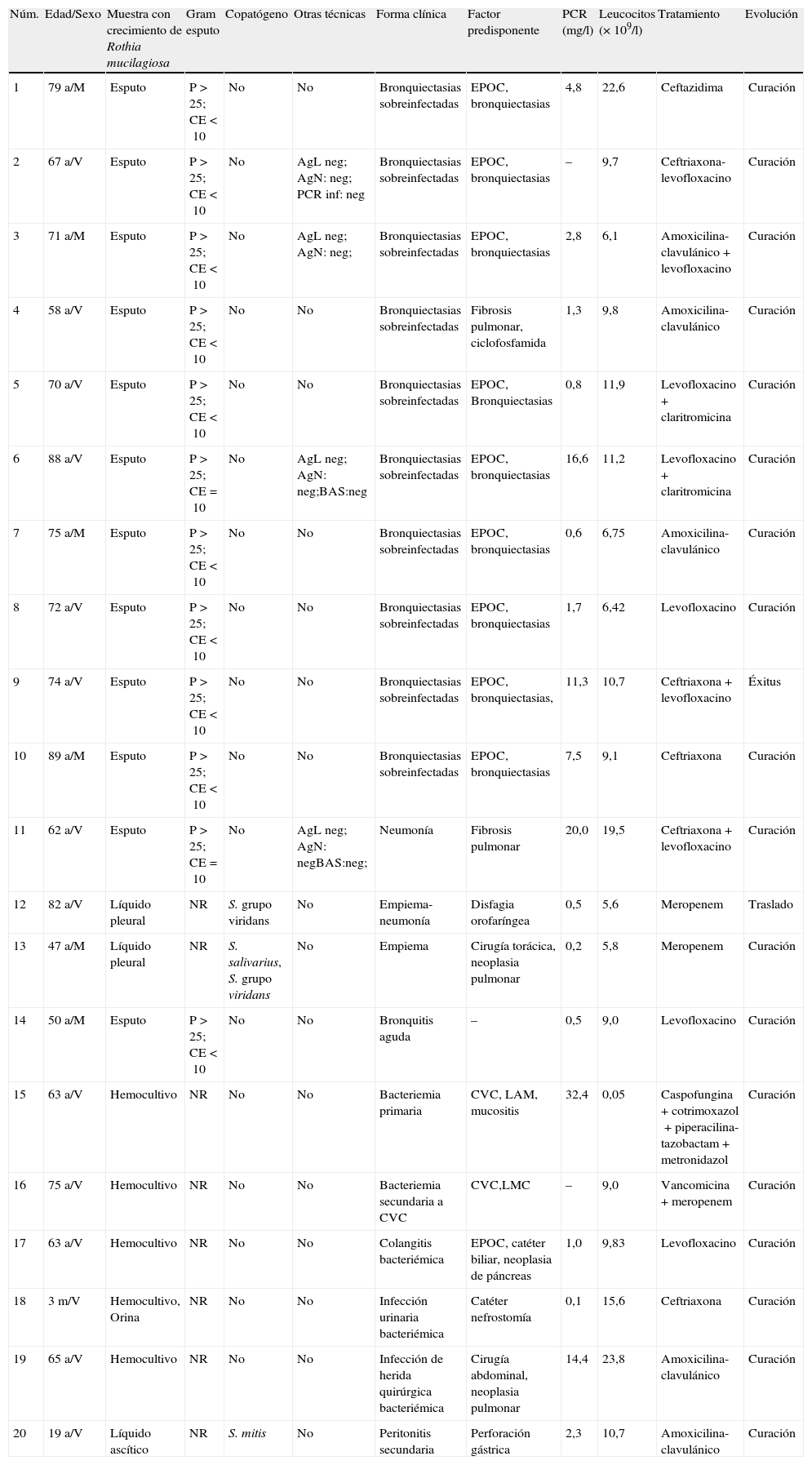
Las características epidemiológicas, clínicas y evolutivas de estos pacientes se recogen en la tabla 2. La mediana de edad de los enfermos fue de 68,5años (rango: 3meses-89años). Catorce (70%) eran varones y 6 (30%) mujeres. La infección pulmonar fue la forma clínica más frecuente (n=14; 70%): bronquiectasias sobreinfectadas (n=10), empiema pleural (n=2), neumonía (n=1) y bronquitis aguda (n=1). Dos episodios fueron digestivos: colangitis bacteriemia y peritonitis secundaria. Dos episodios fueron de bacteriemia (primaria y secundaria a catéter venoso central) en pacientes con neoplasia hematológica. Un paciente presentó una infección bacteriémica de herida quirúrgica, y otro, infección urinaria bacteriémica en portador de nefrostomía. El 30% (6/20) de los pacientes tenían leucocitosis (>11,0×109/l) y uno (5%) neutropenia (<0,50×103/l). La proteínaC reactiva estaba elevada (>4,0mg/l) en 38,9% (7 de los 18 con esta determinación realizada) de los pacientes. Salvo una paciente, el resto tenían al menos un factor predisponente, entre los que destacaban la enfermedad pulmonar obstructiva crónica (EPOC)/bronquiectasias (n=12; 60%) y la neoplasia oncohematológica (n=5; 25%) (tabla 1). La tasa de infección por R.mucilaginosa en pacientes oncohematológicos ingresados fue de 7,3casos por/10.000ingresos).
Características epidemiológicas, clínicas y microbiológicas de los 20 pacientes con aislamiento de Rothia mucilaginosa
| Núm. | Edad/Sexo | Muestra con crecimiento de Rothia mucilagiosa | Gram esputo | Copatógeno | Otras técnicas | Forma clínica | Factor predisponente | PCR (mg/l) | Leucocitos (×109/l) | Tratamiento | Evolución |
| 1 | 79 a/M | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | 4,8 | 22,6 | Ceftazidima | Curación |
| 2 | 67 a/V | Esputo | P>25; CE<10 | No | AgL neg; AgN: neg; PCR inf: neg | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | – | 9,7 | Ceftriaxona-levofloxacino | Curación |
| 3 | 71 a/M | Esputo | P>25; CE<10 | No | AgL neg; AgN: neg; | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | 2,8 | 6,1 | Amoxicilina-clavulánico+levofloxacino | Curación |
| 4 | 58 a/V | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | Fibrosis pulmonar, ciclofosfamida | 1,3 | 9,8 | Amoxicilina-clavulánico | Curación |
| 5 | 70 a/V | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | EPOC, Bronquiectasias | 0,8 | 11,9 | Levofloxacino+claritromicina | Curación |
| 6 | 88 a/V | Esputo | P>25; CE=10 | No | AgL neg; AgN: neg;BAS:neg | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | 16,6 | 11,2 | Levofloxacino+claritromicina | Curación |
| 7 | 75 a/M | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | 0,6 | 6,75 | Amoxicilina-clavulánico | Curación |
| 8 | 72 a/V | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | 1,7 | 6,42 | Levofloxacino | Curación |
| 9 | 74 a/V | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias, | 11,3 | 10,7 | Ceftriaxona+levofloxacino | Éxitus |
| 10 | 89 a/M | Esputo | P>25; CE<10 | No | No | Bronquiectasias sobreinfectadas | EPOC, bronquiectasias | 7,5 | 9,1 | Ceftriaxona | Curación |
| 11 | 62 a/V | Esputo | P>25; CE=10 | No | AgL neg; AgN: negBAS:neg; | Neumonía | Fibrosis pulmonar | 20,0 | 19,5 | Ceftriaxona+levofloxacino | Curación |
| 12 | 82 a/V | Líquido pleural | NR | S. grupo viridans | No | Empiema-neumonía | Disfagia orofaríngea | 0,5 | 5,6 | Meropenem | Traslado |
| 13 | 47 a/M | Líquido pleural | NR | S. salivarius, S. grupo viridans | No | Empiema | Cirugía torácica, neoplasia pulmonar | 0,2 | 5,8 | Meropenem | Curación |
| 14 | 50 a/M | Esputo | P>25; CE<10 | No | No | Bronquitis aguda | – | 0,5 | 9,0 | Levofloxacino | Curación |
| 15 | 63 a/V | Hemocultivo | NR | No | No | Bacteriemia primaria | CVC, LAM, mucositis | 32,4 | 0,05 | Caspofungina+cotrimoxazol+piperacilina-tazobactam+metronidazol | Curación |
| 16 | 75 a/V | Hemocultivo | NR | No | No | Bacteriemia secundaria a CVC | CVC,LMC | – | 9,0 | Vancomicina+meropenem | Curación |
| 17 | 63 a/V | Hemocultivo | NR | No | No | Colangitis bacteriémica | EPOC, catéter biliar, neoplasia de páncreas | 1,0 | 9,83 | Levofloxacino | Curación |
| 18 | 3m/V | Hemocultivo, Orina | NR | No | No | Infección urinaria bacteriémica | Catéter nefrostomía | 0,1 | 15,6 | Ceftriaxona | Curación |
| 19 | 65 a/V | Hemocultivo | NR | No | No | Infección de herida quirúrgica bacteriémica | Cirugía abdominal, neoplasia pulmonar | 14,4 | 23,8 | Amoxicilina-clavulánico | Curación |
| 20 | 19 a/V | Líquido ascítico | NR | S. mitis | No | Peritonitis secundaria | Perforación gástrica | 2,3 | 10,7 | Amoxicilina-clavulánico | Curación |
a: años; AgL: antígeno legionella; AgN: antígeno neumococo; BAS: broncoaspirado; CE: células epiteliales; CVC: catéter venoso central; EPOC: enfermedad pulmonar obstructiva crónica; LAM: leucemia aguda mieloblástica; LMC: leucemia mieloide crónica; m: meses; M: mujer; P: polimorfonucleares; PCR: proteína C reactiva; PCR inf: reacción en cadena de la polimerasa frente a influenza; V: varón.
Los pacientes fueron tratados con diferentes pautas de antibióticos en las que estaba incluido un antibiótico al que el microorganismo era sensible. Fallecieron 2pacientes (10%): uno presentaba leucemia aguda con bacteriemia asociada a catéter y el otro EPOC grave con bronquiectasias sobreinfectadas.
DiscusiónEn este estudio destacan las infecciones pulmonares por R.mucilaginosa en forma de bronquiectasias sobreinfectadas, empiema, neumonía y bronquitis aguda. Nuestros resultados son parecidos a los presentados en el estudio de Korsholm et al.2, donde muestran 8casos de infección pulmonar por R.mucilaginosa. Este microorganismo de la cavidad orofaríngea podrían ser el responsable de la infección respiratoria que presentaban los pacientes, como se ha visto en diferentes casos comunicados en pacientes con sida6, trasplante hepático7, linfoma4, leucemia aguda mieloblástica y neutropenia5, o artritis reumatoide2. El papel que puede tener R.mucilaginosa en las reagudizaciones de los pacientes con EPOC/bronquiectasias no está aclarado. En nuestro estudio todos los aislamientos estaban en muestras de esputo de buena calidad, y este microorganismo fue considerado por el médico clínico como el responsable de la infección de las bronquiectasias. La EPOC ha sido descrita como causa predisponente en la infección pulmonar por R.mucilaginosa2,3. En nuestra serie, la EPOC/bronquiectasias fue la primera condición predisponente en los pacientes con infección pulmonar por R.mucilaginosa. Podríamos especular una similitud de la adhesión de R.mucilaginosa al endotelio bronquial dañado de pacientes con bronquiectasias, con el poder de adhesión que tiene el microorganismo sobre la placa agar formando colonias mucilaginosas1. Lim et al.8 han encontrado que el 83% de los pacientes con fibrosis quística están colonizados por R.mucilaginosa por metagenómica. Mediante técnicas de biología molecular observaron que las cepas de Rothia se han adaptado a vivir en la microbiótica microaerofílica de la mucosa de estos pacientes8. Los hallazgos de estos investigadores apoyan los resultados encontrados en nuestra serie.
La bacteriemia y la endocarditis son las formas clínicas clásicas en las que se ha visto implicada R.mucilaginosa9,10. En nuestra serie, 5pacientes tenían bacteriemia; cabe destacar el caso de un paciente con leucemia mieloblástica aguda en fase neutropénica y otro con leucemia mieloide crónica. Se ha identificado R.mucilaginosa hasta en el 5,6% de las bacteriemias en pacientes oncohematólogicos9, y en estos casos la bacteriemia puede deberse a mucositis o enterocolitis9,10, o bien estar asociada a catéter venoso central, tal y como sucedió en nuestra serie.
La presencia de catéter protésico (urinario, biliar y venoso central) en 4 de los 5episodios de bacteriemia sugiere la importancia del catéter en la patogenia de la infección por R.mucilaginosa. La presencia de catéter biliar o urinario permitiría la entrada del microorganismo en la vía biliar y urinaria, respectivamente. El microorganismo tiene la capacidad de adherirse al material protésico y formar parte del biofilm del catéter, favoreciendo la aparición de infecciones posteriormente1,10.
En conclusión, R.mucilaginosa es un microorganismo de la flora orofaríngea con escaso poder patógeno y responsable de infecciones respiratorias y sistémicas. Puede tener un papel etiopatogénico en las infecciones de vías respiratorias bajas en pacientes con EPOC/bronquiectasias, en infecciones sistémicas en inmunodeprimidos y en infecciones asociadas a material protésico. Creemos que el poder patógeno real de este microorganismo no se conoce y puede estar infravalorado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de este estudio se ha presentado en el XVII Congreso de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), 2013, Zaragoza, España.