Las infecciones periimplantarias van a ser cada vez más frecuentes debido al aumento de pacientes con implantes de más de 10 años. Existen dos fases en la afectación periimplantaria: la primera o mucositis, que es la inflamación del tejido periimplantario sin afectación ósea y una forma más avanzada en la que se produce pérdida de osteointegración denominada periimplantitis. Se estima que esta infección afecta al 10% de los implantes con más de 5 años y el principal factor de riesgo asociado es la existencia de enfermedad periodontal previa al implante. La etiopatogénesis de la periimplantitis está relacionada principalmente con reservorios de perioodontopatógenos de bolsas residuales, aunque también influyen aquellos factores que facilitan la colonización de la superficie implantaria y la susceptibilidad a la infección. El tratamiento debe incluir la eliminación de la biocapa bacteriana, el desbridamiento de la superficie y la regeneración quirúrgica de la bolsa implantaria.
Dental implant-associated infections are expected to be increasingly more common as the number of patients with implants for more than 10 years rises. There are 2 stages of peri-implant infection: early mucositis, consisting of inflammation of the peri-implant soft tissues without loss of supporting bone, and a more advanced form involving a loss of osseointegration, known as peri-implantitis. The estimated prevalence of this latter infection is 10% of 5-year implants and the main risk factor is previous periodontal disease. The etiopathogenesis of peri-implantitis is related with reservoirs of periodontal pathogens; however factors that lead to colonization of the implant surface or increased susceptibility to infection may also have an influence. Treatment should include removal of the bacterial biofilm, debridement of the exposed surface, and surgical regeneration of the peri-implant pocket.
Los implantes dentales constituyen una alternativa frecuente para reemplazar la dentición perdida y, en la actualidad, cada vez con más frecuencia encontramos pacientes adultos portadores de este tipo de prótesis dentarias. Aunque se consideran dispositivos protésicos con resultados favorables a largo plazo, se describen infecciones relacionadas denominadas periimplantitis, que, además de conducir a la caída del implante por el tejido en el que se desarrollan, constituyen un serio desafío dentro del tratamiento de las infecciones asociadas a dispositivos. Hasta hace poco, disponíamos de pocos estudios que analizaban la frecuencia y características de las periimplantitis, dado como veremos que la infección es una complicación tardía que requiere tiempo para desarrollarse. En la situación actual, el aumento de pacientes con implantes de más de 10 años va a traer como consecuencia que la infección periimplantaria se convierta en una complicación cada vez más frecuente, estimada en entre el 3 y el 10% de los implantes.
El uso de implantes orales en clínica comienza a finales de la década de 1980, aunque su desarrollo técnico se produce a principios de la de 1960, cuando el grupo de Bránemark puso en marcha un nuevo implante que permitía un anclaje óseo directo. Este nuevo tipo de anclaje, denominado osteointegrado, tenía una mejor función clínica y presentaba como innovación un contacto directo del tejido óseo con la superficie del implante sin mediar una capa de tejido blando. Hoy en día, se admite que la osteointegración es una reacción primitiva de cuerpo extraño al material del implante. Existen una serie de factores que necesitan controlarse para la osteointegración: a) la biocompatibilidad, b) el diseño, c) el tipo de superficie, d) el estado del huésped, e) la técnica quirúrgica de inserción y, por último, f) las cargas aplicadas sobre el implante. De todos los biomateriales sintéticos usados, como las cerámicas y los polímeros, el que se utiliza con mayor frecuencia actualmente es el de titanio y el de aleación de titanio-aluminio-vanadio (Ti6Al4V). Estas aleaciones pueden recubrirse de hidroxiapatita o plasma para producir una superficie bioactiva, aumentando hasta más del 70% la cantidad de hueso que contacta con el implante, mientras que el titanio desnudo es bioinerte y contacta sólo con el 46%1.
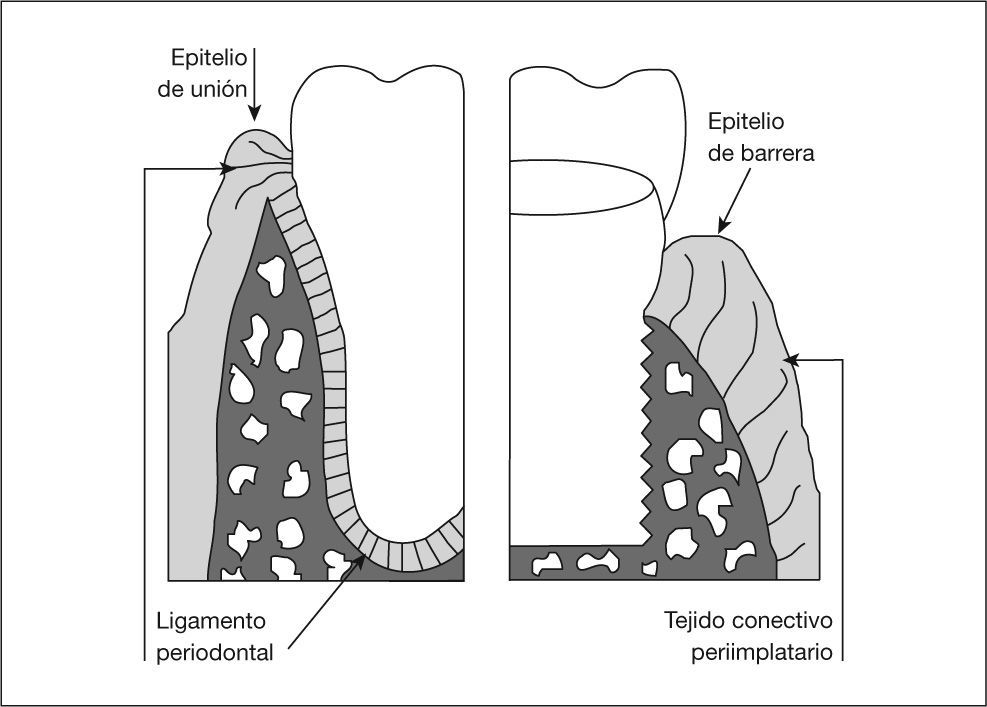
El implante dental de titanio no es estable en las primeras semanas y la sobrecarga es determinante en el período temprano porque puede estimular la producción de tejido blando de interfase y conducir al fallo implantario temprano. No obstante, una vez osteointegrado, la unión hueso-implante puede soportar de forma ocasional grandes cargas. Por otra parte, la cicatrización de la herida quirúrgica produce el establecimiento de una unión transmucosal de la mucosa gingival al implante. Esta unión transmucosal se compone de dos partes (fig. 1): 1) el epitelio de barrera, semejante al epitelio de unión al diente, y 2) el tejido conectivo que se adhiere al implante y contiene abundantes fibras de colágeno que discurren paralelas al implante, a diferencia del tejido sustentorio del diente, en el que las fibras de colágeno son perpendiculares al cemento dental2. Esta disposición condiciona que el tejido periimplantario se adapte peor que el periodontal al estrés biomecánico, ya que existe menos zona de soporte, y tiene menos movilidad, por lo que se producen con más facilidad microfracturas en el tejido óseo. Además, el tejido periimplantario se diferencia del periodontal por una mayor respuesta inflamatoria frente a la colonización bacteriana, más extendida apicalmente y hacia los compartimentos perivasculares distantes del implante3, así como una menor resistencia la infección, en parte debida a que en la zona más próxima a la superficie del implante carece de vasos sanguíneos4. Otra diferencia importante con la enfermedad periodontal clásica es que, debido al contacto directo del tejido óseo con el implante, la infección periimplantaria no se circunscribe al tejido conectivo, como en el caso de la periodontitis, sino que afecta de forma directa, y desde un principio, al tejido óseo alveolar. Constituye, por lo tanto, una osteomielitis.
El fallo implantario que conduce a la caída del implante, en general, se produce debido a complicaciones que tienen lugar o bien de forma temprana tras la colocación del implante o tardíamente cuando el implante osteointegrado ha estado funcionando durante un período de tiempo. Los fallos tempranos están producidos por eventos que impiden la osteointegración, asociados a una mala técnica, y ocurren con poca frecuencia (2,5%). Los fallos tardíos, en cambio, se relacionan con los fallos por sobrecarga (por características del implante o del hueso receptor) y por la infección periimplantaria5.
Definición de periimplantitis y criterios clínicosEl término periimplantitis fue introducido a finales de la década de 19806 para describir la afectación inflamatoria destructiva en el tejido de osteointegración, que lleva a la formación de la bolsa periimplantaria y a la pérdida del hueso de soporte marginal. Como la parte inferior del implante retiene la osteointegración, la destrucción ósea inicial puede seguir avanzando sin que haya signos de movilidad y no apreciarse clínicamente hasta que la pérdida de la osteointegración sea completa. Hay que distinguir dos fases dentro de la respuesta que se produce a la colonización bacteriana: una inicial que afecta al tejido blando de forma reversible, denominada mucositis periimplantaria, pero que puede, en una fase más avanzada, denominada periimplantitis, conducir a la destrucción tisular del tejido periimplantario.
Hay signos clínicos comunes entre mucositis y periimplantitis que hacen difícil diferenciar estas dos entidades, como el sangrado en la exploración e inflamación de los tejidos blandos marginales. Además, tanto en la mucositis como en la periimplantitis es rara la aparición de supuración y el paciente no suele sentir dolor, por lo que hay que tenerlo en cuenta para programar controles periódicos. El rasgo fundamental que las diferencia es que en la mucositis apenas hay pérdida ósea, al contrario que en la periimplantitis. Por eso, para definir la periimplantitis se utiliza una combinación de criterios clínicos y radiográficos que nos indican afectación del tejido de osteointegración: movilidad, dolor o sensación de cuerpo extraño, supuración, radioluminiscencia alrededor del implante, sangrado al sondaje y, por último, profundidad de sondaje ≥ 5 mm y/o pérdida ósea ≥ 2,5 mm o > 3 roscas de tuerca7,8.
Epidemiología de la periimplantitisHasta hace poco tiempo disponíamos de la información generada en estudios con seguimientos cortos, de menos de 5 años, en los que se apreciaba una frecuencia baja de complicaciones infecciosas. Sin embargo, en un reciente metaanálisis, seleccionando implantes con una supervivencia a los 5 años de colocación, la prevalencia de periimplantitis es del 9,7% al final del período de observación en el total de pacientes9. Con los datos recogidos en la última década, se observa que las infecciones tardías que afectan al hueso marginal del implante se agrupan en pacientes con antecedentes de periodontitis, evidenciada por la pérdida ósea en los dientes remanentes previos a la colocación del implante10. En una revisión sistemática de estudios realizados sobre implantes de larga evolución, con seguimiento de entre 5 y 14 años de implantes colocados a pacientes con pérdidas dentarias previas por periodontitis y otras causas, se observa un incremento significativo de la incidencia de periimplantitis en sujetos con patología periodontal, desde el 2,2-6% en pacientes no periodontales hasta el 16-29% en el grupo con antecedentes11. Schou et al12 encuentran también una frecuencia mayor de periimplantitis en cohortes de pacientes con periodontitis previa al implante (riesgo relativo [RR] de 9 e intervalo de confianza del 95% [IC 95%], 3,94-20,57), así como una consiguiente mayor pérdida de hueso marginal.
Existen diferencias entre el número de piezas que son sustituidas y la frecuencia de aparición de periimplantitis. Cuando se trata bien de dentaduras completas o reemplazamiento de una única pieza, la frecuencia de periimplantitis tras 5 años de supervivencia es muy baja, entre el 0,31 y el 0,71%, mientras que si se trata de dentaduras parciales fijas, la frecuencia observada en los estudios longitudinales aumenta hasta el 6,47% (IC 95%, 5,26-7,69)13.
Por otra parte, los mismos factores que se han relacionado con periodontitis (tanto los generales como la mala higiene bucal y el tabaco, como los específicos como la inmunodepresión medicamentosa y el virus de la inmunodeficiencia humana [VIH]) también aumentan el riesgo de periimplantitis11.
Etiopatogenia de las periimplantitisEn el origen y desarrollo de la periimplantitis hay que tener en cuenta tres grupos de factores: los relacionados con la facilidad de colonizar la superficie del implante, la composición de la flora periimplantaria y la susceptibilidad a la infección. En ensayos in vitro de formación de biocapas orales, se puede observar que un aumento en la rugosidad por encima de un umbral de 0,2 μ y/o una superficie libre de energía facilitan la formación de biocapas sobre materiales de osteointegración. Cuanto más rugosa es la superficie del implante, más fácil resulta la colonización, observándose que tiene un RR de 0,80 (IC 95%, 0,670,96) de verse afectado por infección14. Algunos autores han encontrado, por lo tanto, diferencias en el desarrollo de complicaciones periimplantarias según el tipo de implante dental, y son mayores en los sistemas ITI que en los Bránemark15 atribuidas a las diferencias que hay en su diseño y características de superficie16. Esto es importante a la hora de planificar el tipo de superficie y hay que evaluar que los mismos factores que favorecen la osteointegración aumentan las probabilidades de formación de biocapas bacterianas.
De los factores etiológicos, el más importante es el tipo de flora periimplantaria y la formación de biocapas sobre la superficie implantaria. La placa subgingival de los dientes adyacentes al implante es la fuente de colonizadores de la nueva superficie insertada en el paciente parcialmente desdentado. La dinámica de la colonización es muy rápida, y se detectan en la superficie implantaria bacterias periodontopatógenas de bolsas residuales a las 12 semanas de inserción17. Tras la colonización, existe una asociación entre el tipo de flora periimplantaria y el estado del implante y constituye una indicación del papel específico que tienen las bacterias en este tipo de lesiones. En el implante estable encontramos principalmente cocos grampositivos y escasa presencia de espiroquetas y bacilos gramnegativos. En cambio, en las mucositis aumentan los recuentos de bacilos gramnegativos anaerobios, incluido Fusobacterium, y disminuyen las proporciones de cocos grampositivos. En localizaciones con periimplantitis hay un cambio significativo respecto al diente sano, y se detectan especies periodontopatógenas con alta afinidad por el titanio y capacidad de formar biocapas, como Porphyronomas gingivalis18, aunque raramente se aísla Actiobacillus actinomycetemcomitans. Con menor frecuencia que los periodontopatógenos se observan infecciones causadas por bacterias oportunistas como enterobacterias, Pseudomonas spp., Staphylococcus aureus y Candida spp.19,20. El aislamiento de microorganismos poco habituales de la flora oral, pero con afinidad por las aleaciones del implante, constituye un rasgo diferencial respecto a la enfermedad periodontal. De forma similar que en la periodontitis, la eliminación de la flora periodontal está asociada con la ganancia de inserción ósea en estudios con animales y observacionales longitudinales.
Tratamiento de la periimplantitisEl abordaje terapéutico de la periimplantitis comprende varios aspectos como la eliminación de la placa bacteriana supraimplantaria, el desbridamiento quirúrgico de la superficie del implante, la eliminación del tejido de granulación y la eliminación quirúrgica de la hendidura periimplantaria mediante varias alternativas (gingivectomía, reposición del colgajo apical o regeneración ósea) y, finalmente, el establecimiento de un régimen adecuado de control de placa. Los ensayos clínicos aleatorizados disponibles hasta la fecha que analizan la eficacia de las distintas modalidades de tratamiento en la periimplantitis incluyen un número muy reducido de pacientes y periodos cortos de seguimiento, por lo que, de momento, no existe un estándar recomendado21. El tratamiento debería comprender dos fases: una no quirúrgica, que incluye el desbridamiento y/o pulido mecánico o mediante dispositivos con láser Er:YAG o ultrasonidos, combinados con la terapia con antibióticos, cuyo objetivo es la eliminación de las biocapas bacterianas, y una fase quirúrgica, utilizando técnicas regenerativas. Por el momento, no existen ensayos clínicos controlados que valoren los posibles beneficios de los antibióticos sistémicos, pero varios autores muestran efectos clínicos como la disminución de la inflamación y ganancia ósea22. Por otra parte, dada la afectación ósea que se evidencia en los análisis histológicos y el espectro de agentes etiológicos, parece lógico considerar la necesidad de un diagnóstico microbiológico que guíe un tratamiento antibiótico específico para abordar la osteomielitis periimplantaria. No obstante, para determinar pautas antibióticas sería necesario llevar a cabo ensayos clínicos que aporten evidencias sobre este aspecto.