La cuantificación del ARN del virus de la hepatitis C —VHC— (carga viral) constituye el marcador más utilizado para diagnosticar y confirmar la infección activa por el VHC. El antígeno core del VHC forma parte de la estructura interna del virus y, al igual que el ARN del VHC, su detección indica también replicación viral, y presenta algunas ventajas frente a la carga viral como los costes que conlleva, que son menores que los de la carga viral, la estabilidad de la diana, que es superior que la de la carga viral, la posibilidad de trabajar con el mismo tubo primario que el que se utiliza para la serología de VHC y la rapidez para obtener resultados, ya que no es necesario trabajar en lotes como ocurre con la mayoría de las plataformas de carga viral. Aunque el antígeno core presenta menor sensibilidad analítica que el ARN del VHC para la detección de viremias bajas, diversos estudios y guías han puesto ya de manifiesto su utilidad para la identificación de pacientes con infección activa por VHC. En este capítulo se resumirán las plataformas actuales para la determinación de carga viral, incluyendo los sistemas “point of care”; se revisarán igualmente las indicaciones que las principales guías de tratamiento de hepatitis C atribuyen a este marcador. Además, se revisarán las características del antígeno core del VHC, las plataformas existentes para su determinación, la correlación que existe con la determinación de carga viral y las indicaciones que las distintas guías reconocen para este marcador.
Quantification of hepatitis C virus (HCV) RNA (viral load) is the most widely used marker to diagnose and confirm active HCV infection. The HCV core antigen forms part of the internal structure of the virus and, like HCV RNA, its detection also indicates viral replication and presents certain advantages over viral load testing such as its lower cost, the greater stability of the target, the possibility of working with the same primary tube as that used for HCV serology, and the rapidity of obtaining results, since there is no need to work in batches, unlike the situation with most viral load platforms. Although the core antigen has lower analytical sensitivity than HCV RNA for the detection of low viremia levels, several studies and guidelines have already shown their utility in the identification of patients with active HCV infection. This article summarises current platforms for viral load determination, including point-of-care systems, and also reviews the indications attributed to this marker by the main HCV treatment guidelines. The article also reviews the characteristics of HCV core antigen, the available platforms for its determination, its correlation with viral load determination, and the indications for this marker in the distinct guidelines.
Solo 30 años después del descubrimiento del virus de la hepatitis C (VHC), asistimos a una de las más importantes oportunidades en microbiología clínica para contribuir a la eliminación de una enfermedad infecciosa. En la actualidad, la eliminación del VHC constituye un verdadero reto de los profesionales sanitarios, en el que los microbiólogos clínicos jugamos un papel fundamental, y al que debemos sentirnos obligados a participar.
Para contribuir a este reto, el diagnóstico en un paso representa un eslabón fundamental. El diagnóstico de la hepatitis C debe consistir en realizar, sobre la misma muestra, en un solo paso, la detección de anticuerpos y un ensayo que permita establecer si el paciente es virémico, es decir, si tiene infección activa por VHC, o no. Este tipo de diagnóstico ha demostrado un importante impacto en salud1,2, y también ha revelado ser coste-eficaz3. Para determinar la viremia, clásicamente se ha utilizado la cuantificación del ARN del VHC (carga viral [CV]), por lo que es el marcador más extendido para diagnosticar y confirmar la infección activa por VHC. El antígeno core del VHC forma parte de la estructura interna del virus y, al igual que el ARN del VHC, su detección indica también replicación viral.
En este capítulo se presentarán las plataformas actuales para la determinación de CV, incluyendo los sistemas “point of care”, y se revisarán igualmente las indicaciones que las principales guías de tratamiento de hepatitis C atribuyen a este marcador. Además, se revisarán las características del antígeno core del VHC, las plataformas existentes para su determinación, la correlación que existe con la determinación de CV y las indicaciones que las distintas guías reconocen para este marcador. Para finalizar se discutirán las ventajas e inconvenientes de la determinación de antígeno core del VHC.
2La carga viral de la hepatitis CPreviamente a la implementación de los tratamientos con antivirales de acción directa (AAD) de última generación, la cuantificación y monitorización de la CV del VHC fue durante mucho tiempo, por su correlación con el éxito/fracaso de la terapia, una de las herramientas más determinantes en el abordaje de los tratamientos, especialmente en los años en los que la combinación basada en interferón pegilado y ribavirina constituía el estándar de atención para el tratamiento de la hepatitis C crónica4. La conocida como terapia guiada por la respuesta (RGT) ayudó a mejorar las tasas de respuesta viral sostenida (RVS) y a disminuir las de los efectos adversos, estableciéndose diferentes pautas de duración del tratamiento sobre la base de la cuantificación basal del ARN-VHC y a su cinética durante diferentes semanas de tratamiento5–9. La monitorización de la CV a las 2 semanas (vRVR, respuesta virológica precoz), 4 semanas (RVR, respuesta virológica rápida), 12 semanas (eRVR, respuesta virológica extendida) y 24 semanas, también permitió una estimación de la supresión viral y de la adherencia del paciente5,6, así como la definición de la llamada RVS, la erradicación deseada del ARN viral 24 semanas después de finalizar el tratamiento5,6, lo que sin duda ponía en valor la determinación de la CV del VHC en los pacientes infectados que estaban en tratamiento.
Con los actuales AAD disponibles, la reducción de la CV por debajo del límite de cuantificación y/o detección a menudo se puede lograr dentro de las primeras semanas de tratamiento y su monitorización de cara a acortar, extender o suspender el tratamiento no tiene sentido, excepto en pacientes difíciles de tratar, como medida de control de su adherencia9,10.
Todo lo anterior pone de manifiesto la evolución experimentada por la monitorización de la cinética viral del ARN-VHC, con la finalidad de satisfacer en cada momento y con cada tipo de tratamiento las necesidades clínicas cambiantes9; sin embargo, y aunque la CV del VHC no se relaciona con la gravedad de la enfermedad hepática del paciente ni tampoco pronostica su progresión11, es un hecho que su determinación sigue considerándose una labor primordial del laboratorio de microbiología molecular y en la actualidad constituye una prueba habitual para el abordaje de los pacientes infectados, ya que su presencia refleja la replicación viral existente y, por tanto, confirma la infección activa, además de utilizarse para evaluar la respuesta a tratamiento
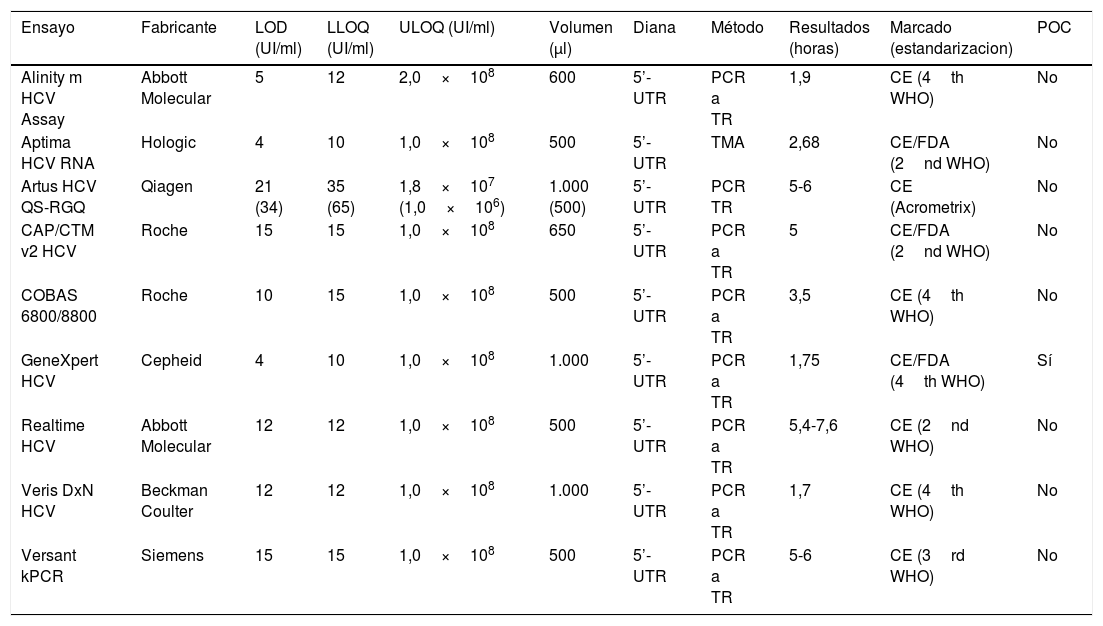
2.1Plataformas para determinar la carga viral del virus de la hepatitis CLa concentración del ARN-VHC en plasma o suero puede cuantificarse en la actualidad con diferentes ensayos moleculares comerciales en tiempo real9,12, que tienen un amplio rango dinámico de cuantificación y son sensibles, específicos, precisos y reproducibles (tabla 1) y cuyas características operacionales13,14 han mejorado sustancialmente con respecto a otros ensayos disponibles anteriormente. Los resultados de la CV se expresan habitualmente en unidades internacionales/ml (UI/ml) y los diferentes métodos y ensayos comerciales disponibles presentan un límite inferior de cuantificación (LLOQ) y un límite inferior de detección (LOD) propios9,13,14, por lo tanto, los resultados de un paciente pueden informarse de manera diferente dependiendo del ensayo utilizado. No obstante, se ha consensuado recomendar, con los regímenes de tratamiento con AAD, ensayos con un LLOQ<25 UI/ml y un LOD<15 UI/ml. En este sentido, conviene tener presente que la presencia de ARN del VHC detectable pero no cuantificable es clínicamente relevante porque determina viremia verdadera.
Principales características de los ensayos que cuantifican el ARN-del virus de la hepatitis C (VHC)
| Ensayo | Fabricante | LOD (UI/ml) | LLOQ (UI/ml) | ULOQ (UI/ml) | Volumen (μl) | Diana | Método | Resultados (horas) | Marcado (estandarizacion) | POC |
|---|---|---|---|---|---|---|---|---|---|---|
| Alinity m HCV Assay | Abbott Molecular | 5 | 12 | 2,0×108 | 600 | 5’-UTR | PCR a TR | 1,9 | CE (4th WHO) | No |
| Aptima HCV RNA | Hologic | 4 | 10 | 1,0×108 | 500 | 5’-UTR | TMA | 2,68 | CE/FDA (2nd WHO) | No |
| Artus HCV QS-RGQ | Qiagen | 21 (34) | 35 (65) | 1,8×107 (1,0×106) | 1.000 (500) | 5’-UTR | PCR TR | 5-6 | CE (Acrometrix) | No |
| CAP/CTM v2 HCV | Roche | 15 | 15 | 1,0×108 | 650 | 5’-UTR | PCR a TR | 5 | CE/FDA (2nd WHO) | No |
| COBAS 6800/8800 | Roche | 10 | 15 | 1,0×108 | 500 | 5’-UTR | PCR a TR | 3,5 | CE (4th WHO) | No |
| GeneXpert HCV | Cepheid | 4 | 10 | 1,0×108 | 1.000 | 5’-UTR | PCR a TR | 1,75 | CE/FDA (4th WHO) | Sí |
| Realtime HCV | Abbott Molecular | 12 | 12 | 1,0×108 | 500 | 5’-UTR | PCR a TR | 5,4-7,6 | CE (2nd WHO) | No |
| Veris DxN HCV | Beckman Coulter | 12 | 12 | 1,0×108 | 1.000 | 5’-UTR | PCR a TR | 1,7 | CE (4th WHO) | No |
| Versant kPCR | Siemens | 15 | 15 | 1,0×108 | 500 | 5’-UTR | PCR a TR | 5-6 | CE (3rd WHO) | No |
LOD: límite de detección; es el nivel más bajo de ARN del VHC que se detecta sin cuantificar el 95% de las veces.
LLOQ: límite inferior de cuantificación; es el nivel más bajo de ARN del VHC que está dentro del rango lineal de cuantificación y es analíticamente aceptable en el ensayo.
ULOP: límite superior de cuantificación; es el nivel más alto de ARN del VHC que está dentro del rango lineal de cuantificación y es analíticamente aceptable en el ensayo.
Las diferentes guías de práctica clínica (GPC) para el abordaje de la infección por el VHC de las principales sociedades científicas (AASLD, American Association for the Study of Liver Diseases; EASL, European Association for the Study of the Liver; APASL, Asian Pacific Association for the Study of the Liver; AEEH, Asociación Española para el Estudio del Hígado) establecen recomendaciones en mayor o menor medida y con diferentes grados de evidencia para la utilización de la CV del VHC15–19. Estas GPC recomiendan en líneas generales su realización para detectar la viremia y confirmar la infección activa por el VHC y también para guiar la terapia antiviral, incluyendo una determinación basal de inicio y otras 12 o 24 semanas después de finalizar este para determinar la RVS. Por otra parte, también recomiendan su realización en diversas situaciones como una prueba negativa de anticuerpos frente al VHC en las personas que están inmunocomprometidas, que están siendo hemodializadas o que pudieron haber estado expuestas al VHC en los últimos 6 meses; también en la exposición perinatal y, por último, anualmente, en las personas con riesgo de reinfección (usuarios de drogas por vía parenteral, hombres que tienen sexo con hombres) después de la eliminación viral previa de manera espontánea o relacionada con el tratamiento. En todos estos casos, las GPC también recomiendan, como ya se señaló, que la detección y cuantificación del ARN-VHC en suero o plasma debe realizarse mediante un ensayo molecular con un LOD ≤ 15 UI/ml. Sin embargo, en entornos especiales de poblaciones vulnerables (sin techo, centros de drogadicción, inmigrantes, etc.) y, al igual que para los países con ingresos bajos y moderados, se podrían usar ensayos cualitativos con un LOD ≤ 1.000 UI/ml, si no estuviesen disponibles ensayos cuantitativos más sensibles a tal fin, ya que el riesgo excepcionalmente bajo de un resultado falso negativo con estos ensayos, en un pequeño porcentaje de individuos infectados, se ve compensado por el beneficio de ampliar el acceso al diagnóstico y la atención a una población mayor. Finalmente, alguna de estas GPC ya contempla entre sus recomendaciones16, la de utilizar muestras de sangre seca (DBS) como una alternativa al suero o plasma obtenido por punción venosa para la prueba de ARN del VHC, para su envío a un laboratorio capacitado donde se realizará la detección molecular y también la de reemplazar la detección de anticuerpos anti-VHC por un análisis de ARN de VHC en el punto de atención al paciente (POC, del inglés point of care), si tal ensayo está disponible y la estrategia de detección demuestra ser rentable.
A este respecto, la determinación de la CV en muestras de sangre capilar y DBS en papel de filtro puede ser una excelente alternativa al tratarse de muestras de fácil obtención, almacenamiento y transporte y su uso puede constituir una solución simple y rentable en entornos desfavorecidos, de alta prevalencia y países de bajos recursos20–24 y, por tanto, facilitar el acceso a los cuidados necesarios.
2.3Utilidad actual de la carga viral del virus de la hepatitis CPor tanto, y tal como se ha señalado, entre las principales utilidades reconocidas para la determinación de la CV del VHC estarían: a) confirmar un resultado positivo de anticuerpos anti-VHC y/o hacer el diagnóstico de infección activa; b) determinar la CV basal antes de iniciar el tratamiento; c) monitorizar la respuesta al tratamiento en pacientes especiales, y d) determinar si un paciente ha conseguido la RVS. De todas ellas, serían la primera y la última las que realmente estarían justificadas con los AAD actuales y con el objetivo de eliminación de la hepatitis C de la OMS en el horizonte de 20309.
No obstante, y con referencia a la primera indicación, también habría que considerar la determinación del ARN-VHC en las muestras seropositivas de VHC con resultados negativos de Ag-VHC, ya que con los actuales tratamientos, estas pruebas menos sensibles se están utilizando para medir la falta de adherencia y los fracasos y como sustitutivo de la CV en el diagnóstico de la infección activa por VHC24.
2.4Futuro de la carga viral del virus de la hepatitis CCon estas indicaciones, y de cara a los objetivos establecidos por la OMS, se hace imprescindible mejorar el acceso a estas pruebas que determinan y cuantifican el ARN-VHC mediante métodos alternativos de muestreo (DBS), desarrollando nuevas tecnologías moleculares de amplificación de ácidos nucleicos (NAT) que sean capaces de utilizarse en el POC y también optimizando las infraestructuras disponibles actualmente, incluyendo su descentralización si fuese necesaria25, para así reducir la proporción de infección no diagnosticada. En este sentido, la disponibilidad de pruebas NAT en el POC tiene el gran potencial de simplificar los algoritmos actuales, aumentar el diagnóstico y facilitar el tratamiento de cara a la eliminación del VHC26–28.
A este respecto, se están optimizando métodos comerciales21–23, especialmente a nivel de extracción y amplificación, que se desarrollaron para muestras de suero o plasma y sus primeros resultados apuntan a una fuerte correlación en especificidad y sensibilidad en muestras con viremias superiores a 1.000 UI/ml22, aunque bien es cierto que los resultados obtenidos en estos estudios fueron más bajos que los procedentes de plasma, probablemente por la degradación de la muestra o por su menor sensibilidad relacionada con el tipo y volumen de la muestra utilizada20. Probablemente, con el actual ritmo de avance tecnológico, a corto plazo la detección rápida del ARN-VHC dispondrá de cara al diagnóstico y eliminación de la infección por el VHC de pruebas más sencillas y económicas.
Por último, conviene señalar que con la posible incorporación de los ensayos moleculares que detectan y cuantifican, también a partir de sangre capilar, el ARN-VHC en los POC26–28 y de la determinación rutinaria en DBS procedente de entornos especiales, en los laboratorios de microbiología, el uso de la cinética de replicación del VHC para iniciar la terapia seguirá estando limitada por el rango dinámico y la variabilidad de las pruebas de laboratorio.
En este sentido, los microbiólogos clínicos, como ya hicieron con la RGT, deberán estar informados sobre estas diferencias, para asegurar el cuidado apropiado del paciente infectado, y aconsejar al clínico de la necesidad de seguir siendo cautos al interpretar los resultados cuando estos están próximos a los umbrales de decisión10,11.
3El antígeno core del virus de la hepatitis CEl genoma del VHC contiene un marco abierto de lectura que codifica una poliproteína de aproximadamente 3.000 aminoácidos que se procesa por una combinación de proteasas virales y del huésped29, lo que genera al menos 10 proteínas individuales, y el core es una de las 4 proteínas estructurales. Durante la formación o ensamblado del virus, el antígeno se libera al plasma y se puede detectar antes que los anticuerpos correspondientes30. La presencia del antígeno en sangre se correlaciona con la presencia de viriones completos, aunque también se puede deber a la presencia de inmunocomplejos o a la liberación de antígeno por los hepatocitos tras procesos de lisis de mediación inmune o apoptosis31.
El antígeno core del VHC, por su precocidad en pasar a la sangre, su elevada concentración plasmática y su correlación con el ARN viral, constituyó una diana diagnostica de gran interés desde hace décadas32,33.
3.1Métodos para la detección del antígeno coreLa primera publicación en la que aparece la detección del antígeno core del VHC como un nuevo marcador serológico, que se determinaba mediante técnicas de ELISA, data de 199630, destacándose su utilidad en el período ventana de la infección, ya que se podía detectar con una antelación de más de 1 mes respecto a los anticuerpos VHC32,34. El antígeno core del VHC es detectable tan solo 1-2 días después de que aparezca el ARN-VHC en sangre34,35. Por ello, se propone como un excelente marcador para utilizar en el cribado de pacientes con riesgo de infección aguda por VHC, situación clínica que cada vez está adquiriendo más importancia entre el colectivo de hombres que tienen sexo con hombres36.
Inicialmente se desarrollaron 2 tipos de pruebas, una para detectar antígeno en sangre, previo a la aparición de anticuerpos, y otra capaz de detectarlo en presencia de estos37; posteriormente se desarrollaron técnicas duales basadas en ELISA capaces de detectar simultáneamente anticuerpos y antígeno35. Además, con el fin de mejorar la sensibilidad en la detección del antígeno se desarrollaron técnicas que incorporaban una fase previa de separación de inmunocomplejos30,32.
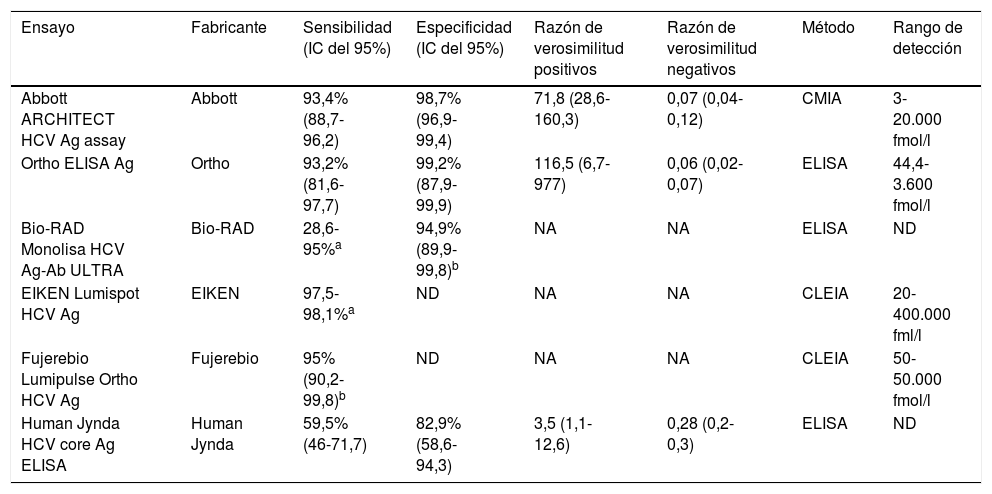
A lo largo de los años han aparecido en el mercado diferentes pruebas diagnósticas para la determinación del antígeno core del VHC, unas basadas en quimioluminiscencia y otras en enzimoinmunoanálisis, con diferentes sensibilidades y especificidades, que se resumen en la tabla 2. Freiman et al38 publicaron un metaanálisis diseñado con el propósito de evaluar la exactitud de las diferentes pruebas diagnósticas basadas en la detección de AgVHC para diagnosticar infección activa por VHC comparando con técnicas de ácidos nucleicos. En este metaanálisis (12.670 muestras) que comparó estos marcadores se encontró una sensibilidad y una especificidad de Architect® HCV Assay del 93,4 y el 98,8%, respectivamente, similar a las de Ortho® ELISA con el análisis de 11.777 muestras (el 93,2 y el 99,2%, respectivamente). Los peores datos fueron los detectados con la técnica Human Jynda Bioengineering Group, con una sensibilidad del 59,5% y una especificidad del 82,92%, sobre un total de 592 muestras.
Principales características de los ensayos para la detección del antígeno core del VHC
| Ensayo | Fabricante | Sensibilidad (IC del 95%) | Especificidad (IC del 95%) | Razón de verosimilitud positivos | Razón de verosimilitud negativos | Método | Rango de detección |
|---|---|---|---|---|---|---|---|
| Abbott ARCHITECT HCV Ag assay | Abbott | 93,4% (88,7-96,2) | 98,7% (96,9-99,4) | 71,8 (28,6-160,3) | 0,07 (0,04-0,12) | CMIA | 3-20.000 fmol/l |
| Ortho ELISA Ag | Ortho | 93,2% (81,6-97,7) | 99,2% (87,9-99,9) | 116,5 (6,7-977) | 0,06 (0,02-0,07) | ELISA | 44,4-3.600 fmol/l |
| Bio-RAD Monolisa HCV Ag-Ab ULTRA | Bio-RAD | 28,6-95%a | 94,9% (89,9-99,8)b | NA | NA | ELISA | ND |
| EIKEN Lumispot HCV Ag | EIKEN | 97,5-98,1%a | ND | NA | NA | CLEIA | 20-400.000 fml/l |
| Fujerebio Lumipulse Ortho HCV Ag | Fujerebio | 95% (90,2-99,8)b | ND | NA | NA | CLEIA | 50-50.000 fmol/l |
| Human Jynda HCV core Ag ELISA | Human Jynda | 59,5% (46-71,7) | 82,9% (58,6-94,3) | 3,5 (1,1-12,6) | 0,28 (0,2-0,3) | ELISA | ND |
CLEIA: enzimoinmunoanálisis quimioluminiscente; CMIA: inmunoanálisis de micropartículas quimioluminiscente; ELISA: enzimoinmunoanálisis; IC: intervalo de confianza; NA: no aplicable; ND: no datos.
Actualmente, la técnica de detección de antígeno VHC de uso más extendido en Europa es Architect® HCV Ag Assay comercializazada por Abbott Diagnostic. Esta técnica consiste en un inmunoanálisis de 2 pasos que utiliza micropartículas quimioluminiscentes. En el primer paso, el pretratamiento de la muestra con urea, ácido clorhídrico y detergentes lisa los virus presentes y separa los inmunocomplejos liberando el antígeno core, que se detecta en el segundo paso. El procesamiento se hace en el autoanalizador Architect® de Abbott, y la concentración de antígeno se calcula mediante una curva de calibración. Se considera una muestra reactiva si la concentración de antígeno es ≥ 3 fmol/l, aconsejándose repetir por duplicado las muestras con valores entre 3 y 10 fmol/l.
Hu y Cui39 han descrito recientemente un inmunoanálisis con el que logran incrementar la sensibilidad en la detección del VHC dirigiéndolo hacia varias dianas proteicas, estructurales y no estructurales (core, NS3, NS4b y NS5a), de esta forma logran una sensibilidad analítica equivalente a 150-250 UI/ml de VHC, cercana a las técnicas de ácidos nucleicos.
3.2El antígeno core como alternativa a la carga viralCualquier prueba que pueda sustituir a la determinación de ARN-VHC para el abordaje de los pacientes infectados por VHC debe de ser capaz de a) identificar a los pacientes virémicos y b) evaluar la respuesta terapéutica. A continuación se presentan los datos existentes en la literatura con relación a cada uno de estos puntos.
En la actualidad no parece existir ninguna duda sobre la utilidad del antígeno core del VHC para identificar pacientes virémicos, es decir, para el diagnóstico de infección activa por VHC. Diferentes publicaciones han posicionado al antígeno VHC como un marcador de replicación similar al ARN-VHC, aunque con la limitación de una menor sensibilidad analítica (3 fmol/l), equivalente a 400-3.000 IU/ml ARN-VHC32,38,40,41. Sin embargo, esta falta de sensibilidad no limita su uso para el diagnóstico de la infección activa. Recientemente, van Tilborg et al42 estudiaron una cohorte de más de 10.000 pacientes cribados para hepatitis C y encontraron una sensibilidad del 94% y una especificidad del 100% en el diagnóstico de los 80 pacientes virémicos (ARN-VHC+) de su serie, y destacaron que todos los falsos negativos de antígeno core se debieron a la baja CV de las muestras. Estos autores detectaron antígeno core del VHC en todas las muestras con niveles de ARN VHC>1.000 UI/ml. Otros estudios que comparan niveles de antígeno core del VHC con niveles de ARN-VHC41,43–46, muestran una buena correlación entre ambos parámetros, siempre que los niveles de ARN sean>3.000 UI/ml. Por otro lado, la correlación descrita en algunos trabajos con un coeficiente de Pearson>0,95 podría permitir estimar el valor de la CV a partir de la concentración de antígeno core del VHC mediante una simple fórmula47.
Un estudio reciente48 analizó los datos de 3 cohortes españolas en las que se dispone de datos en paralelo de CV y de antígeno core. Se analizaron 17.189 pruebas de CV y 2.735 resultados de antígeno core. Solo el 3,5% de las determinaciones de CV mostró resultados entre 15-5.000 UI/ml y solo el 0,4% era nuevo diagnóstico de la hepatitis C. De las muestras que se evaluaron para determinación de antígeno core, el 2,9% mostró resultados entre 3-10 fmol/l (un 0,9% en pacientes sin tratamiento) y el 3% entre 1-2,99 fmol/l (un 1,2% en pacientes sin tratamiento). Como era de esperar, se detectó mayor número de positivos para CV en los pacientes con 3-10 fmol/l (10/15) que en los de 1-2,99 fmol/l (6/25). No se detectó ningún paciente con CV positiva cuando el antígeno core era<1 fmol/l. A la vista de estos resultados, los autores proponen utilizar el antígeno core como alternativa segura a la CV para el diagnóstico de la infección activa por VHC, y recomiendan determinar la CV solo en los pacientes en los que los niveles de antígeno estén entre 1 y 10 fmol/l.
En un nuevo estudio49 se evaluó la validez y la seguridad de las posibles estrategias del diagnóstico de la infección por VHC en un solo paso, así como sus costes y eficiencia. Las posibles estrategias de diagnóstico evaluadas fueron: anti-VHC seguida de CV (Ac-CV), anti-VHC seguida de antígeno core (Ac-Ag), y anti-VHC seguida de antígeno y de CV (Ac-Ag-CV). Todas las estrategias para el diagnóstico de VHC en un solo paso que se evaluaron presentaron validez y seguridad aceptables, a consecuencia de la elevada sensibilidad y especificidad de las pruebas utilizadas. La estrategia más eficiente es Ac-Ag, seguida de Ac-Ag-CV y Ac-CV, debido a su menor coste por paciente cribado, aunque es menos eficaz que Ac-CV. En este modelo no se tiene en cuenta la propuesta de algoritmo de diagnóstico del estudio anterior.
La determinación de antígeno core, además de como herramienta diagnóstica, también se ha investigado para la monitorización del tratamiento50–54. Aunque es poco probable que un paciente que no haya respondido a tratamiento, o recidive tras su finalización, lo haga con niveles<1.000 UI/ml de ARN de VHC, esta situación es posible y más frecuente, como se ha indicado anteriormente, que cuando se utiliza este marcador para el diagnóstico. Por ello, es aquí donde hay que tener en cuenta la principal limitación del antígeno core del VHC, ya que su sensibilidad desciende hasta el 64,7-81,9% en las muestras con bajas concentraciones de ARN del VHC40,44. En su serie, van Tilborg et al42 describen que ambas técnicas fueron capaces detectar el fracaso terapéutico a las 12 semanas en todos los pacientes salvo uno. Al no disponer de muestra a las 24 semanas postratamiento, no se pudo ver si el antígeno VHC se hubiese detectado. Por otro lado, Alados et al50 describen similares resultados en la semana 12 postratamiento, y encuentran 2 pacientes con viremias<1.000 UI/ml y con los niveles de antígeno que no superan el umbral de 3 fmol/l (1,92 y 2,26 fmol/l); sin embargo, al analizar muestras posteriores sí se detectó antígeno.
3.3Nuevas metodologías y usos de la determinación del antígeno coreEn 2015, la OMS estableció como una prioridad el diseño de técnicas diagnósticas que permitiesen la detección directa del virus en el paciente en formato POC. Fruto de la colaboración entre Daktari Diagnostics y Merck, próximamente saldrá al mercado la primera técnica de detección del antígeno del VHC a partir de sangre capilar obtenida por punción dactilar en formato POC. Aunque su sensibilidad se ve disminuida al 85%, puede resultar de extrema utilidad en situaciones especiales, en las que sea la única alternativa para poder diagnosticar la infección activa55.
La aplicación de los DBS, cuya utilidad ya se ha comentado en el apartado de CV, parece tener menor aplicación para su uso para la determinación de antígeno core del VHC, debido a que la sensibilidad analítica disminuiría sensiblemente, aunque de igual manera puede también resultar de utilidad en escenarios sin acceso a ensayos de CV56.
3.4Ventajas de la determinación del antígeno core para el diagnóstico de infección activaA continuación se resumen las ventajas, algunas ya comentadas previamente, de la utilización del antígeno core del VHC. Entre estas destacan los costes, que son menores que los de la CV, la estabilidad de la diana, que es superior que la de la CV, la posibilidad de trabajar con el mismo tubo primario utilizado para la serología de VHC y la reducción del tiempo de respuesta (rapidez para obtener resultados), ya que no es necesario trabajar en lotes como ocurre con la mayoría de las plataformas de CV.
Aunque el antígeno core presenta una menor sensibilidad que el ARN-VHC para la detección de viremias bajas, diversos estudios y guías han puesto de manifiesto su utilidad para la identificación de pacientes con infección activa por VHC.
Las ventajas y los inconvenientes de la utilización del antígeno core se resumen en la tabla 3.
Ventajas y desventajas de la determinación del antígeno core del virus de la hepatitis C (VHCAg) en comparación con la determinación de carga viral por técnicas moleculares (reacción en cadena de la polimerasa [PCR]) como marcador cuantitativo de viremia
| Ventajas | Desventajas |
|---|---|
| Apto para cualquier número de muestras (incluso una única determinación). No hay necesidad de trabajar por lotes | No es el método de referencia (la carga viral por técnicas moleculares está mucho más referenciada y es preferida en la actualidad para el seguimiento clínico) |
| Disponibilidad inmediata, muy útil para situaciones de urgencia (p. ej., donante de órganos seropositivo para VHC) | Poca oferta comercial: básicamente un único proveedor. Es necesario que el laboratorio cuente previamente con el autoanalizador adecuado y lo utilice para otras aplicaciones |
| Rapidez: 45min (frente a horas-días para la PCR) | Sensibilidad ligeramente inferior a la del método de referencia (no detecta viremias inferiores a 1.000-3.000 UI/ml) |
| Posibilidad de utilizar una única muestra para “screening” serológico y cuantificación de la viremia | |
| Simplicidad técnica. No es necesario personal especializado ni instalaciones complejas | |
| Alta correlación con el método de referencia (PCR) y posibilidad de cálculo de equivalencias entre ambas técnicas con fórmulas sencillas | |
| No hay variaciones significativas entre los distintos genotipos | |
| Precio: aproximadamente 15 €/determinación (frente a 30-50 €/determinación para la PCR) |
Juan Carlos Alados ha recibido ayudas para asistencia a congresos/reuniones científicas de Werfen y Gilead y también ha recibido compensación económica por ponencias de Abbvie y Gilead.
Antonio Aguilera ha recibido ayudas para asistencias a congresos y reuniones científicas de Roche, Hologic, Abbott Científica y Siemens Healthcare y también ha recibido compensación económica por charlas de Roche y Abbott Científica.
José María Eiros Bouza ha realizado labores de consultoría para Abbvie, Abbott Diagnostics y Gilead.
Roberto Alonso ha realizado labores de consultoría, recibido bolsas para asistencia a congresos, y contratos de investigación de Siemens, Abbott, Roche, DiaSorin, BioRad, Vircell, Copan, Gilead y ViiV.
Federico García ha realizado labores de consultoría, recibido bolsas de viaje y disfrutado de contratos de investigación de Abbott, Abbvie, Hologic, Vircell, Qiagen, Glead, Werfen, ViiV y Merck.