En la actualidad el complejo Burkholderia cepacia (B. cepacia) está compuesto por 20 especies filogenéticamente muy relacionadas. Algunas especies han emergido como patógenos oportunistas en pacientes inmunocomprometidos y son responsables de brotes intrahospitalarios. El complejo B. cepacia es un reconocido patógeno respiratorio en pacientes con fibrosis quística. B. cenocepacia y Burkholderia multivorans (B. multivorans) son las especies prevalentes en el mundo, según la literatura. Sin embargo, grupos de investigación en Argentina han descripto una epidemiología local particular, con prevalencia de la especie Burkholderia contaminans (B. contaminans).
MétodosSe estudiaron 68 aislamientos del complejo B. cepacia aislados de 46 pacientes con fibrosis quística de 14 hospitales distribuidos en 9 provincias del país. La identificación se llevó a cabo por métodos fenotípicos convencionales y fue confirmada por secuenciación parcial del gen recA. Los alineamientos de las secuencias se realizaron mediante el programa BLAST y fueron comparadas con las secuencias de las cepas tipo de cada una de las especies del complejo B. cepacia. Se determinó el perfil de sensibilidad a 4 agentes antimicrobianos para los aislamientos de las especies más prevalentes, según lo recomendado por la norma CLSI M45.
ResultadosLa especie prevalente resultó B. contaminans (49%, n = 33) seguida por B. cenocepacia (25%; n = 17). El resto de las especies identificadas fueron: Burkholderia seminalis (B. seminalis) (7%; n = 5), B. cepacia (7%; n = 5), B. multivorans (6%; n = 4), Burkholderia vietnamensis (5%, n = 3) y Burkholderia pyrrocinia (1%; n = 1).
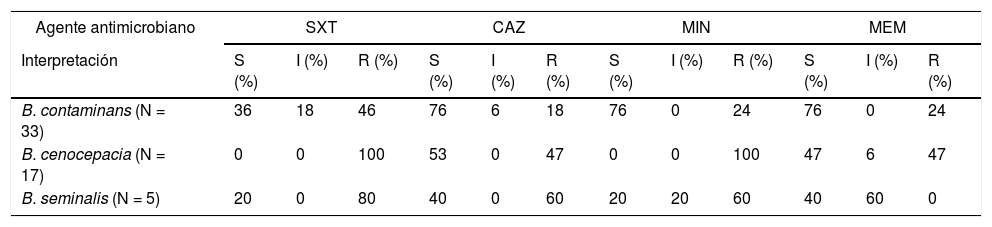
El 46% de los aislamientos de B. contaminans fueron resistentes a SXT y el 76% sensible a MIN, MEM y CAZ. Los aislamientos de B. cenocepacia fueron 100% resistentes a SXT y MIN, y el 47% a CAZ y MEM. En B. seminalis se observa un alto nivel de resistencia a TMS (80%), CAZ (60%) y MIN (60%), y un 60% de los aislamientos mostraron sensibilidad intermedia a MEM.
ConclusiónLos únicos países que han documentado la prevalencia de B. contaminans en infecciones respiratorias de pacientes fibroquísticos por complejo B. cepacia son Argentina, España y Portugal, y recientemente se reportó un caso de 2 pacientes con fibrosis quística en Irlanda. Debido a la alta frecuencia con que B. contaminans es aislada en nuestro país, es necesario promover la investigación de las posibles fuentes de infección y comprender los factores y mecanismos implicados en la aparente mayor transmisibilidad de esta especie. Se observaron distintos patrones de sensibilidad entre las especies estudiadas.
Burkholderia cepacia (B. cepacia) complex is composed of 20 phylogenetically closely related bacterial species. Some species have emerged as opportunistic pathogens in immunocompromised patients and are responsible for nosocomial outbreaks. The B. cepacia complex is a recognized respiratory pathogen in patients with cystic fibrosis. Burkholderia cenocepacia and Burkholderia multivorans (B. multivorans) are the most prevalent species in the world, according to the literature. However, research groups in Argentina have described a particular local epidemiology, with prevalence of Burkholderia contaminans (B. contaminans).
MethodsA total of 68 isolates of B. cepacia complex recovered of 46 cystic fibrosis patients attended at 14 hospitals distributed in 9 provinces of the country were studied. Identification was carried out by conventional phenotypic methods and was confirmed by recA gene sequencing. Sequences were analysed using the BLASTN program and comparing with B. cepacia complex type strains sequences deposited in GenBank. Antibiotic susceptibility tests were performed on isolates of the most prevalent species according to CLSI M45 guidelines.
ResultsThe prevalent specie was B. contaminans (49%, n = 33) followed by B. cenocepacia (25%; n = 17). The remaining species were Burkholderia seminalis (B. seminalis) (7%, n = 5), B. cepacia (7%, n = 5), B. multivorans (6%, n = 4), Burkholderia vietnamensis (5%, n=3) and Burkholderia pyrrocinia (1%; n = 1).
The 46% of B. contaminans isolates were resistant to SXT and 76% sensitive to MIN, MEM and CAZ. The isolates of B. cenocepacia were 100% resistant to SXT and MIN and 47% to CAZ and MEM. B. seminalis showed high levels of resistance to TMS (80%), CAZ (60%) and MIN (60%), and 60% of the isolates showed intermediate sensitivity to MEM.
ConclusionPrevious reports have described the prevalence of B. contaminans isolation from cystic fibrosis patients in Argentina, Spain and Portugal, and a case of two patients with cystic fibrosis in Ireland has recently been reported. Due to the high frequency with which B. contaminans is isolated in our country, it is necessary to promote the investigation of possible sources of infection and to understand the factors and mechanisms involved in the apparent greater transmissibility of this species. Different antimicrobial resistance profiles were detected between the species.
Las bacterias que conforman el complejo Burkholderia cepacia (B. cepacia) son patógenos oportunistas capaces de causar enfermedades en plantas, humanos y animales1. En humanos pueden establecer infecciones crónicas y frecuentemente severas, a las cuales resultan particularmente sensibles los pacientes con fibrosis quística, enfermedad granulomatosa crónica e inmunocomprometidos2. En el mundo, dentro del complejo B. cepacia, las especies Burkholderia multivorans (B. multivorans) y Burkholderia cenocepacia (B. cenocepacia) son las más frecuentemente halladas en estos pacientes, aunque la prevalencia descrita para cada especie varía dependiendo del país y el centro de salud bajo estudio3,4.
En Argentina, los primeros aislamientos del complejo B. cepacia recuperados de pacientes fibroquísticos fueron documentados en la década del 90. En ese momento, en forma esporádica y con una prevalencia muy baja (< 0,1%), se detectaban microorganismos gramnegativos a los que solo podía asignarse el género Burkholderia spp. La detección de estos microorganismos comenzó a aumentar durante los últimos 15 años con valores del 0,2 hasta el 3,6%. A principios de 2004, comenzaron a describirse brotes por complejo B. cepacia en centros de atención hospitalaria y se observó un aumento de la proporción de pacientes fibroquísticos (19-36%), de los cuales se recuperaban aislamientos pertenecientes al complejo B. cepacia. En la actualidad, con la aplicación de estrictos procedimientos de control para prevenir las infecciones, la incidencia de Burkholderia spp. en estos pacientes se redujo aproximadamente a un 10%4.
Dentro del complejo B. cepacia, B. cenocepacia es considerado el patógeno más severo, altamente virulento y transmisible y junto a B. multivorans representan la mayoría (80%) de las infecciones en pacientes con fibrosis quística alrededor del mundo, aunque su prevalencia varía de acuerdo al país en estudio4. La especie Burkholderia contaminans (B. contaminans), formalmente descripta en 20095, tiene una baja prevalencia en pacientes con fibrosis quística alrededor del mundo, con marcadas excepciones en Argentina4,6,7, España8,9 y Portugal10, y recientemente fue reportado un caso en Irlanda11. La frecuencia con que B. contaminans es aislada en Argentina y España podría ser el resultado de la transmisión paciente a paciente, así como también a la exposición a fuentes de infección como el medio ambiente y productos farmacéuticos12.
Dado que las especies del complejo B. cepacia son intrínsecamente resistentes a la mayoría de los antimicrobianos disponibles clínicamente, como aminoglucósidos, quinolonas, polimixinas y ß-lactámicos, este tipo de infecciones resultan extremadamente dificultosas de tratar13.
El objetivo del estudio es identificar las especies del complejo B. cepacia aisladas de muestras respiratorias de pacientes fibroquísticos recibidos en el laboratorio de referencia durante el período 2011-2015 y conocer el patrón de sensibilidad a los antimicrobianos de las especies prevalentes.
Materiales y métodosAislamientos bacterianosUn total de 68 aislamientos identificados presuntivamente como complejo B. cepacia fueron derivados al Laboratorio Nacional de Referencia Servicio Bacteriología Especial, Instituto Nacional de Enfermedades Infecciosas-ANLIS Dr. Carlos G. Malbrán) durante el período 2011-2015. Los mismos provenían de 14 hospitales distribuidos entre 9 provincias del país. Los aislamientos fueron conservados como parte de la Colección de Cultivos del Servicio Bacteriología Especial, perteneciente a la Federación Latinoamericana de Colecciones de Cultivos (FELACC).
Identificación fenotípicaLos aislamientos fueron recuperados de muestras de esputo de 47 pacientes fibroquísticos tomadas durante los episodios de exacerbación respiratoria o de deterioro clínico. Hubo 13 pacientes de los cuales fueron remitidos más de un aislamiento a lo largo del período estudiado 2011-2015. De estos pacientes, 7 tuvieron infección crónica, es decir, con cultivos positivos durante más de un año con la misma especie del complejo B. cepacia.
La caracterización bioquímica de los aislamientos se realizó según descripto por Henry et al.14, junto al uso de galerías comerciales miniaturizadas API® 20NE (bioMérieux, Marcy l¿Etoile, Francia) según las instrucciones del fabricante.
Identificación genotípicaSe utilizó el método de extracción de ADN por lisis alcalina según descripto por Storms et al.15. La amplificación del gen recA fue realizada según el protocolo descripto por Mahenthiralingam et al.16. Los productos de amplificación fueron purificados utilizando el AccuPrep® PCR Purification Kit (Bioneer, Bioneer Corporation, Corea), según las recomendaciones del fabricante. Los productos purificados fueron utilizados inmediatamente o almacenados a −20°C hasta su uso. Para la secuenciación de los amplicones se utilizó el cebador BCR316 y se empleó el método de secuenciación cíclica con el kit BigDye Terminator Cycle Sequencing (Applied Biosystems, EE. UU.) y el secuenciador ABI PRISM® 3.0 Genetic Analyzer (Applied Biosystems, EE. UU). Las secuencias fueron realizadas en el Servicio de Neurovirosis, Departamento de Virología del Instituto Nacional de Enfermedades Infecciosas-ANLIS Dr. Carlos G. Malbrán.
Las secuencias nucleotídicas fueron analizadas y corregidas con el programa Chromas 2.4.3 (Technelysium Pty. Ltd., Helensvale, Australia) y comparadas con las secuencias disponibles en GenBank. El criterio de aceptación para la asignación de especie fue > 99% respecto de las secuencias de las cepas tipo depositadas en la base de datos del NCBI descriptas por Kong et al.17.
Susceptibilidad antibióticaA las especies más frecuentemente identificadas, B. contaminans, B. cenocepacia y Burkholderia seminalis (B. seminalis), se les ensayó la sensibilidad por el método de difusión por disco a los siguientes antibióticos: ceftazidima (CAZ), minociclina (MIN), meropenem (MEM) y trimetroprima-sulfametoxazol (SXT). Los aislamientos fueron clasificados como susceptibles, intermedios o resistentes, según los criterios de interpretación indicados por la norma CLSI M4518.
ResultadosTodos los aislamientos fueron indistinguibles bioquímicamente. Los resultados obtenidos por secuenciación parcial del gen recA y por comparación con la base de datos en línea, la especie prevalente resultó B. contaminans (49%, n = 33) seguida por B. cenocepacia (25%; n = 17). El resto de las especies identificadas se distribuyeron homogéneamente: B. seminalis (7%; n = 5), B. cepacia (7%; n = 5), B. multivorans (6%; n = 4), Burkholderia vietnamensis (5%, n=3) y Burkholderia pyrrocinia (1%; n=1). Todos los aislamientos identificados por el método molecular como B. contaminans exhibieron pigmento verdoso y hemólisis positiva.
Las especies asociadas a los 7 pacientes fibroquísticos con infección crónica fueron B. cenocepacia (un paciente), B. multivorans (2 pacientes), B. contaminans (3 pacientes) y B. seminalis (un paciente).
Respecto a la sensibilidad, el 46% (n = 15) de los aislamientos de B. contaminans fueron resistentes a SXT y en su mayoría sensibles (76%; n=25) a MIN, MEM y CAZ. La resistencia a SXT y MIN de B. cenocepacia se observó en todos los aislamientos, mientras que el 47% (n = 8) fueron resistentes a CAZ y MEM. B. seminalis mostró un alto nivel de resistencia a TMS (80%; n = 4), CAZ (60%; n = 3) y MIN (60%; n = 3), y un 60% (n = 3) de los aislamientos mostraron sensibilidad intermedia a MEM. Todos los resultados se detallan en la tabla 1.
Resultados de sensibilidad obtenidos de los 55 aislamientos estudiados
| Agente antimicrobiano | SXT | CAZ | MIN | MEM | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Interpretación | S (%) | I (%) | R (%) | S (%) | I (%) | R (%) | S (%) | I (%) | R (%) | S (%) | I (%) | R (%) |
| B. contaminans (N = 33) | 36 | 18 | 46 | 76 | 6 | 18 | 76 | 0 | 24 | 76 | 0 | 24 |
| B. cenocepacia (N = 17) | 0 | 0 | 100 | 53 | 0 | 47 | 0 | 0 | 100 | 47 | 6 | 47 |
| B. seminalis (N = 5) | 20 | 0 | 80 | 40 | 0 | 60 | 20 | 20 | 60 | 40 | 60 | 0 |
CAZ: ceftazidima; I: intermedio; MEM: meropenem; MIN: minociclina; N: número de aislamientos; R: resistente; S: sensible; STX: trimetroprima-sulfametoxasol.
El aislamiento y la identificación apropiada de los patógenos involucrados en pacientes con fibrosis quística resultan un paso crítico para el control de la enfermedad y tienen un impacto significativo en el tratamiento antimicrobiano, el cuidado del paciente, la prevención de nuevas infecciones y el control de las unidades de cuidado, así como en la mejora de su calidad de vida.
La gravedad de la enfermedad por infección con complejo B. cepacia en pacientes con fibrosis quística es sustancialmente más alta que con otras bacterias y es dramática la heterogeneidad en el pronóstico de estos pacientes, ya que mientras algunos tienen una declinación fulminante de la función pulmonar, otros portadores de CBC no tienen efectos adversos obvios por largos períodos.
Dado que B. cenocepacia y B. multivorans son las especies prevalentes en el mundo, la mayoría de los estudios dedicados a la patogenia del complejo B. cepacia están enfocados en estas 2 especies, por lo que falta información respecto del impacto de las otras especies. Cabe destacar que la literatura19 demuestra que todas las especies del complejo B. cepacia producen un empeoramiento clínico, que incluye desde infecciones crónicas o transitorias hasta el síndrome cepacia.
A diferencia de lo descripto en otros países, en particular en Argentina, España y Portugal, B. contaminans presenta una mayor prevalencia en pacientes fibroquísticos. Recientemente fue descripto un caso en Irlanda que involucró a 2 hermanos con esta enfermedad. Si bien las infecciones por B. contaminans en los pacientes con fibrosis quística son usualmente de naturaleza transitoria y, por lo tanto, causan la colonización del tracto respiratorio más que infección verdadera, Nunvar et al.20. documentaron un caso de un paciente cuyo deceso fue asociado a septicemia por B. contaminans.
Debido a la alta frecuencia con que B. contaminans es aislada en Argentina, es necesario promover la investigación de las posibles fuentes de infección y sobre todo comprender los factores y los mecanismos implicados en la aparente mayor transmisibilidad de esta especie o distribución medioambiental.
La secuenciación del gen recA continua siendo el método patrón de oro para la identificación a nivel de especie dentro del complejo B. cepacia. Es importante la utilización de secuencias de cepas tipo o cepas de referencia bien caracterizadas para determinar los porcentajes de similitud. No obstante, con la descripción de nuevas especies probablemente sea necesaria la incorporación de nuevos genes o técnicas que permitan la diferenciación entre ellas.
Los resultados de la sensibilidad antibiótica de B. cenocepacia y B. seminalis mostraron resistencia a más de 2 antibióticos, confirmando el rasgo de multirresistencia que caracteriza al complejo B. cepacia. B. contaminans, la especie prevalente en la población fibroquística en Argentina, mostró un patrón que aún conserva altos niveles de sensibilidad a CAZ, micociclina y MEM. No se observaron cambios en los patrones de sensibilidad en los aislamientos de los pacientes con infección crónica documentada a lo largo del tiempo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la colaboración de Laboratorios Britania S.A. Argentina, por la provisión de discos para los estudios de sensibilidad a los antimicrobianos.