Determinar la prevalencia de la infección por Trypanosoma cruzi, los factores epidemiológicos asociados y el riesgo de transmisión materno-fetal en las mujeres gestantes procedentes de zonas endémicas atendidas en el área de influencia del Hospital de Cruces (País Vasco, España).
MétodosEstudio descriptivo. Diagnóstico de la infección por T. cruzi en las mujeres gestantes y en neonatos por serología y detección del parásito mediante PCR. Encuesta epidemiológica y análisis multivariante para identificación de los factores de riesgo asociados a la infección por T. cruzi.
ResultadosSe incluyeron en el estudio un total de 158 mujeres atendidas entre el 15 de diciembre de 2008 y el 15 de enero de 2010, con una edad media de 28,5 (±5,3) años. Diecinueve (12,0%) gestantes presentaban infección por T. cruzi, de las cuales 16 (84,2%) procedían de Bolivia, con una prevalencia en estas del 22,2%. Los factores de riesgo epidemiológicos que se asociaron de forma independiente con la infección por T. cruzi fueron el antecedente de residencia en casa de adobe (OR: 4,62; IC95%: 1,54-13,87; p=0,006) y el conocimiento del vector (OR: 9,07; IC95%: 1,91-43,11; p=0,006). Hubo un recién nacido infectado, lo que supone una tasa de transmisión congénita del 5,8%.
ConclusionesLa elevada prevalencia detectada de infección por T. cruzi en mujeres gestantes latinoamericanas y el riesgo de transmisión vertical hacen recomendable la implantación de programas de cribado basados fundamentalmente en la identificación del origen geográfico y variables epidemiológicas.
To estimate the prevalence of Trypanosoma cruzi infection, the epidemiological factors associated with it, and the risk of maternal-foetal transmission in pregnant women from endemic areas seen in the catchment area of Cruces Hospital (Basque Country, Spain).
MethodsDescriptive study. Diagnosis of T. cruzi infection in pregnant women and neonates by performing serological tests and parasitological diagnosis using PCR. Epidemiological survey and multivariate analysis to identify the risk factors associated with T. cruzi infection.
ResultsA total of 158 women participated in the study between December 2008 and January 2010, with mean age of 28.5 (±5.3). Nineteen (12%) pregnant mothers were seropositive, of whom 16 (84.2%) came from Bolivia, with a prevalence, in this group, of 22.2%. Independent epidemiological risk factors associated with T. cruzi infection were a history of living in mud houses (OR: 4.62; 95%IC: 1.54-13.87; P=.006) and knowledge of the vector (OR: 9.07; 95%IC: 1.91-43.11; P=.006). There was one newborn infected, which assumed a congenital transmission rate of 5.8%
ConclusionsOn the basis of the high prevalence of T. cruzi infection detected in Latin-American pregnant women and the risk of vertical transmission, a screening program would be recommended, which would be fundamentally based on the identification of geographic origin and epidemiological variables.
La enfermedad de Chagas (EC) o tripanosomiasis americana es una zoonosis causada por el parásito Trypanosoma cruzi, endémica de áreas rurales de Centro y Sudamérica, que se estima afecta a 8-10 millones de personas. La Organización Panamericana de la Salud (PAHO) ha identificado a la EC como la enfermedad parasitaria más importante en Latinoamérica, así como la principal causa de enfermedad cardiaca1.
La infección en área endémica se adquiere principalmente a través de la vía vectorial por medio de diversas especies de chinches triatominos hematófagos conocidos popularmente en Bolivia como vinchucas. La vía transfusional y la transmisión vertical son los otros modos principales de adquisición del parásito en zonas urbanas y en países no endémicos; finalmente, otras vías de transmisión alternativa que se han descrito son la oral, el trasplante de órganos y tejidos y los accidentes de laboratorio2.
En la historia natural de la EC existen 2 fases o estadios clínicos: aguda y crónica3,4. La infección aguda dura aproximadamente 6-8 semanas, pasa habitualmente desapercibida por ser asintomática u oligoasintomática y es más frecuente en niños, por lo que en esta fase el diagnóstico es efectuado en menos del 10%. De esta fase inicial la mayor parte de las personas que no han recibido tratamiento pasan a una fase latente (forma crónica indeterminada), en la que se encuentran aproximadamente el 60% de los infectados y que puede durar décadas o persistir indefinidamente: el paciente está asintomático, sin evidencia de daño orgánico y la parasitemia es baja3,4. El 30-40% de los casos desarrollará de 10 a 30 años después de la infección inicial alteraciones cardiacas, digestivas o del sistema nervioso central (forma crónica sintomática), produciendo en ocasiones alteraciones graves, tales como miocardiopatía, megacolon y megaesófago5. Se estima que la EC causa en torno a 14.000 muertes al año en todo el mundo6.
Tradicionalmente la EC se consideraba una enfermedad de zonas rurales empobrecidas, aunque en la actualidad, debido a los flujos migratorios, puede diagnosticarse en áreas urbanas de países endémicos y en países receptores de la inmigración, lo que origina cambios sustanciales en la epidemiología de la enfermedad7. Otros cambios han sido propiciados por los programas de control epidemiológico que se han implementado desde hace más de 2 décadas, centrados básicamente en el control del vector de la EC y en la vigilancia de la infección transfusional, lo que ha producido una emergencia relativa de la importancia de la transmisión vertical3,8,9.
La inmigración procedente de Latinoamérica en España se ha multiplicado por cinco en los últimos años, de 446.000 inmigrantes en 2001 a 2.096.695 en 2008, con Ecuador, Argentina, Bolivia y Perú como los principales países de procedencia10. En estos datos no se incluyen los inmigrantes no censados o ilegales (por ejemplo, de los 550.000 turistas procedentes de 17 países de Latinoamérica que entraron en España en 2002, solo 86.000 retornaron), por lo que la cifra real es mayor11.
La ausencia del vector transmisor de la infección, exclusivo del continente americano, descarta la transmisión de la enfermedad por esta vía a la población autóctona de España8. Existe desde el año 2005 un Real Decreto en nuestro país que obliga a todos los centros de transfusión a realizar el estudio serológico a todo posible donante nacido en países donde la enfermedad es endémica, hijo de madre nacida en estos países, o que haya sido transfundido en América Latina, y los excluye de la donación si el cribado es positivo o no se puede realizar por algún motivo12. Por ello, el principal reto que plantea actualmente la EC en nuestro país es el cribado en embarazadas y el tratamiento precoz de los recién nacidos infectados. Hay dos hechos que dotan de mayor relevancia el control de la transmisión vertical: más de la mitad de la población procedente de Latinoamérica residente en nuestro país (cerca de 1.800.000 personas) son mujeres, con el 73% de estas en edad fértil (unas 700.000 mujeres en edades entre 15-44 años)10, y por otra parte la eficacia del tratamiento con beznidazol en niños menores de un año con infección por T. cruzi es cercana al 100%, con un buen perfil de tolerancia y de seguridad8,13. Sin embargo, así como la transmisión por transfusiones y trasplantes está controlada, la detección de una posible transmisión vertical es un tema pendiente de regulación; España carece de un consenso nacional sobre este tema, y solo dos comunidades autónomas (Cataluña y Valencia)14,15 disponen de programas legislados de cribado serológico (otras comunidades, como Madrid, presentan iniciativas aún sin legislar)16.
En este contexto, el objetivo de este trabajo es determinar la prevalencia de la infección por T. cruzi en las mujeres gestantes procedentes de zonas endémicas residentes en nuestra área de influencia, determinar el riesgo de transmisión a sus recién nacidos y describir los factores de riesgo epidemiológicos asociados con la infección por T. cruzi.
MetodologíaCriterios de inclusiónLa población diana estaba formada por las mujeres gestantes latinoamericanas que acudieron a las consultas prenatales dependientes del Servicio de Ginecología del Hospital de Cruces (País Vasco, España) desde el 15 de diciembre del 2008 hasta el 15 de enero de 2010, a las que se ofrecía participar en el estudio en la primera visita que realizaban al ginecólogo, generalmente en el primer trimestre de embarazo. Las que accedieron a participar firmaron un consentimiento informado, aprobado previamente por el comité de ética del Hospital de Cruces.
Diagnóstico de enfermedad de ChagasLas técnicas diagnósticas para la detección de T. cruzi realizadas a las participantes fueron:
Técnicas serológicasInmunofluorescencia indirecta (IFA para la tripanosomiasis, MarDx®, Inc. Trinity Biotech plc Bray, Co. Wicklow, Irlanda) y dos tests ELISA, uno con antígenos recombinantes (T .cruzi Ab, Dia.Pro, Milán, Italia) y el otro con lisado (antígenos totales) preparado a partir de T. cruzi (ORTHO®T.cruzi ELISA Test System, Buckinghamshire, Reino Unido) que realizamos según las instrucciones del fabricante, incluido el punto de corte. En la determinación de anticuerpos por inmunofluorescencia indirecta (IFI), como el fabricante indica, se han considerado positivos los sueros con títulos ≥ 1/32.
Detección de ADN de T. cruzi mediante PCRSe obtuvieron de las pacientes 10ml de sangre con EDTA para la detección de ADN. Se separó la capa leucocitaria con ficol (Biocoll Separating Solution, Biochrom Ag, Berlín, Alemania). El sedimento se resuspendió en 200μl PBS que se utilizaron para la extracción del ADN con High Pure PCR Template Preparation Kit (Roche Diagnostics, Mannheim, Alemania). La amplificación y detección del ADN de T. cruzi se realizó utilizando una PCR a tiempo real con sonda de hidrólisis (Universal Probe Library, Roche Diagnostics, Mannheim, Alemania) en un LightCycler 480 utilizando los cebadores TCZ-F: 5′- GCT CTT GCC CAC AMG GGT GC y TCZ-R: 5′- CCA AGC AGC GGA TAG TTC AGG17.
Para la confirmación de la amplificación y detección de ADN de T. cruzi se utilizó un segundo esquema de PCR a tiempo real empleando un intercalador (SYBR Green) como fluoróforo en sistema LightCycler™ 2.0 (Roche Applied Science, Mannheim, Alemania). Se calculó la temperatura de disociación del amplicón obtenido tras la amplificación para verificar la especificidad de los resultados obtenidos con esta segunda técnica. Las muestras cuya temperatura de disociación coincidía con la del control positivo empleado se secuenciaron con el kit BigDye Terminator Kit v.3.1 en un secuenciador ABI 3130 Genetic Analyzer (Applaied Biosystems, Foster City, EE.UU.) siguiendo las recomendaciones del fabricante.
Recogida de datos clínicos y epidemiológicosTodas las participantes fueron remitidas a la consulta de medicina interna, donde se realizó una historia clínica que recogía antecedentes epidemiológicos, personales, obstétricos y familiares, así como manifestaciones clínicas asociadas a la EC. Se comunicaba en esta visita el resultado de las pruebas serológicas. Se realizó una encuesta telefónica a las pacientes que tuvieron dificultad para acudir a la consulta y cuyos resultados serológicos fueron negativos. Además del control rutinario de la gestación, todas las participantes recibieron atención médica específica en función de la presencia de otros síntomas. En las pacientes con serología positiva para T. cruzi se realizaron pruebas diagnósticas dirigidas a descartar la presencia de afectación orgánica por EC así como serología frente a VIH, y fueron remitidas a la unidad de enfermedades infecciosas para seguimiento y tratamiento.
Serología y seguimiento en neonatosA los neonatos de madres con serología positiva se les realizó dentro de la primera semana de vida una extracción de sangre para realizar las pruebas parasitológicas (PCR) y serología, repitiendo la PCR un mes después, así como la serología al 8.°-9.° mes. Todos ellos fueron remitidos al servicio de pediatría para seguimiento y tratamiento en su caso. Se remitió asimismo al resto de hijos menores de 15 años al servicio de pediatría para cribado y tratamiento de la infección por T. cruzi.
Análisis estadísticoLos análisis estadísticos se han realizado con el programa SPSS 19.0 (SPSS Inc., Chicago, IL, EE.UU.). Las variables continuas con distribución normal se han descrito empleando la media y la desviación estándar, mientras que para las variables cuantitativas de distribución no normal se han empleado la mediana y el rango. Las variables cualitativas se describen mediante frecuencia y porcentajes. La comparación de proporciones entre variables cualitativas se ha realizado mediante el estadístico de chi-cuadrado o sus correspondientes correcciones, como la corrección de Fisher cuando las frecuencias esperadas son inferiores a 5. Para la comparación entre variables cuantitativas con distribución normal se ha empleado la prueba t de Student no pareada, mientras que para las variables cuantitativas de distribución no normal se ha empleado la prueba no paramétrica de U de Mann-Whitney. Finalmente se ha realizado un análisis multivariante consistente en un modelo de regresión logística con eliminación secuencial de variables no significativas. En todos los análisis estadísticos se han empleado tests de dos colas, considerándose como significativa una probabilidad de error α (p<0,05).
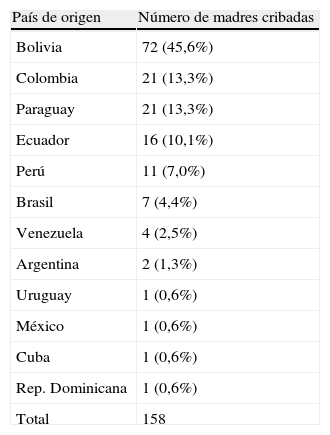
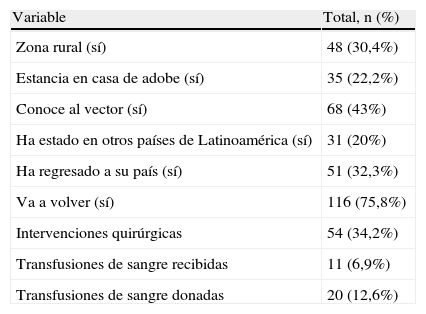
ResultadosDescripción del grupo estudiadoDesde el 15 de diciembre del 2008 al 15 de enero del 2010 se identificaron un total de 176 mujeres gestantes que cumplían los criterios de inclusión; 17 mujeres no continuaron el seguimiento necesario para ser incluidas en el estudio, y una paciente abandonó el seguimiento antes de realizarse el estudio serológico tras presentar aborto espontáneo, por lo que el grupo a estudio incluyó finalmente 158 participantes. La edad media fue de 28,5 (±5,3) años, y en la mayor parte de los casos la consulta se realizó en el primer trimestre de gestación (113/158). Las mujeres participantes procedían de 12 países diferentes (tabla 1), y mayoría eran originarias de Bolivia (72 casos, 45,6%). El tiempo de estancia media en España en el momento en que se realizó la entrevista era de 4,4 (±2,84) años. La mediana de gestaciones por mujer fue de 2 (1-10). El 30,4% de las participantes eran primigestas; en el resto de los casos, los hijos de las gestaciones previas se encontraban sanos, sin referir ningún caso de infección. Los datos epidemiológicos y los antecedentes obstétricos se muestran en las tablas 2 y 3, respectivamente.
Características epidemiológicas
| Variable | Total, n (%) |
| Zona rural (sí) | 48 (30,4%) |
| Estancia en casa de adobe (sí) | 35 (22,2%) |
| Conoce al vector (sí) | 68 (43%) |
| Ha estado en otros países de Latinoamérica (sí) | 31 (20%) |
| Ha regresado a su país (sí) | 51 (32,3%) |
| Va a volver (sí) | 116 (75,8%) |
| Intervenciones quirúrgicas | 54 (34,2%) |
| Transfusiones de sangre recibidas | 11 (6,9%) |
| Transfusiones de sangre donadas | 20 (12,6%) |
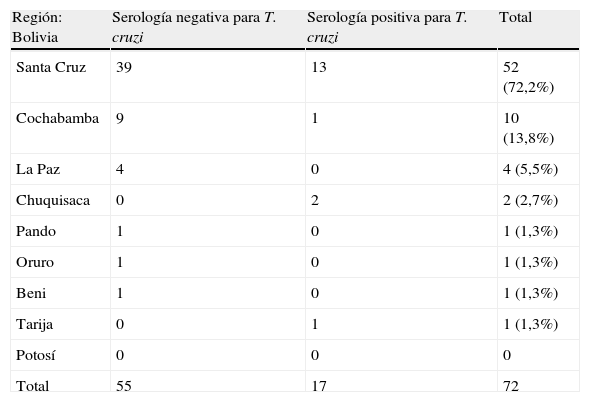
En 19 pacientes la serología frente a T. cruzi fue positiva tanto por IFI como por los 2 métodos de ELISA, y en 2 casos la PCR fue positiva. Una de las pacientes positivas (IFI 1/256, ELISA positivo) previamente había recibido tratamiento en su país de origen (Bolivia) en el año 1995. Otra paciente boliviana, seronegativa en el momento actual, había sido diagnosticada (con serología positiva) y tratada por EC en 1998 en Argentina. Exceptuando las dos mujeres que habían sido diagnosticadas y tratadas con anterioridad, las 18 restantes desconocían padecer la infección. El grupo de pacientes positivas quedó formado, por tanto, por 19 mujeres, con una edad media de 28,4±4,9 años y un tiempo medio de estancia en España de 3,8±1,6 años, lo que supone una prevalencia del 12% (19/158). De estas, 16 (84,2%) procedían de Bolivia, 2 de Paraguay y 1 de Brasil. La prevalencia de serología positiva entre las participantes originarias de Bolivia, Paraguay y Brasil fue del 22,2% (16/72), del 9,5% (2/21) y del 14,2% (1/7), respectivamente. Entre las pacientes bolivianas, la mayor parte de los casos procedían de la región de Santa Cruz (70,5%,12/17), con un 23% (12/52) de seroprevalencia en esta población (tabla 4). No se identificó ningún caso positivo entre las mujeres procedentes de los otros 9 países incluidos en el estudio.
Región de origen de mujeres bolivianas según serología de Trypanosoma cruzi
| Región: Bolivia | Serología negativa para T. cruzi | Serología positiva para T. cruzi | Total |
| Santa Cruz | 39 | 13 | 52 (72,2%) |
| Cochabamba | 9 | 1 | 10 (13,8%) |
| La Paz | 4 | 0 | 4 (5,5%) |
| Chuquisaca | 0 | 2 | 2 (2,7%) |
| Pando | 1 | 0 | 1 (1,3%) |
| Oruro | 1 | 0 | 1 (1,3%) |
| Beni | 1 | 0 | 1 (1,3%) |
| Tarija | 0 | 1 | 1 (1,3%) |
| Potosí | 0 | 0 | 0 |
| Total | 55 | 17 | 72 |
Las características clínico-epidemiológicas de las mujeres incluidas en el estudio se muestran en la tabla 5. Entre los datos epidemiológicos más relevantes cabe destacar el antecedente de residencia en casa de adobe y el conocimiento del vector; 35 mujeres (22,2%) habían vivido en casa de adobe, de las cuales 27 (77,1%) eran bolivianas; 12 (34,2%) de las participantes que habían vivido en casa de adobe resultaron seropositivas para la infección por T. cruzi, y 11 (91,6%) de estas procedían de Bolivia. Un total de 68 (43,0%) mujeres conocían el vector, de las cuales 60 (88,2%) eran bolivianas; únicamente una de las mujeres con serología positiva no conocía el vector y procedía de Paraguay. Dos de las pacientes seropositivas habían recibido transfusiones de sangre en sus países de origen (Paraguay y Bolivia). La mediana de gestaciones entre las pacientes con serología positiva fue de 3 (1-4), y el 10,5% eran primíparas.
Análisis univariantes
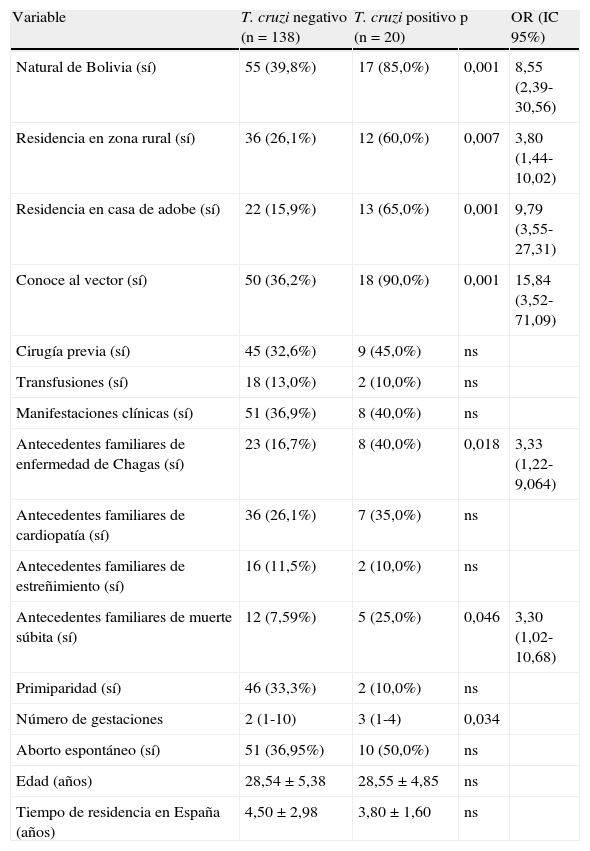
| Variable | T. cruzi negativo (n=138) | T. cruzi positivo (n=20) | p | OR (IC95%) |
| Natural de Bolivia (sí) | 55 (39,8%) | 17 (85,0%) | 0,001 | 8,55 (2,39-30,56) |
| Residencia en zona rural (sí) | 36 (26,1%) | 12 (60,0%) | 0,007 | 3,80 (1,44-10,02) |
| Residencia en casa de adobe (sí) | 22 (15,9%) | 13 (65,0%) | 0,001 | 9,79 (3,55-27,31) |
| Conoce al vector (sí) | 50 (36,2%) | 18 (90,0%) | 0,001 | 15,84 (3,52-71,09) |
| Cirugía previa (sí) | 45 (32,6%) | 9 (45,0%) | ns | |
| Transfusiones (sí) | 18 (13,0%) | 2 (10,0%) | ns | |
| Manifestaciones clínicas (sí) | 51 (36,9%) | 8 (40,0%) | ns | |
| Antecedentes familiares de enfermedad de Chagas (sí) | 23 (16,7%) | 8 (40,0%) | 0,018 | 3,33 (1,22-9,064) |
| Antecedentes familiares de cardiopatía (sí) | 36 (26,1%) | 7 (35,0%) | ns | |
| Antecedentes familiares de estreñimiento (sí) | 16 (11,5%) | 2 (10,0%) | ns | |
| Antecedentes familiares de muerte súbita (sí) | 12 (7,59%) | 5 (25,0%) | 0,046 | 3,30 (1,02-10,68) |
| Primiparidad (sí) | 46 (33,3%) | 2 (10,0%) | ns | |
| Número de gestaciones | 2 (1-10) | 3 (1-4) | 0,034 | |
| Aborto espontáneo (sí) | 51 (36,95%) | 10 (50,0%) | ns | |
| Edad (años) | 28,54±5,38 | 28,55±4,85 | ns | |
| Tiempo de residencia en España (años) | 4,50±2,98 | 3,80±1,60 | ns |
ns: no significativa.
Ocho de las mujeres positivas para T. cruzi refirieron presentar síntomas gastrointestinales y/o cardiológicos, sin que se observara afectación orgánica cardiaca o digestiva en las pruebas realizadas según recomendaciones para el diagnóstico y manejo de pacientes con EC18,19. Únicamente en una paciente asintomática se observó bloqueo de rama derecha con ecocardiograma normal. La serología frente a VIH fue negativa en todas las pacientes. Un total de 9 (47,3%) de las pacientes seropositivas han continuado seguimiento en consultas de la unidad de enfermedades infecciosas, y 6 de ellas han recibido tratamiento con beznidazol.
Análisis univariantesLos análisis univariantes se muestran en la tabla 5. Las variables en las que se observó una diferencia significativa entre los grupos de mujeres negativas y positivas fueron «natural de Bolivia», «residencia en zona rural», «residencia en casa de adobe», «conoce al vector», «primiparidad» y «antecedentes familiares de EC».
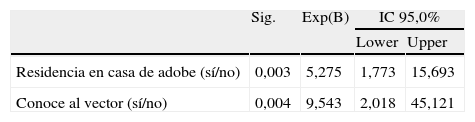
Análisis multivarianteEl análisis multivariante consistió en un modelo de regresión logística con eliminación secuencial de variables no significativas, introduciendo como variable dependiente «serología positiva frente a T. cruzi (sí/no)», y como variables independientes las variables que en los análisis univariantes presentaron una p<0,2: «natural de Bolivia (sí/no)», «residencia en zona rural (sí/no)», «residencia en casa de adobe (sí/no)», «conoce al vector (sí/no)», «primiparidad (sí/no)» y «antecedentes familiares de EC (sí/no)». En el modelo final mantuvieron una asociación independiente las variables «residencia en casa de adobe» (OR: 4,62; IC95%: 1,54-13,87; p=0,006) y «conoce al vector» (OR: 9,07; IC95%: 1,91-43,11; p=0,006) (tabla 6).
Problemas gestacionales y descripción de las características clínicas de los neonatosDe las 19 gestaciones incluidas en el estudio, 15 tuvieron un parto a término sin incidencias, una paciente precisó cesárea a término por indicación obstétrica y en 2 casos se produjo parto pretérmino (una preeclampsia y un parto pretérmino sin identificarse desencadenante claro); una paciente sufrió aborto precoz (primer trimestre del embarazo). Una de las pacientes abandonó el estudio tras el parto, por lo que pudieron analizarse 17 recién nacidos.
Se identificó un único caso de transmisión congénita, que presentó PCR para T. cruzi positiva en el primer mes de vida, confirmándose con una nueva PCR un mes después, lo que supone una tasa de transmisión congénita del 5,8%. Se trataba de una niña con una gestación a término sin incidencias y cuya madre había presentado una serología frente a T. cruzi con una IFI 1/1280, los 2 test de ELISA positivos y la PCR negativa. La niña recibió tratamiento con beznidazol (10mg/kg/día durante 60 días), que toleró sin ninguna reacción adversa, y con negativización de PCR al mes y serología negativa a los 6 meses de finalizar el tratamiento.
Los 16 neonatos restantes presentaron PCR negativas y serología materna positiva en el primer mes de vida, que se negativizó en el noveno mes.
Finalmente, las pacientes seropositivas con hijos de gestaciones previas recibieron consejo médico y un total de 15 niños acudieron a la consulta de pediatría; en todos los casos la serología frente a T. cruzi fue negativa.
DiscusiónLa prevalencia de serología positiva para EC fue relativamente alta (12%) en nuestro grupo de gestantes, ya que en otras series publicadas en nuestro país las cifras oscilaron entre el 3,4% (Barcelona), el 4,6-9,7% (Valencia) y el 3,96% (Madrid)20–23; al igual que en otros estudios, la seroprevalencia fue mayor en pacientes naturales de Bolivia (22,2%), cifra similar a las de otras series (27% en Barcelona, 17,5-26% en Valencia y 11,4-18% en Madrid)20–24. La mayor seroprevalencia global en nuestro grupo se explica probablemente por el alto número de pacientes bolivianas incluidas (45,6%), ya que en las otras series citadas están representadas en mayor medida mujeres procedentes de países con menores tasas de infección por T. cruzi. Además, en nuestro estudio la mayoría de pacientes bolivianas procedían de la región de Santa Cruz, zona donde la prevalencia de EC es alta (se han descrito tasas de infección de hasta el 51% en donantes de sangre y, más recientemente, del 29% en mujeres gestantes)25,26. Esto refleja la realidad de la inmigración latinoamericana en Vizcaya, donde los inmigrantes bolivianos son el grupo mayoritario (17% del total de la población extranjera residente en Vizcaya, aproximadamente 9.600 personas, de las cuales el 45% son mujeres en edad fértil10) y están particularmente sensibilizados frente a la EC dada la alta prevalencia en su país de origen. El resto de casos positivos fueron pacientes originarias de Paraguay (9,5%) y Brasil (14,2%), donde la prevalencia es del 2,5% y del 1%, respectivamente27 (aunque persisten determinadas zonas en Brasil en las que aún se observa una endemicidad superior a la indicada)28.
En nuestro estudio la sensibilidad de la PCR con respecto al número de gestantes seropositivas es 10,53%, valor menor que los que aparecen en la literatura (45-100%)29–32. Esta disparidad de resultados puede explicarse debido a ciertas diferencias. Primero, los estudios citados utilizan como diana el ADN del kinetoplasto, y nosotros hemos empleado cebadores que amplifican y detectan una porción repetitiva del ADN satélite. Si bien estos son una de las parejas que según el estudio de Schijman et al.33 mejores sensibilidades se obtienen. Segundo, para realizar la extracción de ADN emplean directamente la sangre total con tampón guanidina/EDTA y nosotros partimos de la capa leucocitaria, que se ha obtenido de sangre total con EDTA. Sin embargo, Fitzwater et al.34 obtienen una mayor sensibilidad de la capa leucocitaria (46,5%) que de la sangre total (40%). Tercero, la extracción del ADN se realizó automáticamente. Schijman et al.33 concluyen que para realizar la extracción de ADN es apropiada la utilización de reactivos basados en tampones de lisis que contengan sales de guanidina. Nuestro método de extracción contiene dichas sales, pero puede que al no partir de sangre con guanidina/EDTA la extracción con dichas sales no sea óptima. Cuarto, todas las pacientes estudiadas se encontraban en la fase crónica de la enfermedad. En esta fase las parasitemias son intermitentes y se recomienda la extracción de varias muestras para optimizar el rendimiento de la PCR. Es cierto que Brutus et al.35 demuestran en su estudio parasitemias más elevadas durante el embarazo, especialmente en el tercer trimestre. Entre nuestras pacientes seropositivas, solamente una se encontraba en el tercer trimestre, lo que podría explicar una menor detección del parásito.
En cuanto a los factores de riesgo epidemiológicos asociados con la EC, resulta lógico que el antecedente de residencia en tipo de vivienda precaria o casa de adobe sin revoque y el conocimiento del vector se asocien de forma independiente con la infección por T. cruzi, ya que la vía vectorial es la forma más común de adquisición del parásito y este tipo de vivienda promueve la infestación domiciliario por el insecto vector5. En nuestra población, las pacientes originarias de Bolivia son sistemáticamente las que en mayor medida conocen al vector y/o han vivido en casa de adobe. Todo ello permitiría reconocer en nuestro medio a un grupo de gestantes de riesgo, que podría identificarse sencillamente mediante una encuesta epidemiológica. Sin embargo, debido a los eventos socioeconómicos acontecidos en las tres últimas décadas en Latinoamérica, se ha producido un cambio en la epidemiología y transmisión de la EC, llegándose incluso a describir casos congénitos de segunda generación en zonas urbanas de Argentina y Chile en mujeres que no han residido en zona rural ni en casas de adobe36,37. Por otra parte, hay estudios en zonas no endémicas que demuestran que un cuestionario dirigido a las condiciones de la vivienda (adobe y zona rural) no es suficiente para determinar el riesgo de infección por T. cruzi38. En cuanto a la realización de cribado selectivo según el país de procedencia, hay que tener en cuenta que en España se han descrito casos de transmisión congénita en mujeres procedentes de países endémicos diferentes de Bolivia39,40. En esta línea, ciertos autores han sugerido recientemente el cribado universal de todas las mujeres embarazadas procedentes de áreas endémicas como la medida más adecuada y coste-efectiva23,41.
Nuestro estudio no ha identificado ninguna manifestación clínica asociada de forma significativa con la infección por T. cruzi, probablemente debido a que los síntomas de la EC son muy inespecíficos y que las pacientes estudiadas, todas ellas jóvenes, se encontrarían en la fase latente de la enfermedad y desconocerían el hecho de presentar la infección. Sin embargo, la ausencia de síntomas no debe eximir el cribado de EC en embarazadas procedentes de regiones en donde la enfermedad es endémica debido a la importancia de realizar un diagnóstico precoz de las complicaciones cardiológicas y/o digestivas asociadas a la enfermedad con el fin de controlarlas y evitar su avance en la medida de lo posible.
La infección congénita por T. cruzi ha sido frecuentemente asociada con alteraciones severas en el crecimiento y la madurez del feto, así como con un incremento en la morbimortalidad neonatal. Sin embargo, si no hay transmisión parasitaria la infección crónica materna no parece tener efecto en el desarrollo del embarazo, el crecimiento fetal y la salud de los niños no infectados36,42–44. En nuestro caso, la infección materna no afectó al curso de los embarazos actuales y las complicaciones que aparecieron en el parto no fueron mayores de las esperadas en la población general. Un dato interesante es el alto número de abortos previos que presentan en su historia obstétrica las mujeres gestantes infectadas. Sin embargo, no encontramos relación significativa entre el antecedente de aborto y la presencia de la infección por T. cruzi, y desconocemos si los fetos estaban infectados o no. La tasa de transmisión congénita detectada (5,8%) está dentro del rango descrito (1-10%)45 y no es significativamente diferente a las tasas descritas en nuestro entorno: 2,7% en Valencia, 7,3% en Barcelona y 2,6% en Madrid20,22,23. El tratamiento en el único caso de infección neonatal que se produjo en nuestro estudio fue eficaz y bien tolerado, tal y como se refiere en la mayoría de las series46,47. La eficacia del tratamiento disminuye paulatinamente con la edad, y es asimismo mayor la frecuencia de efectos adversos45. Por estas razones se recomienda el tratamiento en todos los casos de infección congénita o aguda y en niños de hasta 18 años con infección por T. cruzi48,49. Por ello, aunque en nuestro trabajo no se identificó ningún caso entre los 15 hijos estudiados de gestaciones previas, resulta lógico remitir a estos a las consultas de pediatría para la realización de cribado de EC.
La baja representación de gestantes procedentes de la mayoría de países endémicos de EC es la principal limitación a la hora de interpretar los resultados de nuestro estudio. Esto se aprecia en el relativamente pequeño número de mujeres originarias de Colombia y de Brasil, ya que aunque son un colectivo numeroso en Vizcaya (20 y 11,8%, respectivamente, de las mujeres originarias de Latinoamérica)10, suponen solo el 13,3 y 7,4% de las participantes, un porcentaje inferior a lo esperado que sugiere cierto sesgo en la selección de la muestra con una sobrerrepresentación de mujeres originarias de Bolivia. Sería interesante confirmar estos resultados mediante estudios epidemiológicos más amplios que incluyeran un mayor número de gestantes procedentes de otros países menos representados en este trabajo, mejorando asimismo los detalles técnicos como la utilización de la observación directa de parásito tras concentración en el recién nacido (técnica de hematocrito) y la optimización de la PCR (utilización de tampón de guanidina/EDTA e inclusión de control interno) para estudiar la parasitemia materna.
En conclusión, dado que la transmisión vertical de la EC no puede ser prevenida pero el tratamiento de los neonatos infectados es muy eficaz, parece razonable identificar a las mujeres gestantes con mayor riesgo de presentar infección por T. cruzi. De nuestros datos podría deducirse la utilidad de realizar un cribado a las mujeres embarazadas basado en una encuesta epidemiológica centrada fundamentalmente en la identificación del origen geográfico y de los factores epidemiológicos relacionados con la transmisión vectorial, aunque otros autores proponen el cribado universal de gestantes procedentes de zona endémicas como medida idónea. Por ello sería necesaria la realización de estudios epidemiológicos más amplios que incluyan gestantes procedentes de todos los países endémicos y que comparen la efectividad de cribados basados en encuestas epidemiológicas frente al cribado universal.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Agradecemos al Dr. A. Martinez-Berriotxoa su ayuda en la elaboración del manuscrito, al Servicio de Microbiologia del Hospital de Basurto su asistencia técnica y a las matronas pertenecientes a los ambulatorios del área estudiada su colaboración durante la realización del estudio.