Los objetivos de este estudio son determinar la prevalencia de las infecciones por Acinetobacter baumannii resistente a carbapenemas (ABRC) en España, su tendencia, diferencias geográficas, e identificar factores asociados a su resistencia.
MétodosSe analizaron las encuestas anuales del estudio de prevalencia EPINE (1999-2005), incluyendo la localización de la infección, los cultivos y sus resistencias antibióticas, y las características de los pacientes y de los hospitales.
ResultadosParticiparon 246 hospitales/año. Se identificaron 1.168 aislamientos de A. baumannii (tasa de prevalencia de infecciones por A. baumannii de 3/1.000). El 14% correspondieron a infecciones de inicio en la comunidad. La tasa de resistencia a carbapenemas fue del 34,5% (intervalo de confianza del IC95% [IC 95%]: 31,8-37,3) y del 43,8% (IC 95%: 38,9-48,7) en unidad de cuidados intensivos. Se observó una mayor resistencia en las comunidades autónomas de la zona centro. Las infecciones respiratorias (43%) y las bacteriemias asociadas a dispositivo (47,6%) se asociaron a una mayor tasa de resistencia (p=0,003). Los principales factores asociados a ABRC son los procedimientos quirúrgicos o de traqueotomía, la utilización de dispositivos invasivos, tales como la sonda urinaria o nasogástrica, los catéteres venosos centrales y la ventilación mecánica, así como el sexo varón y la presencia de úlceras por presión.
ConclusionesLa prevalencia de ABRC es muy elevada y se encuentran diferencias por zonas geográficas, y por areas de hospitalización. Determinados procedimientos invasivos, así como el sexo varón y las úlceras por presión, se encuentran asociados a una mayor tasa de resistencia carbapenemas.
This study determines the prevalence of infections by carbapenem-resistant Acinetobacter baumannii (CRAB) in Spain, and identifies trends over time, geographical variations, and factors associated with resistance.
MethodsYearly prevalence surveys (EPINE, Estudio de Prevalencia de las Infecciones Nosocomiales en España) during 1999 to 2005 were analyzed, including data on the site of infection, culture, and antimicrobial susceptibility, and characteristics of the patients and hospitals.
ResultsOn average, 246 hospitals/year participated in the survey. A total of 1168 A. baumannii isolates were identified, yielding an infection prevalence rate of 3/1,000 hospitalized patients. Fourteen percent of isolates were related to community-onset infections. The most frequent sites of infection were the respiratory tract (42.2%), surgical wound (15.1%), urinary tract (12.9%), and skin (11.7%).
Rate of carbapenem resistance was 34.5% (95% CI, 31.8-37.3), and was even higher among ICU patients (43.8%; 95% CI, 38.9%-48.7%). There were considerable differences between Spanish regions, with the highest rates of resistance in central regions.
Higher resistance rates were observed in respiratory tract infections (43%) and catheter-related bacteremia (47.6%) than among other sites of infection (P =.003). Main factors associated with CRAB identified by multivariate analysis were surgical or tracheostomy procedures, use of invasive devices such as urinary, nasogastric, or central venous catheters, and mechanical ventilation, as well as male gender and pressure sores.
ConclusionsThe prevalence of CRAB in Spain is very high. Differences in resistance rates have been observed according to geographic region and area of hospitalization. Several invasive procedures, as well as male gender and pressure sores, are associated with higher rates of carbapenem resistance.
Acinetobacter spp. es un bacilo gramnegativo aerobio no fermentador de la glucosa que origina infecciones especialmente en el ámbito hospitalario y que puede sobrevivir durante largos períodos de tiempo en el ambiente y en las manos de los trabajadores sanitarios1-3. La proporción de infecciones asociadas a los servicios sanitarios causadas por Acinetobacter spp. ha aumentado en las últimas décadas4. Además, las infecciones por Acinetobacter se han hecho muy difíciles de tratar debido a la emergencia de cepas resistentes a todos o a casi todos los fármacos antimicrobianos más comúnmente prescritos5-7. Estas cepas resistentes a múltiples antimicrobianos, y especialmente a los carbapenemas, son en ocasiones únicamente sensibles a las polimixinas (colistina y polimixina B), antimicrobianos que no han sido muy utilizados durante décadas y que son más tóxicos que otros antibióticos utilizados más frecuentemente. Se han descrito brotes hospitalarios por Acinetobacter resistente a carbapenemas (ABRC) por todo el mundo y recientemente se ha identificado que el efecto de estas infecciones por Acinetobacter multirresistente incrementa la duración de la hospitalización8.
Los objetivos del estudio fueron determinar la prevalencia de infecciones por Acinetobacter baumannii, y su tasa de resistencia a carbapenemas en los pacientes hospitalizados en nuestro país, así como identificar tendencias temporales, diferencias geográficas y factores asociados a dicha resistencia.
MétodosEl estudio EPINE se estableció en el año 1990 y desde entonces viene realizando anualmente una encuesta nacional de prevalencia en hospitales españoles. Desde el año 1999 se incluyeron datos de las resistencias a los antimicrobianos. La participación en el estudio EPINE es voluntaria y se realiza en todas las áreas de los hospitales de enfermos agudos donde los pacientes son hospitalizados. El estudio es transversal y mide prevalencia puntual. Incluye información de todos los pacientes hospitalizados y de todas las infecciones que presenten en cualquier localización de la infección. Las fuentes de obtención de los datos son las historias clínicas y las hojas de registro de enfermería, completadas con las pruebas de laboratorio y, cuando es necesario, la visita a los propios pacientes. Para el presente estudio incluimos los datos correspondientes a los pacientes estudiados durante el período 1999-2005 que presentaron infecciones por A. baumannii. La encuesta recoge la información relativa a la localización y fecha de de la infección, la etiología y la sensibilidad a las carbapenemas. La realización de la encuesta la lleva a cabo el personal del equipo de control de infecciones con la colaboración, a criterio de cada hospital, de personal sanitario entrenado para la recogida de datos. Además, el responsable del estudio de cada hospital realiza una validación de los datos previa a su incorporación a la base de datos nacional. Para la categorización de las infecciones se utilizaron las definiciones del Centers for Disease Control and Prevention (CDC) para infección hospitalaria9 con algunas modificaciones (p. ej., se incluye la bacteriemia secundaria como localización de la infección aunque corresponda a la extensión de otro foco primario de infección). Aquellas infecciones que estaban presentes en el momento del ingreso, o que se desarrollaron en las primeras 48 h tras el ingreso, en pacientes que no procedían de una institución hospitalaria se clasificaron como de inicio en la comunidad. Asimismo, se recogió de todos los pacientes información demográfica; de la presencia de potenciales factores de riesgo intrínseco de infección (insuficiencia renal, coma, neoplasia, neutropenia, cirrosis, enfermedad pulmonar obstructiva crónica, inmunodeficiencia, obesidad, desnutrición, diabetes mellitus y la presencia de úlceras por presión)10; de factores de riesgo extrínseco de infección que estuvieran presentes en el momento de la encuesta (utilización de vías venosas centrales, sonda urinaria, traqueotomía, ventilación mecánica, sonda nasogástrica), o de intervención quirúrgica previa. Los hospitales se clasificaron por su tamaño en pequeños (< 200 camas), medianos (200-500 camas) y grandes (> 500 camas). En cada hospital colaborador de EPINE, los laboratorios de microbiología realizaron las pruebas de sensibilidad a imipenem y/o meropenem por los métodos estándares y clasificaron los microorganismos como resistentes, intermedios o sensibles con criterios internacionales (Clinical and Laboratory Standards Institute [CLSI], anteriormente National Committee for Clinical Laboratory Standards [NCCLS])11. Sólo se incluyeron como resistentes los aislados que mostraron resistencia a imipenem o en los que se indicaba genéricamente resistencia a carbapenemas.
Para valorar las diferencias entre porcentajes se utilizaron las pruebas estadísticas de la chi al cuadrado, chi al cuadrado para tendencias y, además, se calcularon las odds ratios (OR) de prevalencia. Para identificar los factores asociados independientemente al desarrollo de infección por ABRC se realizó un análisis univariante con las variables de tamaño de hospital, año de la encuesta, datos demográficos de los pacientes y los potenciales factores de riesgo intrínseco o extrínseco, comparando a los pacientes con infección por ABRC con el resto de infectados por A. baumannii. Posteriormente, se realizó un análisis multivariante, con la infección por ABRC como variable dependiente, mediante el desarrollo de un modelo de regresión logística múltiple por un procedimiento paso a paso hacia atrás con las variables que mostraron asociación significativa en el análisis univariante a un nivel de p < 0,2. Todos los test se consideraron significativos para un valor de p < 0,05 a dos colas.
ResultadosDurante el período 1999-2005 un promedio de 246 hospitales participaron anualmente en la encuesta. En total, se identificaron 50.069 aislamientos bacterianos, de los cuales 1.168 correspondieron a A. baumannii (2,3%), con una prevalencia de infecciones por A. baumannii de 3 por cada 1.000 pacientes hospitalizados. Tan sólo 170 (14,6%) de los aislamientos correspondieron a infecciones de inicio en la comunidad. Del total de aislamientos, los más frecuentes correspondieron a infecciones de las vías respiratorias, seguido de las infecciones quirúrgicas, urinarias y cutáneas (tabla 1).
Distribución de Acinetobacter baumannii por localización de la infección
| Total N (%) | |
| Respiratorias | |
| Neumonía | 200 (17) |
| Infección respiratoria de las vías bajas | 285 (24) |
| Quirúrgicas | |
| Superficial | 54 (5) |
| Profunda | 81 (7) |
| De órgano o espacio | 38 (3) |
| Tracto urinario | 148 (13) |
| Infección cutánea y tejidos blandos | 134 (11) |
| Bacteriemias | |
| Primarias | |
| De origen desconocido | 38 (3) |
| Asociada a dispositivo | 42 (4) |
| Secundarias | 32 (3) |
| Otras | 116(10) |
| Total | 1.168 (100) |
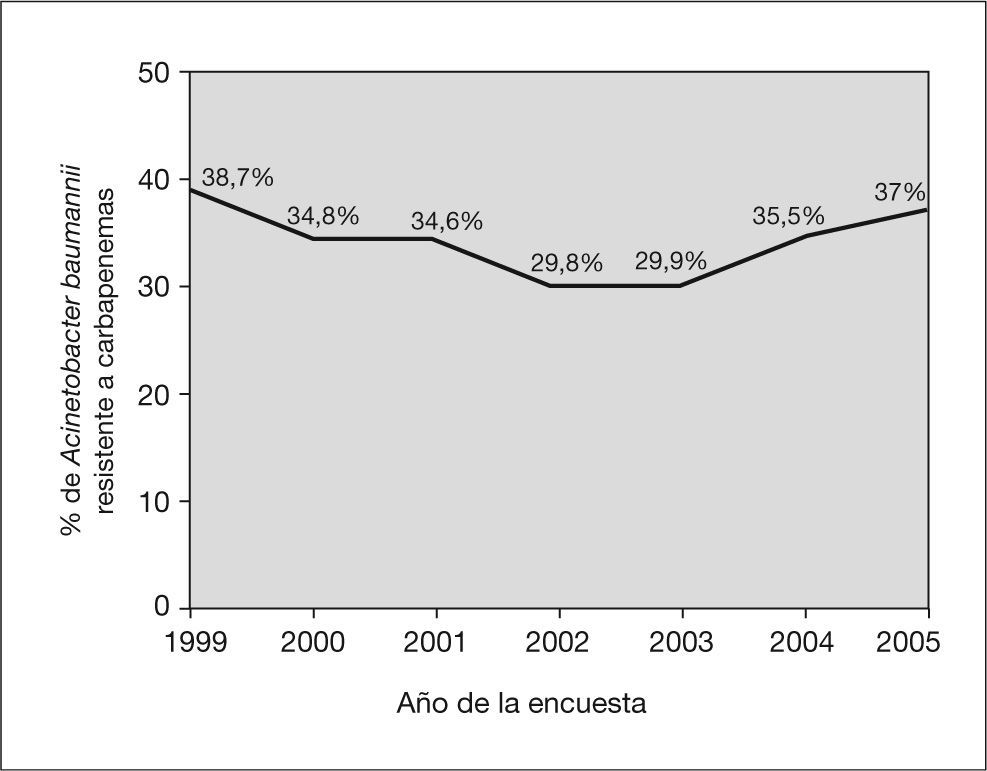
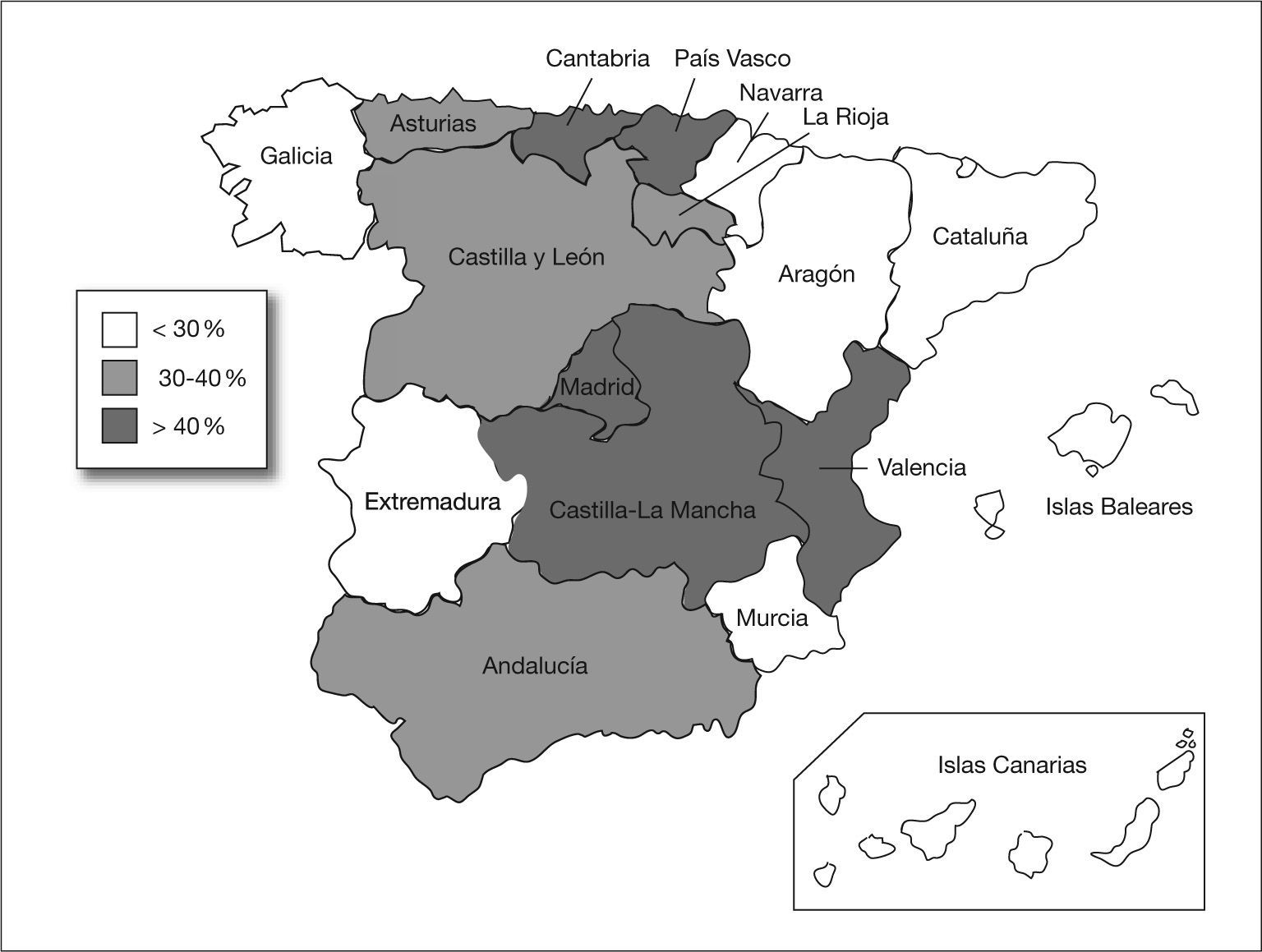
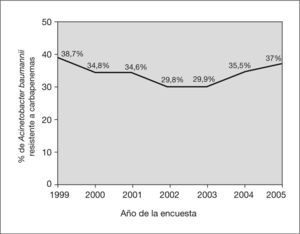
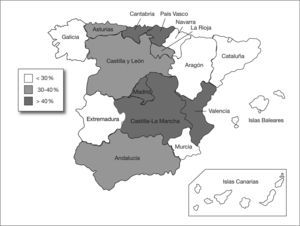
En total se identificaron 403 aislamientos de ABRC, alcanzando una tasa de resistencia a carbapenemas del 34,5% (IC 95%: 31,8-37,3). Esta tasa disminuyó desde el año 1999 (38,7%) hasta el año 2002 (29,8%), y posteriormente experimentó un incremento gradual hasta alcanzar el 37% en el año 2005. No se observaron tendencias temporales lineales significativas durante el período de estudio (fig. 1). Por comunidades autónomas se observaron amplias diferencias con Madrid, Castilla-La Mancha, Valencia, Cantabria y el País Vasco a la cabeza (fig. 2). Los pacientes con aislamientos comunitarios mostraron un promedio de edad de 62,6 ± 19,8 años (media ± desviación estándar [DE]) frente a 58,8 ± 19,3 años en los de inicio hospitalario (p = 0,006).
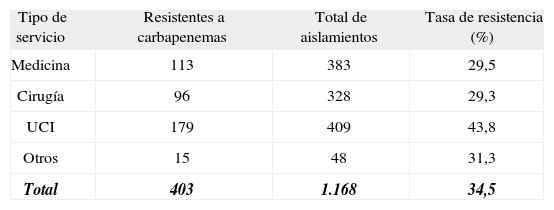
La resistencia a carbapenemas fue superior en las infecciones nosocomiales (38,2%; IC 95%: 35,1-41,4) que en las de inicio comunitario (18,8%; IC 95%: 13,2-25,5) (OR: 2,0; IC 95%: 1,3-3,0). Los hospitales pequeños obtuvieron tasas de resistencia inferiores a las de los hospitales medianos y grandes (30,4% frente al 35,6% y al 35,7%; p = 0,31), pero sin alcanzar significación estadística. Por áreas de asistencia la tasa de resistencia fue significativamente superior en las unidades de cuidados intensivos (UCI) (43,8%; IC 95%: 38,9-48,7) que en el resto de las áreas (rango: 29-31%; p < 0,001) (tabla 2).
Tasas de resistencia de Acinetobacter baumannii a carbapenemas por tipo de servicio
| Tipo de servicio | Resistentes a carbapenemas | Total de aislamientos | Tasa de resistencia (%) |
| Medicina | 113 | 383 | 29,5 |
| Cirugía | 96 | 328 | 29,3 |
| UCI | 179 | 409 | 43,8 |
| Otros | 15 | 48 | 31,3 |
| Total | 403 | 1.168 | 34,5 |
p < 0,001.
UCI: unidades de cuidados intensivos.
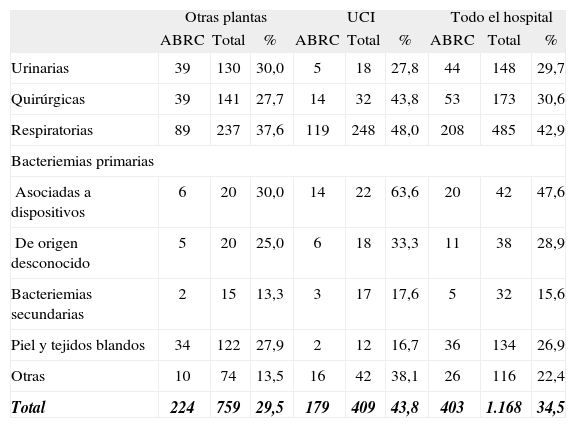
Las infecciones respiratorias (neumonías e infecciones de las vías respiratorias) y las bacteriemias asociadas a dispositivo se asociaron a una mayor tasa de resistencia que el resto de las localizaciones de infección (p = 0,003) (tabla 3).
Tasas de resistencia de Acinetobacter baumannii a carbapenemas por localización de la infección y área de cuidados
| Otras plantas | UCI | Todo el hospital | |||||||
| ABRC | Total | % | ABRC | Total | % | ABRC | Total | % | |
| Urinarias | 39 | 130 | 30,0 | 5 | 18 | 27,8 | 44 | 148 | 29,7 |
| Quirúrgicas | 39 | 141 | 27,7 | 14 | 32 | 43,8 | 53 | 173 | 30,6 |
| Respiratorias | 89 | 237 | 37,6 | 119 | 248 | 48,0 | 208 | 485 | 42,9 |
| Bacteriemias primarias | |||||||||
| Asociadas a dispositivos | 6 | 20 | 30,0 | 14 | 22 | 63,6 | 20 | 42 | 47,6 |
| De origen desconocido | 5 | 20 | 25,0 | 6 | 18 | 33,3 | 11 | 38 | 28,9 |
| Bacteriemias secundarias | 2 | 15 | 13,3 | 3 | 17 | 17,6 | 5 | 32 | 15,6 |
| Piel y tejidos blandos | 34 | 122 | 27,9 | 2 | 12 | 16,7 | 36 | 134 | 26,9 |
| Otras | 10 | 74 | 13,5 | 16 | 42 | 38,1 | 26 | 116 | 22,4 |
| Total | 224 | 759 | 29,5 | 179 | 409 | 43,8 | 403 | 1.168 | 34,5 |
ABRC: Acinetobacter baumannii resistente a carbapenemas; UCI: unidades de cuidados intensivos.
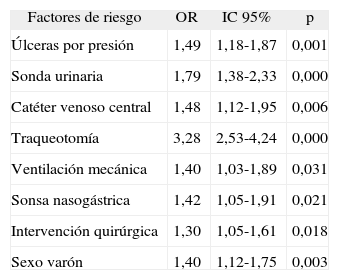
Numerosos factores de riesgo extrínseco se encontraron asociados significativamente a mayor tasa de resistencia a las carbapenemas: la presencia de vía venosa central (OR: 2,1), la traqueotomía (OR: 1,9), la ventilación mecánica (OR: 1,9), la sonda nasogástrica (OR: 1,8) y la intervención quirúrgica (OR: 1,3). Los únicos factores de riesgo intrínseco asociados significativamente a mayor resistencia fueron el sexo varón (OR: 1,2) y la presencia de úlceras por presión (OR: 1,4). La distribución de resistencias por grupos muestra un máximo en el grupo de edad de los 46-55 años (40,1%) y un patrón descendente a partir de ese grupo etario hasta un mínimo en los mayores de 85 años (18,2%), aunque sin alcanzar significación estadística.
Los resultados del análisis multivariante por regresión logística múltiple de los factores asociados a resistencias se muestran en la tabla 4.
Factores asociados a infección por Acinetobacter baumannii resistente a carbapenemas. Análisis multivariante por regresión logística múltiple
| Factores de riesgo | OR | IC 95% | p |
| Úlceras por presión | 1,49 | 1,18-1,87 | 0,001 |
| Sonda urinaria | 1,79 | 1,38-2,33 | 0,000 |
| Catéter venoso central | 1,48 | 1,12-1,95 | 0,006 |
| Traqueotomía | 3,28 | 2,53-4,24 | 0,000 |
| Ventilación mecánica | 1,40 | 1,03-1,89 | 0,031 |
| Sonsa nasogástrica | 1,42 | 1,05-1,91 | 0,021 |
| Intervención quirúrgica | 1,30 | 1,05-1,61 | 0,018 |
| Sexo varón | 1,40 | 1,12-1,75 | 0,003 |
IC: intervalo de confianza; OR: odds ratio.
Nuestro estudio ha valorado la magnitud de la frecuencia de la resistencia de A. baumannii a carbapenemas en una amplia muestra de hospitales españoles que representan a más de la mitad de la población hospitalizada en España, durante un período de 7 años. La prevalencia de infecciones encontrada es de 3,0 casos por 1.000 pacientes hospitalizados, y la proporción de A. baumannii sobre el total de microorganismos se incrementó durante el período del estudio del 2,8 al 3,5%, una tendencia que no ha dejado de crecer desde el año 1990 (1,4%)12. La prevalencia es similar a la incidencia encontrada en una muestra de hospitales españoles durante el año 2000 (3,0 casos/1.000 ingresos)13.
Cabe señalar que el 15% de las infecciones fueron de inicio comunitario. Esta prevalencia al ingresar es muy importante y debería confirmarse. Dado que la definición de infección de inicio comunitario es arbitraria e incluye aquellas infecciones que se manifiestan en las primeras 48 h tras el ingreso, es difícil conocer si algunos de estos pacientes adquirieron la infección tras el ingreso. Además, dada la naturaleza de la encuesta, tampoco se pudo identificar qué proporción de esos pacientes había recibido atención en instituciones sanitarias en los meses precedentes, por lo que la verdadera prevalencia de infecciones estrictamente comunitarias (de cepas que circulan en pacientes sin contacto previo con instituciones sanitarias) probablemente esté sobreestimada y deben establecerse estudios especialmente diseñados para determinarla.
Una parte importante de estas infecciones estaba presente en pacientes ingresados en UCI (35%), pero la mayor parte se distribuyó por las áreas medicoquirúrgicas donde, en ocasiones, originó bacteriemias primarias o asociadas a catéter e incluso infecciones del sistema nervioso central en pacientes con procedimientos neuroquirúrgicos, lo que pone de manifiesto la importancia de este patógeno para desarrollar infecciones graves fuera de las UCI.
La tasa de resistencia a carbapenemas encontrada en las infecciones por A. baumannii es del 34,5%. Esta tasa, aunque inferior a la publicada para una muestra de hospitales españoles durante el año 2000, es muy elevada13. Las diferencias encontradas en ambos estudios pueden ser debidas a múltiples factores, ya que sus diseños son muy dispares. A diferencia del estudio de Rodríguez-Baño et al13, el presente estudio incluye solamente infecciones y no colonizaciones, se realiza en un período de tiempo de 7 años y recoge información de más de 240 hospitales por año, con un tamaño muestral de más de 1.000 infecciones. Otro posible factor que podría explicar esta diferencia encontrada en ambos estudios es la posibilidad de que se hayan clasificado como A. baumannii otras especies de Acinetobacter menos resistentes a las carbapenemas y que son indiferenciables por los métodos habituales14. Otros autores han encontrado tasas de resistencia a carbapenemas en Europa, para períodos anteriores, entre el 20 y el 30%15,16.
Nuestro estudio encuentra una tasa de resistencias en los pacientes hospitalizados en UCI (43,8%) superior a la del resto de las áreas del hospital. Este fenómeno es conocido, puesto que los factores de riesgo comúnmente asociados a ABRC (gravedad de la enfermedad, dispositivos invasivos, ventilación mecánica, tratamientos antibióticos previos, nutrición enteral, hospitalizaciones prolongadas) son más frecuentes en esta población de pacientes que en la de otras áreas del hospital17. Estas tasas son, asimismo, superiores a las encontradas en un estudio en UCI españolas durante el período 1997-2003 (35%)18, aunque nuestra muestra incluye pacientes posteriores al año 2003, período en el que hemos observado un incremento de las resistencias y representa a más de 240 hospitales. Pero además, son mucho mayores que las encontradas en UCI de Estados Unidos (20%) y de otros países europeos19,20. Otro factor diferencial que hay que tener en cuenta a la hora de comparar con otros estudios en UCI es que EPINE mide la tasa de resistencia de las infecciones de cualquier localización que están siendo atendidas en la UCI y no únicamente las que se inician en esas unidades y están asociadas a procedimientos invasivos.
La prevalencia de resistencia no se distribuye homogéneamente por las diferentes comunidades autónomas españolas. Se observa una mayor tasa de resistencia en las comunidades del centro geográfico, a excepción de un par del litoral cantábrico (fig. 2). Estas tasas por comunidades deben tomarse con cautela, pues corresponden a promedios de diferentes años e instituciones. Además, y debido a que A. baumannii es un patógeno que con frecuencia se asocia a brotes hospitalarios, la precisión de los indicadores para los diferentes subgrupos es menor que para el total nacional, por lo que no son válidos para predecir el nivel de resistencia en un hospital o zona geográfica determinada.
La distribución de A. baumannii asociada con las diferentes localizaciones de infección (tabla 1) muestra que más del 40% de los aislamientos correspondieron a infecciones respiratorias (42%), seguidas en frecuencia por las quirúrgicas (15%) y las infecciones del tracto urinario y las de piel y tejidos blandos, y concuerda con la de estudios previos13. Además, la resistencia a carbapenemas es más elevada en las infecciones respiratorias y bacteriemias asociadas a dispositivos que en el resto de las infecciones (tabla 3). Esta mayor resistencia en las muestras respiratorias ya ha sido observada previamente, aunque se desconocen sus causas21, pero podría estar en relación con un mayor inóculo bacteriano y con la mayor probabilidad de selección de variantes resistentes. En parte, también podría estar explicada por la mayor frecuencia de las infecciones respiratorias o bacteriemias asociadas a dispositivos en pacientes en UCI, donde las tasas de ABRC son superiores (tabla 3). Como cabía esperar por las diferencias en la prevalencia de factores de riesgo de infección, la tasa de resistencia a carbapenemas para las infecciones hospitalarias fue mayor que para las de inicio comunitario (OR: 2,0), algo similar a lo que ocurre para las resistencias de Staphylococcus aureus a la oxacilina22.
De todos los potenciales factores asociados a infección por ABRC estudiados, a excepción del sexo varón y la presencia de úlceras por presión, el resto son factores relacionados con operaciones quirúrgicas o dispositivos médicos invasivos utilizados con los pacientes (sonda urinaria o nasogástrica, catéter venoso central [CVC], traqueotomía y ventilación mecánica). Todos estos factores concuerdan con los de estudios previos y están presentes con mayor frecuencia en los pacientes de UCI6,23-26. No obstante, en nuestro estudio no se pudieron evaluar los antecedentes de tratamiento antibiótico previo, ni dispusimos de una escala de gravedad del paciente en el momento del ingreso, factores previamente identificados con un mayor riesgo de ABRC. Además, al tratarse de una serie de estudios de prevalencia concreta, la atribución de factores de riesgo a exposiciones presentes en el momento de la infección impide garantizar que la causa precede al efecto.
El estudio presenta algunas limitaciones. Como la identificación de A. baumannii por métodos moleculares no se realiza habitualmente en la práctica asistencial, cabe la posibilidad de que algunos de los aislados clasificados como A. baumannii no lo fueran. Además, no existe garantía de que todos los hospitales participantes estén realizando las pruebas de sensibilidad siguiendo estrictamente los criterios de CLSI. Sin embargo, tanto la identificación de la especie, como la valoración de la sensibilidad y de la resistencia por los laboratorios de microbiología de los hospitales son la misma fuente de información de que disponen los clínicos a la hora de evaluar las infecciones y el tratamiento de los pacientes. Además, y puesto que en numerosos laboratorios se realiza de forma sistemática el estudio de sensibilidad a una de las dos carbapenemas, imipenen y meropenem, las posibles discrepancias en la resistencias a ambos fármacos descritas en otros estudios no han podido ser valoradas aquí27.
Otra limitación del estudio, común a los estudios de prevalencia, es que los pacientes con estancias más largas están sobrerrepresentados y que la estimación de la tasa de resistencia se ve afectada además por la duración de la infección. En la medida en que la duración de la estancia, o de la infección, sea inferior en los pacientes con infección por A. baumannii sensible que en los pacientes con infección por ABRC, la tasa de resistencia a carbapenemas estará sobreestimada.
Para concluir, la estimación de la prevalencia de infecciones por A. baumannii, su resistencia a carbapenemas, tendencias y distribución geográfica son útiles para evaluar la carga asociada a estas infecciones. La creciente prevalencia de este patógeno, así como la elevada prevalencia de resistencias a carbapenemas encontrada es un problema grave en nuestro país, con trascendencia para la seguridad de los pacientes y para el coste de la asistencia sanitaria.
AgradecimientosEste estudio estuvo financiado en parte por el Fondo de Investigación Sanitaria, del Ministerio de Sanidad y Consumo, beca PI20765 FIS.
Grupo de trabajo EPINE. Coordinadores en los hospitales (2005)Andalucía: M.A. Torres, P. Blasco, F. Garrachón, A. Domínguez, F. Calbo, S. Oña, D. Román, J. Fernández-Crehuet, F. López, R. Varela, M.D. Pérez Ramírez, S. Oliver, J.L. Martín Ruiz, E. Fernández Molle, J. Bajo, J.A. Zafra, S. Dueñas, G. Ramiraz, C. Caballero, J.A. Lepe, M. D. Sureda, J. Chamorro, J.M. Domínguez, M.I. Galán. Aragón: M.J. Hernández, J.L. Arribas, J.I. Barrasa, S. Pastor, P. Prieto, P. Egido. Asturias: T. Fernández Gala, P. Prendes, A. Torreblanca, P. Fernández Fuentes, C. Natal, F. Hidalgo. Baleares: O. Hidalgo, A.M. Sureda,J. Sánchez Gómez. Canarias: G. López, M.A. Figuerola, C.M. García Rodríguez, P.E. Barrera, V. Hernández Vaquero, R.M. Gallardo,T. Montserrat Blasco, J. Molina. Cantabria: F.M. Antolín, J.A. Sanz, T. Dierssen. Castilla-La Mancha: E. Muñoz, A. Biurrún, S. Illescas, M.R. Sánchez Blanqué, M. Lizán, A.F. Hita, E. García Puente, S. de Juan, I. Sánchez Ruiz, M.C. Romero, M.M. Gómez. Castilla-León: J.L. Vaquero, N. Coladas, L.M. Sanz, M.C. Sanz, M.C. Sáenz, M. Vázquez Salvado, G. Fernández Quintana, A. García, J. Lozano, F. Piniella, J.A. Marcos Pérez, E. Robles, C. Carrillo, M.M. Jiménez, M.D. García Arcal, M.I. Santos, M.S. Martínez. Cataluña: M. Campins, J.M. Sánchez, L. Armadans, A. Trilla, M.D. Salvia, J. Tuyet, N. San Juan, M. Segarra, F. Rosell, C. Latorre, J. Martínez Montauti, M. González Vázquez, I. Casas, M.G. Esteve, A. Espí, I. Fort, M.G. Serrate, M.A. Gasós, F. Corcoy, L. Force, R. Pérez Vidal, J.M. Marcos, M. Esquius, M.A. García Flores, J.A. Hernández, J. Cuquet, J. Vilaró, A.M. Lizándara, A. Vilamala, J.M. Baucells, L. Gavaldá, J. Gené, J. Bisbe, C. García Tejero, J. Matesanz, A.A. Serna, A.A. Manonelles, M. Olona, X. Raga, J.M. Calbet, F. Ballester, T. Sans Mateu, J. Rebull, J. Galbany. Extremadura: A.A. Cerrillo, P. Stoduto, F. Suero, P. Aguirre, E. Benítez Cano, P. Hernández. Galicia: J.M. Fernández Naveiro, J.J. Gestal, V. Domínguez, M.D. Rodríguez Mayo, M. Posada, B. Uriel, M.J. Pereira, M. Cueto, V.M. del Campo, R.M. Fungeiriño, JC Quintas, P Alonso, J Uribe, MN Zorrilla. La Rioja: C. Belio. Madrid: J. García Caballero, R. Herruzo, A. Asensio, M.A. Blanco, B. Pérez Gorricho, F. Jaén, J.R. Méndez, F.M. Dávila, S. García de San José, M. Baquero, R. Díez, J.A. Vicente, J. Gómez, T. Sayalero, T. Pascual, J.R .Villagrasa, M.P. González Sánchez, C. Martín. Murcia: F. Botía, J.A. García Henarejos, V. Martínez, S. Nicolás, A. López Paredes, M. López Yepes, A. Más Castillo. Navarra: J.I. Sainz, M. Torres, J. García de Jalón, B. Sábada. Comunidad Valenciana: A. Hernández Galve, L. Segarra, E. Castellano, R. Ortí, R. Llucián, M. Tejeda, V. Zanón, D.M. Pérez, M.J. Torres, J. Sánchez Payá, J.F. Navarro, A.A. González Torga, T. Aparicio, J.M. López Lozano, C. Castañ, J. Brau, F.J. Pardo. País Vasco: J.L. Novales, J.R. Sáenz Domínguez, J.M. Arévalo, R. Núñez, M. Elósegui, H. Gómez, B. Carrandi, J.I. Villate, M.J. Arroyo, L. Elorduy, G. Martín, C. Canduela, F.J. Collado, A. Cabarcos, V. Riaño.