Las infecciones fúngicas invasoras (IFI) por hongos filamentosos siguen teniendo cifras de mortalidad elevadas como consecuencia de las dificultades para diagnosticarlas precozmente y de las limitaciones terapéuticas. Por ello, una de las estrategias más adecuada es evitar que los enfermos con factores de riesgo contacten con las conidias de Aspergillus y de otras especies de hongos filamentosos. Este documento describe las recomendaciones sobre la prevención de la infección fúngica invasora por hongos filamentosos realizadas por un grupo de expertos españoles pertenecientes a diferentes especialidades médicas y profesionales. El texto revisa la incidencia de infección fúngica invasora en distintos grupos de población e incluye la discusión de cuestiones relacionadas con medidas ambientales de prevención, medidas de control de la infección nosocomial, medidas especiales y adicionales de prevención, medidas de prevención fuera del hospital y la profilaxis farmacológica.
Invasive fungal infections (IFI) due to filamentous fungi still have high rates of mortality associated with the difficulties of early detection of the infection and their therapeutic limitations. Consequently, a useful approach is to prevent patients at risk of fungal infection from getting in contact with conidia of Aspergillus and other mould species. This document describes the recommendations to prevent IFI due to filamentous fungi, prepared by Spanish experts from different medical and professional fields. The paper reviews the incidence of the IFI in different risk populations and the questions related to environmental measures of prevention, control of hospital infections, additional procedures for prevention, prevention of IFI outside hospitals, as well as antifungal prophylaxis.
La infección fúngica invasora (IFI) por hongos filamentosos, en particular la aspergilosis invasora (AI), se ha convertido en una infección de elevada prevalencia en algunos grupos de enfermos con factores predisponentes. Las conidias de Aspergillus y de otras especies de hongos filamentosos se encuentran en suspensión en el aire, por lo que son inhaladas continuamente y colonizan las superficies corporales con frecuencia1.
La IFI sigue teniendo cifras de mortalidad elevadas en parte como consecuencia de las dificultades para diagnosticarla precozmente y también a causa de las limitaciones terapéuticas que siguen existiendo en la actualidad. Por ello, una de las estrategias más adecuada es minimizar que los enfermos con factores de riesgo contacten con las conidias de Aspergillus y de otras especies de hongos filamentosos2,3.
El Grupo de Estudio de Micología Médica (GEMICOMED) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) consideró que era necesario elaborar un documento con recomendaciones sobre la prevención de la IFI por hongos filamentosos, que contestara las cuestiones que se plantean a diario en la práctica clínica. Para ello, se invitó a expertos de diversos grupos de estudio y sociedades científicas, pertenecientes a diferentes especialidades médicas y profesionales, implicados en el control de la IFI.
El documento se ha estructurado en 6 bloques. En primer lugar, se ha incluido una breve revisión sobre la epidemiología de la IFI con la definición de poblaciones de riesgo según la incidencia de la infección. Tras ello, se han añadido cinco bloques articulados en preguntas, respuestas y niveles de recomendación. Los cinco bloques son:
- 1.
Medidas ambientales de prevención.
- 2.
Medidas de control de la infección nosocomial.
- 3.
Medidas especiales y adicionales de prevención.
- 4.
Medidas de prevención fuera del hospital.
- 5.
Profilaxis farmacológica.
La pretensión de los expertos ha sido elaborar un documento práctico, que intente contestar las cuestiones a las que se enfrentan los profesionales sanitarios a la hora de diseñar estrategias de prevención de la IFI. En la tabla 1 se definen los niveles de recomendación utilizados. En la tabla 2 se incluyen las respuestas a las preguntas planteadas con los niveles de evidencia, según las recomendaciones específicas de los expertos.
Clasificación de las recomendaciones de las medidas a tomar en la prevención de la IFI según los niveles de evidencia
| Categoría de la evidencia | Definición |
| Categoría IA | Evidencia firme apoyada por estudios experimentales, clínicos o epidemiológicos bien diseñados. Siempre se deben instaurar |
| Categoría IB | Evidencia firme apoyada por estudios experimentales, clínicos o epidemiológicos o una firme evidencia teórica. Se deben instaurar en la mayoría de las ocasiones |
| Categoría IC | Requerida por leyes estatales o autonómicas o incluidas en un estándar de aplicación nacional o europeo |
| Categoría II | Evidencia moderada apoyada por estudios clínicos o epidemiológicos o evidencias teóricas. Se deben instaurar en algunos casos |
| Sin resolver | No se ofrece recomendación ya que no hay consenso o no existe evidencia suficiente |
Resumen de las recomendaciones específicas realizadas por el panel de expertos para prevenir la infección fúngica invasora (IFI) por hongos filamentosos
| Clase de medida | Cuestión | Recomendación | Nivel de evidencia |
| Medidas ambientales de prevención | 1. ¿Cuál es la concentración habitual de esporas en el aire hospitalario? | Se deben realizar estudios en cada centro para conocer la concentración normal y detectar aumentos significativos. Recuentos superiores a 25UFC/m3 pueden considerarse muy elevados | II |
| 2. ¿Qué características deben cumplir las instalaciones con aire protegido? | Deben ser independientes del resto del hospital, con climatización continua y filtrada a través de filtros absolutos HEPA y con al menos 12 recambios de aire a la hora | IA | |
| 3. ¿Qué áreas hospitalarias deben tener aire protegido? | Las habitaciones protegidas para enfermos con inmunodeficiencias graves y los quirófanos. Otras instalaciones como las UCI deben mantener al menos un sistema de sobre presión | IA | |
| 4. ¿Cómo debe analizarse la calidad del aire protegido? | Algunas instituciones y comunidades autónomas recomiendan controles periódicos del número de conidias de hongos filamentosos ambientales. Complementariamente pueden utilizarse recuentos de de partículas contenidas por unidad de volumen de aire según UNE100713 (tabla 4) | IC | |
| 5. ¿Cuándo deben hacerse controles microbiológicos del aire? | Se recomienda realizar cultivos ambientales cuando lo exige la legislación vigente y cuando aparecen casos de IFI por hongos aéreos o cuando hay obras de remodelación o de mantenimiento. No obstante, algunos expertos aconsejan realizar cultivos rutinariamente para comprobar el buen funcionamiento de la instalación, tanto en quirófanos como en habitaciones protegidas | IA | |
| 6. ¿Cuál es la concentración de UFC de hongos aceptable en el aire protegido? | El límite de UFC/m3 de aire es de 0,5, es decir, que como máximo se puede detectar una colonia de hongo filamentoso en una toma de 2m3 de aire | IC | |
| 7. ¿Cuál es la concentración de UFC de hongos aceptable en el aire no protegido hospitalario? | Existen variaciones según el estudio consultado. En condiciones normales deberían estar por debajo de 25UFC/m3 | II | |
| 8. ¿Tienen los cultivos rutinarios de vigilancia microbiológica alguna utilidad adicional? | Pueden ser útiles para conocer la integridad de los filtros de zonas protegidas, si bien el mantenimiento de los mismos es más importante. Puede ayudar a conocer focos de contaminación inesperados en centros sin instalaciones adecuadas. Permiten obtener mediciones históricas con las que compararse | II | |
| 9. ¿Se deben hacer cultivos microbiológicos del agua hospitalaria? | No existen recomendaciones sobre qué concentraciones de conidias son aceptables, por lo que no se recomienda la realización de cultivos de vigilancia del agua hospitalaria | Sin Resolver | |
| 10. ¿Quién debe tomar las decisiones de actuación sobre las medidas ambientales? | Toda institución sanitaria debe tener un Comité de Control y Evaluación del Riesgo de Infección que coordine las medidas a tomar en cada centro | IC | |
| Medidas de prevención de la infección nosocomial | 1. ¿Qué medidas de educación sanitaria se recomiendan? | El personal sanitario a cargo de pacientes en riesgo de IFI ha de recibir una formación específica sobre la epidemiología, los mecanismos de transmisión y las medidas de prevención y control de la infección | II |
| 2. ¿Qué medidas específicas de vigilancia se recomiendan? | Creación de un registro de casos de IFI que permita detectar aumentos de incidencia | II | |
| 3. ¿Deben hacerse cultivos de vigilancia en pacientes de riesgo o de materiales y equipos? | No han demostrado valor predictivo por lo que no se recomienda su realización | IB | |
| 4. ¿Qué pacientes deben hospitalizarse en habitaciones protegidas? | Pacientes con trasplantes alogénicos de progenitores hematopoyéticos o con neutropenias graves (menos de 100 células por mm3) de más de una semana de duración | IC | |
| 5. ¿Qué medidas de limpieza y desinfección se recomiendan en las áreas protegidas? | Deben limpiarse al menos dos veces cada día y siempre que haya un vertido accidental de líquidos, con productos limpieza convencionales. Debe realizarse una sanitización preventiva periódica con H2O2 u ozono | IC | |
| 6. ¿Pueden trasladarse los pacientes en riesgo por el hospital? | Deben restringirse al máximo la salida de las zonas protegidas. Si es inevitable, se debe colocar máscara respiratoria protectora FFP3 y evitar áreas en reformas o en obras | II | |
| 7. ¿Se deben tomar precauciones estándar adicionales para disminuir el riesgo de IFI? | No existen datos, pero se recomienda las precauciones habituales como vestuario exclusivo, guantes, máscaras y lavado de manos | Sin resolver | |
| 8. ¿Existen recomendaciones sobre la higiene personal de los pacientes ingresados con riesgo de IFI? | Deben usarse esponjas de un solo uso. Se desaconseja la ducha o el baño por la presencia de conidias. No existen datos sobre la eficacia preventiva de filtros en los grifos | IB | |
| 9. ¿Qué recomendaciones existen si se detectan casos o un brote de IFI? | Identificar si es de origen nosocomial. Realizar cultivos de enfermos y ambientales. Comprobar el estado de las instalaciones de aislamiento. Tipificación molecular de la cepas aisladas | IB | |
| Medidas especiales y adicionales de prevención | 1. ¿Qué recomendaciones deben darse en caso de tener enfermos con algún riesgo de IFI ingresados en zonas no protegidas en obras o con labores de mantenimiento? | No existen recomendaciones, pero la realización de recuentos de conidias podría ayudar. Concentraciones superiores a 25UFC/m3 pueden considerarse como elevadas y potencialmente asociadas a un incremento en el riesgo de IFI | II |
| 2. ¿Deben clasificar las obras hospitalarias por su riesgo de IFI? | Debe realizarse una estratificación de las obras que se realizan en el interior y exterior del hospital y adecuar las mediadas de prevención al grado de riesgo (tablas 6 y 7) | IC | |
| 3. ¿Cómo debe actuarse en cuanto a la prevención de la IFI ante una obra hospitalaria? | Debe crearse un grupo multidisciplinar integrado en la llamada Comisión de Obras, que debe trabajar conjuntamente con el Comité de Control y Evaluación del Riesgo de Infección | IC | |
| 4. ¿Debe hacerse alguna recomendación adicional en el plan de obra para prevenir la IFI? | Se debe elaborar una tabla-esquema (tipo tabla 7) con las medidas a tomar según el tipo de obra y el riesgo de infección | IC | |
| Medidas de prevención fuera del hospital | 1. ¿En qué pacientes se deben tomar medidas para prevenir la IFI de origen comunitario? | En paciente neutropénicos que van a su domicilio a pasar el periodo de aplasia. El riesgo aumenta con catéter vascular central, la nutrición parenteral ambulatoria, la colonización por levaduras o el tratamiento inmunosupresor | IB |
| 2. ¿Qué recomendaciones generales se deben hacer en estos enfermos ambulatorios? | Evitar zonas con obras, con labores de jardinería, con abundancia de polvo y baños y piscinas públicas. Si es inevitable se debe usar máscara de tipo FFP3 | IC | |
| 3. ¿Qué recomendaciones deben darse respecto al domicilio y vida cotidiana? | Extremar las medidas higiénicas del domicilio, lavados de manos frecuentes y usar esponjas individuales. Limitar el contacto con mascotas. Evitar las plantas ornamentales y los peluches. En paciente pediátricos se deben limpiar los juguetes | IC | |
| 4. ¿Hay recomendaciones sobre el tabaco? | Se debe prohibir fumar tabaco, marihuana y cannabis | IB | |
| 4. ¿Qué recomendaciones existen respecto a los alimentos? | Deben prohibirse por sus altos contenidos de conidias las especias, el té y otras hierbas para infusión, cervezas no pasteurizadas, las hierbas aromáticas, frescas o secas, que no hayan tenido un proceso de cocción de varios minutos y los quesos azules o aquellos con procesos de fermentación fúngica prolongada como el queso de Cabrales | IC | |
| 5. ¿Pueden realizarse más recomendaciones respecto al domicilio del enfermo? | No existen estudios definitivos, pero se puede recomendar la limpieza y control del sistema de climatización domiciliario. Evitar alfombras y moquetas. No usar aspiradores si no tienen un filtro HEPA. No se recomiendan realizar cultivos de vigilancia domiciliario ni instalar filtros en los grifos | Sin resolver |
HEPA: high efficacy particles aerosolized; IFI: invasión fúngica invasora; UFC: unidades formadoras de colonias.
Desde el principio de la década de los 90, se ha observado un incremento en la frecuencia de AI4. Las alteraciones en las defensas del huésped que favorecen la presencia de estas infecciones son muy variadas, aunque en términos generales, pueden destacarse tres tipos, la neutropenia, los déficit en la función fagocítica y las alteraciones en la inmunidad celular5.
Así pues, las poblaciones en riesgo de AI son las que se indican a continuación. En primer lugar, pacientes neutropénicos (<500neutrófilos/mm3 durante >10 días), como los que reciben quimioterapia por leucemia mieloide aguda (LMA) o síndrome mielodisplásico (SMD), donde la incidencia de aspergilosis se cifra entre el 10–24%3,6. Asimismo, personas sometidas a trasplante alogénico de progenitores hematopoyéticos (TPH)2,7,8, que tienen una incidencia de la infección del 5–8% en TPH de donantes haploidénticos y del 10–25% en trasplantes no relacionados.
Debe indicarse, que más que un incremento en el número absoluto de IFI probadas, lo que está aumentando es el número de pacientes de alto riesgo de padecer dichas infecciones, con el subsiguiente incremento en el consumo de antifúngicos en terapias empíricas y profilaxis. El crecimiento de las poblaciones de riesgo se debe a la intensificación de la quimioterapia en varias enfermedades, al aumento de trasplantes y al uso de nuevos inmunosupresores que favorecen la aparición de estas infecciones. Además, se está produciendo un desplazamiento en cuanto a los enfermos en riesgo. La reducción del periodo de neutropenia mediante el uso de factores estimulantes de colonias o de nuevas técnicas de trasplante, como el trasplante no mieloablativo, parece haber reducido el papel de la neutropenia como factor de riesgo de IFI. Sin embargo, el mayor número de trasplantes de donante no emparentado o de cordón umbilical han incrementado el número de infecciones que aparecen tras el implante, fundamentalmente en relación con la enfermedad del injerto contra el huésped (EICH) y su tratamiento9–11. Los factores de riesgo relacionados con la aparición tardía de AI son la administración de inmunosupresores que reduzcan los linfocitos T o CD34, los corticoides, la neutropenia con linfopenia, la EICH crónica extensa y la infección por citomegalovirus8. No obstante, el uso de los nuevos antifúngicos en profilaxis en estos pacientes hematológicos de alto riesgo está contribuyendo a disminuir la incidencia de la infección en este grupo12.
Otro grupo de alto riesgo de AI son los pacientes sometidos a trasplante de órgano sólido (TOS). Esta infección aparece durante el primer año postrasplante y su incidencia varía dependiendo del tipo de injerto, siendo más frecuente en el trasplante pulmonar, el cardíaco, el intestinal y el hepático13–15. En nuestro país, la prevalencia de la AI en el TOS ha decrecido a <3% con el uso de profilaxis14.
En tercer lugar existe un grupo heterogéneo de enfermedades en las que se ha descrito una mayor frecuencia de AI. Entre estas destaca la enfermedad granulomatosa crónica, donde se estima una incidencia de 0,1 infecciones fúngicas por paciente y año, aunque se administre IFNγ16, siendo la AI la principal causa de muerte en este grupo17. Otro grupo de riesgo ha estado constituido por los enfermos con sida, pero con el uso de tratamientos antiretrovirales de alta eficacia, la AI no es ya una infección frecuente en esta población. La AI puede diagnosticarse en pacientes sin tratamiento antiretroviral con CD4 <100/μl, neutropénicos y en tratamiento con esteroides2.
En los últimos años, se ha documentado una incidencia cada mayor de IFI en otro tipo de pacientes como aquellos con bronconeumopatía crónica obstructiva (BNCO), particularmente en los que reciben esteroides crónicamente18–23, el paciente cirrótico24, el paciente crítico25–30 y el paciente que ha sufrido una cirugía mayor, generalmente cardiaca31,32. La AI en pacientes BNCO es una entidad de la que todavía se desconoce su incidencia, así como sus características epidemiológicas. Hace una década se publicaron varios estudios poco representativos en los que la patología crónica respiratoria era el factor de riesgo entre el 1–1,5% de los casos18,20–22. Sin embargo, estudios recientes indican que la presencia de BNCO puede ser factor de riesgo de AI hasta en un 20% de los casos. Este porcentaje aumenta en el caso de enfermos críticos con patología respiratoria no neoplásica, donde se ha observado que el 42% de las aspergilosis afectan a pacientes con BNCO, por lo que se ha definido como factor de riesgo independiente19,20,23,25. En lo que se refiere al enfermo cirrótico, no se tienen datos fiables, pero un estudio ha cifrado que el 7% de los pacientes críticos con AI podrían padecer cirrosis23.
En cuanto a la AI en otros enfermos críticos, esta micosis parece estar subestimada, ya que se ha descubierto que hasta un 2,7% de los pacientes que mueren en UCI presentaba AI en los estudios necrósicos, y que un 30% de los mismos no fueron diagnosticados ni tratados24,33. La prevalencia de AI en enfermos críticos osciló entre el 0,3–5,5%, dependiendo del tipo de población estudiada, con o sin enfermedades hematológicas asociadas23,28,30,34. También se ha analizado la frecuencia de aislamiento de Aspergillus spp. en muestras de enfermos críticos. Está se ha cifrado entre el 0,33–1,1%25,35.
Finalmente, otra población de riesgo para desarrollar AI es el enfermo posquirúrgico. En una reciente revisión de la literatura incluyendo más de 500 pacientes, la cirugía cardiaca (32%), la dental (19%), la ocular (17%) y la torácica (10%) fueron los que se asociaron con mayor frecuencia a la AI, aunque se desconoce la tasa de infección en dichas poblaciones32, a excepción de la endocarditis fúngica tras cirugía cardiaca, que afecta al 0,1% del total de recambios valvulares, siendo Aspergillus spp. la causa del 25% de dichos episodios31.
Respecto a las infecciones por otros hongos filamentosos, se está observando un aumento en la incidencia de algunas especies como los Mucorales, Scedosporium spp. y Fusarium spp. No obstante, su incidencia es muy inferior a la de la AI y no existen medidas de prevención específicas para estas especies emergentes aunque, probablemente, la mayoría de los conceptos desarrollados para la prevención de AI son aplicables a las micosis por estos otros hongos3,36.
En lo que se refiere a los factores ambientales que afectan a la incidencia de la IFI, debe indicarse que Aspergillus spp. y otras especies fúngicas son hongos ambientales ubicuos. Cientos de conidias se inhalan diariamente, siendo eliminadas sin consecuencias clínicas en la mayor parte de los casos1,37. Sin embargo, en caso de personas con alteraciones anatómicas o de la inmunidad, la inhalación puede causar una infección38. Además, existe una influencia geográfica en la exposición al hongo, lo que podría explicar la mayor incidencia de AI en unos centros que en otros, considerando pacientes con iguales factores de riesgo39.
La construcción y las obras de remodelación en el hospital o en zonas cercanas al mismo, junto con la colonización de las conducciones de aire y las aguas contaminadas, constituyen las principales fuentes de origen de la aspergilosis nosocomial40–43. Sin embargo, la infección nosocomial podría ser poco frecuente, ya que la mayoría de las infecciones son esporádicas y es difícil determinar si se han adquirido dentro o fuera del hospital. Dos hechos podrían apoyar el origen extrahospitalario de la AI, aunque no existen evidencias claras sobre este asunto. En primer lugar, cuando esta aparece en la fase granulopénica postrasplante, el paciente se encuentra habitualmente en cámaras de aislamiento con filtros high efficacy particles aerosolized (HEPA), que evitan la inhalación de conidias, lo que sugiere que la infección debe haberse originado tras una colonización previa al ingreso. En segundo lugar, en los casos de aparición tardía, los pacientes se hallan en su domicilio desde hace meses, lo que hace pensar que deben aplicarse medidas preventivas en el domicilio de estos enfermos.
Existen varias fuentes ambientales de conidias, como suelo, plantas ornamentales y arreglos florales, detritus vegetal, restos de comida y agua41. Pocos estudios han correlacionado la concentración de conidias de Aspergillus spp. en el aire y el riesgo de infección o de colonización. Es evidente que en pacientes de alto riesgo, concentraciones tan bajas como 1UCF/m3 pueden causar infección43, por eso se han propuesto medidas de control ambiental. Estas medidas son difíciles de seguir durante periodos muy prolongados de tiempo tanto en el hospital como en el domicilio de los enfermos. Por ello, la profilaxis farmacológica es una alternativa muy útil en estas poblaciones de alto riesgo.
Por último, no existen recomendaciones sobre qué porcentaje de incidencia justifica la aplicación de las medidas preventivas en una población de riesgo, aunque deben aplicarse en los grupos con mayor riesgo de sufrir una IFI. Como se indicó anteriormente, la duración de la neutropenia y su asociación a otros factores como tratamientos inmunosupresores (esteroides, anticuerpos monoclonales, etc.), usados principalmente para la prevención y/o tratamiento de la EICH favorecen la aparición de la AI. Asimismo, el principal factor descrito asociado al desarrollo de AI en el paciente BNCO es el uso de esteroides, especialmente aquellos que reciben dosis altas (>20mg/ día o bien una dosis acumulada de 700mg)19,20. En el caso del enfermo crítico, la asociación de varios factores como la neutropenia (<500neutrófilos/mm3), neoplasia hematológica y TPH alogénico elevan mucho el riesgo de AI. Otros tienen un riesgo más moderado como la corticoterapia prolongada antes del ingreso, TPH autólogo, BNCO, cirrosis hepática, tumores de órgano sólido, sida, trasplante pulmón y tratamientos con alemtuzumab o etanercept, además de los tratamientos antibacterianos concomitantes. Deben considerarse asimismo con riesgo menor pero con incidencia aumentada, los pacientes con quemaduras graves, TOS pulmonar, corticoterapia<7 días, estancia UCI >21 días, malnutrición y cirugía cardiaca previa11,34. Finalmente, los factores asociados a AI posquirúrgica están asociados a contaminación del escenario quirúrgico o posquirúrgico con conidias del hongo. También se han documentado contaminación a través de los circuitos de diálisis, material quirúrgico contaminado (especialmente el protésico) e incluso, el origen puede ser el propio paciente por diseminación desde lesiones del enfermo31,32.
Medidas ambientales de prevención. Diseño arquitectónico e instalaciones de agua/aire¿Qué concentraciones de hongos filamentosos son normales en el aire ambiental intra y extrahospitalario?No existe un consenso sobre el número de UFC/m3 de aire que es normal en el ambiente tanto intra como extrahospitalario. En España, se realizó un estudio en la Comunidad de Madrid en el que se analizó la concentración de Aspergillus spp. en el aire de esta región44. Los resultados indicaron que hay variaciones estacionales. En la primavera se obtuvieron los menores recuentos y en otoño los mayores (mediana 1,3UFC/mm3 vs. 12UFC/m3). Las condiciones ambientales también influyeron en el recuento de UFC/m3. El intervalo de los recuentos fue entre 0–85UFC/m3. Otros autores apoyan la existencia de variaciones estacionales pero encuentran recuentos medios más elevados, que varían entre 20–105UFC/m345,46.
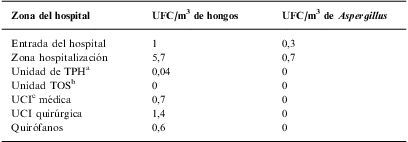
Dentro del hospital los datos son igualmente controvertidos. Sin embargo, es necesario distinguir entre áreas normales de hospitalización y otras, donde debe existir algún nivel de protección. Las cifras ofrecidas como normales también varían según las fuentes. El aire sin filtrar debería contener no más de 5 conidias/m3, aunque otros expertos aceptan entre 10–25CFU/m345,47. Sin embargo, el aire filtrado por HEPA con una eficiencia >95% y ≥12 renovaciones por hora debe tener un recuento <0,1UFC/m3. Una medición realizada antes de abrir un hospital provisto de filtros HEPA para tratar el aire de todas las dependencias obtuvo los resultados expuestos en la tabla 348.
UFC/m3 en diferentes zonas de un hospital con tratamiento completo de aire mediante filtros HEPA
| Zona del hospital | UFC/m3 de hongos | UFC/m3 de Aspergillus |
| Entrada del hospital | 1 | 0,3 |
| Zona hospitalización | 5,7 | 0,7 |
| Unidad de TPHa | 0,04 | 0 |
| Unidad TOSb | 0 | 0 |
| UCIc médica | 0,7 | 0 |
| UCI quirúrgica | 1,4 | 0 |
| Quirófanos | 0,6 | 0 |
HEPA: high efficacy particles aerosolized; UFC: unidades formadoras de colonias.
Por último, merece la peña reseñar un estudio que analizó la concentración de hongos en un hospital durante 10 años seguidos49. Los autores encontraron que crecían muchas más colonias cuando la incubación de las placas era a 25°C, en vez de a 37°C. Así el aire externo del hospital se muestreó 129 veces y la media del recuento a 25°C fue de 848UFC/m3 vs. 122UFC/m3 a 37°C.
En conclusión, las concentraciones de esporas en el aire pueden variar significativamente debido a: a) zona geográfica; b) grado de actividad en la zona muestreada; c) fluctuación en la temperatura, humedad o flujo del airel, y d) cambios en la intensidad de la luz. Sin embargo, en zonas donde el aire suministrado es tratado a través de un filtro HEPA, el número de UFC/m3 disminuye hasta concentraciones cercanas a cero. Por tanto, para conocer lo que se considera como concentración habitual de esporas en el ambiente intrahospitalario, habría que hacer un exhaustivo trabajo local que incluya áreas del hospital con diferentes medidas de protección teniendo en cuenta las variables mencionadas más arriba. En paralelo, un estudio del aire extrahospitalario ayudaría a definir las concentraciones habituales de esporas en dicha área geográfica. En los apartados siguientes se ofrecen algunas recomendaciones sobre las cifras de conidias que pueden considerarse normales, según los estudios disponibles.
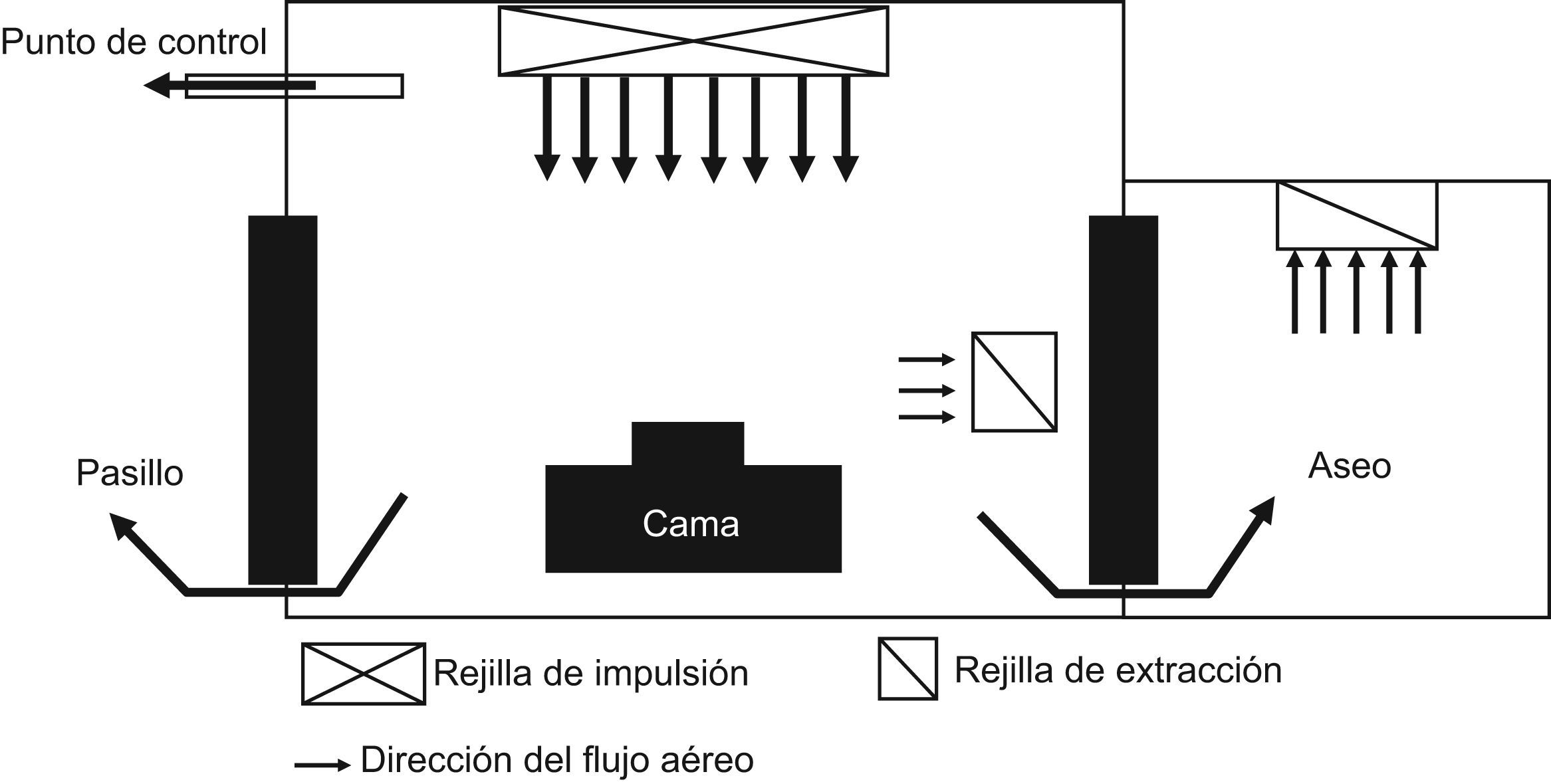
¿Qué es aire protegido?Se puede definir aire protegido como aquel que se encuentra dentro de un ambiente protegido. El ambiente protegido es una zona del hospital lo más hermética posible que tiene una mayor presión de aire (sobre presión) que las zonas circundantes, lo que provoca que el aire fluya desde el ambiente protegido hacia el exterior. En quirófanos y en las llamadas habitaciones protegidas, el tratamiento de aire debería ser independiente del resto del hospital. La climatización debería ser continua y filtrada a través de filtros absolutos HEPA y con un número elevado de recambios de aire a la hora. En caso de UCI, no existen recomendaciones generales, pero al menos, el sistema de climatización debe mantener el sistema en sobre presión, de forma que las zonas más críticas estén a mayor presión que las zonas menos criticas y estas a su vez en mayor presión que el resto del hospital. Es recomendable diseñar sistemas independientes para cada área o subárea de forma que, en caso de contaminación, esta no se extienda y pueda ser fácilmente contenida y neutralizada50.
¿Qué áreas hospitalarias no necesitan protección?Hay dos áreas que no necesitan protección por el bajo riesgo de infección, las áreas administrativas/públicas y las áreas de hospitalización de pacientes sin riesgo de IFI. En las administrativas, el sistema de aire acondicionado se puede desconectar por la noche, aunque se tiene que asegurar que la desconexión de estas zonas no altere las presiones diferenciales en otras áreas del hospital como los laboratorios, las UCI, las habitaciones de aislamiento, las protegidas o los quirófanos. En las áreas de pacientes sin riesgo, el sistema de aire acondicionado en sobre presión no debe ser interrumpido50,51.
¿Qué áreas hospitalarias necesitan protección?Son las denominadas áreas especiales: a) habitaciones protegidas; b) los quirófanos, y c) cualquier otra área elegida por el Comité de Evaluación y Control del Riesgo de Infección como las UCI, de quemados, las unidades de oncología y trasplante, unidades y policlínicas de pacientes con infección VIH, unidades de diálisis, áreas de angiografía cardiaca, o unidades de preparación de medicamentos inyectables en el servicio de farmacia. Para otras áreas donde pueden albergarse pacientes con riesgo medio-alto de AI como las salas de urgencia, radiología y diagnóstico por la imagen, unidades de reanimación postanestésica, paritorios, áreas de neonatología (no críticos), cirugía ambulatoria, medicina nuclear, ecocardiografía, laboratorios, pediatría, geriatría y unidades de crónicos, no existen recomendaciones. El Comité de Evaluación y Control del Riesgo de Infección de cada hospital debe evaluar y recomendar si otras áreas del hospital deben estar protegidas. Otra área especial es la formada por las habitaciones de aislamiento para pacientes con infecciones causadas por microorganismos transmisibles, cuyo diseño es diferente a las zonas protegidas, ya que deben disponer de presión negativa.
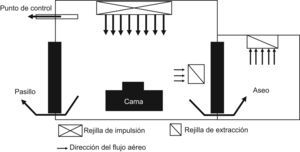
Las habitaciones con ambiente protegido son para albergar pacientes con inmunodepresión grave y en ellas el aire debe ser filtrado con filtros HEPA, manteniendo una presión positiva en relación con las áreas que la rodean. La presión positiva recomendada es entre +2,5 y +8 pascales en relación al pasillo. Se recomienda un intercambio de ≥12 veces por hora del volumen de aire de la habitación. El aire que entra en la habitación debe ser impulsado a una velocidad mínima de 0,25m/s a través de un filtro HEPA con 99,97% de eficacia para partículas ≥0,3μm. El aire expulsado de la habitación no requiere filtración. El flujo de aire filtrado debe ser dirigido hacia el paciente y después eliminado. En la figura 1 se puede ver un esquema de una habitación con ambiente protegido50–52.
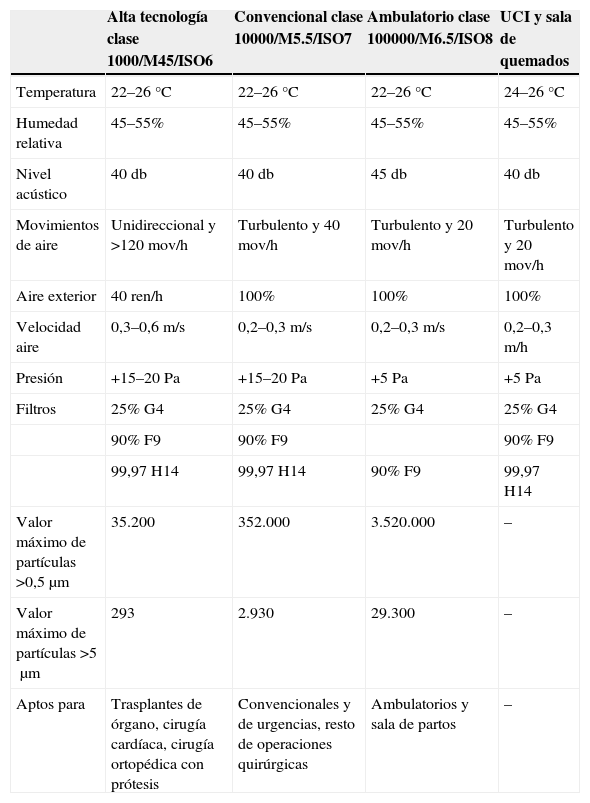
Las características principales de los quirófanos, las UCI y salas de quemados según la norma UNE100713 se recogen en la tabla 4. El aire debe tener tres etapas de filtrado con un filtro HEPA terminal. Debe indicarse que la calidad del aire del interior de las instalaciones sanitarias se recoge en la norma ISO 14644 sobre Salas Limpias y Locales Anexos. Clasificación de la Limpieza del Aire, donde se define como nivel de partículas contenidas por unidad de volumen de aire. Asimismo, se puede encontrar una aplicación para el ámbito farmacéutico en la guía EC Guide to Good Manufacturing Practice. Las partículas inertes contenidas en el aire actúan como vehículos de transporte para los organismos patógenos. Por tanto, el control del nivel de partículas en el aire es fundamental para reducir los riesgos de infecciones, por lo que varias legislaciones autonómicas han adoptado estas recomendaciones y normas50–53. Dado que los tamaños de las esporas de hongos filamentosos son del orden de 2,5μm una calidad de aire inferior a nivel ISO 8 (tabla 4) en las zonas de riesgo debería ser suficiente.
Clasificación de los quirófanos y unidades de cuidados críticos según UNE100713
| Alta tecnología clase 1000/M45/ISO6 | Convencional clase 10000/M5.5/ISO7 | Ambulatorio clase 100000/M6.5/ISO8 | UCI y sala de quemados | |
| Temperatura | 22–26°C | 22–26°C | 22–26°C | 24–26°C |
| Humedad relativa | 45–55% | 45–55% | 45–55% | 45–55% |
| Nivel acústico | 40db | 40db | 45db | 40db |
| Movimientos de aire | Unidireccional y >120mov/h | Turbulento y 40mov/h | Turbulento y 20mov/h | Turbulento y 20mov/h |
| Aire exterior | 40ren/h | 100% | 100% | 100% |
| Velocidad aire | 0,3–0,6m/s | 0,2–0,3m/s | 0,2–0,3m/s | 0,2–0,3m/h |
| Presión | +15–20Pa | +15–20Pa | +5Pa | +5Pa |
| Filtros | 25% G4 | 25% G4 | 25% G4 | 25% G4 |
| 90% F9 | 90% F9 | 90% F9 | ||
| 99,97 H14 | 99,97 H14 | 90% F9 | 99,97 H14 | |
| Valor máximo de partículas >0,5μm | 35.200 | 352.000 | 3.520.000 | – |
| Valor máximo de partículas >5μm | 293 | 2.930 | 29.300 | – |
| Aptos para | Trasplantes de órgano, cirugía cardíaca, cirugía ortopédica con prótesis | Convencionales y de urgencias, resto de operaciones quirúrgicas | Ambulatorios y sala de partos | – |
En aquellos hospitales donde se operan pacientes infectados se debe considerar la construcción de quirófanos donde el aire expulsado este filtrado a través de HEPA, especialmente si hay recirculación del mismo. Las intervenciones quirúrgicas en cualquier paciente inmunodeprimido deberían ser realizadas en quirófanos clase 1000.
La filtración del aire a través de filtro HEPA es un paso en la contención de las partículas portadoras de patógenos, aunque no es el único. Hay una serie de medidas que pueden tomarse para incrementar el nivel de limpieza y seguridad de las zonas criticas:
- •
Aislamiento físico de las zonas de riesgo del resto del hospital. Con esta medida se evita un primer contacto y se minimiza el riesgo de que los patógenos generados en el exterior puedan alcanzar la zona controlada. El aislamiento debe ser integral, no solo a través de los elementos arquitectónicos sino también a través de las instalaciones de aire.
- •
Esclusas de acceso. El acceso a través de esclusas aumenta la seguridad de la zona crítica e interpone un elemento de ruptura que permite instaurar otras medidas de contención, como el cambio de vestuario o calzado, limpieza y desinfección de manos y utensilios, etc.
- •
Zona de riesgo en flujo laminar. El flujo laminar o unidireccional es el sistema mas estricto de protección, se basa en una corriente continua de aire ultra filtrado a velocidad uniforme (0,36–0,54m/s), que barre uniformemente la zona critica manteniendo el ambiente en una clasificación ISO5 (grado A GMP). No son necesarias en las zonas de ambiente protegido, salvo en instalaciones especiales que vayan a albergar enfermos con inmunodeficiencias muy intensas y poco habituales.
Deben tomarse en consideración varios aspectos en el diseño de estos espacios. Los materiales utilizados en la construcción de estas zonas críticas no deberán desprender partículas, ser fáciles de limpiar, ignífugos y que resistan los procedimientos periódicos de desinfección. Las superficies deberían ser lisas y presentar el menor número posible de bordes, ranuras y aperturas donde el polvo y partículas puedan depositarse. Debería ponerse especial atención en la facilidad de limpieza, (superficies lisas, encuentros curvos y ausencia de rincones). Puntos especialmente críticos son las uniones pared/suelo, para las que se recomienda el tipo continuo, en el que el recubrimiento del suelo hace el encuentro curvo con la pared. Debe existir un falso techo, que separe el ambiente controlado interior del ambiente del espacio técnico superior. Las ventanas deben ser no practicables y estancas, para evitar el contacto con el ambiente exterior. Asimismo los marcos deben estar integrados con la arquitectura, sin presentar bordes, ranuras o discontinuidades. Las puertas deben estar fabricadas con materiales inertes, que no desprendan partículas y que presenten superficies lisas y sean fáciles de limpiar. La madera y sus derivados deben ser evitados. Los bordes de las puertas deberían presentar formas curvas con líneas suaves para facilitar la limpieza. Los sistemas de cierre deben presentar un mínimo de ranuras y oquedades50–53.
¿En qué niveles de protección y con qué periodicidad deben hacerse controles microbiológicos del aire ambiental?No existe un consenso sobre la necesidad y frecuencia de los controles microbiológicos en las habitaciones con ambiente protegido, aunque algunos expertos las recomiendan para comprobar el buen funcionamiento de la instalación49,54–56. La vigilancia ambiental sí que está recomendada cuando aparece algún caso de IFI causada por un hongo que se transmite por el aire como Aspergillus spp., cuando haya que evaluar el riesgo debido a condiciones ambientales especiales (obras de renovación o mantenimiento) y cuando haya que verificar que el riesgo ha desaparecido49,54–58. Asimismo, un aumento en la incidencia de IFI de supuesto origen hospitalario debe originar una investigación ambiental exhaustiva49,54–58. Debe añadirse, que hay disposiciones autonómicas españolas que aconsejan la realización de controles microbiológicos periódicos en los quirófanos. La vigilancia ambiental está también recomendada inmediatamente antes de la apertura inicial del quirófano o tras sufrir algún tipo de remodelación59–62. En los quirófanos clase 1000 y 10000 (tabla 4) el límite de UFC/m3 es de 0,5; es decir, que como máximo se puede detectar una colonia de hongo filamentoso en una toma de 2m3 de aire, norma que también puede aplicarse en otras áreas con ambiente protegido.
Hay recomendaciones de expertos que sugieren que la monitorización mensual de la calidad del aire mediante un contador láser con sonda isocinética, que analiza el número y el tamaño de las partículas entre 0,3–10μm, puede ser un marcador sustitutivo de la calidad microbiológica del aire. En algunos países ya se recomienda realizar la monitorización de la calidad del aire de los quirófanos mediante este tipo de contadores láser58. En cualquier caso puede tratarse de una técnica complementaria sobre la que se necesita más literatura científica. Debe indicarse además, que los recuentos de partículas no permiten identificar microorganismos patógenos ni correlacionarlos con los aislados de pacientes en episodios de brotes.
Los recuentos de Aspergillus en aire ambiente no protegido suelen estar entre 10–25UFC/m3. Recuentos mayores pueden ser considerados como anormales, sobre todo en áreas hospitalarias con ambiente no protegido donde puedan ingresarse pacientes con riesgo de IFI. Dichos ascensos en el recuento suelen guardar correlación con las obras y con los movimientos de tierras y estructuras, por lo que se recomienda realizar recuentos en caso de obras cercanas63–66.
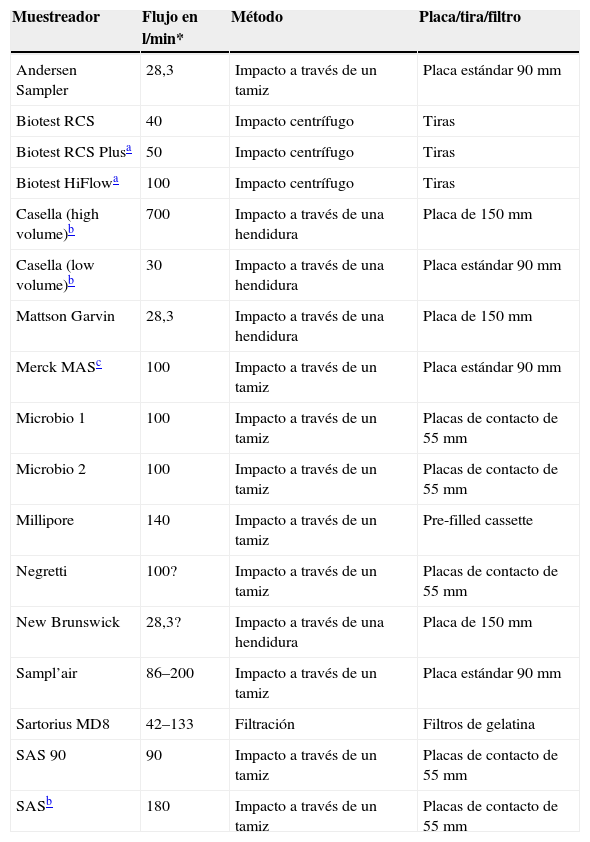
¿Máquinas más recomendables para la realización de cultivos de muestreo?Muchas de las máquinas para muestreo de aire no están diseñadas para el control de las habitaciones protegidas o quirófanos por lo que no todas son adecuadas. Las máquinas deben reunir una serie de características como ser capaces de muestrear un volumen adecuado de aire en un tiempo razonable o antes de que el medio de cultivo se deseque (2m3 en 10min). Deberían ser operadas mediante control remoto y ser fáciles de usar y de limpiar. Se recomiendan emplear métodos de muestreo basados en la aspiración en los que se hace impactar, filtrar o burbujear el aire sobre diversos soportes que sirven como colectores: filtros porosos, medios de agar, películas adhesivas, o líquidos de diversa naturaleza. Si no utilizan placas de petri convencionales, hay que analizar el coste de los filtros o las tiras ya que algunos son muy caros. Si se van a utilizar para monitorizar el quirófano en funcionamiento, deben poder colocarse cerca de la herida quirúrgica67. Estos sistemas permiten identificar a los hongos aislados en los soportes y cuantificar el número de esporas presentes en un determinado volumen de aire aspirado.
La tabla 5 incluye un sumario de las máquinas disponibles más empleadas en la actualidad.
Características de las máquinas de muestreo de aire
| Muestreador | Flujo en l/min* | Método | Placa/tira/filtro |
| Andersen Sampler | 28,3 | Impacto a través de un tamiz | Placa estándar 90mm |
| Biotest RCS | 40 | Impacto centrífugo | Tiras |
| Biotest RCS Plusa | 50 | Impacto centrífugo | Tiras |
| Biotest HiFlowa | 100 | Impacto centrífugo | Tiras |
| Casella (high volume)b | 700 | Impacto a través de una hendidura | Placa de 150mm |
| Casella (low volume)b | 30 | Impacto a través de una hendidura | Placa estándar 90mm |
| Mattson Garvin | 28,3 | Impacto a través de una hendidura | Placa de 150mm |
| Merck MASc | 100 | Impacto a través de un tamiz | Placa estándar 90mm |
| Microbio 1 | 100 | Impacto a través de un tamiz | Placas de contacto de 55mm |
| Microbio 2 | 100 | Impacto a través de un tamiz | Placas de contacto de 55mm |
| Millipore | 140 | Impacto a través de un tamiz | Pre-filled cassette |
| Negretti | 100? | Impacto a través de un tamiz | Placas de contacto de 55mm |
| New Brunswick | 28,3? | Impacto a través de una hendidura | Placa de 150mm |
| Sampl’air | 86–200 | Impacto a través de un tamiz | Placa estándar 90mm |
| Sartorius MD8 | 42–133 | Filtración | Filtros de gelatina |
| SAS 90 | 90 | Impacto a través de un tamiz | Placas de contacto de 55mm |
| SASb | 180 | Impacto a través de un tamiz | Placas de contacto de 55mm |
Como se indicó anteriormente, algunas legislaciones autonómicas han adaptado las normas UNE e ISO en lo que se refiere a las áreas quirúrgicas50–52. Varias comunidades autónomas recomiendan hacer cultivos de vigilancia periódicos en zonas quirúrgicas. Algunas legislaciones europeas, entre las que no se cuenta la española, recomiendan también realizar recuentos de partículas con contadores láser, así como el número de partículas aceptable según la clase de quirófano (tabla 4).
En una guía editada por la Sociedad Española de Medicina Preventiva se recomienda realizar estos cultivos en áreas de alto riesgo con periodicidad máxima mensual, ya que muchos de los centros hospitalarios están ubicados en zonas urbanas contaminadas y a que se encuentran, con frecuencia, en situación de remodelación u obras68.
Según los expertos que han elaborado estas recomendaciones, la realización periódica de cultivos ambientales para evaluar la calidad del aire, en cuanto a la presencia de hongos se refiere, podría recomendarse en algunas ocasiones. Es una estrategia útil para la detección de problemas relacionados con los sistemas de climatización de las zonas protegidas (integridad de los filtros), si bien el mantenimiento de los mismos es más importante que dicho muestreo y los recuentos de partículas con láser pueden utilizarse como técnica complementaria. Los cultivos periódicos además pueden ayudar a conocer focos de contaminación inesperados en centros cuyas instalaciones no cumplen con las recomendaciones arquitectónicas actuales y permite obtener mediciones históricas con las que compararse en momentos de niveles elevados.
¿Cómo deben realizarse los muestreos de vigilancia?Aunque se pueden procesar tanto muestras de aire, como superficiales y de agua para la búsqueda de hongos ambientales oportunistas40,69,70, la cuantificación a partir de muestras de aire es más representativa de la exposición del enfermo a conidias presentes en el ambiente71. El volumen de aire total a recoger puede oscilar entre 180–1.080l, según el tamaño de la zona a muestrear.
Las principales zonas en las que preocupa la presencia de hongos oportunistas y, por tanto, candidatas a muestrearse, serían aquellas que alojan a pacientes de riesgo elevado como aquellos que van a sufrir cirugías mayores (quirófanos), habitaciones con enfermos neutropénicos y, en términos generales, todas aquellas zonas que por alguna razón se han equipado con filtros HEPA.
En cuanto a la periodicidad de los muestreos, tampoco hay reglas fijas. Debe ser regular para dar información útil, pero tampoco debe de sobrecargar al laboratorio de microbiología. La realización de tomas ambientales de forma mensual en las zonas equipadas con filtros HEPA es la práctica más extendida. Una vez que las muestras de aire han sido recogidas, se deben sellar las placas e incubarse durante 5 días en un rango comprendido entre 28–37°C. Pueden existir diferencias en los recuentos cuando las placas se incuban a diferentes temperaturas, obteniéndose recuentos más elevados a temperaturas bajas, mientras que a 37°C solo se recuperan los hongos capaces de crecer a temperatura corporal y, por tanto, potencialmente patógenos49.
¿Qué responsabilidad tiene el agua?Diversos estudios han demostrado que el agua del hospital contiene hongos40,69,72–76. Las principales conclusiones de estos trabajos son que hay hongos filamentosos en el sistema de distribución del agua hospitalaria y que las mismas especies se recuperan también del agua corriente extrahospitalaria. Además, se ha demostrado mediante epidemiología molecular que cepas aisladas del agua han sido las causantes de IFI. Los hongos forman parte del biofilm acuático del hospital y se detecta un aumento de la concentración de conidias en baños en comparación con habitaciones y recibidores. Asimismo, existe correlación entre las especies aisladas en el agua y en el aire intrahospitalario. No hay relación estacional entre la concentración de conidias extra e intrahospitalarias, y a mayor antigüedad del edificio, la concentración de esporas aumenta.
También se sabe que la concentración de hongos filamentosos depende de la localización del agua. Así, el agua subterránea no suele estar colonizada y siempre lo está el agua embalsada en superficie, donde un 55% de las conidias aisladas son de Aspergillus fumigatus. Debe indicarse que el proceso de purificación y potabilización no parece afectar a las conidias, y que solo la limpieza y desinfección diaria de los baños de las habitaciones protegidas, incluyendo suelo y paredes, reducen significativamente la concentración de esporas por metro cúbico. No existe consenso sobre qué concentraciones de conidias son aceptables, por lo que no se recomienda la realización de cultivos de vigilancia.
¿Quién toma las decisiones de actuación para prevenir la IFI?La legislación actual así como los estándares internacionales y los expertos recomiendan que toda institución sanitaria tenga un Comité de Control y Evaluación del Riesgo de Infección, que se encargue de coordinar las medidas de control necesarias en cada institución, dependiendo de su actividad, localización e incidencia de infección.
Medidas de control de la infección nosocomialLas medidas encaminadas a la prevención y el control de la IFI en los pacientes de riesgo elevado ingresados en las instituciones sanitarias no han sido abordadas, hasta el momento actual, en una guía específica sobre el tema. Las recomendaciones más utilizadas se pueden extraer de guías que tratan sobre la prevención de las infecciones oportunistas en los receptores de trasplantes hematopoyéticos77, sobre las infecciones nosocomiales relacionadas con actividades de construcción o reforma de las instituciones sanitarias78, sobre el control de las infecciones transmitidas por el medio ambiente79 y, por último, sobre la prevención de la neumonía asociada a la ventilación mecánica o a la neumonía asociada a los cuidados sanitarios80. El rigor y el valor científico de todas estas recomendaciones ofrecen, sin lugar a dudas, una excelente información para la elaboración de la presente guía. Por lo tanto, una buena parte de las respuestas de este apartado se basarán en las mismas.
¿Qué medidas de educación sanitaria destinadas a la prevención de la IFI son necesarias?El personal sanitario que se encarga de la atención a pacientes de riesgo elevado de IFI ha de recibir una formación específica sobre la epidemiología, los mecanismos de transmisión y las medidas de prevención y control de la infección. Asimismo, sería conveniente involucrar a este personal en la adecuada implementación de estas recomendaciones o en la puesta en práctica de medidas especiales o adicionales de intervención, mediante la utilización de marcadores o técnicas de mejora de la calidad asistencial79,80.
¿Qué medidas de vigilancia de la IFI nosocomial han de realizarse y a qué pacientes han de dirigirse estas medidas?En los pacientes con un estado de inmunodepresión grave y riesgo elevado de AI (ver apartado 1 del documento) ha de mantenerse un alto índice de sospecha de la enfermedad en caso de síntomas o signos de afección pulmonar8,10,81–86. Los pacientes más susceptibles serían los trasplantados de órganos hematopoyéticos y, en menor grado, los afectos de neoplasias hematológicas en tratamiento quimioterápico, los trasplantados de órgano sólido y los receptores de terapias prolongadas con dosis altas de esteroides.
Los profesionales encargados de la vigilancia y el control de las infecciones en las instituciones sanitarias han de mantener un sistema permanente de registro de nuevos casos de IFI, por lo que han de recibir información precisa y rápida sobre la detección de Aspergillus spp. y otros hongos en muestras respiratorias. Asimismo, es necesaria la revisión periódica de los datos microbiológicos, histopatológicos o de necropsias que sean sugestivos de infección79,80.
La práctica rutinaria de pruebas moleculares o de detección de antígenos y de estudios radiológicos para el diagnóstico de presunción de la enfermedad puede originar una disminución notable de la identificación de nuevos casos probados de AI87,88. La vigilancia de la incidencia de AI mediante la inclusión de estas nuevas modalidades diagnósticas es un tema que está sin resolver.
Las definiciones propuestas por la European Organization for Research and Treatment of Cancer/National Institute of Allergy and Infectious Diseases, Mycoses Study Group (EORTC/MSG) para el diagnóstico de la aspergilosis probada, probable o posible han de ser utilizadas para detectar nuevos casos de IFI en pacientes hospitalizados de alto riesgo89.
La práctica sistemática de cultivos de vigilancia de muestras respiratorias para la detección de Aspergillus spp. no está recomendada en ningún tipo de población hospitalizada, incluidos los pacientes con riesgo elevado de AI90,91. De igual manera, no está indicada la realización de cultivos periódicos del material, de los equipos o de las superficies de las áreas especiales para hospitalización de pacientes trasplantados de órganos hematopoyéticos77,91.
¿Qué pacientes han de estar hospitalizados en áreas de ambiente protegido y durante cuánto tiempo?Teniendo en consideración que la mayoría de pacientes hospitalizados tienen un riesgo mínimo de IFI y que la exposición a conidias es extremadamente difícil de evitar, las medidas de prevención de la exposición se deberían limitar a las poblaciones de mayor riesgo de padecer la enfermedad. Las recomendaciones limitan el uso de habitaciones con ambientes de aire y climatización protegidos a pacientes con TPH alogénico o con neutropenias graves (menos de 100 células por mm3) de más de una semana de duración. La recuperación de una cifra de neutrófilos por encima de 500 células por mm3 sería una condición suficiente para la ubicación de este tipo de pacientes en habitaciones convencionales77–79.
La colocación en habitaciones de ambiente protegido de otras poblaciones de pacientes inmunodeprimidos, como los receptores de trasplantes autólogos de progenitores hematopoyéticos, los trasplantados de órgano sólido o los expuestos a tratamiento esteroideo intenso y prolongado, es un tema no resuelto. El ingreso de este tipo de pacientes en zonas específicas del hospital podría ser de utilidad en algunas circunstancias, como las fases iniciales del trasplante pulmonar o los tratamientos inmunosupresores intensivos.
¿Qué medidas de limpieza y desinfección se recomiendan en las instalaciones de ambiente protegido?Todas las habitaciones de los pacientes con riesgo de IFI han de limpiarse al menos dos veces cada día y siempre que haya un vertido accidental de líquidos sobre el suelo o las superficies. La limpieza se ha realizar con desinfectantes convencionales y siguiendo las instrucciones del fabricante. La utilización de instrumentos para la limpieza que puedan producir polvo o aerosolización de conidias está absolutamente contraindicado en todo el recinto de las instituciones sanitarias77. No hay evidencias sobre la utilización de medidas especiales, como serían el uso de sustancias fungicidas o la colocación de pavimentos de materiales sintéticos de una sola pieza, para la reducción de la exposición a las conidias de Aspergillus, aunque se deben seguir las recomendaciones incluidas en el apartado sobre las estructuras de prevención. La limpieza y la desinfección de las habitaciones con pacientes con riesgo de IFI, incluidas las de ambiente protegido para enfermos de riesgo muy elevado, ha de realizarse de forma convencional ya que otras medidas no tienen ningún impacto demostrado sobre la exposición fúngica de los pacientes.
En las áreas de ambiente protegido tiene que realizarse también, una desinfección preventiva periódica que debe incluir superficies, instalaciones y ambiente. No existen recomendaciones sobre la periodicidad, pero siempre debe hacerse en caso de que se superen los límites recomendados de partículas en suspensión o de UFC/m3 de aire. La desinfección y limpieza de superficies tienen que estar definidas en los protocolos hospitalarios, donde se contemple la limpieza de las instalaciones de tratamiento de aire, conductos y sistemas de difusión50,51. Los sistemas basados en H2O2, conocidos también comos sistemas VHP (vapores de peroxido de hidrogeno) son muy eficaces. Concentraciones superiores a 1ppm no se permiten en zonas ocupadas por personas, por lo que la efectividad del sistema depende de la posibilidad de aislar periódicamente las zonas para su desinfección. Los sistemas basados en ozono se basan en la inyección controlada de ozono en el ambiente a desinfectar y en el sistema de difusión y tratamiento de aire. Para tratamientos de choque sin personal en las áreas a desinfectar se utilizan concentraciones de 1mg/m3. Para tratamientos de mantenimiento y reducción de carga biológica con personal presente, se utilizan concentraciones inferiores 0,1mg/m3.
En caso de fuga de agua en los sanitarios o en tuberías que estén cercanas a las paredes o techos de las habitaciones de pacientes con riesgo de IFI es necesario reparar rápidamente la avería. La reparación debería hacerse en menos de 72h para evitar el sobrecrecimiento de especies fúngicas sobre las superficies húmedas77.
¿Qué medidas han de aplicarse para el traslado de pacientes en riesgo entre diferentes zonas del hospital?En la medida de lo posible, la salida de los pacientes de las habitaciones con riesgo elevado de IFI que se encuentren hospitalizados en zonas con ambiente protegido ha de restringirse. En los casos de abandono de estas habitaciones, para la realización de medidas diagnósticas o terapéuticas, se ha de evitar el traslado a través de zonas de la institución donde puedan existir recuentos elevados de conidias, como por ejemplo zonas en reformas de albañilería o sometidas a limpieza extraordinaria. Asimismo, se ha de colocar al paciente una máscara protectora respiratoria del tipo FFP3 que, salvo circunstancias excepcionales, no se debe retirar durante todo el tiempo que el paciente permanezca fuera de la zona de ambiente protegido77–79. La utilización de aparatos de rayos X portátiles no parece disminuir el riesgo de IFI, además de que pueden ser fuente de contaminación, ya que no pueden desinfectarse eficazmente.
¿Qué precauciones estándar han de aplicarse de forma específica para la prevención de la IFI?El uso sistemático de determinadas precauciones estándar, como el vestuario del personal de uso exclusivo para las zonas de ambiente protegido, las máscaras respiratorias y la higiene adecuada de las manos, así como la utilización de guantes, no ofrecen un protección específica para la adquisición de Aspergillus spp. Sin embargo, la mayoría de las instituciones optan por estas recomendaciones para intentar disminuir la transmisión entre pacientes o a través del personal sanitario de otros microorganismos causantes de infección en este tipo de población77.
¿Qué medidas de higiene personal son recomendables para la prevención de la IFI?Respecto a los hábitos higiénicos de los pacientes con elevado riesgo de IFI, especialmente los receptores de trasplantes de precursores hematopoyéticos en fase de neutropenia grave y prolongada, se ha de recomendar la utilización de esponjas de un solo uso para la higiene corporal diaria en la propia cama del paciente, y desaconsejar el uso del baño o la ducha por parte del propio paciente70,77–79.
La utilización de filtros en los grifos y en las duchas parece que puede controlar la aerosolización de conidias fúngicas, aunque no existen datos contrastados. Este filtro debe sustituirse periódicamente en caso de que se utilice de forma continuada.
¿Qué medidas han de adoptarse en casos de detección de un nuevo caso de IFI o de un brote epidémico?En caso de diagnosticarse un nuevo caso de IFI, el episodio ha de ser investigado con el objetivo de determinar si su adquisición es comunitaria o relacionada con la hospitalización. Si se determina el origen nosocomial se tendrá que efectuar un análisis exhaustivo, de tipo retrospectivo y prospectivo, para identificar la existencia de casos nuevos que puedan condicionar la caracterización del brote epidémico. La realización de controles del sistema de ventilación y la corrección de las posibles deficiencias son actividades obligatorias en casos de detección de pacientes con IFI77,79.
La declaración de un brote epidémico requiere de la realización de una adecuada investigación epidemiológica y de su comunicación inmediata a las autoridades sanitarias y a los organismos administrativos encargados de la salud pública77,79. Se han de realizar tomas de muestras ambientales, fundamentalmente de aire y, en ocasiones, de agua, e investigar la presencia de Aspergillus spp. y otros hongos. El estudio molecular de las especies detectadas en los pacientes y en el ambiente puede contribuir a identificar el origen del brote epidémico. Las deficiencias en los sistemas de ventilación también se han de identificar y reparar de la forma más rápida posible77,79.
Medidas especiales y adicionales de prevención¿Cuáles son las variaciones de los niveles aéreos de hongos filamentosos en relación con las obras?Como ya se indicó con anterioridad, no existe un nivel aéreo de conidias de Aspergillus que pueda considerarse como normal o como patológico. Sin embargo, sí que existe una buena evidencia de las elevaciones de los niveles de conidias de Aspergillus durante la realización de obras tanto dentro como en la proximidad del hospital. La concentración media de hongos del género Aspergillus dentro del hospital varía entre 3–105UFC/m3, según los estudios consultados49,54,92–95. Curtis et al realizaron una vigilancia de un año en un hospital terciario con un extenso programa de renovación y demolición de edificios anexos al mismo96. En este estudio, los autores observaron numerosos picos en la concentración aérea de hongos filamentosos, como consecuencia de intervenciones o incidentes en los sistemas de filtración del aire. Asimismo, la demolición por voladura controlada de un edificio aumenta sustancialmente los niveles de conidias en el aire. En un estudio realizado en España para ver el impacto de la voladura de un edificio vecino sobre los niveles de conidias de Aspergillus en un hospital, los recuentos de hongos en el aire durante los días previos a la voladura fueron de 17,6UFC/m3, cifra que se elevó a 70,2UFC/m3, con la ola de polvo que siguió a la demolición. Los niveles tardaron en volver a los basales casi dos semanas47. No se produjeron diferencias significativas en los recuentos de conidias entre el aire exterior y el aire no protegido del interior del hospital. Por el contrario, la mayoría de las áreas protegidas con presión positiva y filtros HEPA permaneció con recuentos negativos.
¿Qué evidencia existe de la relación entre niveles de conidias en el aire y micosis invasoras por hongos filamentosos?Aunque no se haya establecido un nivel de Aspergillus en el aire a partir del cuál aumenta el riesgo de AI en una institución, el aumento de conidias en el aire se ha correlacionado con un aumento de la incidencia de AI97,98 y de otras IFIs por hongos filamentosos99, generalmente asociado a obras de remodelación en los centros hospitalarios o áreas próximas41,98,100,101. Vonberg realizó una revisión sistemática en 2006 en la que se incluyeron todos los brotes incluidos en la outbreak database, un registro de brotes epidémicos hospitalarios (www.outbreak-database.com), causados por Aspergillus spp., desde 1966 hasta 200543. En dicho estudio, se recogieron 53 brotes que afectaron a 458 pacientes, la mayor parte de ellos con cáncer hematológico (65,3%). Menos en uno de los brotes, el aire contaminado fue el origen de las epidemias y en la mayoría de los pacientes, el pulmón fue el primer órgano afectado. Las obras fueron las causantes de casi la mitad de los brotes acaecidos.
Otra evidencia indirecta la proporciona la protección de pacientes hospitalizados en habitaciones y espacios con aire protegido con filtros HEPA y presión positiva97,102–106. Un estudio reciente, publicado en 2007 por Benet, demuestra la protección que supone hospitalizar a una parte de la población bajo aire protegido frente a la que permanece bajo sistemas convencionales107. De los 356 pacientes hospitalizados en tres unidades de hematología durante el periodo de estudio, 21 de ellos desarrollaron AI. Las tres unidades, originalmente, carecían de filtros HEPA. Una de las unidades se reubicó en otro módulo y fue equipada con medidas de barrera. La incidencia de aspergilosis en esta unidad, pasó del 13,2% (9 pacientes) antes de la reubicación al 1,6% (un paciente, p=0,018). La incidencia de aspergilosis en el grupo control (las otras dos unidades que no se remodelaron) no varió. Los tipos de pacientes ingresados en las tres unidades eran similares. Dadas estas evidencias, debe insistirse en utilizar habitaciones de ambiente protegido en enfermos con alto riesgo de AI, así como realizar recuentos en zonas hospitalarias expuestas a obras o remodelaciones. Estos recuentos pueden ser además, de especial utilidad en zonas de ambiente no protegido con pacientes en riesgo de micosis. No existen cifras de conidias que puedan considerarse como normales, pero concentraciones superiores a 25UFC/m3 pueden ser muy elevadas y asociadas a un incremento de la AI en pacientes con factores de riesgo.
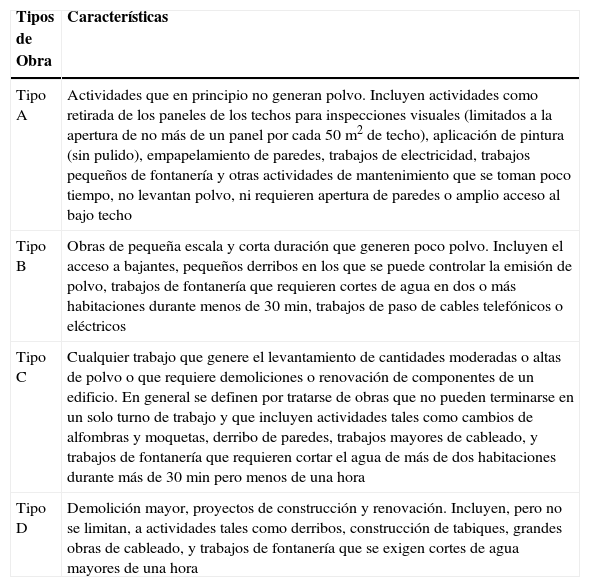
¿Cómo deben clasificarse las obras por su riesgo de causar niveles elevados de conidias en aire?Es necesario una estratificación de las obras que se realizan en el interior y exterior del hospital con el fin de adecuar las medidas de prevención al grado de riesgo que llevan asociado, así como las especificaciones que deben constar en el contrato de la obra. Actualmente existe una clasificación de obras propuesta por la Sociedad Española de Medicina Preventiva que resulta fácil de aplicar, pero no incluye una adecuada evaluación de riesgos. Está clasificación diferencia las obras según la capacidad de planificación previa, considerando las programadas y no programadas68. También considera una clasificación establecida en la Ley de contratos de las administraciones públicas (artículo 123), que diferencia las obras en función del objeto de las mismas (creación de un inmueble, reparación, mantenimiento y demolición) y su envergadura (reparación simple o gran reparación). Sin embargo, las clasificaciones que se utilizan en los servicios sanitarios canadienses y británicos resultan más útiles para planificar las intervenciones preventivas. El servicio de salud canadiense78 define cuatro niveles de actividad, desde el que supone menor riesgo hasta la demolición grande o proyecto de reconstrucción, realizando una evaluación de riesgos mediante una lista de verificación. Los elementos que se valoran son, entre otros, el grado de polvo originado así como la posibilidad de controlar su salida y diseminación, el tiempo que dura la intervención, si se cortan, sustituyen o derriban componentes fijos del edificio y las intervenciones de fontanería. Esta clasificación diferencia actividades de corta o larga duración en función de si se pueden llevar a cabo en un día laboral o lo exceden, pero no contempla factores como el número de personal requerido para la obra o el tráfico de material o personal. En tabla 6 se incluye la clasificación de las obras según el sistema canadiense.
Tipos de obra según el sistema de salud canadiense
| Tipos de Obra | Características |
| Tipo A | Actividades que en principio no generan polvo. Incluyen actividades como retirada de los paneles de los techos para inspecciones visuales (limitados a la apertura de no más de un panel por cada 50m2 de techo), aplicación de pintura (sin pulido), empapelamiento de paredes, trabajos de electricidad, trabajos pequeños de fontanería y otras actividades de mantenimiento que se toman poco tiempo, no levantan polvo, ni requieren apertura de paredes o amplio acceso al bajo techo |
| Tipo B | Obras de pequeña escala y corta duración que generen poco polvo. Incluyen el acceso a bajantes, pequeños derribos en los que se puede controlar la emisión de polvo, trabajos de fontanería que requieren cortes de agua en dos o más habitaciones durante menos de 30min, trabajos de paso de cables telefónicos o eléctricos |
| Tipo C | Cualquier trabajo que genere el levantamiento de cantidades moderadas o altas de polvo o que requiere demoliciones o renovación de componentes de un edificio. En general se definen por tratarse de obras que no pueden terminarse en un solo turno de trabajo y que incluyen actividades tales como cambios de alfombras y moquetas, derribo de paredes, trabajos mayores de cableado, y trabajos de fontanería que requieren cortar el agua de más de dos habitaciones durante más de 30min pero menos de una hora |
| Tipo D | Demolición mayor, proyectos de construcción y renovación. Incluyen, pero no se limitan, a actividades tales como derribos, construcción de tabiques, grandes obras de cableado, y trabajos de fontanería que se exigen cortes de agua mayores de una hora |
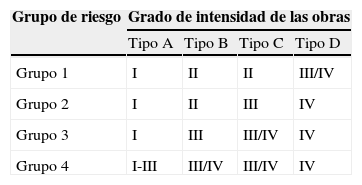
La decisión sobre las medidas a tomar ante cualquier obra en un hospital debe tomarse colegiadamente por un grupo multidisciplinar normalmente integrado en la llamada Comisión de Obras, que debe trabajar conjuntamente con el Comité de Control y Evaluación del Riesgo de Infección. En el estudio anticipado de riesgos deben definirse con claridad la intensidad y riesgos de las obras, según lo expuesto en el apartado anterior. La población en riesgo de IFI puede subdividirse en grupos (grupo 1: bajo riesgo, grupo 2: riesgo medio, grupo 3: riesgo alto y grupo 4: riesgo máximo, que es la que suele estar ingresada en ambientes protegidos).
Debe describirse en el protocolo de prevención aspectos como la localización de las obras, la fecha de comienzo de las mismas y su duración estimada. Debe ponerse por escrito el nombre del responsable de la obra, del contratista de la misma y del profesional de la institución que se responsabiliza del control de la infección. En el documento deben constatarse los teléfonos de los responsables para que pueda haber una comunicación fluida entre ellos.
Las medidas a aplicar deben clasificarse en clases (I–IV) también con arreglo a su intensidad y dividiendo las responsabilidades que corresponden a cada uno de los grupos del equipo multidisciplinar. En las medidas de «clase I», los obreros deben reemplazar inmediatamente las baldosas y material levantado, así como aspirar y limpiar el polvo producido. Los fontaneros deben programar los cortes de agua para momentos de baja actividad, drenar las tuberías de aire antes de volver a dar el agua y vigilar el color del agua. También deben asegurar que se alcanzan las temperaturas prefijadas del agua, mantener el entorno lo más seco posible y comunicar y reparar pérdidas de agua que mojen paredes o suelos. Los servicios de vigilancia deben comunicar pérdidas de agua o la presencia de agua no transparente a los servicios de mantenimiento o de control de la infección. El personal sanitario debe minimizar la exposición de pacientes a la zona de obras y también comunicar la presencia de agua no transparente a los servicios de mantenimiento.
En las medidas de «clase II», los obreros deben controlar el polvo, ejecutar el trabajo con medidas que levanten la menor cantidad de polvo, usar trapos húmedos o aspiración, mantas de agua para minimizar dispersión de polvo y sellar puertas y ventanas con cinta adhesiva. Se deben colocar alfombras antipolvo a la entrada de la zona de obras y limitar físicamente el espacio. Se debe desactivar la ventilación en el área de la obra para evitar la diseminación del polvo. Hay que evaluar la necesidad de cambiar filtros en las áreas de construcción o renovación. Se deben retirar los escombros en contenedores cerrados y cubiertos con mantas húmedas. Los fontaneros deben evitar que se mantenga agua retenida en tuberías o en charcos. Los servicios de vigilancia y limpieza deben pasar fregona húmeda y aspirar con filtros HEPA según se necesite al terminar el trabajo. Además, se deben limpiar las superficies horizontales con un desinfectante. El personal sanitario debe identificar a pacientes de alto riesgo que puedan necesitar ser cambiados de habitación a áreas alejadas del área de construcción. Además debe asegurarse que el equipo y material necesario para el cuidados de los pacientes se almacena protegido de la exposición al polvo.
En las medidas de «clase III», los obreros tienen que asegurarse que se ha completado el protocolo de obras y que ha sido aprobado por la Comisión tras consultar a todos los implicados. Deben erigir una barrera impermeable para el polvo, de suelo a techo. Asegurarse que ventanas, puertas, entradas de tuberías, tomas y salidas de aire y otros lugares de potencial entrada de polvo están convenientemente sellados con cinta adhesiva. Aspirar el polvo de los conductos de aire y los espacios encima de los falsos techos si es necesario. Asegurarse que los obreros en la zona de la construcción visten ropa que se quitan al salir del área de trabajo y con la que no pasan a la zona de los pacientes. No retirar la barrera mecánica hasta que se haya terminado el proyecto, se hayan retirado los escombros y se haya limpiado e inspeccionado el área. Retirar la barrera mecánica con cuidado, minimizando la creación de polvo. En cuanto a la ventilación, deben mantener la presión negativa en la zona de construcción utilizando filtros HEPA portátiles, asegurarse que el aire de la zona de obras es eliminado lejos de las tomas de aire o filtrado a través de filtros HEPA antes de ser recirculado y asegurarse que el sistema de ventilación está funcionando adecuadamente y que los filtros se limpian. Además, deben retirar residuos al final de cada jornada de trabajo, hacer una tolva externa si las obras tienen lugar sobre el nivel del suelo y aspirar diariamente el área de la obra con sistemas de vacío que terminen en filtros HEPA. Los fontaneros deben drenar las tuberías en el área de los pacientes antes de que vuelvan a utilizarse las habitaciones. Los servicios de vigilancia deben inspeccionar las barreras de polvo y diseñar vías de tráfico para los obreros de la construcción que evite el tráfico de sucio a limpio por el área de pacientes. El personal sanitario debe cambiar de emplazamiento a los pacientes de alto riesgo de las áreas próximas a las obras, asegurarse que los pacientes no se aproximan a la zona de obras y asegurarse que la zona de obras se limpia adecuadamente al terminar el trabajo.
Las medidas de «clase IV» incluyen que los obreros erijan una barrera impermeable frente al polvo que tenga una antecámara, antes de iniciar el proyecto. Poner alfombras anti-polvo a la salida y entrada de la zona de obras para evitar la contaminación con los zapatos. Deben de dejar la zona de trabajo a través de la antecámara para que puedan ser sometidos a aspiración con un sistema con filtros HEPA antes de dejar el área de trabajo. El personal que entre la zona de construcción debe llevar cubrezapatos desechables. En caso de orificios en paredes deben repararse en un plazo de 8h o sellarlos temporalmente. Se deben asegurar que se mantiene la presión negativa en la antecámara y en la zona de construcción, así como que los sistemas de ventilación funcionen bien en las áreas adyacentes y en las de construcción. Los servicios de vigilancia deben revisar periódicamente las medidas de protección y hacerlo también al final del proyecto. El personal sanitario debe revisar las medidas del plan de protección con todos los miembros de la Comisión durante y al final del proyecto, así como su eficacia. Los sanitarios no deben entrar en la zona de obras.
El plan para cada obra debe tener una tabla-esquema, como la mostrada en la tabla 7, en la que se contemplen el nivel de medidas a tomar I–IV, según el tipo de obra A–D y el riesgo de los pacientes 1–4.
Medidas de prevencion fuera del hospitalLas recomendaciones destinadas a prevenir la infección fúngica fuera del hospital en los pacientes inmunodeprimidos no han sido evaluadas en estudios de diseño adecuado, por lo que es difícil aplicar a las mismas una categorización en niveles de evidencia científica. Estas recomendaciones están basadas en las prácticas hospitalarias adaptadas a la vida cotidiana de los pacientes fuera de las instituciones sanitarias77,79.
¿Quién está en riesgo de adquisición de IFI en la comunidad?Los factores implicados en el riesgo de padecer IFI son complejos siendo el principal la neutropenia inducida por quimioterapia en pacientes que van a su domicilio a pasar el periodo de aplasia. Existen, además, otros condicionantes que incrementan el riesgo como la presencia de un catéter vascular central, la nutrición parenteral ambulatoria, la colonización por levaduras o el tratamiento inmunosupresor3,8,9,11,14,36. Los subgrupos de enfermos con riesgo elevado de IFI se indicaron en el apartado de la epidemiología. En lo que se refiere a riesgo en pacientes ambulatorios se pueden destacar los enfermos neutropénicos que reciben quimioterapia por leucemia mieloide aguda y/o SMD y que van a pasar el periodo de aplasia a su domicilio. La incidencia se cifra entre el 10–25%9,11,14. El uso de análogos de las purinas como parte de algunos regimenes de quimioterapia ambulatoria en diversas patologías hematológicas también se ha asociado a un mayor riesgo de IFI. Los pacientes sometidos a TPH alogénico9 también tienen una incidencia alta, que puede alcanzar el 10–25% en trasplantes no relacionados o trasplantes de cordón.
Otro grupo de pacientes con riesgo de AI es el paciente con patología respiratoria crónica con uso prolongado de esteroides, especialmente aquellos que reciben dosis altas (>20mg/día o bien una dosis acumulada de 700mg), aunque también se han documentando casos recibiendo altas dosis de esteroides inhalados19. Así como pacientes inmunodeprimidos por otras causas (TOS, cirrosis hepática) o sometidos a tratamiento con anticuerpos monoclonales24.
¿Qué factores ambientales influyen en dicho riesgo y deben evitarse?Aspergillus spp. es un hongo que se encuentra habitualmente en el ambiente, por lo que se inhala con frecuencia. Por tanto, hay que intentar evitar que las personas en riesgo de IFI estén en lugares donde la cantidad de conidias sea superior a la habitual, como zonas de construcción o remodelación y áreas donde se estén llevando a cabo labores de jardinería77–79,108.
Existen varias fuentes adicionales de conidias, como el polvo que se deposita en el suelo y superficies, las plantas ornamentales y elementos de decoración como alfombras, cortinas, cojines. Por tanto, debe limpiarse la residencia del enfermo y evitar el contacto con estos elementos, en la medida de lo posible. En pacientes pediátricos debe mostrarse especial atención al control y limpieza de los juguetes, en particular los peluches.
En cuanto a los hábitos higiénicos de los pacientes con elevado riesgo de IFI, especialmente los receptores de trasplantes de precursores hematopoyéticos en fases de neutropenia grave y prolongada, se ha de recomendar el uso de esponjas y objetos de aseo personal individuales77,79
La inhalación del humo del tabaco o del humo de la combustión del cannabis y/o la marihuana se han asociado con la aparición de AI pulmonar en pacientes inmunodeprimidos, por lo que ambas actividades han de prohibirse en estos pacientes.
Las mascotas también pueden transportar conidias de hongos filamentosos y ser fuente de infección. No existen recomendaciones específicas sobre las IFI transmitidas por mascotas, pero sí que existen recomendaciones generales sobre la prevención de las zoonosis, así como medidas de prevención de infecciones para la población inmunodeprimida en relación a tenencia de mascotas109–112. Para evitar infecciones transmitidas por mascotas se deben instaurar unas sencillas normas de comportamiento e higiene personal. Como normas generales, en caso de convivir o de contactar con animales de compañía, el lavado de manos debe hacerse frecuentemente y no se deben introducir en la boca objetos (lápices, juguetes, etc.). Después de jugar o alimentar a la mascota se deben lavar las manos. Se debe evitar sentarse, recostarse o jugar en lugares contaminados con deposiciones de perros y gatos. Por último, se debe evitar el contacto directo con animales infectados.
¿Qué procedimientos invasivos pueden influir en la adquisición de IFI en la comunidad?No es habitual que los pacientes sean sometidos en su domicilio a procedimientos invasivos que puedan aumentar el riesgo de IFI. Si se diera el caso de alguna manipulación como cambio de catéter, cambio de sonda uretral o nasogástrica o cambios de apósitos de heridas y cicatrices, se debe recomendar la higiene de manos, asepsia y medidas de barrera como guantes estériles, batas estériles y mascarillas77,79.
En el cuidado de personas enfermas, las manos constituyen un vehículo de transmisión de agentes patógenos, ya sea por contacto directo de persona a persona, o indirecto a través de objetos contaminados previamente. La higiene de las manos es una acción muy simple, y se debe de practicar por toda persona que realice cuidados a un paciente, ya se trate de personal sanitario o cuidadores.
¿Puede influir la alimentación en el riesgo de AI?Durante su estancia en las instituciones sanitarias los pacientes con riesgo muy elevado de infecciones oportunistas están sometidos a un riguroso control de ingestión de productos alimentarios. Las principales recomendaciones radican en no ingerir alimentos crudos o no cocinados, evitar aquellos en los que no pueda comprobarse una baja carga bacteriana, evitar que las frutas se consuman sin pelar y no utilizar cubitos de hielo para refrigerar las bebidas77,79. Estas recomendaciones se realizan para evitar infecciones oportunistas de origen bacteriano y se desconoce cual es su papel en la prevención de la infección fúngica. Determinados productos alimentarios, como las especias, el té y otras hierbas para infusión, cervezas no pasteurizadas, las hierbas aromáticas, frescas o secas, que no hayan tenido un proceso de cocción de varios minutos y los quesos azules o aquellos con procesos de fermentación fúngica prolongada como el queso de Cabrales, pueden contener altas concentraciones de hongos filamentosos en su composición, por lo que estarían totalmente prohibidos en los enfermos en riesgo de IFI.
¿Cuáles son las condiciones que deben cumplir el domicilio del paciente para disminuir el riesgo de IFI?Las recomendaciones sobre las condiciones ambientales del hábitat de los pacientes con riesgo de IFI están encaminadas a mantener unas características de climatización y de limpieza que evite, en lo posible, la existencia de conidias en el aire inhalado. La mayor parte de los lugares de residencia de los pacientes cumplen con unas condiciones que, muy probablemente, ofrecen un riesgo muy escaso de transmisión de estos patógenos. Sin embargo, es importante que tanto los enfermos como sus familiares sean ser informados y educados sobre las normas básicas de actuación.
La climatización del domicilio puede efectuarse mediante aparatos convencionales de uso doméstico ya que, en general, no se encuentran conectados a una red general de climatización y, por lo tanto, no existe riesgo de que lleguen conidias desde los circuitos de distribución de dicho aire. Debería instaurarse la práctica sistemática de mantener adecuadamente estos dispositivos, en especial, el recambio frecuente de los filtros de partículas de los mismos77,79.
Se debe aconsejar que no se realicen obras, remodelaciones ni trabajos de jardinería en el domicilio del enfermo mientras exista el riesgo de IFI. En caso de que sean inevitables y el enfermo no pueda ser trasladado, se podría aconsejar el uso de mascarillas protectoras adecuadas (mascarillas de tipo FFP3), si el riesgo potencial se considerara alto.
La limpieza de superficies en el domicilio ha de realizarse de forma regular eliminando la suciedad y el polvo. Los hongos generalmente están presentes en el polvo del ambiente, aunque pueden diseminarse desde materiales o superficies que tengan restos de humedad persistente. Por lo tanto, ha de recomendarse evitar el uso de sistemas de limpieza ambiental que generen polvo, como por ejemplo los aspiradores convencionales domésticos por su potencial riesgo de aerosolización de conidias, aunque sí pueden utilizarse aspiradores con filtros HEPA. También se deben reparar de forma rápida las posibles humedades persistentes en techos y paredes. Deberían evitarse la existencia de alfombras y moquetas que puedan almacenar grandes cantidades de polvo. La limpieza de las superficies puede efectuarse con agua y jabón o detergentes y con una periodicidad en función de su grado de suciedad, aunque podría recomendarse un mínimo de dos o tres veces por semana. Respecto a las plantas ornamentales y las mascotas deben aplicarse las recomendaciones recogidas en las cuestiones precedentes.
El agua también puede ser una fuente de conidias fúngicas. No existe acuerdo sobre si deben instalar filtros en los grifos domiciliarios, pero sí que se debe extremar la higiene y limpiar con lejía los sanitarios. Además, se deben evitar cortinas de ducha ya que son reservorio de hongos. El acceso a piscinas climatizadas o a elementos de recreo, públicos o privados, donde pueda existir una aerosolización de agua tendría que evitarse durante los periodos de máximo riesgo de padecer una IFI.
¿Se precisan controles ambientales extrahospitalarios?La presencia y la cuantificación de conidias de Aspergillus spp. en el aire y el agua del exterior de los hospitales es un tema poco estudiado. Recientemente, se ha publicado un extenso estudio en el área de Madrid en el que se ha comprobado que pueden existir niveles elevados de conidias (hasta 85UFC/m3) en el aire, con predominio de A. fumigatus, y ausencia de las mismas en el agua44. El significado clínico de esta detección no se conoce por lo tanto no puede realizarse ninguna recomendación al respecto, ni relacionada con la vigilancia sistemática de los niveles de colonización ambiental ni con las precauciones dirigidas a los pacientes con riesgo de aspergilosis.
Profilaxis farmacologicaEn los apartados precedentes se han expuesto recomendaciones para intentar evitar que los enfermos en riesgo de IFI adquieran la infección. Pero en algunos grupos de enfermos, en los que el riesgo es muy elevado, debe administrarse además profilaxis con fármacos antifúngicos. En este apartado no puede realizarse una revisión en profundidad sobre la profilaxis antifúngica, ya que se escapa al objetivo de las presentes recomendaciones. No se incluyen los niveles de evidencia de las recomendaciones para lo que remitimos a los lectores a las diferentes guías específicas sobre la profilaxis antifúngica.
¿Qué grupos de pacientes con enfermedades hematológicas tienen que recibir profilaxis con fármacos para la prevención de micosis invasoras causadas por hongos filamentosos?Varios ensayos clínicos han demostrado que la profilaxis con fluconazol113–118 reduce las micosis y aumenta la supervivencia en los receptores de trasplante de precursores hematopoyéticos y en los sometidos a tratamiento quimioterápico intensivo por hemopatías malignas. Sin embargo, por su acción selectiva sobre levaduras, el empleo de fluconazol profiláctico no tiene impacto alguno sobre la incidencia de IFI por hongos filamentosos. Por ello, a lo largo de la década en curso, tras la aparición de los azoles de espectro extendido (itraconazol, voriconazol, posaconazol), la comunidad científica se ha planteado la necesidad de hacer profilaxis con cobertura de hongos filamentosos en ciertas cohortes de pacientes de alto riesgo119.
La pertinencia de la profilaxis antifúngica debe estar guiada por la consideración del coste, la eficacia, las interacciones, la toxicidad y la generación de resistencias, así como por la incidencia de IFI en cada situación clínica. La incidencia de IFI por hongos filamentosos va desde el 0,5% en el trasplante autólogo hasta el 14% en el alogénico con EICH activa, pasando por el 4,3% en la leucemia aguda linfoblástica y el 7,9% en la leucemia aguda mieloblástica36,120. La tabla 8 refleja una síntesis de las recomendaciones de diferentes guías de sociedades científicas, las prácticas estándar de los principales centros y las principales publicaciones respecto a la profilaxis antifúngica primaria en los pacientes hematológicos. En cuanto a la profilaxis secundaria, la evidencia bibliográfica es escasa, aunque la mayoría de los centros emplean profilaxis frente a hongos filamentosos en los pacientes que han sufrido una IFI cuando presentan de nuevo algún factor de alto riesgo.
Síntesis de las recomendaciones sobre la profilaxis antifúngica primaria en enfermos hematológicos
| Enfermedad hematológica | Levaduras | Hongos filamentosos | Duración profilaxis | |
| LAM/SMD | Tto de inducción | Sí | Sí | RAN >1.000/μl |
| Tto de consolidación/intensificación | Sí | ¿?¿¿ | RAN >1.000/μl | |
| LAL | Con tto esteroideo prolongado¿ | Sí | ¿?¿¿ | PDN ≤0,5mg/kd/d |
| Sin tto esteroideo prolongado | No¿¿ | No¿¿ | RAN >1.000/μl | |
| Trasplante autólogo | Con mucositis grado ≥2 (OMS) | Sí | No¿¿ | Día+30 |
| Sin mucositis grado ≥2 (OMS) | No¿¿ | No¿¿ | Día+30 | |
| Trasplante alogénico | Con EICH activa | Sí | Sí | Control EICH |
| Tto esteroideo | Sí | Sí | PDN ≤0,5mg/kg/d | |
| Sin EICH activa ni tto esteroideo | Sí | ¿?¿¿ | Día+75 |
EICH: enfermedad injerto contra huésped; LAL: leucemia aguda linfoblástica; LAM: leucemia aguda mieloblástica; PDN: prednisona; RAN: cifra de neutrófilos en sangre; SMD: síndromes mileodisplásicos; Tto: tratamiento; ¿?: datos insuficientes.
La profilaxis de la IFI por mohos se ha realizado con polienos, candinas y, sobre todo, con triazoles de espectro extendido. Los antifúngicos orales no absorbibles (solución de anfotericina B, nistatina, clotrimazol) pueden reducir la colonización fúngica mucosa e intestinal. Sin embargo, estos fármacos no han demostrado que prevengan el desarrollo de invasión fúngica local ni de IFI y, por tanto, no se recomiendan como estrategia profiláctica121.
Anfotericina B endovenosa, tanto la convencional como sus formas lipídicas, se han mostrado útiles como tratamiento profiláctico de la IFI por mohos a dosis diarias bajas o intermedias o en forma de pulsos de dosis altas122–126. Sin embargo, los resultados de estos estudios no han alcanzado, por ahora, niveles de evidencia suficientes como para que esta estrategia pueda ser considerada de elección en la profilaxis primaria127. Por otra parte, en un reciente estudio aleatorizado y controlado con placebo, la anfotericina B liposomal inhalada ha reducido la incidencia AI pulmonar en pacientes con hemopatías y neutropenia128.
Micafungina, a raíz de un estudio en el que demostró no inferioridad frente a fluconazol, está indicada en profilaxis de la candidiasis invasora en trasplante alogénico o en pacientes en los que se espera el desarrollo de neutropenia profunda (<500 neutrófilos/μl) durante ≥10 días129,130. No existen evidencias suficientemente relevantes del uso candinas como profilaxis de la IFI por hongos filamentosos, por lo que no deben emplearse para esta indicación en enfermos hematológicos.
Itraconazol en cápsulas, a causa de la deficiente y variable biodisponibilidad del fármaco en esta presentación, no debe emplearse como profilaxis de la IFI. Por el contrario, itraconazol en solución oral y endovenoso ha mostrado, en distintos estudios, ser eficaz en la prevención de la IFI por hongos filamentosos, reduciendo la incidencia y la mortalidad de la misma131–134. Estos y otros estudios han demostrado que itraconazol es más efectivo que fluconazol en la prevención de IFI en los pacientes de alto riesgo, pero que causa efectos adversos, principalmente gastro-intestinales, que pueden limitar su uso. Las guías del National Comprehensive Cancer Network (NCCN), la Infectious Disease Society of America (IDSA) y la European Conference on Infections in Leukemia recomiendan el uso profiláctico de itraconazol en el trasplante alogénico con niveles de evidencia/categoría 1, 1 y BI, respectivamente135–137.
La solución oral de itraconazol está aprobada en España como profilaxis de las IFIs en las que previamente se ha visto su sensibilidad a itraconazol y cuando los tratamientos estándar no se consideren apropiados, en pacientes con neoplasias hematológicas malignas o trasplantados y de los que cabe esperar que lleguen a presentar neutropenia profunda (<500neutrófilos/μl)138. En los pacientes que reciban itraconazol en solución oral debe administrarse con el estómago vacío para conseguir una adecuada absorción del fármaco, y si la tolerancia al fármaco no es adecuada, se debe sustituir por otro alternativo.
Voriconazol, en función de su espectro y su favorable perfil de seguridad, podría ser igualmente eficaz y mejor tolerado que itraconazol en la profilaxis de la IFI por hongos filamentosos. El NCCN y la IDSA adjudican a voriconazol profiláctico un nivel de evidencia/categoría BII en LMA/SMD y en los trasplantes alogénicos136,137. Hasta la fecha, el fármaco no está aprobado para dicha indicación en nuestro país.
Posaconazol, disponible a día de hoy únicamente en forma de solución oral, ha demostrado en dos recientes estudios aleatorizados y controlados, alta eficacia y excelente perfil de seguridad en la profilaxis de la IFI en pacientes de alto riesgo. El primero de los estudios incluyó enfermos con LMA o SMD, tratados con quimioterapia intensiva. La mitad de los pacientes recibió posaconazol oral y la otra mitad itraconazol o fluconazol. La rama de posaconazol presentó menor incidencia de IFI (2 vs. 8%, p<0,001) y de AI (1 vs. 7%; p<0,001). La mortalidad relacionada con IFI fue significativamente menor con posaconazol. El porcentaje de efectos adversos fue similar en los dos grupos de tratamiento12. El otro estudio incluyó pacientes sometidos a trasplante alogénico que presentaban EICH. La mitad de los pacientes recibió posaconazol y la otra mitad fluconazol, durante 16 semanas. La incidencia global de IFI tendió a ser menor en el grupo de posaconazol, sin alcanzar la significación estadística. Sin embargo, la incidencia de IFI durante el tratamiento, la incidencia de AI y las infecciones de brecha durante el tratamiento fueron significativamente menores en los pacientes con posaconazol. La mortalidad relacionada con la IFI fue también menor en el brazo de posaconazol. El perfil de efectos adversos fue similar en ambos grupos139. El NCCN y la IDSA recomiendan la administración de posaconazol profiláctico en las LMA/SMD y en el trasplante alogénico con EICH (categoría/nivel de recomendación 1)136,137. Las guías de la European Conference on Infections in Leukemia lo recomiendan en las leucemias agudas en tratamiento quimioterápico de inducción y en el trasplante alogénico con un nivel de evidencia AI135. Posaconazol está aprobado en España para profilaxis de la IFI en pacientes que estén recibiendo quimioterapia de remisión-inducción para LMA o SMD, que se espera desarrollen neutropenia prolongada y que presenten alto riesgo de desarrollar IFI; y para receptores de trasplante que estén recibiendo dosis altas de terapia inmunosupresora para EICH y que tengan alto riesgo de desarrollar IFI140.
¿En qué momento y durante cuánto tiempo se debe administrar la profilaxis en enfermos hematológicos?La duración óptima de la profilaxis antifúngica frente a los hongos filamentosos no está completamente aclarada y depende de los factores de riesgo subyacentes141. Así pues, en los pacientes neutropénicos resulta lógico mantenerla hasta que los neutrófilos sean > 1.000/μl y en los portadores EICH activa hasta que se controle la actividad del brote y la dosis de corticoide sea ≤0,5mg/kg/día de prednisona (tabla 8).
¿Qué pacientes con enfermedades no hematológicas son candidatos a recibir profilaxis para micosis invasoras causadas por hongos filamentosos?Las poblaciones no hematológicas en riesgo de padecer una infección por un hongo filamentoso son los receptores de un TOS y un grupo heterogéneo de otro tipo de pacientes inmunodeprimidos.
Gracias a los avances en el uso de la terapia inmunosupresora, los pacientes receptores de un TOS presentan una mayor supervivencia. De forma paralela la mortalidad de origen infecciosa ha disminuido sustancialmente, aunque las complicaciones infecciosas son aún una de las principales causas de muerte de estos pacientes142. En este sentido, la incidencia de AI es muy elevada entre los pacientes trasplantados de pulmón, de corazón y de intestino, situándose entre el 6–14%, según la profilaxis empleada143. En el receptor de un trasplante de pulmón, la AI presenta dos formas bien diferenciadas en función del tiempo postrasplante. En el periodo precoz predominan las afecciones de la vía aérea, como la traqueobronquitis ulcerativa y la infección de la anastomosis bronquial. Las formas pulmonares y diseminadas son mas frecuentes en el periodo tardío y suelen observarse en enfermos con rechazo crónico144,145.
En el trasplante hepático, la incidencia documentada en un reciente estudio nacional fue del 2,8%14. Ahora bien, en los pacientes de alto riesgo (insuficiencia renal, técnica de depuración renal, retrasplante o reintervención quirúrgica), la incidencia puede alcanzar el 20%13. Una menor incidencia (<1%) se encuentra entre los receptores de un trasplante renal13–15,143.
Por otra parte, existe un grupo heterogéneo de pacientes en riesgo de presentar una IFI cuyo estado de inmunosupresión no está en relación con un TOS y que ya fueron descritos en el primer apartado de estas recomendaciones. Estos son pacientes con sida que no reciben tratamiento antirretroviral de alta actividad, grandes quemados y enfermos críticos23,25,146,147. En estos pacientes las alteraciones que condicionan un estado de inmunosupresión son numerosas, destacando la malnutrición, la enfermedad pulmonar obstructiva crónica, insuficiencia hepática o administración de corticoesteroides. Asimismo, las inmunodeficiencias congénitas son las enfermedades que presentan la mayor incidencia de AI entre los niños. Así, en los pacientes afectos de la enfermedad de Wiskott-Aldrich puede alcanzar el 30–6,5% en la enfermedad granulomatosa crónica16,148.
Así pues, las estrategias profilácticas podrían ser útiles en este tipo de pacientes con alto riesgo de contraer IFI por hongos filamentosos. Sin embargo, hasta la fecha solo existen evidencias de que la profilaxis es una estrategia útil en los receptores de un trasplante pulmonar, determinados receptores de alto riesgo de otros trasplantes de órgano sólido y los pacientes que padecen trastornos hereditarios de inmunidad como, por ejemplo, los afectos de enfermedad granulomatosa crónica.
¿Qué fármacos y por qué vías deben administrarse en los pacientes no hematológicos?En receptores de un trasplante de pulmón, estudios no aleatorizados con anfotericina B en aerosol como profilaxis han presentado resultados discordantes a causa de las limitaciones en el diseño de los mismos y en la selección de pacientes en riesgo. No obstante, la eficacia de este polieno alcanza el 92%149–151. Esta vía de administración evita los efectos secundarios sistémicos y las interacciones medicamentosas. La administración de 25mg de anfotericina B liposomal es eficaz para proteger al trasplantado pulmonar de la infección por Aspergillus spp., durante un periodo de 15 días, sin que se detecte absorción sistémica ni se muestren efectos deletéreos sobre la función pulmonar150. En un ensayo clínico en el que se incluyeron un total de 104 pacientes que recibieron de forma profiláctica anfotericina B liposomal nebulizada, únicamente se diagnosticaron dos episodios de IFI (1,9%)152. La administración de anfotericina B complejo lipídico nebulizada, a dosis de 50mg cada 2 días las 3 primeras semanas y semanalmente desde entonces, también ha demostrado ser efectiva en esta población151,153.
Otra opción es la administración de voriconazol. En un estudio no aleatorizado que incluyó 95 pacientes trasplantados de pulmón redujo la incidencia de AI al 1,5% y la de infecciones fúngicas producidas por otros hongos al 3%154. Sin embargo, se presentó toxicidad hepática hasta en el 60% de los casos y el 14% abandonó la profilaxis debido a los efectos secundarios. Además se debe realizar una estrecha monitorización de las concentraciones de anticalcineurínicos dado que voriconazol inhibe el metabolismo de los mismos. Para evitar estos inconvenientes se han iniciado los estudios de la administración de voriconazol de forma inhalada en modelos murinos155.
La profilaxis en el trasplante hepático con anfotericina B deoxicolato es ineficaz a dosis bajas (0,5mg/kg/d) y a dosis superiores produce graves efectos secundarios como reacciones infusionales, nefrotoxicidad o trastornos metabólicos. En cambio, las formulaciones lipídicas disminuyen la nefrotoxicidad y las reacciones infusionales. Un estudio prospectivo aleatorizado con anfotericina B liposomal a dosis de 1mg/kg/día durante 5–10 días demostró una reducción de las micosis invasoras en general, pero no de la AI en particular156. Otros estudios con controles históricos sugerían una asociación protectora entre la utilización de anfotericina B liposomal y la adquisición de IFI en receptores de un trasplante hepático157,158. En otro trabajo en pacientes con estancia en UCI superior a 5 días se ensayaron diferentes dosis de anfotericina B liposomal con idénticos resultados159. En todo caso se debe administrar a determinados pacientes de forma dirigida por un periodo de tiempo variable en relación a la duración de los factores de riesgo (tabla 9)160.
Esquema de profilaxis frente a hongos filamentosos en pacientes de alto riesgo
| Indicación | Población diana | Fármaco antifúngico | Duración | Observaciones |
| Trasplante pulmonar | Toda | 1. Anfotericina B liposomal 25mg o anfotericina B complejo lipídico 50mg, nebulizada 3 veces/semana hasta resolución sutura bronquial, una vez/semana del segundo al sexto mes y una vez/quincenal desde el sexto mes | Indefinida | Broncoespasmo como efecto secundario |
| 2. Voriconazol 200mg/12h oral2 | Determinada por la presencia de factores de riesgo, aunque suele administrarse un mínimo de 4 meses | Monitorizar enzimas hepáticas y concentraciones de voriconazol y anticalcineurínicos | ||
| Otro trasplante de órgano sólido | Pacientes de alto riesgo de IFI precoz: técnica depuración renal, enfermedad por CMV, insuficiencia hepática fulminante (trasplante hepático), fallo primario del injerto, retrasplante | 1. Anfotericina B formulación lipídica 2,5–5mg/kg/d Parenteral | Determinada por la presencia de factores de riesgo | Estudios realizados preferentemente en trasplante hepático |
| 2. Itraconazol 400mg/d oral | Estudio realizado en trasplante cardíaco. Monitorizar concentraciones de anticalcineurínicos | |||
| 3. Caspofungina 70mg/d en primera dosis y seguir con 50mg/d | Estudio realizado en trasplante hepático. Monitorizar enzimas hepáticas. En el estudio se administró durante 21 días | |||
| Pacientes de alto riesgo de IFI tardío: rechazo crónico, recidiva hepatopatía VHC (trasplante hepático), técnica depuración renal | 1. Anfotericina B liposomal 25mg o anfotericina B complejo lipídico 50mg, nebulizada 3 veces/semana el primer mes, una vez/semana del segundo al sexto mes y una vez/quincenal desde el sexto mes en adelante | Broncoespasmo como efecto secundario | ||
| Enfermedad granulomatosa crónica | Pacientes mayores de 5 años | 1. Itraconazol 200mg/día vía oral (100mg/día<13 años o<50kg de peso) | Indefinida | En el ensayo clínico la profilaxis se efectuó durante un año |
Itraconazol se ha evaluado en un ensayo prospectivo en receptores de trasplante hepático donde ha demostrado una eficacia limitada161. No obstante, en los pacientes receptores de trasplante cardíaco de alto riesgo (aislamiento de Aspergillus spp. en muestra respiratoria, reintervención quirúrgica, técnica de depuración renal, enfermedad por citomegalovirus), su administración a dosis de 400mg/día desde el quinto día hasta el tercer o sexto mes se asoció a una incidencia inferior de la enfermedad162. Asimismo, en la enfermedad granulomatosa crónica, el itraconazol administrado durante un año a dosis de 200mg/día se ha mostrado eficaz en la prevención de la AI163.
Recientemente la caspofungina, administrada durante 21 días, ha sido evaluada para la profilaxis de la IFI en los pacientes trasplantados hepáticos de alto riesgo en un estudio multicéntrico, abierto y no comparativo. De los 71 pacientes incluidos, dos desarrollaron IFI, uno por Mucor y otro por Candida albicans. Se observaron alteraciones de las enzimas hepáticas de toxicidad grado IV en el 27,7% de los pacientes que obligaron al abandono de la profilaxis de seis pacientes164.
En los pacientes trasplantados de órgano sólido que presenten factores de riesgo de forma tardía, como sería la hemodiálisis, la recidiva de la infección por el virus de la hepatitis C o el rechazo crónico, se debe plantear una profilaxis a largo plazo, por lo que no parece recomendable la utilización de fármacos por vía parenteral dada su incomodidad y la aparición de efectos adversos. En estos casos podría ser más adecuado la utilización de profilaxis con otras vías de administración como la anfotericina B lipídica nebulizada.
¿En qué momento y durante cuánto tiempo deben recibir profilaxis los pacientes no hematológicos?En el trasplante de pulmón un periodo de cuatro meses podría ser suficiente en los pacientes con resolución de la sutura bronquial, sin rechazo, sin daño alveolar, sin infección por citomegalovirus o sobreinmunosupresión. Sin embargo, puede mantenerse de forma indefinida por el riesgo de infección tardía y el beneficio potencial de la profilaxis, así como por los escasos efectos secundarios, en caso de utilizar anfotericina B liposomal nebulizada.
En el resto de receptores de TOS la profilaxis se debe administrar en el momento que aparezcan los factores de riesgo y debe durar mientras los mismos estén presentes165. Un esquema de las recomendaciones de la profilaxis frente a hongos filamentosos en pacientes de riesgo se muestra en la tabla 9.
¿Cuándo deben monitorizarse las concentraciones plasmáticas de los antifúngicos?En los últimos años se ha producido un aumento en el interés en la cuantificación de la concentración plasmática de antifúngicos. Esto se debe a que existen algunas evidencias que indican que el fracaso terapéutico está relacionado en ocasiones con la existencia de concentraciones subóptimas del fármaco y que, además, estos fármacos tienen graves efectos tóxicos cuando se supera una determinada concentración plasmática166.
Varios de los antifúngicos comercializados muestran características farmacocinéticas que hacen que sus concentraciones sean impredecibles, por lo que debe recomendarse su cuantificación. Tanto los polienos como las equinocandinas no necesitan de la determinación de concentraciones. Sin embargo, los triazoles, a excepción de fluconazol, tienen una variabilidad farmacocinética tan significativa, que la mayoría de los expertos recomiendan realizar la cuantificación de las concentraciones plasmáticas de itraconazol, voriconazol y posaconazol166–168.
Itraconazol muestra problemas de absorción en sus formulaciones orales, tiene variaciones en su metabolismo que hace que un 25% de seres humanos metabolicen rápidamente el fármaco y, además, tiene interacciones medicamentosas con varias decenas de fármacos que se metabolizan en el hígado por el complejo P450167,169. No existen recomendaciones basadas en evidencias de mucho peso estadístico, pero actualmente se recomienda realizar concentraciones plasmáticas al iniciar la medicación oral, si existen alteraciones gastrointestinales que dificulten la absorción, si se produce deterioro clínico o si se coadministran fármacos con interacciones. Las determinaciones deben hacerse tras 5–7 días de tratamiento y en el valle farmacocinético. Las concentraciones de itraconazol deben ser superiores a 0,5mg/l para ser eficaces como profilaxis y >1mg/l si se utiliza como terapia específica166.
Voriconazol no tiene problemas de absorción, pero muestra una gran variabilidad en su metabolismo. Es degradado, entre otros, por el CYP2C19 que muestra variaciones individuales. Así un 70% de la población caucasiana es metabolizadora rápida y resulta más complicado que se alcancen las concentraciones plasmáticas eficaces. Por otro lado, hasta un 20% de la población oriental es homocigota metabolizadora lenta y alcanzan concentraciones tóxicas con facilidad. Además, voriconazol tiene interacciones medicamentosas con muchos fármacos metabolizados en el hígado. Las recomendaciones para determinar concentraciones de este fármaco indican que debe hacerse al inicio de la terapia, si aparece empeoramiento clínico, cuando se cambie la dosis, si existen alteraciones hepáticas o gastrointestinales, si se pautan fármacos con interacciones y en niños. Debe realizarse tras 48h de tratamiento y en el valle. Las concentraciones recomendadas deben ser 1–4mg/l para ser óptimas. Por debajo de 1mg/l hay evidencias de fracaso terapéutico y por encima de 4mg/l de toxicidad hepática. Por encima de 5,5mg/l aparece toxicidad neurológica168,170.
Posaconazol se absorbe con dificultad en el estómago dependiendo del pH gástrico. Su absorción se favorece si se administra con una comida que incluya grasa. Un total de 14g de grasa incremente la AUC de posaconazol en un 200%. Asimismo, tiene interacciones con fármacos que se metabolizan en el hígado. Se recomienda determinar concentraciones de este azol al inicio de la terapia, si hay empeoramiento clínico, si existen alteraciones gastrointestinales o fármacos con interacciones. Se deben realizar tras cinco días de tratamiento y en el valle farmacocinético. Concentraciones >0,7mg/l se han correlacionado con eficacia clínica. En caso de no alcanzar esta concentración, se recomienda revisar si el enfermo se toma el fármaco con una comida grasa y se puede aumentar la dosis a 400mg/8h166.
Conflicto de intereses- 1.
En los últimos cinco años, I.R. ha sido consultora/asesora y ha recibido honorarios por ponencias de Gilead Sciences, Pfizer, Merck Sharp and Dohme, Esteve, Novartis, Cephalon, Astellas Pharma y Schering Plough.
- 2.
En los últimos cinco años, J.M.A. ha sido consultor y ha dado ponencias remuneradas por Astellas, Pfizer, Gilead, Merck, Roche, y Schering-Plough.
- 3.
En los últimos cinco años, B.A. ha recibido fondos de investigación de Gilead Sciences, Pfizer, y el Instituto de Salud Carlos III. Ha recibido honorarios por ponencias de Gilead Sciences, Merck Sharp and Dohme, Pfizer, y Novartis.
- 4.
En los últimos cinco años, E.B. ha sido asesor de Pfizer, Novartis, Janssen, Baxter, McDonalds, Astellas, Wyeth Lederle, Optimer y Gilead. Ha recibido fondos de investigación de Pfizer, Novartis, Schering-Plough, y honorarios por ponencias de Pfizer, Novartis, Astellas, Wyeth Lederle, y Gilead.
- 5.
En los últimos cinco años, O.L. ha recibido honorarios por ponencias de Pfizer, Novartis y Roche.
- 6.
En los últimos cinco años, J.L.R.T. ha recibido fondos de investigación de Astellas Pharma, Gilead Sciences, Merck Sharp and Dohme, Pfizer, Schering Plough, Soria Melguizo SA, the European Union, the Spanish Agency for International Cooperation, the Spanish Ministry of Culture and Education, The Spanish Health Research Fund, The Instituto de Salud Carlos III, The Ramon Areces Foundation, The Mutua Madrileña Foundation. Ha sido consultor/asesor de the Panamerican Health Organization, Gilead Sciences, Merck Sharp and Dohme, Mycognostica, Pfizer, y Schering Plough. Ha recibido honorarios por ponencias de Gilead Sciences, Merck Sharp and Dohme, Pfizer, y Schering Plough.
- 7.
En los últimos cinco años, A.S ha recibido fondos de investigación de Pfizer. Ha sido consultar/asesor de Pfizer, Novartis, y Astellas. Ha recibido honorarios por ponencias de Gilead Sciences, Merck Sharp and Dohme, Pfizer, Astellas Pharma, Novartis y Cephalon.
- 8.
En los últimos cinco años, C.V. ha sido consultor/asesor y ha recibido honorarios por ponencias de Gilead Sciences, Pfizer, Esteve, Astellas Pharma y Schering Plough.
- 9.
En los últimos cinco años, R.Z. ha recibido fondos de investigación de Pfizer. Ha sido asesor/consultor de Merck Sharp and Dohme, Pfizer, y Astellas. Ha precibido honorarios por ponencias Gilead Sciences, Merck Sharp and Dohme, Pfizer, Astellas Pharma y Cephalon.
- 10.
En los últimos cinco años, M.C.E. ha recibido fondos de investigación de Astellas Pharma, bioMerieux, Gilead Sciences, Merck Sharp and Dohme, Pfizer, Schering Plough, Soria Melguizo SA, the European Union, the ALBAN program, the Spanish Agency for International Cooperation, the Spanish Ministry of Culture and Education, The Spanish Health Research Fund, The Instituto de Salud Carlos III, The Ramon Areces Foundation, The Mutua Madrileña Foundation. Ha sido asesor/consultor de the Panamerican Health Organization, Gilead Sciences, Merck Sharp and Dohme, Pfizer, and Schering Plough. Ha recibido honorarios por ponencias de Gilead Sciences, Merck Sharp and Dohme, Pfizer, Astellas Pharma y Schering Plough.
- 11.
Otros autores: declaran no tener ningún tipo de conflicto.