Introducción
En los últimos años se ha observado un incremento en la prevalencia de cepas resistentes a los fármacos en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) que no han recibido previamente un tratamiento antirretroviral (TAR)1-4. Además, se ha detectado en estos pacientes la aparición de cepas multirresistentes5. Estas resistencias se producen por la transmisión de virus desde pacientes en TAR sin supresión completa de la replicación viral, principalmente, por el uso de pautas de tratamiento subóptimas o por falta de adherencia. Se ha demostrado que la presencia de virus resistentes reduce la eficacia del tratamiento inicial y de los posteriores, ya que el fracaso virológico se produce antes1. Por tanto, la realización de una prueba de resistencia es útil para escoger la mejor opción de tratamiento y así conseguir una respuesta óptima.
La mayoría de los estudios de resistencias primarias se han realizado en pacientes con infección primaria reciente1,2,6,7. Las guías publicadas por las sociedades científicas recomendaban realizar pruebas de resistencia en la infección aguda o reciente y sólo aconsejaban realizarlos en pacientes con infección establecida cuando la prevalencia de resistencia esperada superase el 5%8,9. Estas recomendaciones se han basado en parte en que, en ocasiones, las subpoblaciones de cepas resistentes, tienden a ser minoritarias respecto a las cepas salvajes en ausencia de TAR, y las pruebas genotípicas, habitualmente usadas en los estudios de resistencia, no son capaces de detectar cepas minoritarias. Esta reversión en la proporción de mutantes resistentes respecto a las cepas salvajes, sin embargo, se ha observado principalmente en pacientes tras el TAR más que en aquellos infectados con cepas resistentes, las cuales se detectan durante tiempo prolongado. Por otra parte, los pacientes de nuevo diagnóstico que asisten a las consultas especializadas y que van a requerir un tratamiento presentan, en su mayor parte, una infección crónica o de duración desconocida.
Por estos motivos, realizamos este estudio para conocer la prevalencia de resistencias primarias a los fármacos antirretrovirales en los pacientes diagnosticados de infección por VIH, tanto aguda como crónica, en una unidad de VIH de Gran Canaria (en donde toda la población tiene acceso gratuito al TAR) durante el período 2002-2005 y las características clínico-epidemiológicas de los mismos.
Métodos
Pacientes
Se realizó un estudio prospectivo en que se incluyeron todos los pacientes diagnosticados de infección por VIH en los años 2002 y 2005 y aquellos pacientes en que se solicitó por el clínico la realización de las pruebas de resistencia en los años 2003 y 2004, siguiendo las recomendaciones de los organismos oficiales. En los casos en que no se realizó la prueba de resistencia fue exclusivamente porque no se dispuso de muestra suficiente para el estudio o porque la carga viral plasmática era inferior a 1.000 copias/ml. Se estudiaron un total de 125 pacientes: 43 diagnosticados en el año 2002 (88,0% del total de pacientes), 31 en los años 2003-2004 (28,9%) y 51 en el año 2005 (87,9%). Trece de ellos se diagnosticaron de infección primaria reciente (5 en los años 2003-2004 y 8 en el año 2005), definida por una seroconversión documentada en los 12 meses previos, o evidencia de una infección aguda. Se recogieron los datos demográficos y clínicos de la población de estudio (edad, sexo, fecha de diagnóstico de la infección por VIH, prácticas de riesgo de infección, inmigración, carga viral basal, recuento de CD4 y subtipo de VIH).
Muestras
Se extrajo muestra de sangre de los pacientes en tubos con anticoagulante EDTA (ácido etilendiaminotetraacético). En las primeras 2 h de la extracción se separó el plasma y se congeló a 80 °C en 3 alícuotas hasta la realización de la prueba. Antes del estudio de resistencia, se midió la carga viral plasmática mediante el equipo Cobas Amplicor HIV Monitor o Cobas TaqMan HIV (Roche Diagnostics). Para la realización de las pruebas de resistencia se requirió la presencia de más de 1.000 copias/ml de ARN-VIH en plasma.
Pruebas de resistencia genotípicas
Las pruebas de resistencia se realizaron por secuenciación genética del gen pol que codifica la proteasa (PR) y la transcriptasa inversa (TI) usando el sistema ViroseqTM HIV-1 Genotyping System v.2 (Abbott Molecular). La interpretación de la secuencia se realizó con la base de datos de la Universidad de Stanford versión 4.2.2. (http://hivdb.stanford.edu). Las mutaciones en el gen de la TI para análogos de nucleósido/tido (ITIAN) consideradas fueron la M41L, E44DA, A62V, K65R, D67NG, T69i, K70R, L74V, V75AIMTS, F77L, Y115F, F116Y, V118I, Q151M, M184IV, L210W, T215YFCDESNIV y K219QER y las asociadas a resistencia a los no análogos de nucleósido/tido (ITINAN) fueron la A98G, L100I, K101E, K103NS, V106AM, V108I, Y181CI, Y188LHC, G190ASEQ, P225H, M230L y P236L. En el gen de la PR se consideraron mutaciones mayores para los inhibidores de la proteasa (IP) la D30N, V32I, L33F, M46I/L, G48V, I50V, V82A/T/F/S, I84V y L90M.
Análisis estadístico
Para el análisis estadístico de los resultados se utilizó la prueba de chi cuadrado para comparar variables cualitativas. Se aceptó la significación estadística para una p < 0,05.
Resultados
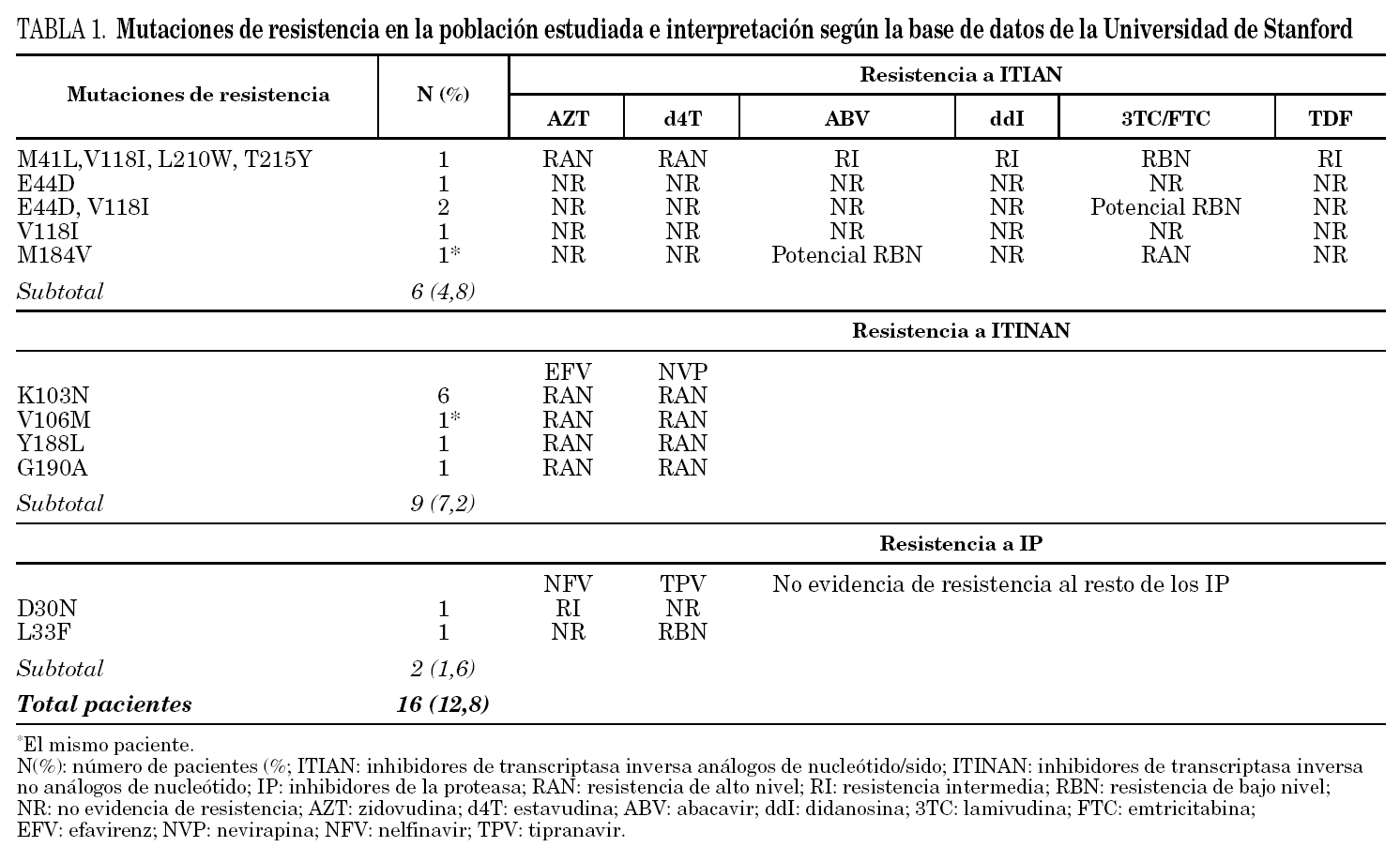
De los 125 pacientes incluidos en el estudio, en 16 (12,8%) se detectó la presencia de mutaciones de resistencia, 4 pacientes con infección reciente (30,8% del total de pacientes con infección reciente) y 12 pacientes con infección crónica o con duración de la infección desconocida (10,7%). En la tabla 1 se muestran las mutaciones de resistencia detectadas en estos pacientes. Seis pacientes (4,8%) presentaron mutaciones de resistencia a los ITIAN, 9 (7,2%) a los ITINAN y 2 pacientes (1,6%) a los IP.
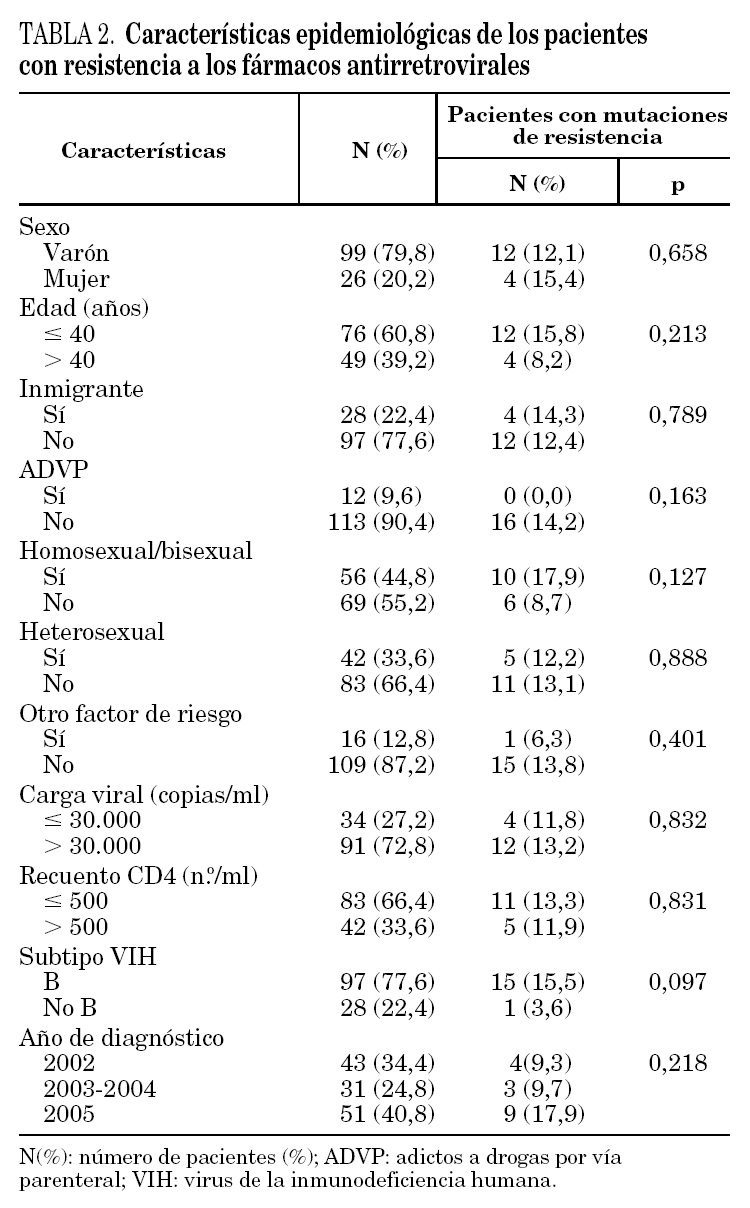
En la tabla 2 se muestran las características epidemiológicas y clínicas de todos los pacientes incluidos en el estudio y de los pacientes con mutaciones de resistencia a los antirretrovirales. No se observaron diferencias estadísticamente significativas en las características clínico-epidemiológicas de los pacientes con y sin resistencia a los fármacos antirretrovirales. Sin embargo, presentó mayor porcentaje de resistencias la población homosexual/bisexual (17,9%), frente a la heterosexual (12,2%) y adictos a drogas por vía parenteral (ADVP) (0%), los pacientes con subtipo B (15,5%) frente al subtipo no B (3,6%) y los pacientes diagnosticados en el año 2005 (17,9%) en relación con los diagnosticados en 2002 (9,3%).
En los pacientes con diagnóstico de infección crónica o de duración desconocida, la tasa de resistencia aumentó desde un 9,3% (4 pacientes) en el año 2002 hasta un 16,3% (7 pacientes) en el año 2005.
Discusión
En los pacientes con infección por VIH, la elección de la primera combinación de fármacos antirretrovirales es uno de los factores más importantes para conseguir una respuesta virológica máxima y duradera10. El tratamiento se debe elegir de forma que se facilite su cumplimiento y se conserven las opciones terapéuticas futuras. Debido al aumento en la prevalencia de resistencias primarias, las pruebas de sensibilidad se han convertido en una herramienta de ayuda para elegir la mejor opción al iniciar el TAR. La tasa global de resistencia primaria encontrada en nuestra población fue elevada (12,8%), similar a otros estudios realizados en diferentes países europeos en los últimos años, en donde las resistencias globales oscilan entre un 8% en Francia11, 8,6% en Alemania12, 10,4% en un estudio multicéntrico realizado en 19 países en Europa4 y un 14,2% en el Reino Unido3. Nuestra tasa de resistencia es casi el doble de la comunicada en un estudio multicéntrico realizado en España13 entre los años 1997 y 2001 en donde participó nuestro hospital (6,7%). No obstante, los resultados de los diferentes estudios no siempre pueden ser comparables debido a diferencias en el diseño del estudio, ya que las tasas de resistencia pueden variar dependiendo de las características clínico-epidemiológicas de la población de estudio (si se incluyen sólo pacientes con infección aguda o con infección crónica, del subtipo de VIH más prevalente, de la edad media de la población, de los principales factores de riesgo, etc.), del período de tiempo en que se realiza (a lo largo de los años se ha observado un aumento en las tasas de resistencia), del acceso a los fármacos en las distintas regiones geográficas y de la interpretación de los resultados de las pruebas de sensibilidad.
En nuestro estudio, los resultados del período 2003-2004 están limitados por la baja representatividad de las muestras, no obstante, observamos un aumento en los porcentajes de resistencia a lo largo de los años, llegando a casi un 18% en los pacientes diagnosticados en el año 2005 (16,3% en los pacientes con infección crónica), porcentaje cercano al comunicado en el Reino Unido, que es el país que ha comunicado las tasas más elevadas en Europa, en un estudio realizado en los años 2002-20033. Además, hemos encontrado una alta tasa de prevalencia de resistencias en los pacientes con infección primaria (> 30%), superior a la comunicada en los últimos años en un estudio realizado en España14. Este porcentaje es uno de los más altos comunicados, aunque debe de contemplarse teniendo en cuenta que sólo se incluyen 13 pacientes con infección primaria reciente.
Con relación a las características de la población, observamos diferencias no significativas respecto al factor de riesgo de transmisión (mayor porcentaje de resistencia en la población homosexual/bisexual) y al subtipo de VIH. El bajo número de pacientes diagnosticados de infección por VIH con transmisión por ADVP en la población de Gran Canaria en los últimos años (http://www.gobiernodecanarias.org/sanidad/scs/3/3-5/3-5-6/boletin/ppal.jsp), hace que la ausencia de resistencias en este grupo de pacientes no se pueda extrapolar a otros estudios. Las resistencias detectadas en los subtipos no B son más bajas que en el subtipo B al igual que en otros trabajos publicados4. Esto, probablemente, es debido al tiempo de exposición de los virus a los fármacos, ya que el subtipo B es más prevalente en Europa y Norteamérica y los subtipos no B en África y Asia, en donde no hay un acceso universal a los fármacos. No obstante, a medida que el acceso a los fármacos aumente o estos subtipos se distribuyan en otros países, estas resistencias probablemente aumentarán, y de hecho ya en algún estudio se ha observado un aumento en las resistencias en diferentes subtipos a lo largo de los años4.
En nuestro estudio, hemos detectado resistencias en todas las familias de fármacos antirretrovirales. Las tasas de resistencia más altas se han producido frente a los ITINAN (7,2%) y en todos los casos, un cambio en un solo nucleótido produjo resistencia a todos los fármacos de esta familia. Debido a que los ITINAN son fármacos de primera línea en el tratamiento inicial de los pacientes VIH, se hace imprescindible la realización de pruebas de resistencia a todos los pacientes, al menos si se va a iniciar un tratamiento con ITINAN. En relación con la resistencia a los ITIAN, sólo 2 pacientes presentaron altos niveles de resistencia; uno por la acumulación de mutaciones relacionadas con análogos de timidina (TAM) y otro por la mutación en el codón 184. No obstante, se evidencia la presencia de mutaciones de resistencia en otros 4 pacientes, que por sí solas no generan resistencia pero, en estos casos, sería importante seleccionar bien la combinación de fármacos que hay que utilizar así como realizar un seguimiento temprano del paciente ya que hay una mayor probabilidad de fracaso terapéutico por la presencia de mutantes resistentes con menor capacidad de replicación (fitness viral). En relación con los IP, las tasas de resistencia son bajas y sólo se ha detectado un paciente con resistencia a nelfinavir por la mutación D30N y otro con una resistencia de bajo nivel a tipranavir por la L33F, que no generan resistencia cruzada con otros IP. Esta baja tasa encontrada probablemente se deba, en parte, a la mayor barrera genética de estos fármacos, lo que significa que, en general, precisan de la acumulación de varias mutaciones para que el VIH escape a su acción, a diferencia de las otras familias que son más lábiles a las mutaciones. No obstante, hemos detectado mutaciones secundarias a los IP en un alto porcentaje de los pacientes del estudio.
Probablemente, las resistencias globales en nuestra población sean incluso más altas que las detectadas, ya que no se puede excluir la presencia de mutantes con menor fitness viral que pueden estar enmascaradas debido a la ausencia de presión selectiva del TAR. Estas mutantes se seleccionarán de forma rápida cuando se inicie un TAR, lo que favorecería el posterior desarrollo de resistencias al resto de los antirretrovirales. Esto supondría una progresión más rápida de la enfermedad y, secundariamente, un incremento de la transmisión de variantes resistentes debido al uso de terapias subóptimas. Debido a esto, creemos importante realizar estudios de seguimiento en pacientes en los que no se ha detectado una resistencia inicial a los fármacos antirretrovirales para detectar precozmente el fracaso terapéutico por resistencia a los antirretrovirales y así conocer la magnitud real de lo que consideramos que es un problema de salud pública.
En conclusión, debido al incremento continuo de las tasas de resistencia a los fármacos de primera línea utilizados en el tratamiento inicial de los pacientes con VIH, nuestros datos apoyan el hecho de que se deben de realizar pruebas de resistencias a todos los nuevos pacientes diagnosticados de infección por VIH antes de iniciar un tratamiento antirretroviral, como ya recientemente se está recomendado. Las altas tasas de resistencia encontradas deben de ser tenidas en cuenta en la actualización de las recomendaciones sobre tratamientos iniciales y de profilaxis postexposición en nuestra área geográfica.
Correspondencia: Dra. M.J. Pena López.
Servicio de Microbiología.
Hospital de Gran Canaria Dr. Negrín.
Barranco de la Ballena, s/n.
35020 Las Palmas de Gran Canaria. España.
Correo electrónico: mpenlopd@gobiernodecanarias.org
Manuscrito recibido el 26-6-2006; aceptado el 23-2-2007.