Sr. Editor:
Strongyloides stercoralis es un nematodo intestinal de distribución mundial, endémico en áreas tropicales y subtropicales, que infecta de 50 a 100 millones de personas. En España se presenta en casos esporádicos, especialmente en el área mediterránea1 y en trabajadores agrícolas, con prevalencias del 12,5% en este colectivo2. Con el aumento de la inmigración se ha incrementado el número de casos importados en los últimos años. S. stercoralis es el único nematodo que tiene un ciclo de autoinfección en humanos, por lo que es capaz de mantener una parasitación crónica durante décadas. En pacientes inmunodeprimidos puede producir una infección masiva o un síndrome de hiperinfección con una elevada mortalidad, que puede ser superior al 70%3. A continuación se presenta un caso de síndrome de hiperinfección por S. stercoralis en un paciente con tratamiento inmunosupresor.
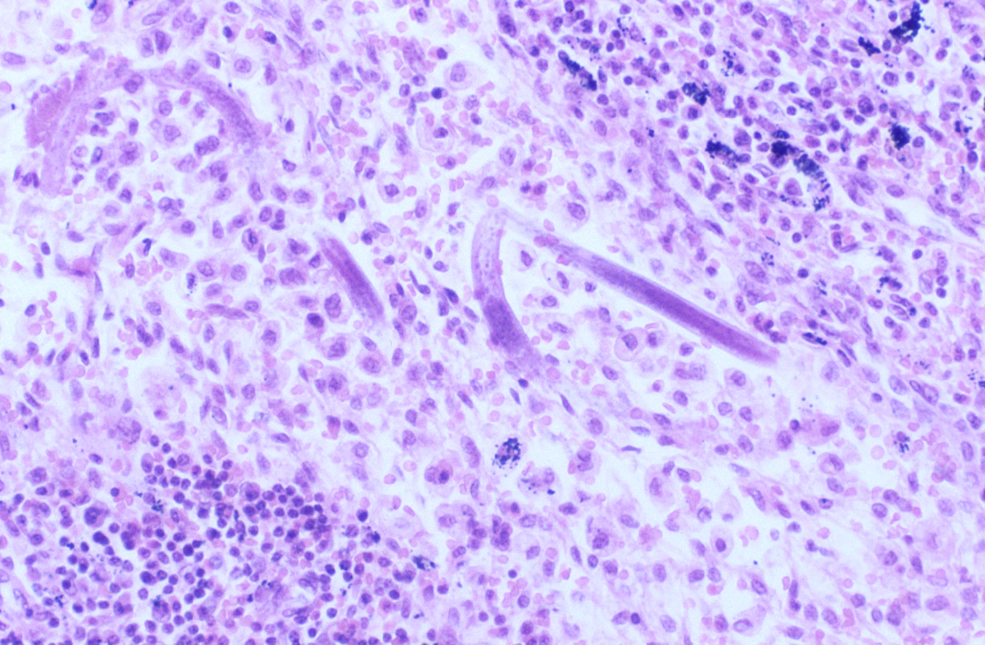
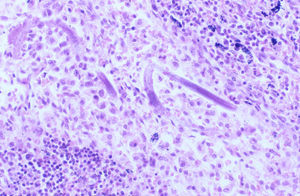
Varón de 37 años, natural de Colombia y residente en España desde hacía 6 meses, se le diagnosticó lupus eritematoso sistémico (LES) con anemia, glomerulonefritis proliferativa difusa, síndrome nefrótico con proteinuria de 3,2g en 24h y acidosis tubular distal tipo I. La prueba de Mantoux fue negativa. Se inició un tratamiento con 3 bolos intravenosos de 1g de 6-metilprednisolona seguido de 60mg al día de prednisona y de bolos intravenosos mensuales de 1g de ciclofosfamida. Tras 2 ciclos comenzó con fiebre, artromialgias, oliguria y lesiones cutáneas purpúricas y urticariformes. El hemograma y la bioquímica mostraron un recuento de leucocitos de 5,4×109/l (3.700neutrófilos, 200linfocitos y 100eosinófilos/mcl), hemoglobina de 8,5g/dl, recuento de plaquetas de 151×109/l, creatinina de 1,7mg/dl, albúmina de 2,2g/dl y gammaglutamil transpeptidasa de 45mg/dl; el resto de los parámetros fue normal. En la orina se observó una hematuria moderada y una proteinuria de 2,4g en 24h. La radiografía de tórax mostró infiltrados alveolares difusos que se confirmaron con una tomografía computarizada torácica. Los valores de la gasometría arterial basal fueron pH de 7,42, presión parcial de dióxido de carbono de 35,1mmHg, presión parcial de oxígeno de 59mmHg y bicarbonato de 23,1mmol/l. Ante la sospecha de exacerbación del LES, se aumentó la dosis de glucocorticoides pero empeoró su estado general, presentó fracaso renal agudo, anemización, hemoptisis e insuficiencia respiratoria aguda que requirió intubación orotraqueal y conexión a ventilación mecánica. Se inició tratamiento antibiótico intravenoso empírico con teicoplanina (400mg/24h), ceftazidima (1g/8h), trimetoprim y sulfametoxazol (320 mg/6h y 1.600 mg/6h), amikacina (750mg/48h) y anfotericina liposomal (300mg/24h) tras la recogida de múltiples muestras para cultivo. Se realizó una fibrobroncoscopia en la que se observó una hemorragia activa en todos los lóbulos pulmonares. El lavado broncoalveolar, los hemocultivos y los urocultivos fueron negativos para bacterias, micobacterias y hongos. Por la hemoptisis y al observarse prolongación de los tiempos de coagulación y de trombocitopenia precisó la transfusión de múltiples concentrados de hematíes, plasma fresco congelado y plaquetas. A pesar del tratamiento, se observó un empeoramiento de los infiltrados intersticiales bilaterales y un mayor deterioro de la oxigenación. El cuadro progresó a una situación de shock séptico y neumotórax bilateral que requirió la colocación de 4 tubos de tórax con empeoramiento hemodinámico. El paciente falleció a los 3 días del ingreso en la unidad de cuidados intensivos por fracaso multiorgánico. En una muestra de tejido pulmonar obtenido post mórtem se observó una hemorragia pulmonar masiva reciente y antigua con daño alveolar difuso y larvas de S. stercoralis en el parénquima pulmonar, la pleura y los ganglios linfáticos (figura 1). En un ganglio linfático también se visualizó una lesión granulomatosa epitelioide necrosante con bacilos resistentes al ácido y al alcohol, y en el cultivo de Lowenstein creció Mycobacterium tuberculosis. No aparecieron lesiones de vasculitis ni inflamatorias y la inmunofluorescencia directa fue negativa.
Figura 1. Ganglio linfático con larvas de Strongyloides stercoralis.
Para comprender mejor el síndrome de hiperinfección por S. stercoralis conviene recordar su ciclo en humanos. Comienza cuando las larvas filariformes del suelo penetran en la piel intacta y alcanzan los alvéolos pulmonares por el torrente sanguíneo. Desde allí ascienden por el árbol traqueobronquial y una vez deglutidas llegan al duodeno y al yeyuno, donde maduran a gusanos adultos hembra. Por partenogénesis, éstas ponen huevos y dan lugar a larvas rabditiformes que no son infectantes para el hombre. Algunas de estas larvas pueden transformarse en larvas filariformes en el propio intestino y autoinfectar al huésped a través de la mucosa colorrectal, lo que perpetúa la infección durante muchos años.
La clínica de la estrongiloidiasis corresponde a los órganos que atraviesan en su ciclo biológico. La enfermedad aguda se manifiesta como prurito, tos, sibilancias, diarrea, vómitos o dolor abdominal. La enfermedad crónica suele ser asintomática aunque puede presentar síntomas leves y recurrentes de diarrea, malabsorción, asma, urticaria o larva currens y suele acompañarse de eosinofilia en más de un 80% de los casos1. La hiperinfección es la forma más grave y se debe a la autoinfección masiva y diseminada, especialmente de piel, pulmones e intestino, acompañada hasta en un 65% de complicaciones infecciosas secundarias a bacterias intestinales1. También puede haber formas diseminadas a otros órganos pero no presentan la gravedad de la hiperinfección.
El principal factor de riesgo para presentar una hiperinfección es la inmunodepresión celular que suele ser secundaria a tratamientos con glucocorticoides y otros inmunosupresores, como en el caso descrito. También aumenta su incidencia en enfermedades debilitantes, pacientes malnutridos, linfomas, trasplantes renales, cardíacos, intestinales o de médula ósea y en la infección por el virus linfotrópico de células T humano tipo I . En cambio, aunque hay casos descritos, la hiperinfección no parece más frecuente en pacientes inmunodeprimidos por el virus de la inmunodeficiencia humana, probablemente por el diferente perfil de alteración de la inmunidad celular de cada virus. La inmunidad humoral también parece importante en el control de esta parasitosis al aumentar el riesgo de hiperinfección en la hipogammaglobulinemia4.
No se conoce bien su fisiopatología, aunque los glucocorticoides reducen los linfocitos Th2, los eosinófilos, la respuesta de los mastocitos y varias interleucinas, principales mediadores de la respuesta inmunitaria a parásitos. También podrían estimular la maduración de las larvas filariformes infectivas y aumentar la susceptibilidad a las infecciones bacterianas5. Todo esto aceleraría el ciclo de autoinfección con un aumento masivo de la carga parasitaria, una diseminación a múltiples órganos y un arrastre a la circulación sanguínea de bacterias intestinales, especialmente bacilos gramnegativos.
La clínica del síndrome de hiperinfección se produce por la invasión directa del parásito y de las infecciones bacterianas secundarias. Se manifiesta con fiebre, diarrea, vómitos, dolor abdominal y formas graves de neumonía con hemoptisis y broncoespasmo, púrpura petequial, meningitis y shock séptico con una mortalidad del 30 al 80% según la precocidad del diagnóstico y del tratamiento1,3,6. En el paciente descrito no se aislaron otros gérmenes en hemocultivos, aunque se mantuvo la amplia cobertura antibiótica y el M. tuberculosis sólo creció en el ganglio donde permanecía latente.
En infecciones crónicas, la sensibilidad diagnóstica de las técnicas de detección de parásitos en heces es baja por métodos de concentración, filtrado o cultivo en agar, aunque aumenta con las múltiples muestras7. La serología no suele estar disponible, puede persistir positiva durante años después del tratamiento, mostrar reactividad cruzada con otros helmintos o ser falsamente negativa en pacientes inmunodeprimidos. En el síndrome de hiperinfección es más probable visualizar el parásito por el elevado número de larvas en heces, esputo, lavado broncoalveolar o aspirado gastroduodenal y, ocasionalmente, en líquido pleural, peritoneal, cefalorraquídeo, orina, en biopsia gastrointestinal o de otros órganos.
Como en nuestro paciente, el diagnóstico tardío (a veces en autopsia) o el diagnóstico casual de la hiperinfección por S. stercoralis es frecuente por múltiples razones y a menudo se acompaña de consecuencias mortales3. En primer lugar, no se está familiarizado con esta infección, considerada como tropical y no presente habitualmente en nuestro medio, por lo que no se incluye en el diagnóstico diferencial ni se solicitan pruebas parasitológicas. La infección puede persistir décadas después de abandonar la zona endémica, por lo que no se da importancia al antecedente epidemiológico. En segundo lugar, la presentación clínica es muy inespecífica y variada, desde la ausencia de síntomas hasta el fracaso multiorgánico. La sintomatología puede corresponder a múltiples infecciones, sobre todo en pacientes inmunodeprimidos. Como se sospechó inicialmente en el caso descrito, también se puede deber al empeoramiento de una enfermedad de base (como el LES)8 o de otras enfermedades que suelen precisar tratamiento con glucocorticoides (como el asma, la enfermedad pulmonar obstructiva crónica, la enfermedad inflamatoria intestinal u otras vasculitis). En la anatomía patológica post mórtem descrita no se demostró actividad de LES en el pulmón pero la clínica superponible puede llevar erróneamente al aumento de los tratamientos inmunosupresores que debilitan aún más la respuesta celular del huésped y empeoran el cuadro infeccioso. La misma sepsis por bacilos gramnegativos no es infrecuente en pacientes inmunodeprimidos sin infección por Strongyloides, pero si la hay, puede enmascararla, lo que hace muy difícil el tratamiento únicamente con antibióticos y medidas de soporte. Tampoco la fiebre es una constante, ya que aparece sólo en un 54% de los pacientes que recibe corticoides6. Finalmente, la eosinofilia, que suele estar presente en las infecciones crónicas y orientar al diagnóstico, aparece sólo en un 32% de pacientes con hiperinfección y tratamiento esteroideo y suele indicar un mejor pronóstico vital6. La eosinofilia también puede aparecer en enfermedades del tejido conectivo, como el LES, otras vasculitis o en pacientes asmáticos y, por tanto, puede hacer pasar por alto la sospecha de parasitosis. En el paciente descrito no apareció eosinofilia en ningún momento del estudio inicial ni durante el seguimiento.
En resumen, para el diagnóstico precoz de la hiperinfección por S. stercolaris se precisa un alto índice de sospecha clínica y este síndrome debe incluirse en el diagnóstico diferencial de procesos infecciosos graves en pacientes inmunodeprimidos procedentes de áreas endémicas, sobre todo si presentan clínica digestiva, respiratoria o eosinofilia. Además de los estudios microbiológicos para bacterias, hongos o virus, deben solicitarse análisis de parásitos en heces, esputo y otras muestras biológicas accesibles.
Para evitar la hiperinfección por Strongyloides, se debería estudiar y erradicar esta parasitosis en todos los pacientes con antecedentes de residencia o de viajes a países endémicos que vayan a recibir un tratamiento inmunosupresor o presenten enfermedades con inmunodepresión, aunque no presenten síntomas compatibles ni eosinofilia. En estos casos podría realizarse un tratamiento empírico con ivermectina aunque no se detecte el parásito en el estudio6. Hay varias razones que justificarían esta práctica. Por un lado, la hiperinfección tiene una elevada mortalidad y el tratamiento erradicador es breve, bien tolerado, efectivo y de bajo coste. Por otro lado, debe tenerse en cuenta la baja sensibilidad o la disponibilidad de las pruebas diagnósticas en infecciones crónicas. Por último, en la práctica diaria, en ocasiones es necesario iniciar tratamientos inmunosupresores de forma inmediata o ya se presentan con estos tratamientos, sin tiempo suficiente para realizar un estudio microbiológico adecuado.
Actualmente, el tratamiento de elección en la infección crónica es ivermectina en 2 dosis únicas consecutivas de 200mcg/kg/día por vía oral9. En la hiperinfección no se conoce la pauta adecuada aunque algunos autores sugieren dar ivermectina en dosis de 200mcg/kg/día durante 5 a 7 días o bien asociarla a albendazol en dosis de 400mg/12h hasta obtener una respuesta terapéutica. En pacientes que no toleren la vía oral se puede dar ivermectina subcutánea o rectal: se ha usado una formulación veterinaria parenteral con éxito en un paciente con malabsorción grave e íleo paralítico10.
Es conveniente el control de la carga parasitaria en heces para valorar la efectividad del tratamiento. Por supuesto, también precisaría soporte vital y cobertura antibiótica de amplio espectro frente a gérmenes intestinales.
Con el aumento de la población procedente de países endémicos que precisan tratamientos inmunosupresores, debemos familiarizarnos con esta infección y sus complicaciones, sin olvidar que también puede haber casos autóctonos de pacientes infectados por S. stercoralis, especialmente del área mediterránea. Al igual que en la infección latente tuberculosa es importante erradicar el parásito antes de iniciar un tratamiento inmunosupresor.