Introducción
En el año 2003 la pandemia del sida causó más de 3 millones de defunciones, estimándose en 5 millones las personas que contrajeron el virus a lo largo del año. Estas cifras elevan a más de 42 millones el número de personas infectadas en todo el mundo, habiendo producido la muerte a unos 20 millones de personas desde que se identificó el origen de la pandemia1. Las diferencias geográficas y económicas de esta enfermedad son evidentes, donde más del 95% de los casos y el 95% de las muertes por sida ocurren en el tercer mundo (70% en África), sobre todo entre jóvenes adultos, con un incremento progresivo entre las mujeres. Es dramático contemplar cómo en el África subsahariana, la epidemia sigue extendiéndose y que en muchos países los elevados porcentajes de personas infectadas y con sida tienen efectos devastadores para las familias y para la economía productiva. La explosión de la epidemia de sida en los países en vías de desarrollo ha planteado la necesidad de adoptar medidas preventivas urgentes y el acceso expandido a la medicación antirretroviral. Sin embargo, en algunas zonas del mundo estas medidas, aunque imprescindibles, serán probablemente insuficientes para frenar la epidemia por lo que la obtención de una vacuna eficaz es la única posibilidad de control de la epidemia.
Por estos motivos, el desarrollo de una vacuna eficaz frente al virus de la inmunodeficiencia humana (VIH) es la gran asignatura pendiente de la investigación sobre el sida y una necesidad dramática para los países en vías de desarrollo. Esta sensibilización ha hecho que en los últimos 5 años la financiación para la búsqueda de vacunas frente al sida se haya incrementado de forma considerable y que su obtención se ha convertido en un objetivo científico prioritario para instituciones públicas y privadas, gobiernos y organizaciones no gubernamentales2-4 (tabla 1). En este capítulo se analizan las dificultades científicas en el desarrollo de una vacuna contra el sida, en especial los mecanismos de escape viral a la respuesta inmunitaria, los prototipos de vacuna en desarrollo y los resultados obtenidos. Por otra parte esta investigación se sitúa en el contexto sanitario, económico y social de la pandemia de sida y se analizan las polémicas actualmente planteadas en el desarrollo de ensayos clínicos con los diferentes tipos de vacunas5.
Dificultades para conseguir una vacuna frente al VIH
Para llevar a cabo el desarrollo de una vacuna es necesario conocer los genes del patógeno involucrados en la inducción de una respuesta inmunitaria específica, así como disponer de modelos experimentales en los que se pueda ensayar la eficacia de la vacuna. Aunque en el pasado ha habido logros importantes en el control de enfermedades infecciosas por procedimientos de vacunación, se desconocen muchos de los mecanismos que determinan la capacidad del patógeno para apoderarse de la maquinaria celular, así como los mecanismos de evasión del sistema inmunitario por el patógeno y cómo conseguir una potenciación de la respuesta inmunitaria capaz de eliminar la célula infectada. Desde el punto de vista científico la obtención de una vacuna eficaz para impedir la infección por el VIH se enfrenta a una serie de desafíos.
Caracterización de los determinantes mayores de inmunogenicidad
La respuesta inmunitaria se inicia mediante el reconocimiento por parte de los linfocitos CD4 a través de su receptor (TcR) de antígenos extraños presentados por las células especializadas en el procesamiento antigénico en el surco antígeno de histocompatibilidad (HLA) de clase II. La presentación de estos antígenos activa los distintos mecanismos efectores del sistema inmunitario: producción de anticuerpos por los linfocitos B, síntesis de citocinas y quimiocinas, activación de linfocitos CD4 y generación de linfocitos CD8 citotóxicos. Estos últimos representan el principal mecanismo de destrucción de células infectadas por virus y para ello los linfocitos citotóxicos deben reconocer determinantes antigénicos del virus imbuidos en el surco HLA de clase I de las células infectadas para iniciar el proceso de lisis6. Debido al polimorfismo del sistema HLA tanto en el reconocimiento del antígeno en las células presentadoras como en las células diana (presentado en el surco HLA de clases II y I, respectivamente) los epítopes seleccionados varían en función del haplotipo HLA individual. En muchos virus existen "determinantes (epítopes) mayores de inmunogenicidad" que inducen una potente respuesta del sistema inmunitario. La eficacia de esta respuesta depende de dos características: corresponden a epítopes o dominios de las proteínas virales que se encuentran conservados entre los distintos aislados incluso en el contexto de virus altamente variables; la segunda característica es que estos determinantes mayores capaces de asociarse a los surcos de la mayoría de haplotipos. La existencia e identificación de estos determinantes mayores de inmunogenicidad es clave para poder desarrollar una vacuna ya que constituyen las dianas virales por excelencia al ser "universales" en un doble sentido: como epítopes conservados en la proteína viral y en cuanto epítopes susceptibles de presentación antigénica por la mayoría de los sujetos independientemente de su haplotipo HLA. Sin embargo, en el caso del VIH no se ha encontrado hasta la fecha un determinante de inmunogenicidad similar, lo que representa una limitación muy importante para diseñar una preparación vacunal. La identificación de estos determinantes mayores de inmunogenicidad en virus con la tremenda variabilidad genética, como el VIH-1, hace prácticamente imposible definir esos epítopes de modo empírico y experimental. Sin embargo, la bioinformática puede suministrar métodos predictivos que faciliten su identificación7.
Definición de los parámetros subrogados de protección
El objetivo de toda vacuna es inducir una respuesta inmunitaria eficaz de tipo memoria que permita al sistema inmunitario reaccionar frente al agente infeccioso impidiendo su propagación. Para alcanzar este objetivo es indispensable saber cuáles son los efectores inmunológicos eficaces en el control de la infección para así definir una serie de parámetros surrogados inmunológicos que permitan evaluar si una preparación vacunal es eficaz o no. En el paciente infectado por el VIH se ha descrito una respuesta inmunitaria intensa que abarca prácticamente todos los mecanismos efectores del sistema inmunitario. Esta respuesta es asimismo relativamente amplia ya que se desarrolla frente a numerosos epítopes y prácticamente todas las proteínas del virus, tanto estructurales como reguladoras son reconocidas como extrañas. Sin embargo, es todavía motivo de controversia el papel "protector" de cada uno de estos componentes de la respuesta antiviral. A continuación se describe el tipo de respuesta inmunitaria generada frente a la infección por el VIH.
Respuesta humoral
La infección por el VIH induce una intensa respuesta de anticuerpos frente a prácticamente todas las proteínas reguladoras y estructurales del VIH8. Algunos de estos anticuerpos tienen capacidad neutralizante in vitro9 y en experimentos de inmunoterapia adoptiva in vivo9-10. Sin embargo, la producción de anticuerpos con capacidad neutralizante es escasa y muy rápidamente se observa un escape viral a éstos11. Por otra parte, en los modelos de inmunización desarrollados hasta el momento no se obtiene de una forma consistente concentraciones elevadas de anticuerpos neutralizantes ni su presencia se asocia de forma sistemática a protección. Estos datos hacen que algunos investigadores planteen dudas sobre el papel de la respuesta humoral en el control de la infección por el VIH12,13. Sin embargo, no existe prácticamente ninguna vacuna preventiva que no induzca anticuerpos neutralizantes y su carácter de marcador surrogado de protección está claramente demostrado en otras enfermedades. Por lo tanto, a priori una vacuna preventiva frente al VIH debería inducir anticuerpos neutralizantes de amplio espectro14 y este es uno de los grandes desafíos planteados en la actualidad en el desarrollo de una vacuna frente al sida. Estudios recientes en los que se define la localización de los epítopes de neutralización, su estructura tridimensional y su mecanismo de acción15 representan avances de gran importancia para definir las características que deben tener los anticuerpos inducidos mediante vacunas.
Respuesta celular
La mayoría de los trabajos coinciden en que la respuesta combinada CD4 y CD8 representa probablemente el mecanismo más importante de protección frente al VIH16. El estudio de la respuesta celular ha demostrado que en los pacientes seropositivos existe una expansión clonal de linfocitos CD4 y CD8 con actividad frente al VIH que es particularmente intensa en pacientes en estadio de primoinfección y correlaciona con el control de la replicación viral17,18. También se ha descrito una intensa respuesta CD4 y CD8 anti-VIH en algunos pacientes en el contexto de la reconstitución inmunitaria obtenida tras tratamiento antirretroviral (TAR), especialmente en aquellos con una buena situación inmunológica antes de iniciar el tratamiento19,20 así como en pacientes con interrupciones estructuradas de tratamiento que controlan de forma espontánea la replicación viral21. Aunque es difícil concluir una relación causa-efecto entre la aparición de un tipo específico de respuesta inmunitaria y el control de la replicación viral todos los datos sugieren que la respuesta celular colaboradora y citotóxica son esenciales para contener la replicación viral en estadios precoces de la enfermedad en que existe una indemnidad relativa del sistema inmunitario. Experimentalmente los datos más concluyentes sobre el papel de la respuesta celular en los que el control de la replicación viral vienen de trabajos en la eliminación de linfocitos CD8 en macacos infectados con virus de la inmunodeficiencia del simio (SIV) origina un gran aumento de la viremia y la evolución a sida22.
Respuesta inmunitaria en mucosas
La transmisión por VIH ocurre mayoritariamente a través de mucosas. La abundancia de linfocitos CD4+ que residen en tejido linfoide genitorrectal se utiliza para la replicación del VIH o SIV, incluso cuando la infección ocurre por vía intravenosa. El sistema de tejido linfoide asociado a mucosas (GALT) está basado en linfocitos B y T activados que migran desde el lugar de presentación antigénico por la vía linfática y sanguínea, para establecerse en el tejido linfoide situado distante del lugar primario de infección, como tejido gastrointestinal, respiratorio, genitourinario y en otras zonas asociadas a mucosas. Así pues, la inducción de una respuesta inmunitaria en mucosas es un requisito necesario para que una vacuna sea eficaz contra el VIH.
Mecanismos de escape viral
Cada familia de virus desarrolla una serie de mecanismos de escape para evitar su eliminación por la respuesta inmunitaria. Una vacuna tendrá que enfrentarse a los mismos mecanismos de escape y, para tener éxito, deberá inducir una serie de respuestas inmunológicas capaces de superarlos.
Variabilidad genética
La tasa de variabilidad del VIH es debida a la alta tasa de error de la transcriptasa inversa (una sustitución por 103-104 nucleótidos y ronda de copia). Existe variabilidad genética intersubtipo e intrasubtipo. Aún desconocemos el potencial de la relevancia inmunológica de los diferentes subtipos genéticos del VIH. Algunas investigaciones han demostrado que los distintos subtipos genéticos no se correlacionan con los inmunotipos, pues más de un subtipo genético diferente podría compartir epítopes protectivos comunes y también es posible que más de inmunotipo se encuentre en un mismo subtipo genético. En general, los anticuerpos neutralizantes parecen ser más específicos de cepa, mientras que la respuesta inmunitaria celular tiene un espectro más amplio. Esta falta de fidelidad genera una alta diversidad en las proteínas del virus que le permiten escapar al control de la respuesta inmunitaria específica. El VIH dispone por tanto de un mecanismo de escape inmunitario frente al VIH común a los virus ARN en los que el alto índice de variabilidad les permite encontrar agujeros en el repertorio inmunológico. A la variabilidad debida a la alta tasa de error de la transcriptasa inversa se añaden otros mecanismos como la recombinación genética que origina nuevos subtipos y virus "mosaico" entre distintos subtipos. Numerosos trabajos de epidemiología molecular han insistido en la rápida diseminación de variantes del VIH y han descrito la distribución de diversos subtipos o virus recombinantes en las distintas regiones del planeta, lo que puede representar un obstáculo en el desarrollo de una vacuna universal23.
Mutaciones en los epítopos virales reconocidos por linfocitos T citotóxicos (CTL)
Un aspecto central no totalmente comprendido en la infección por VIH-1 es por qué a pesar de que en la primoinfección hay una potente respuesta inmunitaria, no se consigue un control de la replicación viral. Aunque se han propuesto varias explicaciones la más documentada es la del escape viral a través de mutaciones en los epítopes del virus reconocidos por los diversos mecanismos efectores del sistema inmunitario24. El escape de la respuesta CTL se debe a mutaciones puntuales de los epítopos virales que interaccionan con el surco de las moléculas de HLA. Tanto en pacientes primoinfectados como en modelos animales se ha demostrado cómo la mutación en un residuo conlleva un escape viral, pérdida de la respuesta CTL e incremento de la viremia25,26. Sin embargo, en la fase crónica no se encuentra una correlación clara entre la eliminación o presencia de una determinada variante viral y la presencia de células CTL frente a la misma27. Además de los datos puramente cuantitativos existen diferencias funcionales entre los CTL de pacientes progresores y no progresores o como la expresión de perforinas28, la producción alterada de citocinas y quimiocinas y una menor actividad del receptor del antígeno TcR por el complejo HLA/epítope viral23. Estos datos sugieren que las características cualitativas de las CTL generadas pueden ser importantes en el control de la replicación viral. En principio una estrategia general para maximizar la eficacia de una vacuna sería la de obtener una respuesta citotóxica frente a un amplio numero de epítopes de diversas proteínas. Sin embargo, estudios recientes sugieren que un enfoque más dirigido puede ser más eficaz. Así las CTL frente a proteínas no estructurales (Tat, Nef) son más eficaces en controlar la infección pero más propensas al escape viral y perduran menos que las CTL frente a proteínas estructurales Gag y Pol29. Para una vacuna esterilizante, el objetivo sería inducir una intensa respuesta CTL frente a proteínas tempranas, mientras que la inmunización frente a proteínas estructurales generaría una respuesta de control que atenuaría la infección. Otro de los problemas que puede representar una importante barrera genética de resistencia consiste en la adaptación del virus al haplotipo HLA del paciente infectado. Los mutantes virales generados reducirían su afinidad al reconocimiento por el TcR y una mayor resistencia a la respuesta CTL30.
Características bioquímicas de la envuelta viral y escape de la acción de los anticuerpos
La estructura de la envuelta viral en su forma nativa oculta los dominios de interacción con los correceptores virales debido a la estructura trimérica y al plegamiento de la proteína (exclusión oligomérica y enmascaramiento entrópico)31. La exposición de estos epítopes conservados que son identificados por anticuerpos neutralizantes se produce en el momento de interacción entre la membrana viral y celular, un contexto en que la eficacia de los anticuerpos es menor dada su baja accesibilidad a los epítopes de neutralización. Un segundo mecanismo de escape más clásico es el de mutación epitópica en las regiones hipervariables que se encuentran en el dominio externo de la envuelta viral. Sin embargo, trabajos recientes demuestran que el escape a estos anticuerpos no requiere en ocasiones la mutación epitópica, sino que puede producirse por glucosilación de los residuos y la formación de estructuras de hidratos de carbono sobre la gp120 viral denominadas "escudos glicano" y que constituyen auténticas barreras a la acción de los anticuerpos neutralizantes32. Uno de los trabajos más espectaculares publicados en el último año demuestra cómo a lo largo de la evolución en un paciente determinado las envueltas virales van progresivamente haciéndose resistentes a todo tipo de neutralización por anticuerpos neutralizantes al acumular los mecanismos de escape descritos previamente32.
Rapidez en el establecimiento de la infección
Tanto en modelos animales como en pacientes primoinfectados el establecimiento de la infección por el VIH después de su inoculación en el organismo por vía sexual es un proceso muy rápido33. En unas horas se produce la infección de las células linfoides de la submucosa vaginal y rectal y en 7 días la infección se ha propagado a ganglios linfáticos sistémicos en los que alcanza un nivel de carga viral y proviral similar al de la infección crónica34. La rapidez de instauración de estos reservorios, antes de que la respuesta inmunitaria específica se desencadene es un obstáculo mayor para el control de la replicación viral ya que el virus se establecerá en los linfocitos infectados en los que "persistirá" a pesar de una respuesta inmunitaria específica35.
Latencia y reactivación
El VIH es capaz de infectar en forma latente sus células diana que escapa de manera absoluta a la vigilancia inmunológica al no expresar productos virales en membrana. Por otra parte, los procesos de reactivación-reinfección se producen en los centros germinales de los órganos linfoides que presentan un microambiente celular idóneo para el proceso de infección: las células dendríticas portan en su membrana una lectina (DC-SIGN) que interacciona a la vez con los viriones y con los linfocitos facilitando su infección36. El reconocimiento antigénico por parte de los linfocitos y la presencia de citocinas en este microambiente aumentan a su vez la infectividad de las células diana y la replicación viral. En confirmación de estos datos se ha demostrado que los clones linfocitarios CD4 específicos frente al VIH se infectan en una proporción más elevada, lo que conlleva una inmunosupresión preferente de las respuestas específicas frente al VIH37. Es importante señalar que la generación continua de nuevas células latentemente infectadas a partir del compartimento de replicación viral activa genera un "archivo continuo" de los cambios del virus a lo largo de la enfermedad, incluyendo los genomas mutados de resistencia a tratamiento y las variantes de escape inmunitario. El compartimento latente no es estático y el VIH almacena su "historia" en las células latentemente infectadas32 lo que constituye un mecanismo de escape tanto frente a tratamiento con antirretrovirales como vacunas.
Prototipos de vacuna frente al VIH. Resultados experimentales
Virus atenuados
Las vacunas de virus atenuados son sin duda las más eficaces porque el germen realiza una serie limitada de ciclos de replicación y simula una infección a bajo nivel que induce todo el espectro de respuesta antiviral en un contexto fisiológico. En el caso de los lentivirus uno de los hallazgos más espectaculares fue el que demostró que una variante defectiva de SIV delecionada en el gen Nef inducía una respuesta protectora frente al challenge con virus viables altamente patogénicos agresivos38. Estos datos experimentales tuvieron un correlato natural en la "Cohorte de Sydney", 14 pacientes infectados por vía sanguínea a partir de un donante seropositivo y que después de 12 años de la infección presentaban un excelente estado clínico e inmunológico. El clonaje y caracterización del virus de estos pacientes y del donante demostró que presentaba deleciones en el gen Nef y en secuencias reguladoras críticas de la región 3´LTR39. Estos hallazgos hicieron proponer la utilización de vacunas de virus atenuados VIH similares a los mutantes SIV defectivos. Sin embargo, es importante destacar que las vacunas atenuadas suelen utilizarse frente a virus que no se establecen de forma definitiva o, alternativamente, el virus atenuado no es capaz de persistir en el hospedador. Este no era el caso para los virus defectivos en Nef que no sólo infectan al hospedador sino que replican y persisten en el mismo, lo que conlleva un riesgo de deriva a variantes más agresivas en el sujeto vacunado. Los primeros datos alarmantes vinieron de la vacunación de macacos recién nacidos en los que el virus inocuo en adultos inducía rápidamente una infección agresiva y la muerte por inmunodeficiencia40. Por otra parte, el seguimiento prolongado de los pacientes de la cohorte de Sydney permitió objetivar en algunos sujetos un deterioro inmunológico y repuntes en la carga viral41. De igual manera algunos macacos adultos vacunados con el virus SIV defectivo desarrollaron sida a partir del virus con el que habían sido vacunados que experimentó reversiones del fenotipo mutante42. Por estos motivos, la utilización de vacunas de virus defectivos frente al VIH se encuentra descartada en el momento actual y este abordaje se encuentra explícitamente excluido en las recomendaciones de las agencias reguladoras.
Virus inactivados
El empleo de virus inactivados ha sido un abordaje muy poco utilizado en los prototipos de vacunas preventivas. Por el contrario, este es el modelo más ampliamente utilizado en las vacunas terapéuticas de las que el Remune® es el prototipo. Estas preparaciones virales están compuestas por viriones completos o por partículas a las que se ha eliminado la envuelta, que posteriormente son inactivadas con distintos métodos químicos y se administran en conjunción con adyuvante incompleto de Freund43.
Proteínas virales
Las primeras vacunas frente al VIH se basaron en el modelo de inmunización frente a la hepatitis B. Estas vacunas están compuestas por proteínas gp120 y gp160 recombinantes producidas por ingeniería genética o utilizando como vectores de expresión virus Vaccinia. En los estudios preclínicos y en los ensayos clínicos de fase I y II el preparado fue seguro e indujo la síntesis de anticuerpos frente a la envuelta viral44, pero estos anticuerpos fueron incapaces de neutralizar in vitro variantes silvestres de pacientes45. A pesar de las evidencias en contra los ensayos en fase III fueron continuados (ver más adelante).
Otros ensayos han utilizado la proteína reguladora tat en forma de toxoide que ha dado buenos resultados de protección en estudios en macacos, aunque su papel sigue siendo controvertido46.
Péptidos virales
Las vacunas de péptidos tienen una escasa capacidad inmunogénica ya que los anticuerpos no reconocen en muchos casos la estructura primaria de la secuencia de aminoácidos, sino estructuras secundarias y terciarias en las proteínas diana que no son simuladas por los péptidos. Por este motivo los péptidos se utilizan generalmente en combinación con otras preparaciones de vacunas como vectores virales o ADN con el fin de inducir una inmunización complementaria47. Las ventajas de estas combinaciones son la baja toxicidad, la posibilidad de preparar cócteles de péptidos que cubran un abanico de aislados virales en proteínas que presentan una alta variabilidad y la utilización de "péptidos mixtos" que al incluir epítopes inmunodominantes T y B inducen respuestas humorales y celulares.
Vectores virales y bacterianos (live-attenuated)
En estos sistemas se utilizan virus o bacterias en cuyo genoma se insertan genes del VIH de manera que sus proteínas son expresadas en el curso de la replicación de los vectores en la célula hospedadora. Los modelos más desarrollados son los que utilizan poxvirus (Vaccinia, Canaripox, virus Ankara modificado [MVA])48 y adenovirus49. Otros abordajes experimentales utilizan bacterias (bacilo de Calmette-Guérin [BCG], Salmonella)50 virus ARN incluyendo lentivirus51 como vectores (coronavirus, VSV, SFV, reovirus, poliovirus, influenza). Algunos de estos sistemas tienen como limitación el riesgo de que se incorpore en el genoma información genética exógena procedente del vector. La ventaja de estos sistemas virales y bacterianos radica en la fuerte inducción en que se pueden insertar varios genes virales y que al expresar elevadas concentraciones de las proteínas virales inducen una respuesta inmunitaria potente y muy prolongada, sobre todo celular, frente a éstas. Los prototipos de vacunas actualmente en desarrollo incluyen los genes gag, pol, env y nef en distintas combinaciones48,49 y distintas estrategias de inmunización inicial y dosis de recuerdo. Este tipo de preparaciones han fracasado como vacunas preventivas en modelos animales ya que por el momento no han conseguido una inmunidad protectora, probablemente debido a que la respuesta humoral inducida frente a proteínas del VIH es errática y poco potente. Sin embargo, sí inducen una potente respuesta celular que hace que las concentraciones de carga viral se estabilicen en valores bajos48,49 por lo que se plantea su potencial utilidad para "atenuar" la infección transformando en escenario más optimista a los individuos vacunados en "supervivientes a largo plazo". Se espera que los nuevos vectores como el BCG, Salmonella y poliovirus induzcan una mayor inmunidad humoral y celular de mucosas al administrarse por vía oral, mejorando así la eficacia de estas vacunas.
Vacunas de ADN
La observación de que el "ADN desnudo" es capaz de inducir una respuesta inmunitaria frente a distintos virus en diferente modelos animales abrió un nuevo campo en el desarrollo de vacunas52. En modelos de infección con SIV y SHIV se ha observado que al igual que con los vectores microbianos, la inmunización con ADN es capaz de inducir una respuesta inmunitaria que, si bien no es protectora frente a la infección, puede en muchos casos atenuar la replicación viral y los síntomas clínicos53. La principal limitación de los vectores de ADN es que la intensidad de la respuesta inmunitaria inducida es baja, por lo que habitualmente se utilizan en combinación con vectores virales. Un inconveniente de este tipo de vacunas son los potenciales efectos secundarios a largo plazo debido a procesos de integración cromosómica.
Nuevos adyuvantes
Los adyuvantes son preparados que potencian la respuesta inmunitaria de los antígenos vacunales mediante distintos mecanismos. Los adyuvantes clásicos como el de Freund son lisados bacterianos que al inducir una respuesta inflamatoria inespecífica "reclutan" células inmunitarias en el punto de la inyección. Otros como el ISCOM o los liposomas mejoran la presentación de antígenos. Trabajos recientes han mostrado la eficacia del uso de interleucinas, especialmente las activadoras de respuestas de tipo Th1 (interleucinas 2 y 12) o quimiocinas en la potenciación de la respuesta inducida por vacunas de vectores atenuados o ADN desnudo54.
Vacunación por combinación de vectores
Se ha demostrado que la inoculación sucesiva con un lapso de semanas de dos vectores distintos que expresan el mismo antígeno de VIH (prime/booster) induce una mayor respuesta celular frente a antígenos del VIH que cuando se administra el mismo vector en dos dosis. Estos procedimientos que potencian la inducción de células T CD8 específicas fueron desarrollados en el sistema murino de malaria, demostrando que este aumento se correlaciona con protección frente al patógeno55. Uno de los mejores sistemas descritos se basa en recombinantes de poxvirus, especialmente del virus de la vacuna atenuado de Ankara (MVA). Este vector debe administrarse en la segunda inmunización (booster), mientras que en la primera inoculación (priming), puede utilizarse indistintamente ADN, cápsides y otros vectores de expresión de proteínas virales. Entre las combinaciones más prometedoras en prime/booster se pueden incluir: ADN/pox, SFV/pox, Adeno/pox.
Situación actual en el desarrollo de una vacuna frente al VIH
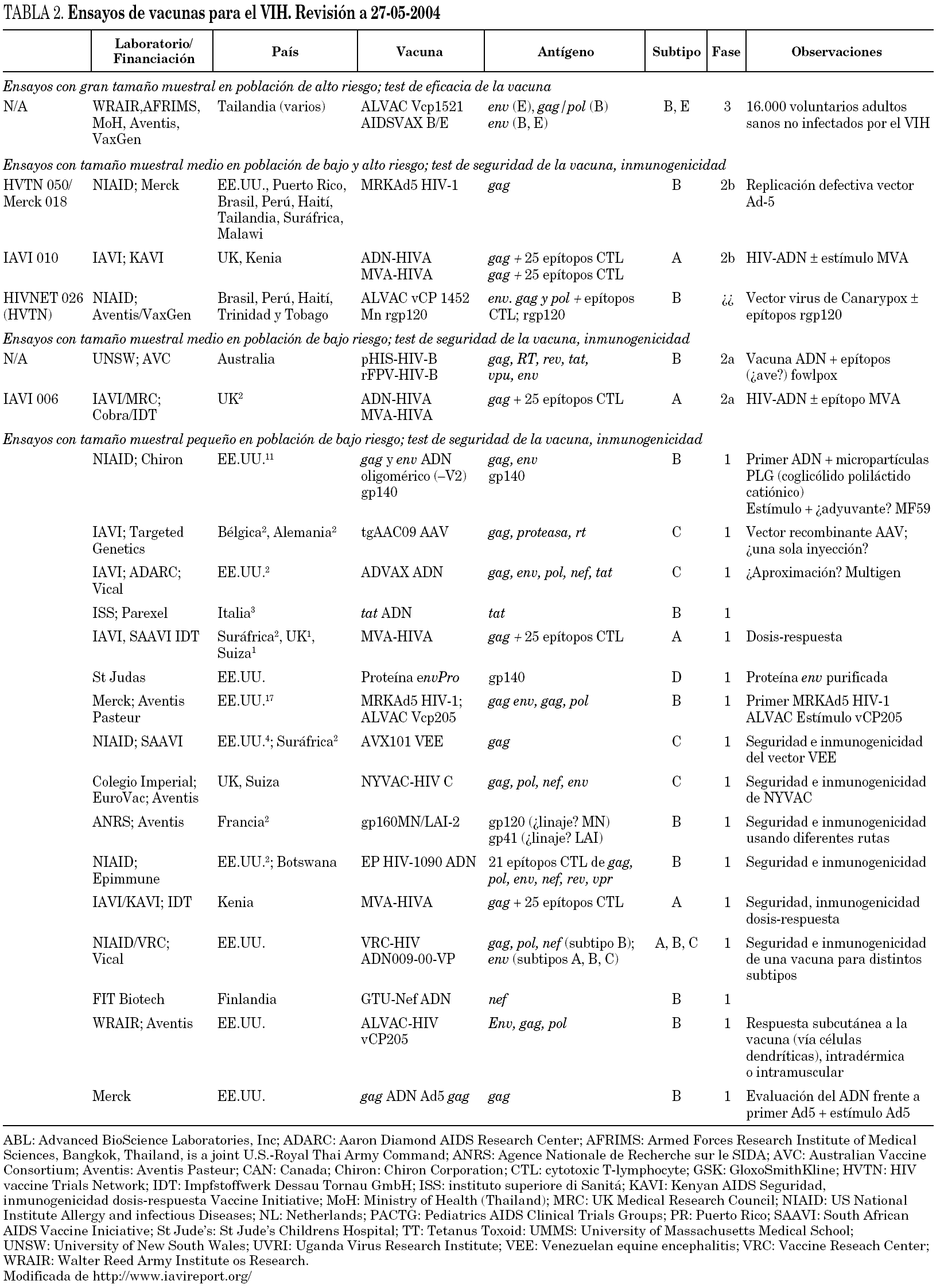
La realidad es que en el momento actual no se dispone de una vacuna preventiva frente a la infección por el VIH. De hecho, en ningún modelo animal se ha conseguido la protección frente a la infección de un solo individuo con las estrategias previamente descritas. En la tabla 2 se detallan los ensayos actualmente en curso y aquellos cuya introducción en fase clínica se prevé para los próximos años.
Los únicos ensayos clínicos en fase III realizados son los basados en la utilización de gp120 del recombinante y bivalente B/B en Estados Unidos o B/E y Tailandia56, pero por desgracia los resultados de estos estudios no han mostrado ningún beneficio en la protección frente a la infección con valor de eficacia de un 3,8%57. En la actualidad se van a iniciar nuevos ensayos en fase III en Tailandia utilizando una combinación de gp120 recombinante y un vector poxviral (ALVAC). El inicio de este ensayo ha levantado una gran polémica sobre la pertinencia de su realización, ya que tanto los resultados experimentales como la respuesta inmunitaria inducida por estas preparaciones vacunales han sido muy limitados58,59.
Entre los protocolos más avanzados para su paso a la fase clínica de los nuevos prototipos de vacunas se encuentran el desarrollado por Aventis Pasteur en Uganda que utiliza un vector de tipo Canarypox para la expresión de proteínas estructurales del virus60. También en Uganda se ha iniciado en enero de 2003 un estudio en fase I combinando ADN + MVA (cepa A)61. Un ensayo clínico similar en fase I patrocinado por IAVI y KAVI se encuentra en desarrollo en Kenia. Desgraciadamente, la introducción de una respuesta inmunitaria suficiente en un personaje significativo de pacientes ha sido muy pobre en estos ensayos, por lo que su continuidad se cuestiona en estos momentos. En Europa se ha completado en junio de 2004 a través de EuroVacc un ensayo clínico en fase I con el vector de poxvirus NYVAC y se ha iniciado el mismo mes otro ensayo en fase I con la combinación ADN/NYVAC expresando gp120/gag-pol-nef de VIH subtipo C, para seguir posteriormente en 2005 con otro ensayo comparativo entre NYVAC-C y MVA-C. Este último inmunógeno generado en el Centro Nacional de Biotecnología del CSIC. Una información completa y actualizada sobre la situación de las vacunas existentes y ensayos clínicos se puede obtener en la página web: www.hvtn.org/trials.
Algunos aspectos éticos y científicos planteados en el momento actual
La obtención de una vacuna contra el sida se ha convertido en un objetivo altamente prioritario en todo el mundo2-5. Esto tiene aspectos muy positivos como la sensibilización social al problema del sida, el aumento de la inversión económica, la priorización de la investigación en vacunas y el desarrollo de nuevos abordajes en un momento en que se conoce mucho mejor que hace una década la patogenia de la enfermedad.
Sin embargo, es importante recordar que la demostración de la utilidad de una vacuna es un proceso largo y costoso. Por este motivo, un aspecto crítico es definir las estrategias que se deben utilizar en las distintas fases de desarrollo de una vacuna: tipos de vacunas, objetivos de estas, diseño experimental, modelos animales, análisis preclínico y en el laboratorio, ensayos en fase I y II y requerimientos e infraestructura para iniciar estudios en fase III. Dada la prioridad sanitaria, social y política, la investigación sobre este tema está sometida en ocasiones a fuertes debates extracientíficos como la presión social por parte de los afectados, la presión política por parte de las organizaciones internacionales y los países devastados por la epidemia y la presión económica por parte de las compañías farmacéuticas. Aunque algunas de estas motivaciones son comprensibles dada la gravedad de la situación, estas actitudes pueden también distorsionar el proceso científico. A continuación se resumen las que siguen siendo las preguntas clave sobre la "vacuna del sida".
¿Es posible una vacuna frente a la infección por el VIH y qué podemos esperar de la misma?
Algunos científicos dudan que sea posible conseguir una vacuna eficaz frente a la infección por el VIH62. El motivo es la dificultad en alcanzar lo que se ha definido como "inmunidad esterilizante" frente a retrovirus. Si se analizan los mecanismos de acción de las vacunas, en la mayoría de los casos las vacunas no consiguen una "inmunidad esterilizante", ya que no impiden la infección sino el establecimiento de la misma y el desarrollo de enfermedad: el germen infecta, pero la respuesta inmunitaria impide su propagación y destruye las células infectadas contribuyendo así a erradicar la infección. En el caso de la infección por SIV y VIH sabemos que, tras el primer inóculo, la infección se establece en un período muy corto de tiempo infectando un reservorio importante de células en el sistema linfoide. En algunas de las células inicialmente infectadas el virus se replica activamente pero en otras permanece en un estado de latencia integrado en el genoma de la célula huésped. Es por tanto posible que a pesar de la respuesta inmunitaria inducida por una vacuna el virus pueda "establecerse" en los reservorios y desde allí replicar de forma persistente.
¿Qué objetivos debe alcanzar una vacuna frente al sida?
Un aspecto especialmente debatido es el "objetivo final" de la vacuna: si no es posible inducir una "inmunidad esterilizante" que evite la infección, puede bastar una respuesta inmunitaria capaz de controlar el nivel de replicación viral a concentraciones lo suficientemente bajas para que no se produzca la destrucción del sistema inmunitario. El objetivo no sería tanto evitar la infección como atenuarla, de manera que los pacientes infectados se transformen en "supervivientes a largo plazo" capaces de convivir con el virus. Otro aspecto debatido es el nivel de protección que debe "exigirse" a la vacuna. Frente a la alta eficacia de protección de la mayoría de las vacunas (superior al 90% de los vacunados) en distintos foros se plantean como "suficientes" tasas parciales de protección situadas en torno al 25-40%.
Este descenso en las exigencias de una vacuna frente al VIH es discutible. Por una parte es dudoso que a medio o largo plazo la "atenuación de la infección" sea un fenómeno definitivo. Tanto en los modelos animales como en los casos aislados en que se ha producido una infección por virus defectivos a largo plazo ese virus aumenta su virulencia. Por otra parte, aunque es cierto que el establecimiento de un nivel bajo de carga viral tras la primoinfección es un factor de buen pronóstico a medio plazo, esto no garantiza que los pacientes que presentan bajas concentraciones de carga viral tras la vacunación se comporten como supervivientes a largo plazo.
El que la eficacia "suficiente" de una vacuna se sitúe por algunos científicos en torno al 30-40% de protección es también criticable. Quizá pueda considerarse una postura realista e incluso en determinadas tasas de prevalencia en determinados grupos de riesgo una vacuna de este tipo puede ser eficaz, pero se desconoce a medio plazo su impacto real en la evolución de la epidemia. No hay que olvidar que uno de los mecanismos de eficacia de las vacunas es el derivado de su "impacto poblacional" al disminuir la prevalencia de la infección y en consecuencia la posibilidad de transmisión del germen en la población general. Este factor poblacional no existiría con las tasas de protección propuestas.
Vacuna universal o vacuna "a la carta": el problema de la variabilidad
Algunos autores sugieren que la variabilidad entre subtipos representa un obstáculo mayor para el desarrollo de una vacuna universal y que deberían fabricarse vacunas ad hoc basadas en los subtipos circulantes en cada región23. Sin embargo, los nuevos prototipos de vacunas utilizan otros genes virales (env, gag, pol, nef, tat) como dianas que tienen una variabilidad mucho menor que la envuelta. De hecho, distintos trabajos demuestran que la respuesta inmunitaria inducida por la vacunación frente a un subtipo concreto del VIH es capaz de actuar frente a otros subtipos63,64.
¿Cómo, cuándo y dónde se va a evaluar la eficacia de las distintas vacunas?
La eficacia de una vacuna frente al sida ha de evaluarse forzosamente en poblaciones que tengan una elevada tasa de ataque de la infección con el fin de poder obtener diferencias significativas entre los grupos control y vacunado en el período más corto posible. Esto hace que prácticamente todos los ensayos se realicen en África y el sudeste asiático, países en los que la seroconversión anual en las zonas más afectadas se sitúa alrededor del 1% de la población1.
La realización de ensayos en países en vías de desarrollo plantea una serie de cuestiones éticas:
1. Es indispensable que los estudios cumplan todos los requisitos éticos y que los pacientes tengan garantizados sus derechos65.
2. Las vacunas ensayadas deben haber satisfecho los requerimientos científicos y médicos de potencia y seguridad exigible a todo medicamento para su ensayo en seres humanos.
3. Los ensayos de vacunas requieren una infraestructura de seguimiento de gran envergadura. Por lo tanto, es indispensable desarrollar estructuras sanitarias (centros de referencia en reclutamiento y en seguimiento de los voluntarios, cuyo cometido es establecer ensayos estandarizados en tomas de sangre [PBL] y su congelación y descongelación, y medidas de parámetros inmunológicos como son poblaciones linfocitarias, producción de citocinas y anticuerpos neutralizantes), que garanticen el correcto seguimiento en la evaluación de la vacuna en pacientes. Sin estos requisitos el análisis de resultados puede resultar sesgado y/o incompleto y la obtención de conclusiones imposible66.
4. Una reivindicación exigida por los gobiernos es que en el caso de que una vacuna sea eficaz se debe garantizar el acceso gratuito a la misma del país que ha participado en su evaluación.
5. Según las directrices éticas de ONUSIDA se ha de administrar tratamiento antirretroviral de por vida a cualquier persona infectada durante el ensayo clínico67.
Un problema importante y que se encuentra en el centro de una gran polémica científica y social es la de los requerimientos que una preparación vacunal debe cumplir para iniciar un ensayo clínico en fase III. La revista Science ha sido el escenario de una serie de cartas firmadas por prestigiosos científicos que polemizan sobre la política de inversión en el desarrollo de una vacuna contra el sida y la realización de estudios en fase III58,59. La posición científica estricta defiende que no existen datos en ninguno de los prototipos existentes para iniciar un ensayo en fase III y que debe invertirse antes en investigación básica para comprender el mecanismo de acción de los mecanismos efectores inmunológicos y en el desarrollo de modelos animales relevantes. Frente a esta postura, una posición más humanista basa el inicio de ensayos en fase III en la situación catastrófica existente en los países en vías de desarrollo y en el contraargumento de que si no existen modelos animales adecuados, será necesario realizar todas las fases de los estudios, incluyendo los de fase III en seres humanos para obtener una respuesta definitiva. A pesar del pesimismo y las reticencias de una parte importante de la comunidad científica, la impresión general es que los ensayos en fase III se van a realizar. Es importante recordar el coste y esfuerzo de estos ensayos que requieren el seguimiento de 10.000 pacientes al menos 5 años para obtener resultados concluyentes.
Por lo tanto, en el campo de las vacunas contra el sida vivimos tiempos difíciles en los que será necesaria una fabulosa inversión económica para que la comunidad científica genere, desarrolle y evalúe todos los prototipos imaginables de vacunas en modelos animales con el fin de encontrar el Santo Grial de la vacuna. Como referencia, se estima que si Europa quisiera poner en marcha un programa de ensayos clínicos en fases II y III con un número limitado de vacunas ya generadas en la Unión Europea, se necesitaría una financiación de al menos 1.200 millones de euros durante los próximos 10 años. Con este objetivo se ha planteado el desarrollo de centros de investigación en vacunas coordinados en todo el mundo68 en los que se combinen: a) una masa crítica de investigadores; b) una dedicación única por parte de los mismos al desarrollo de prototipos de vacunas frente al VIH; c) un compromiso a largo plazo por parte de instituciones académicas, gubernamentales y privadas; d) recursos suficientes, y e) intercambio continuo de la información y colaboración con el sector privado. En este esquema, las grandes organizaciones (NIH, IAVI, ANRS, UE, Fundación Gates, etc.) financiarían estos centros de desarrollo de vacunas y coordinarían su labor. Los prototipos considerados potencialmente interesantes serían preparados en condiciones GMP (good manufacturer practices) para su uso en seres humanos y entrarían en un proceso previamente definido de estudios preclínicos y ensayos clínicos en fases I, II y III. Todos los prototipos deberían cumplir unos requisitos mínimos para su aplicación en la práctica clínica, lo que supondría no sólo definir estos criterios, sino implicar a las autoridades reguladoras (FDA, EMEA) en su desarrollo. La evaluación de los prototipos requiere asimismo definir aquellos marcadores inmunológicos que deben ser utilizados para valorar su potencial eficacia, lo que conllevaría el desarrollo de ensayos normalizados y reproducibles para valorar las respuestas humoral y celular frente al VIH y la acreditación de los laboratorios que realizaran estas determinaciones inmunológicas. Por último, deberían ponerse en funcionamiento las estructuras sanitarias requeridas para la realización de los ensayos en fases clínicas en países en desarrollo y definir claramente los criterios éticos que deben cumplirse en estos ensayos. Dado el gran número de prototipos existentes (tabla 2) la aplicación de criterios homogéneos de valoración es la única manera de poder llegar a conclusiones consistentes y extrapolables a todas las situaciones.
Sin embargo, es importante ser conscientes de que esta búsqueda está llena de interrogantes y puede resultar fallida a pesar de todos los esfuerzos porque quizá la vacuna no sea posible y quizás haya que empezar a comunicar a la sociedad que esta terrible posibilidad es real.
La historia de las vacunas se define en dos palabras: "empirismo" y "éxito". Ninguna intervención ha salvado tantas vidas a lo largo de la historia de la medicina como las vacunas. En muchas ocasiones estos éxitos fueron el fruto del empirismo más descarnado. Sin embargo, en el momento actual de desarrollo científico la obtención de una vacuna frente al sida no puede basarse en el empirismo como base del éxito.
En conclusión, en los últimos 5 años el estado de desarrollo de una vacuna frente al sida ha cambiado radicalmente debido a distintos factores: el devastador crecimiento de la epidemia, la sensibilización social, la inversión económica y muy especialmente la mejor comprensión de la patogenia de la enfermedad permiten abordar con medios y de forma racional este desafío. Sólo el esfuerzo científico combinado con un esfuerzo solidario sin precedentes en la historia permitirá concluir si es posible una vacuna frente al VIH y si su aplicación será suficiente para frenar la actual pandemia de sida.
Agradecimientos
Nuestros laboratorios son financiados por la redes temáticas cooperativas de investigación en sida (RIS G03/173) y de genética clínica y molecular (RIG 03/07), Fundación para la Investigación y la Prevención del Sida en España (FIPSE 36365/02;36344/02;12456/ 03;36259/01), Programa Nacional de Salud (SAF 2003-09209 y 0037-04-01) y Comunidad de Madrid. Agradecemos a Florencia Etcheverry su ayuda en la revisión bibliográfica de este manuscrito.