Para conocer la epidemiología de la infección neumocócica en Galicia (España) tras la incorporación de la vacuna conjugada antineumocócica, se determinaron durante los años 2011 y 2012 la distribución de serotipos, sensibilidad antibiótica, factores de riesgo y mortalidad asociada de los casos de enfermedad neumocócica invasiva (ENI).
MétodosSe estudiaron todas las cepas causantes de ENI en Galicia. El serotipado se realizó por aglutinación y reacción de Quellung. Se determinó la sensibilidad a penicilina, cefotaxima, eritromicina, vancomicina y levofloxacino. Se consideraron factores de riesgo la patología respiratoria crónica, la patología cardíaca, la patología hepática, la patología renal, la diabetes mellitus y la inmunodeficiencia no VIH y VIH.
ResultadosSe recogieron 555 cepas. Se encontraron 43 serotipos diferentes, los más frecuentes: serotipo3 (17,5%), serotipo7F (12,6%), serotipo19A (9,4%), serotipo14 (4,1%), serotipo6C (4,1%), serotipo11A (4%) y serotipo22F (3,8%). El 57,1% de los serotipos aislados estaban incluidos en VNC-13V. Se encontraron 2 cepas no sensibles a penicilina y otras 2 a cefotaxima. El 24,7% de las cepas fueron no sensibles a eritromicina (26,9% en 2011 y 22,5% en 2012). La tasa de letalidad fue del 16,5%, llegando al 23,3% en mayores de 75años. Las patologías con riesgo de morir que mostraron significación estadística fueron: hepática, renal e inmunodeficiencia no VIH.
ConclusionesEl serotipo3 fue el mayoritario en Galicia. Se encontraron muy pocas cepas no susceptibles a penicilina y un descenso de resistencia a eritromicina de 2011 a 2012. Se observó un incremento de letalidad en relación con la edad del paciente. Padecer patología hepática, renal o inmunodeficiencia no VIH aumentó el riesgo de muerte.
To examine the epidemiology of pneumococcal infection in Galicia (Spain) after the incorporation of the pneumococcal conjugate vaccine, and to determine serotype distribution, antibiotic susceptibility, risk factors and associated mortality in cases of invasive pneumococcal disease (IPD) during 2011 and 2012.
MethodsAll strains causing IPD in Galicia were studied. Serotyping was performed by agglutination and Quellung reaction. Antibiotic sensitivity to penicillin, cefotaxime, erythromycin, vancomycin, and levofloxacin was determined. The risk factors considered were chronic respiratory disease, heart disease, liver disease, kidney disease, diabetes mellitus, and HIV and non-HIV immunodeficiency.
ResultsA total of 555 strains were collected, with 43 different serotypes being found. The most frequently isolated ones were: serotype3 (17.5%), serotype7F (12.6%), serotype19A (9.4%), serotype14 (4.1%), serotype6C (4.1%), serotype11A (4%) and serotype22F (3.8%). 57.1% of isolates were serotypes included in VNC-13V. Two non-penicillin-sensitive strains and two others were not sensitive to cefotaxime, and 24.7% of the strains were not susceptible to erythromycin (26.9% in 2011 and 22.5% in 2012). The case fatality rate was 16.5%, reaching 23.3% in patients over 75years. Diseases with a statistically significant risk of mortality were: liver, kidney and immunodeficiency without HIV.
ConclusionsSerotype3 was the most frequent in Galicia. Very few strains were not susceptible to penicillin. Erythromycin resistance decreased from 2011 to 2012. It is highlighted that mortality increases with age. Liver disease, renal disease and non-HIV immunodeficiency increases the mortality risk.
Streptococcus pneumoniae es una causa importante de neumonía, meningitis, otitis media y septicemia y se asocia a una importante morbimortalidad a nivel mundial1. La incidencia de enfermedad neumocócica invasiva (ENI) varía ampliamente de unos países a otros. En 2005, la Organización Mundial de la Salud estimó que 1,6 millones de muertes estaban causadas por este agente. Las tasas de incidencia más elevada se presentan en los extremos de la vida2. Además de la edad, se ha descrito que determinadas condiciones y enfermedades concomitantes subyacentes aumentan el riesgo de ENI y su evolución3.
S.pneumoniae posee una cápsula polisacarídica, principal factor de virulencia1. Se conocen más de 90 serotipos en base a la composición de la cápsula, pero solo unos pocos van a ser responsables de la mayoría de los casos de ENI. La frecuencia de aislamiento de cada serotipo va a depender de la edad, la presentación clínica, el área geográfica y el tiempo4-7. Diferentes estudios muestran la asociación de los factores de riesgo, comorbilidad y letalidad con los diferentes serotipos8-10.
Tras el inicio de la vacunación en la infancia con la vacuna conjugada 7-valente (VNC-7V) se evidenció una gran reducción de los serotipos vacunales en adultos, reflejando que los niños son el reservorio y el vector de la ENI en adultos y que la vacuna proporciona inmunidad de grupo2.
Desde junio de 2010 se dispone en España de la vacuna conjugada frente a 13 serotipos (VNC-13V). Esta vacuna está indicada para la prevención de la enfermedad neumocócica, neumonía y otitis media aguda causada por S.pneumoniae en niños y adolescentes de 6semanas a 17años y de la inmunización activa para la prevención de la enfermedad invasiva causada por S.pneumoniae en adultos de 18años de edad en adelante11. En Galicia, en enero de 2011 se puso en marcha un proyecto piloto de vacunación frente al neumococo con la VNC-13, con el objetivo de vacunar con 3 dosis (2, 4 y 12meses) a todos los nacidos a partir noviembre de 201012. De forma simultánea se inició un estudio de vigilancia de la ENI en toda la comunidad.
El objetivo de este estudio fue describir la distribución de serotipos y sensibilidad de S.pneumoniae causante de ENI en Galicia durante los años 2011 y 2012, analizar los factores de riesgo y la mortalidad asociada.
MétodosSe estudiaron todas las cepas obtenidas en casos de ENI procedentes de todos los hospitales del Servicio Gallego de Salud y del hospital POVISA de Vigo, aisladas de fluidos normalmente estériles. La población de referencia del estudio es la que figura en el padrón de habitantes de Galicia del año correspondiente: 2.795.422 habitantes en 2011 y 2.781.498 habitantes en 2012. Las cepas se enviaron al laboratorio de microbiología del Complexo Hospitalario Universitario de Ferrol junto con un volante donde constaban los datos de filiación del paciente, de la muestra, así como del cuadro clínico. Los datos de factores de riesgo y mortalidad se recogieron posteriormente de la historia clínica.
El serotipado se realizó mediante aglutinación con partículas de látex sensibilizadas, siguiendo las instrucciones del fabricante (Pneumotest látex; Statens Serum Institut, Copenhagen, Dinamarca) y reacción de Quellung (antisueros del Statens Serum Institut, Copenhagen, Dinamarca)13,14.
Se determinó la concentración mínima inhibitoria (CMI) a penicilina, cefotaxima, eritromicina, vancomicina y levofloxacino mediante la técnica de microdilución en caldo con el panel STRHAE2® (Sensititre, IZASA). En el caso de diagnóstico de meningitis o de aquellos neumococos con CMI a penicilina >0,03μg/ml o con CMI a cefotaxima >0,06μg/ml se realizó además comprobación de la sensibilidad a penicilina y cefotaxima con el método de difusión E-test® (BioMérieux). Los resultados se interpretaron siguiendo los criterios de CLSI15. Se consideraron no sensibles a penicilina aquellas cepas con CMI>2μg/ml, y en el caso de infecciones meníngeas cuando CMI>0,06μg/ml. En caso de cefotaxima fueron no sensibles aquellas cepas con CMI>1μg/ml, y en infecciones meníngeas CMI>0,5μg/ml. No sensibles a eritromicina aquellas con CMI>0,25μg/ml, a cotrimoxazol CMI≥2/38μg/ml. Se consideraron resistentes a levofloxacino cuando CMI≥8μg/ml y sensibles a vancomicina si CMI≤0,5μg/ml. En aquellas cepas resistentes a eritromicina (CMI≥1μg/ml) se realizó inducción en Muller-Hinton agar con 5% de sangre de carnero con discos de eritromicina y clindamicina para determinar el fenotipo de resistencia a macrólidos (fenotiposM y MLSb).
Se consideraron factores de riesgo de padecer ENI la patología respiratoria crónica (asma, EPOC, fibrosis pulmonar), la patología cardíaca crónica (isquémica, hipertensiva, arritmias, insuficiencia cardíaca crónica, portadores de marcapasos, valvulopatías), la patología hepática crónica (cirrosis alcohólica, cirrosis criptogénica, VHB, VHC), patología renal crónica (insuficiencia renal crónica), diabetes mellitus (1 y 2), inmunodeficiencia no VIH (tumores, trasplantes, tratamientos quimioterápicos, enfermedades autoinmunes, linfomas, leucemias, mieloma múltiple, enfermedad de Hodgkin, esclerosis múltiple), asplenia y VIH.
Para la comparación de los serotipos aislados en 2011 y 2012 se empleó el test exacto de Fisher. Para el estudio estadístico univariante se empleó como prueba de comparación el chi-cuadrado de Pearson sin corrección. En el análisis multivariante se empleó regresión logística, se tomó como variable dependiente la mortalidad y se relacionó con aquellas variables que, en el análisis univariante, resultaron significativamente asociadas a la variable dependiente (nivel de significación del 20%) para lo cual se estudió la odss ratio (OR), la p y el IC95%. El análisis estadístico se realizó con los programas SPSS 15.0 y EPIDAT 3.1.
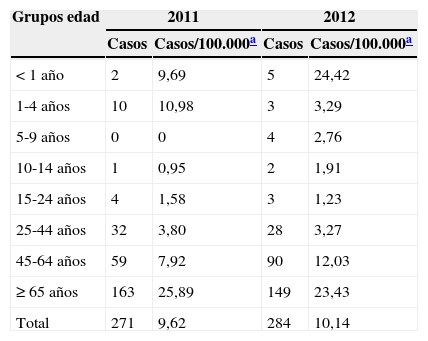
ResultadosDurante los 2 años de estudio se recogieron 555 cepas: 271 en 2011 y 284 en 2012. La población a estudio por grupos de edad se muestra en la tabla 1, representando los de 65años y mayores el 56,2% de los casos (312 pacientes).
Datos demográficos de la población a estudio
S.pneumoniae se aisló en 486 muestras de sangre (87,6%), 31 en LCR (5,6%), 13 en líquido pleural (2,3%), 6 en líquido articular (1,1%), 4 en absceso de mastoideo (0,7%), 3 en líquido ascítico (0,5%), 2 en humor acuoso (0,4%), una en humor vítreo (0,2%) y una en absceso apendicular (0,2%). Se incluyeron además 8 cepas aisladas en raspado corneal (1,4%).
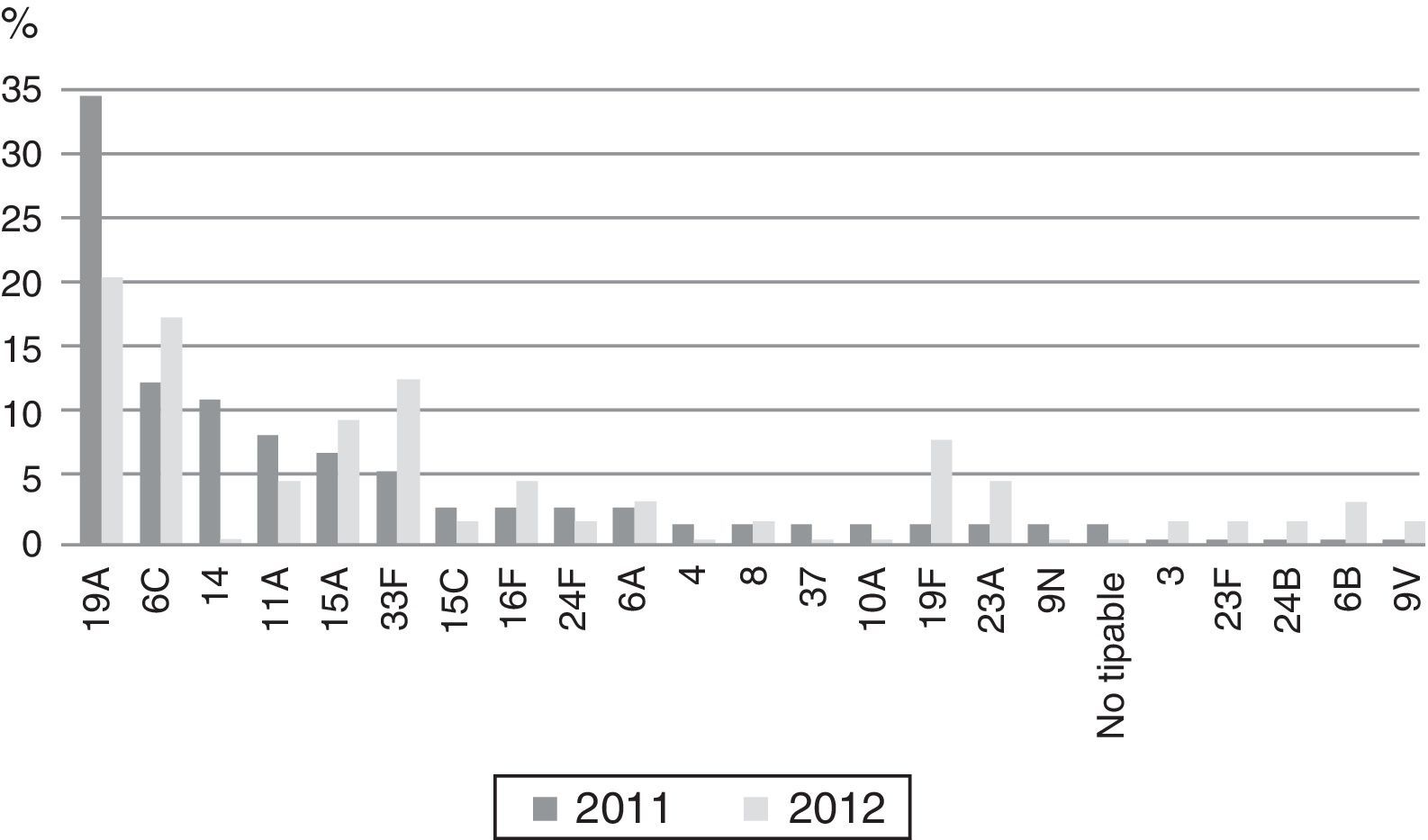
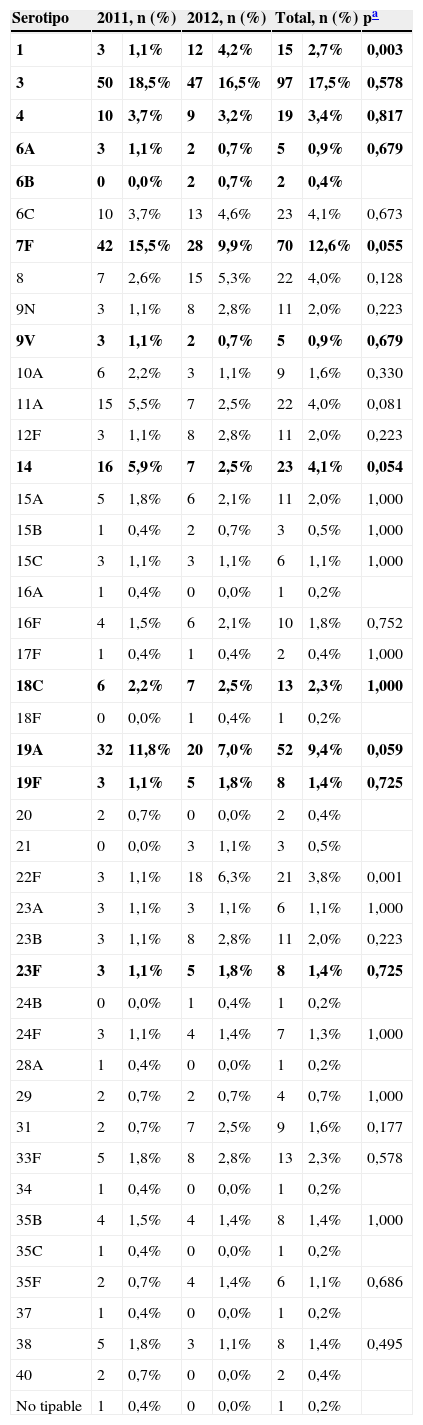
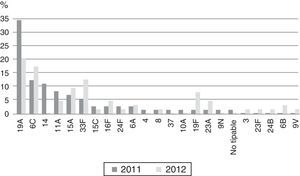
Se encontraron 43 serotipos diferentes (tabla 2). Los serotipos con un número superior a 20 aislamientos durante los 2 años de estudio fueron: serotipo3 (17,5%), serotipo7F (12,6%), serotipo19A (9,4%), serotipo14 (4,1%), serotipo6C (4,1%), serotipo11A (4%) y serotipo22F (3,8%). En estos 2 años se encontró un descenso en el límite de la significación de los serotipos7F (p=0,055), 14 (p=0,054) y 19A (p=0,059) y un aumento de los serotipos1 y 22F estadísticamente significativo (p<0,05).
Distribución de serotipos aislados en los 2 años
| Serotipo | 2011, n (%) | 2012, n (%) | Total, n (%) | pa | |||
|---|---|---|---|---|---|---|---|
| 1 | 3 | 1,1% | 12 | 4,2% | 15 | 2,7% | 0,003 |
| 3 | 50 | 18,5% | 47 | 16,5% | 97 | 17,5% | 0,578 |
| 4 | 10 | 3,7% | 9 | 3,2% | 19 | 3,4% | 0,817 |
| 6A | 3 | 1,1% | 2 | 0,7% | 5 | 0,9% | 0,679 |
| 6B | 0 | 0,0% | 2 | 0,7% | 2 | 0,4% | |
| 6C | 10 | 3,7% | 13 | 4,6% | 23 | 4,1% | 0,673 |
| 7F | 42 | 15,5% | 28 | 9,9% | 70 | 12,6% | 0,055 |
| 8 | 7 | 2,6% | 15 | 5,3% | 22 | 4,0% | 0,128 |
| 9N | 3 | 1,1% | 8 | 2,8% | 11 | 2,0% | 0,223 |
| 9V | 3 | 1,1% | 2 | 0,7% | 5 | 0,9% | 0,679 |
| 10A | 6 | 2,2% | 3 | 1,1% | 9 | 1,6% | 0,330 |
| 11A | 15 | 5,5% | 7 | 2,5% | 22 | 4,0% | 0,081 |
| 12F | 3 | 1,1% | 8 | 2,8% | 11 | 2,0% | 0,223 |
| 14 | 16 | 5,9% | 7 | 2,5% | 23 | 4,1% | 0,054 |
| 15A | 5 | 1,8% | 6 | 2,1% | 11 | 2,0% | 1,000 |
| 15B | 1 | 0,4% | 2 | 0,7% | 3 | 0,5% | 1,000 |
| 15C | 3 | 1,1% | 3 | 1,1% | 6 | 1,1% | 1,000 |
| 16A | 1 | 0,4% | 0 | 0,0% | 1 | 0,2% | |
| 16F | 4 | 1,5% | 6 | 2,1% | 10 | 1,8% | 0,752 |
| 17F | 1 | 0,4% | 1 | 0,4% | 2 | 0,4% | 1,000 |
| 18C | 6 | 2,2% | 7 | 2,5% | 13 | 2,3% | 1,000 |
| 18F | 0 | 0,0% | 1 | 0,4% | 1 | 0,2% | |
| 19A | 32 | 11,8% | 20 | 7,0% | 52 | 9,4% | 0,059 |
| 19F | 3 | 1,1% | 5 | 1,8% | 8 | 1,4% | 0,725 |
| 20 | 2 | 0,7% | 0 | 0,0% | 2 | 0,4% | |
| 21 | 0 | 0,0% | 3 | 1,1% | 3 | 0,5% | |
| 22F | 3 | 1,1% | 18 | 6,3% | 21 | 3,8% | 0,001 |
| 23A | 3 | 1,1% | 3 | 1,1% | 6 | 1,1% | 1,000 |
| 23B | 3 | 1,1% | 8 | 2,8% | 11 | 2,0% | 0,223 |
| 23F | 3 | 1,1% | 5 | 1,8% | 8 | 1,4% | 0,725 |
| 24B | 0 | 0,0% | 1 | 0,4% | 1 | 0,2% | |
| 24F | 3 | 1,1% | 4 | 1,4% | 7 | 1,3% | 1,000 |
| 28A | 1 | 0,4% | 0 | 0,0% | 1 | 0,2% | |
| 29 | 2 | 0,7% | 2 | 0,7% | 4 | 0,7% | 1,000 |
| 31 | 2 | 0,7% | 7 | 2,5% | 9 | 1,6% | 0,177 |
| 33F | 5 | 1,8% | 8 | 2,8% | 13 | 2,3% | 0,578 |
| 34 | 1 | 0,4% | 0 | 0,0% | 1 | 0,2% | |
| 35B | 4 | 1,5% | 4 | 1,4% | 8 | 1,4% | 1,000 |
| 35C | 1 | 0,4% | 0 | 0,0% | 1 | 0,2% | |
| 35F | 2 | 0,7% | 4 | 1,4% | 6 | 1,1% | 0,686 |
| 37 | 1 | 0,4% | 0 | 0,0% | 1 | 0,2% | |
| 38 | 5 | 1,8% | 3 | 1,1% | 8 | 1,4% | 0,495 |
| 40 | 2 | 0,7% | 0 | 0,0% | 2 | 0,4% | |
| No tipable | 1 | 0,4% | 0 | 0,0% | 1 | 0,2% | |
En negrita aparecen los serotipos incluidos en la VNC-13V.
El 57,1% de los serotipos aislados estaban incluidos en VNC-13V. En 2011 estaban incluidos el 63,1% y en 2012 el 51,4% (p=0,007). En menores de 2años (10 cepas), en 2011 estaban incluidos el 60% y en 2012 el 0%. En el grupo de 65 o más años (312 cepas), en 2011 estaban incluidos el 63,2% y en 2012 el 46,3%. El 77,1% de los serotipos estaban incluidos en la 23-PPV: el 79% en 2011 y el 75,3% en 2012.
Se encontraron 2 cepas (0,4%) no sensibles a penicilina, una con CMI=3μg/ml y otra con CMI=4μg/ml, serotipos 14 y 11A, respectivamente, ambas aisladas en el año 2012. Considerando como no sensible CMI>0,06μg/ml, se encontraron 108 cepas (19,4%) no sensibles a penicilina, 56 (20,6%) en 2011 y 52(18,4%) en 2012. Estas cepas correspondieron mayoritariamente a los serotipos14 (21,3%), 19A (20,4%), 6C (13%) y 15A (10,2%).
Dos cepas fueron no sensibles a cefotaxima, ambas aisladas en el año 2012: una con CMI=2μg/ml y otra con CMI=4μg/ml, serotipos19A y 14, respectivamente. Considerando como no sensible CMI>0,5μg/ml, 38 cepas (6,8%) fueron no sensibles a cefotaxima, 23 (8,5%) en 2011 y 15 (5,3%) en 2012, siendo los serotipos predominantes el serotipo14 (44,7%), el 19A (23,7%) y el 11A (13,1%).
Se detectaron 137 cepas (24,7%) no sensibles a eritromicina: 73 (26,9%) en 2011 y 64 (22,5%) en 2012 (p=0,27). En relación con los serotipos no sensibles a eritromicina que fueron predominantes, el serotipo19A se detectó en el 34,2% de los casos durante 2011 y en el 20,3% en 2012, mientras que el 6C se detectó en el 12,3% durante 2011 y en el 17,2% en 2013 (fig. 1). Los fenotipos de resistencia a macrólidos fueron de tipoM en 39 cepas (28,5%), MLSb en 97 cepas (70,8%) y MLSb inducible en una cepa (0,7%). De los 52 aislamientos de serotipo19A, 38 (83,1%) fueron no sensibles a eritromicina y el 68,4% presentaron fenotipo MLSb constitutivo. De los 23 aislamientos del serotipo6C, 20 (86,9%) fueron no sensibles a eritromicina, siendo el 100% del fenotipo MLSb constitutivo.
Se encontraron 3 cepas (0,5%) resistentes a levofloxacino: 2 de serotipo8 y una de serotipo7F. No se encontraron resistencias a vancomicina.
Se recogieron datos de mortalidad y factores de riesgo en 551 casos. Los datos demográficos de la población a estudio se muestran en la tabla 1, donde también figuran las tasas de aislamientos por 100.000 habitantes en la población global de Galicia según el padrón de habitantes en 2011 y 2012. La tasa de letalidad fue del 16,5% (91/551). Hubo diferencias significativas en relación con los grupos de edad. En el grupo de 0 a 14años no hubo ninguna muerte (0/24), en el de 15 a 44años, el 10,6% (7/66); en el de 45 a 64años, el 12% (18/149); en el de 65 a 74años, el 15,29% (13/85), y en el de mayores de 75años, el 23,3% (53/227). Se observa que la mortalidad se incrementa a medida que lo hace la edad. No hubo diferencias significativas al relacionar las muertes con el sexo ni con el tipo de muestra clínica.
Las patologías de base o factores de riesgo que presentaban los pacientes fueron 30,4% cardíaca, 28,1% inmunodeficiencia no VIH, 25,9% respiratoria, 16% diabetes mellitus, 14,9% hepática, 9,4% renal, 3,6% VIH y 1,2% asplenia.
En el análisis univariante que relacionó los factores de riesgo con la mortalidad, mostraron significación estadística la patología hepática (p=0,004), la patología renal (p=0,04), el padecer inmunodeficiencia no VIH (p<0,0001) y la asplenia (p=0,02), aunque de estas, en el análisis multivariante solo tuvieron significación estadística la patología hepática (p=0,001), la patología renal (p=0,03) y la inmunodeficiencia no VIH (p<0,0001).
Los tipos más frecuentes de inmunodeficiencia no VIH fueron mieloma múltiple (15%, p=0,09), cáncer de pulmón (11,6%, p=0,96), linfoma no Hodgkin (11%, p=0,83), cáncer de próstata (7,5%, p=0,24), cáncer de recto (4,1%, p=0,05) y cáncer basocelular (3,4%, p=0,09).
Se cruzaron los datos de los fallecidos en el período del estudio con los serotipos de las cepas aisladas y no se encontraron datos estadísticamente significativos entre ambos.
DiscusiónLa incidencia de ENI ha disminuido con la introducción de las vacunas conjugadas en los programas de inmunización infantil. Numerosos estudios de portadores de neumococos indican que las vacunas conjugadas reducen los portadores de serotipos vacunales en niños vacunados y en los no vacunados por protección indirecta16.
Aunque el período de estudio es corto, en estos 2 años de vigilancia se ha observado un descenso de serotipos vacunales. Este descenso va desde el 63,1% en 2011 hasta el 51,4% en 2012, probablemente debido a una disminución de la transmisión del neumococo entre la población vacunada y los convivientes con niños por inmunidad de grupo, como se evidencia en otros estudios17.
En nuestro estudio el porcentaje de serotipos incluidos en la VNC-13V fue variable en los diferentes grupos de edad. En los grupos donde hubo menor porcentaje de aislamiento de serotipos incluidos en la vacuna fueron los menores de 2años y el grupo de mayor edad. Así, en menores de 2años solo el 30% de los aislamientos correspondieron a serotipos incluidos en la VNC-13V, el 60% en 2011 y ninguno en 2012, aunque en este grupo solo se aislaron 10 cepas en los 2 años. En mayores de 65años, el 55,1% de los aislamientos correspondieron a serotipos incluidos en la 13V, el 63,2% en 2011 y el 46,3% en 2012, con un total de 312 aislamientos. Un menor aislamiento de serotipos vacunales en estos 2 grupos de edad podría ser debido a la acción de la vacuna en el grupo de menores de 2años y a la consecuente baja transmisión en los convivientes con esto niños17,18.
Cabe destacar que el mayor número de aislamientos de S.pneumoniae se produjo en personas de 65años y mayores (56,21%), así que los serotipos mayoritarios encontrados son los que se detectan habitualmente en este grupo de población: serotipo3, 7F y 19A, que coinciden con los encontrados en población mayor de 65años en otros estudios en España, Estados Unidos y Canadá19-21.
Los serotipos8, 6C, 11A y 22F no incluidos en VNC-13V se encontraron fundamentalmente en personas mayores de 65años. Considerando que la VNC-13V puede proporcionar protección cruzada frente al serotipo6C, se podría esperar que en los próximos años disminuyese este serotipo por protección indirecta de la vacuna22. Debido al aumento de serotipos incluidos en la vacuna 23-PPV y no en la VNC-13V (8, 11A, 22F), los adultos de los grupos de riesgo se podrían beneficiar de una vacunación doble, VNC-13V seguida de 23-PPV.
Encontramos un porcentaje muy bajo (0,4%) de cepas no sensibles a penicilina (CMI>2μg/ml). Cuando se consideró CMI>0,06μg/ml, el 19,4% de las cepas fueron no sensibles, y principalmente representadas por los serotipos14, 19A y 6C. En relación con la cefotaxima, el porcentaje de cepas resistentes también fue muy bajo. Para este antibiótico se detectó un 0,4% de no sensibles (CMI>1μg/ml) y un 6,8% con CMI>0,5μg/ml. Estos resultados son similares a los encontrados en otros estudios, en los que el 75-80% de las cepas de S.pneumoniae que causan infección sistémica fueron sensibles a la penicilina (CMI<0,06μg/ml), y el 95-98% fueron sensibles a la cefotaxima (CMI<0,5μg/ml). En el momento actual en España el 95-98% de las cepas invasivas son sensibles a la penicilina (CMI≤2mg/l) y el 99% son sensibles a la cefotaxima (CMI≤1mg/l)23-25.
Se observaron porcentajes de no sensibilidad a eritromicina similares a los encontrados por otros autores en España, donde se detectan tasas altas de resistencia a macrólidos, sobre todo antes de la introducción de la VNC-7V y que posteriormente disminuyen en niños, manteniéndose sin fluctuaciones en población adulta23,24. En nuestro estudio el 24,7% de las cepas fueron no sensibles a eritromicina, siendo los serotipos19A y 6C los que presentaron mayores tasas de resistencia. El fenotipo mayoritario fue el de tipo MLSb constitutivo (70,8%), siendo también el fenotipo de resistencia más frecuente en Europa, especialmente en Bélgica, Francia, Polonia, Italia y España23. Al igual que en otros estudios, en el serotipo6C se encontró un nivel elevado de resistencia a macrólidos. Estas cepas de serotipo6C también presentaron en nuestra serie unas CMI elevadas para penicilina, que si utilizáramos los criterios de infección meníngea serían no sensibles26,27. Se encontró un nivel bajo de resistencia a levofloxacino, al igual que lo encontrado en otros países europeos23.
En nuestro estudio encontramos que la tasa de letalidad fue del 16,5%. Diferentes estudios encuentran que la letalidad en Europa por ENI oscila entre el 6,5 y el 20%, dependiendo del país8,28. En un trabajo publicado en 2013 con datos de la Comunidad de Madrid se constató que la tasa de letalidad por ENI fue del 8,8%9. Los factores relacionados con la letalidad dependen de las características del microorganismo (serotipo, capacidad invasiva) y del hospedador (edad, presencia de enfermedad de base). En trabajos previos se ha mencionado que los pacientes con mayor riesgo de muerte fueron los que presentaron infección por los serotipos más prevalentes en portadores29. Algunos serotipos, como el 3, están asociados con alta letalidad, pero hay serotipos con bajo poder invasivo y gran letalidad y morbimortalidad30. En la muestra que presentamos en este estudio, a pesar de lo que dice la literatura no se evidenció la relación entre los serotipos más frecuentes (3, 7F, 11A, 14, 19A y 22F) y el fallecimiento. Encontramos gran variabilidad en la distribución de serotipos y no se asoció un serotipo concreto con la letalidad, a diferencia de lo detectado en el estudio de Rodríguez et al.9.
En relación con la mortalidad las patologías con un aumento del riesgo de morir, OR superior a 1, fueron la patología respiratoria, la patología hepática, la patología renal, la asplenia y la inmunodeficiencia no VIH, aunque de estas solamente la patología hepática, la renal y las inmunodeficiencias no VIH fueron significativas. Aunque globalmente las inmunodeficiencias no VIH tuvieron significación estadística en relación con la letalidad, no se asoció significación al tratar cada una por separado, relacionado con el escaso tamaño muestral de cada grupo.
Como conclusiones destacamos que se obtuvieron pocos aislamientos de S.pneumoniae causantes de ENI en menores de 5años en Galicia. En cuanto a los serotipos, el 3 fue el mayoritario, aislándose sobre todo en población adulta de más de 65años y fundamentalmente en hombres. Detectamos un descenso de serotipos vacunales de 2011 a 2012, y en la población menor de 2años, durante el segundo año de vigilancia, no se encontraron serotipos incluidos en la VNC-13V. Debemos continuar con la vigilancia de la ENI para estudiar el impacto que la VNC-13V puede tener en la población de Galicia y comprobar la inmunidad de grupo proporcionada por la vacunación de la población infantil.
Con los nuevos criterios de puntos de corte para la penicilina parenteral se encontraron muy pocas cepas no sensibles a penicilina. Se detectó un descenso de resistencia a eritromicina de 2011 a 2012.
FinanciaciónEste trabajo ha sido financiado en parte por Pfizer a través de la Fundación Novoa Santos.
Conflicto de interesesSusana Méndez Lage ha recibido honorarios por parte de la Fundación Profesor Novoa Santos por la participación en el Grupo de trabajo del neumococo de los hospitales de Galicia patrocinado por Pfizer.
A Natividad Somaza Serantes y a Ramón Delgado Fernández por su inestimable ayuda en la elaboración del trabajo.