Las infecciones respiratorias por Pseudomonas aeruginosa se asocian a mala función respiratoria, calidad de vida baja y frecuencia alta de hospitalización.
MétodosEstudio prospectivo de 6 años (2000–2005) de pacientes ingresados en hospitalización a domicilio con infección respiratoria por P. aeruginosa para administración de tratamiento antibiótico parenteral. Se analizan variables clínicas, tratamiento, recidiva, tiempo libre de recidiva (TLR) y factores pronósticos.
ResultadosSe registraron 111 episodios en 81 pacientes. Las bronquiectasias fue la afección más frecuente (57%). El tratamiento más administrado fue ceftazidima y tobramicina (61%). La estancia media fue de 14 días. El 80% tenía un grado de obstrucción respiratoria G-MG (grave-muy grave). El 35% finalizó el tratamiento con cultivo positivo. La mediana de seguimiento hasta la recidiva fue de 144 días. El 65% de los episodios recidivaron, y con más frecuencia los que tenían bronquiectasias, mayor grado de obstrucción respiratoria y llevaban aerosolterapia. El TLR en los pacientes con grado de obstrucción G-MG se redujo de 1.080 a 139 días, los que terminaban con cultivo positivo de 248 a 78 días y los que en el antibiograma tenían alguna resistencia frente a antibióticos antiseudomónicos, de 390 a 97 días. El análisis multivariante mostró la independencia de la gravedad en el grado de obstrucción respiratoria y la resistencia antibiótica en el incremento de la probabilidad de recidivar.
ConclusiónLos pacientes infectados por P. aeruginosa en peor situación clínica, o con alguna resistencia antibiótica frente a antibióticos antiseudomónicos, recidivan más y probablemente en menos tiempo que los demás. Los servicios de hospitalización a domicilio son una buena alternativa para reducir el prolongado tiempo de ingreso de estos pacientes.
Pseudomonas aeruginosa respiratory infections are associated with poor respiratory function, low quality of life, and a high relapse rate.
MethodsA 6-year prospective study (2000–2005) was carried out. Patients with P. aeruginosa respiratory infection admitted to a Hospital at Home service for parenteral antibiotic treatment were enrolled in the study. Clinical response to treatment, relapse, and relapse-free time, were analyzed as primary endpoints.
ResultsA total of 111 episodes were recorded in 81 patients. Bronchiectasia was the most common associated disease (57%). Ceftazidime and tobramycin were the first-line therapies used (61%). The average length of stay was 14 days. Among the total, 80% of patients had severe/very severe respiratory obstruction, and 35% were culture-positive at the end of treatment. Median follow-up to relapse was 144 days; 65% of episodes relapsed. Relapse was associated with bronchiectasia, aerosol therapy, and more severe respiratory obstruction.
In the patients with severe/very severe obstruction, there was a decrease in relapse-free time from 1080 to 139 days, in those with positive culture at the end of therapy from 248 to 78 days, and in those with resistance to any antipseudomonal antibiotic, from 390 to 97 days.
On multivariate analysis, severity of respiratory obstruction and the antibiotic resistance were independent risk factors for relapse.
ConclusionPatients infected by P. aeruginosa in poor clinical condition or showing resistance to any antipseudomonal antibiotics have a higher probability of relapse, and a shorter time to relapse than other patients with this infection. The Hospital at Home Service is a good approach to reducing the long-term hospital stay in these patients.
Las infecciones del tracto respiratorio inferior por Pseudomonas aeruginosa se observan casi exclusivamente en personas con afectación de los sistemas de defensa locales, del aparato respiratorio o sistémicos1,2.
La infección crónica por P. aeruginosa está presente en el 24–33% de los pacientes con bronquiectasias2,3 y se asocia a una función pulmonar peor y una frecuencia mayor de hospitalización.
La necesidad de varios ciclos antibióticos conlleva el riesgo de aumento de resistencias. La inhalación de una solución de tobramicina reduce la concentración de bacterias en el esputo con mejoría clínica en individuos estables con bronquiectasias con y sin fibrosis quística (FQ)4–8.
Se estima que 110.000 personas en Estados Unidos reciben tratamiento para los síntomas derivados de las bronquiectasias, lo que supone un gasto de aproximadamente 600 millones de dólares al año9, atribuibles sobre todo a ingresos hospitalarios por reagudizaciones, especialmente en pacientes colonizados por P. aeruginosa.
Los servicios de hospitalización a domicilio (HAD) integrados en los hospitales, formados por médicos y personal de enfermería, permiten que los pacientes una vez estabilizados durante su ingreso hospitalario, sean tratados en el domicilio de enfermedades, entre las que se encuentran las infecciones respiratorias de tracto respiratorio inferior, con la administración de tratamiento antibiótico parenteral10–13. Asimismo, pueden evitar ingresos, protocolizando algunas enfermedades desde el servicio de urgencias, consultas externas o atención primaria.
El objetivo de este trabajo es conocer las características de los pacientes ingresados en nuestro servicio con infección respiratoria por P. aeruginosa tratados con tratamiento antibiótico parenteral domiciliario, el tiempo libre de recidiva, así como detectar factores pronósticos de recidiva después de finalizar el tratamiento.
MétodosEl Hospital Donostia, centro terciario con 1.172 camas, atiende a una población de 673.000 habitantes. El servicio de HAD, en funcionamiento desde 1993, da cobertura al 40% de la población más cercana al hospital. Consta de 6 médicos, 13 enfermeras y una administrativa; su cobertura es de 8 a 21h todos los días del año. La media de pacientes atendidos/año de 2005–2007 es de 1.030, y su cartera de servicios incluye control clínico y administración de tratamientos parenterales, antibióticos, inmunoglobulinas, corticoterapia, realización de paracentesis, transfusiones, cuidados paliativos, etc.
Para este estudio, se recogieron durante 6 años, de forma prospectiva, datos de pacientes con diagnóstico de infección respiratoria por P. aeruginosa que ingresaron en el servicio de HAD del Hospital Donostia, para control clínico y administración de tratamiento antibiótico parenteral. Después de finalizar el tratamiento y tras el alta por HAD, el seguimiento se realizó mediante el sistema informático del hospital para detectar la aparición de la primera recidiva tras el ingreso en HAD o el fallecimiento del paciente, y se mantuvo 6 meses después del último episodio incorporado al estudio.
Se recogieron los datos siguientes:
- 1.
Al ingreso: edad, sexo, diagnóstico previo, oxigenoterapia domiciliaria, aerosolterapia, grado de alteración obstructiva, según datos existentes en la historia clínica sobre volumen espiratorio máximo en el primer segundo (FEV1)14, clasificándolo en leve, moderada, grave y muy grave (L, M, G, MG), analítica con hemograma, (leucocitosis=leucocitos >10,5*10e3/ul, neutrofilia=neutrófilos >75%), bioquímica, grado de resistencia antibiótica y tratamiento antibiótico administrado.
- 2.
Al alta: duración de tratamiento, 14 o 21 días, analítica con hemograma y bioquímica, cultivo de esputo al día 14 a todos los pacientes, y al día 21 a los pacientes con tratamiento de 21 días, reingreso y causa de éste.
- 3.
Tras el alta: existencia de recidiva y tiempo libre de recidiva (TLR) o muerte del paciente.
Se definió infección respiratoria por P. aeruginosa a la clínica de infección respiratoria de tracto respiratorio inferior (incremento de tos, disnea, aumento de expectoración, cambio en el color o consistencia de ésta, acompañado o no de fiebre) con cultivo de esputo positivo a P. aeruginosa y atribuible a ésta.
Se definió cultivo de esputo positivo, apoyado en los criterios de Murray-Washington, cuando la existencia de leucocitos es mayor que la de células epiteliales y el cultivo es abundante o, al menos, predominante de P. aeruginosa.
Se aplicaron los criterios de sensibilidad antibiótica definidos por el National Committee on Clinical Laboratory Standards del año 2000 actualmente CLSI (Clinical and Laboratory Standards Institute).
Se definió como curación o mejoría a la desaparición de los parámetros clínicos y analíticos indicativos de infección respiratoria, o reducción de éstos a la situación basal del paciente.
Se definió como recidiva a la aparición de un nuevo episodio de infección respiratoria del tracto respiratorio inferior, con cultivo positivo a P. aeruginosa y atribuible a ésta.
La resistencia se midió de 0 a 4 en función de la suma de las resistencias a los diferentes grupos de antibióticos a los que son sensibles las cepas salvajes (aminoglucósidos, β-lactámicos, carbapenemes y ciprofloxacino). No se incluye la resistencia a colimicina (o polimixina B) ya que nuestro laboratorio de microbiología no ha detectado cepas de P. aeruginosa resistentes a ella.
La aerosolterapia antibiótica se realizó con colimicina a dosis de 1–2 millones de unidades/12h, o tobramicina, 100–200mg/12h, aplicados mediante aerosol nebulizador CR-60.
Análisis estadísticoEl software utilizado fue el SPSS PC vs 12.0.
En el análisis de los resultados se han descrito las variables continuas mediante la media y la desviación estándar y las variables categóricas mediante proporciones. Para identificar la asociación entre 2 variables, se han comparado proporciones mediante el test de χ2 cuadrado y/o el test de Fisher y medias mediante el test de Student o el análisis de varianza. El TLR se ha analizado mediante análisis de Kaplan-Meier y se ha aplicado el test de log-rank para estudiar si hay diferencias estadísticamente significativas entre diversas categorías de factores pronóstico. El nivel de significación utilizado ha sido de 0,05. Finalmente se ha ajustado la regresión de Cox para estimar los hazard ratio (HR) junto con sus intervalos de confianza (IC), de las variables que independientemente se asocian con la probabilidad de recidiva. En el análisis multivariado se incluyeron todas las variables que a nivel individual alcanzaban una significación estadística de 0,3 o menor.
ResultadosDesde enero de 2000 hasta junio de 2005 se recogieron 111 episodios en 81 pacientes.
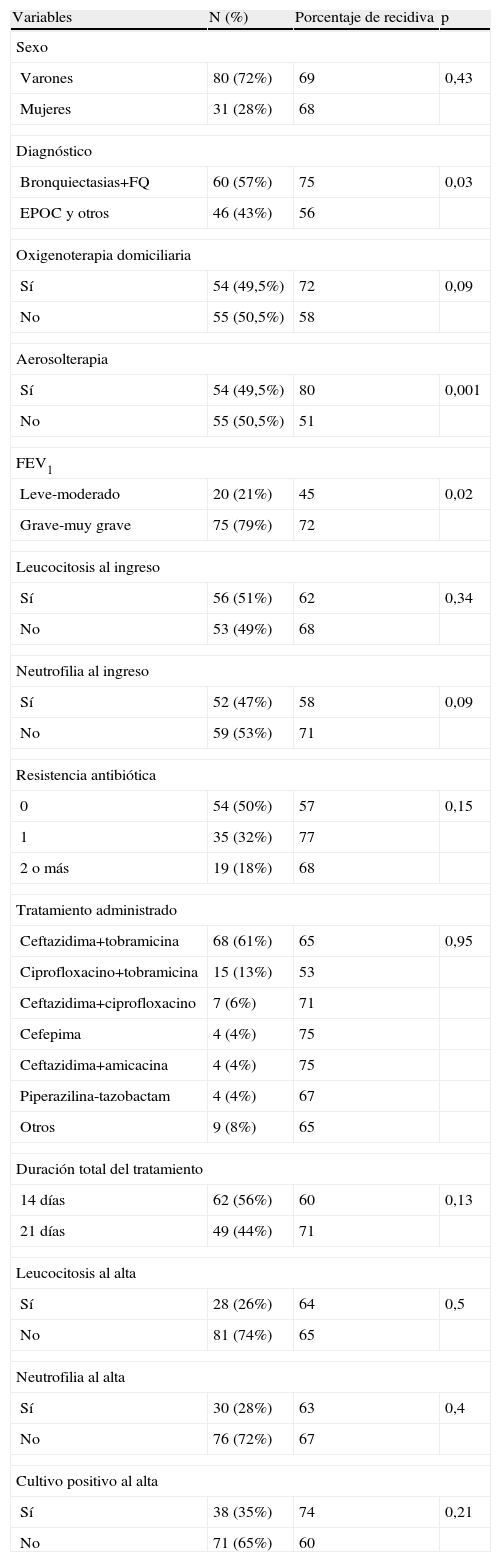
La media (extremos) de edad fue de 61 (31–88) años. El 72% eran varones. En la tabla 1 se describen las variables clínicas y evolutivas de los pacientes del estudio, así como el análisis univariante en cuanto a recidiva.
Variables estudiadas. Análisis univariante de la recidiva
| Variables | N (%) | Porcentaje de recidiva | p |
| Sexo | |||
| Varones | 80 (72%) | 69 | 0,43 |
| Mujeres | 31 (28%) | 68 | |
| Diagnóstico | |||
| Bronquiectasias+FQ | 60 (57%) | 75 | 0,03 |
| EPOC y otros | 46 (43%) | 56 | |
| Oxigenoterapia domiciliaria | |||
| Sí | 54 (49,5%) | 72 | 0,09 |
| No | 55 (50,5%) | 58 | |
| Aerosolterapia | |||
| Sí | 54 (49,5%) | 80 | 0,001 |
| No | 55 (50,5%) | 51 | |
| FEV1 | |||
| Leve-moderado | 20 (21%) | 45 | 0,02 |
| Grave-muy grave | 75 (79%) | 72 | |
| Leucocitosis al ingreso | |||
| Sí | 56 (51%) | 62 | 0,34 |
| No | 53 (49%) | 68 | |
| Neutrofilia al ingreso | |||
| Sí | 52 (47%) | 58 | 0,09 |
| No | 59 (53%) | 71 | |
| Resistencia antibiótica | |||
| 0 | 54 (50%) | 57 | 0,15 |
| 1 | 35 (32%) | 77 | |
| 2 o más | 19 (18%) | 68 | |
| Tratamiento administrado | |||
| Ceftazidima+tobramicina | 68 (61%) | 65 | 0,95 |
| Ciprofloxacino+tobramicina | 15 (13%) | 53 | |
| Ceftazidima+ciprofloxacino | 7 (6%) | 71 | |
| Cefepima | 4 (4%) | 75 | |
| Ceftazidima+amicacina | 4 (4%) | 75 | |
| Piperazilina-tazobactam | 4 (4%) | 67 | |
| Otros | 9 (8%) | 65 | |
| Duración total del tratamiento | |||
| 14 días | 62 (56%) | 60 | 0,13 |
| 21 días | 49 (44%) | 71 | |
| Leucocitosis al alta | |||
| Sí | 28 (26%) | 64 | 0,5 |
| No | 81 (74%) | 65 | |
| Neutrofilia al alta | |||
| Sí | 30 (28%) | 63 | 0,4 |
| No | 76 (72%) | 67 | |
| Cultivo positivo al alta | |||
| Sí | 38 (35%) | 74 | 0,21 |
| No | 71 (65%) | 60 | |
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio máximo en el primer segundo; FQ: fibrosis quística.
Casi el 80% de los pacientes tenían un FEV1 basal G-MG; la enfermedad de base más frecuente fue bronquiectasias+FQ (57%), el tratamiento que más se administró, ceftazidima+tobramicina intravenosa (i.v.) (61%) y la estancia media en HAD fue de 14 días.
El 50% de los pacientes estaba en tratamiento con aerosolterapia, el 85% de ellos con colimicina. El 50% de las P. aeruginosa de los cultivos de esputo de los pacientes tenía algún grado de resistencia antibiótica. El estudio de relación entre estas 2 variables mostró diferencias estadísticamente significativas (p=0,03), asociándose mayor grado de resistencia antibiótica a la presencia de tratamiento con aerosolterapia.
Prácticamente la mitad de los pacientes presentaba al ingreso en el hospital leucocitosis y/o neutrofilia, sin relación según los datos estadísticos con el grado de obstrucción respiratoria.
Los tratamientos administrados tuvieron una duración de 14 o 21 días. Los pacientes no pudieron asignarse de forma aleatorizada a cada grupo, aunque no hubo diferencias significativas en cuanto a las variables que definían a los pacientes de ambos grupos (edad, sexo, grado de obstrucción respiratoria y aerosolterapia); a pesar de ello, se asoció con más frecuencia la falta de gravedad en el FEV1 con la menor duración del tratamiento.
Finalizaron con leucocitosis y neutrofilia el 26 y el 28% de los pacientes, respectivamente.
No se observaron efectos secundarios clínicos o analíticos al tratamiento administrado.
En 38/109 episodios (35%) los pacientes finalizaron el tratamiento con cultivo positivo a P. aeruginosa. La posibilidad de persistir con cultivo positivo al alta fue más frecuente en los pacientes con mayor grado de obstrucción respiratoria (p=0,02); asimismo, fue independiente de la duración del tratamiento.
De los 4 pacientes que reingresaron (3,6%), 3 fueron por disnea y el otro, por hemoptisis.
Se documentaron 72 recidivas. El análisis de las variables estudiadas con respecto a la recidiva (tabla 1) muestra que hay una porcentaje mayor de recidivas en los pacientes con bronquiectasias (FQ+bronquiectasias) que con otros antecedentes (p<0,05). Asimismo, la presencia de aerosolterapia y FEV1 de grado G-MG se asocian a una frecuencia mayor de recidiva; sin embargo, el grado de resistencia antibiótica, el tipo de tratamiento, su duración o la positividad del esputo al alta, no influyen en ella.
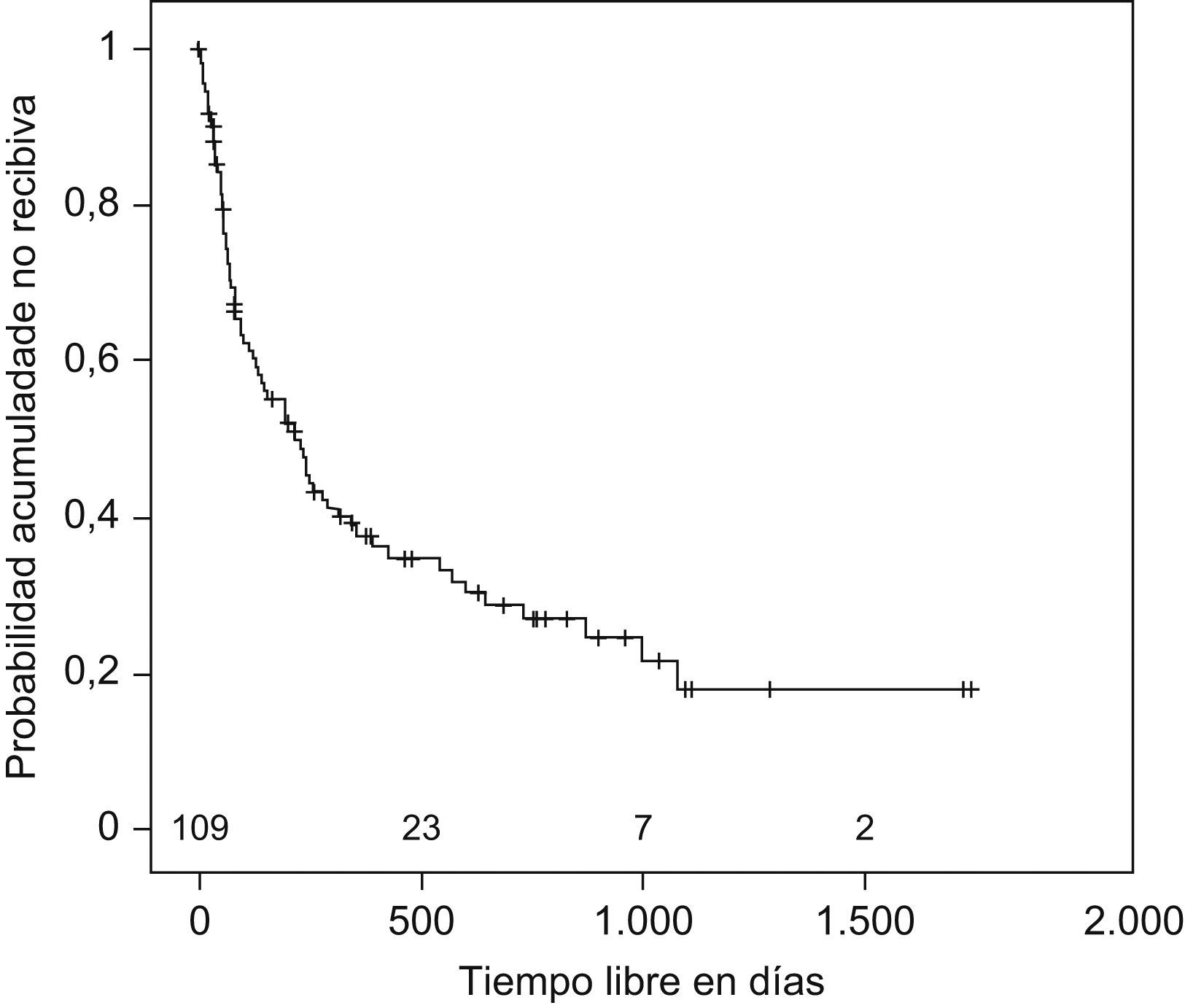
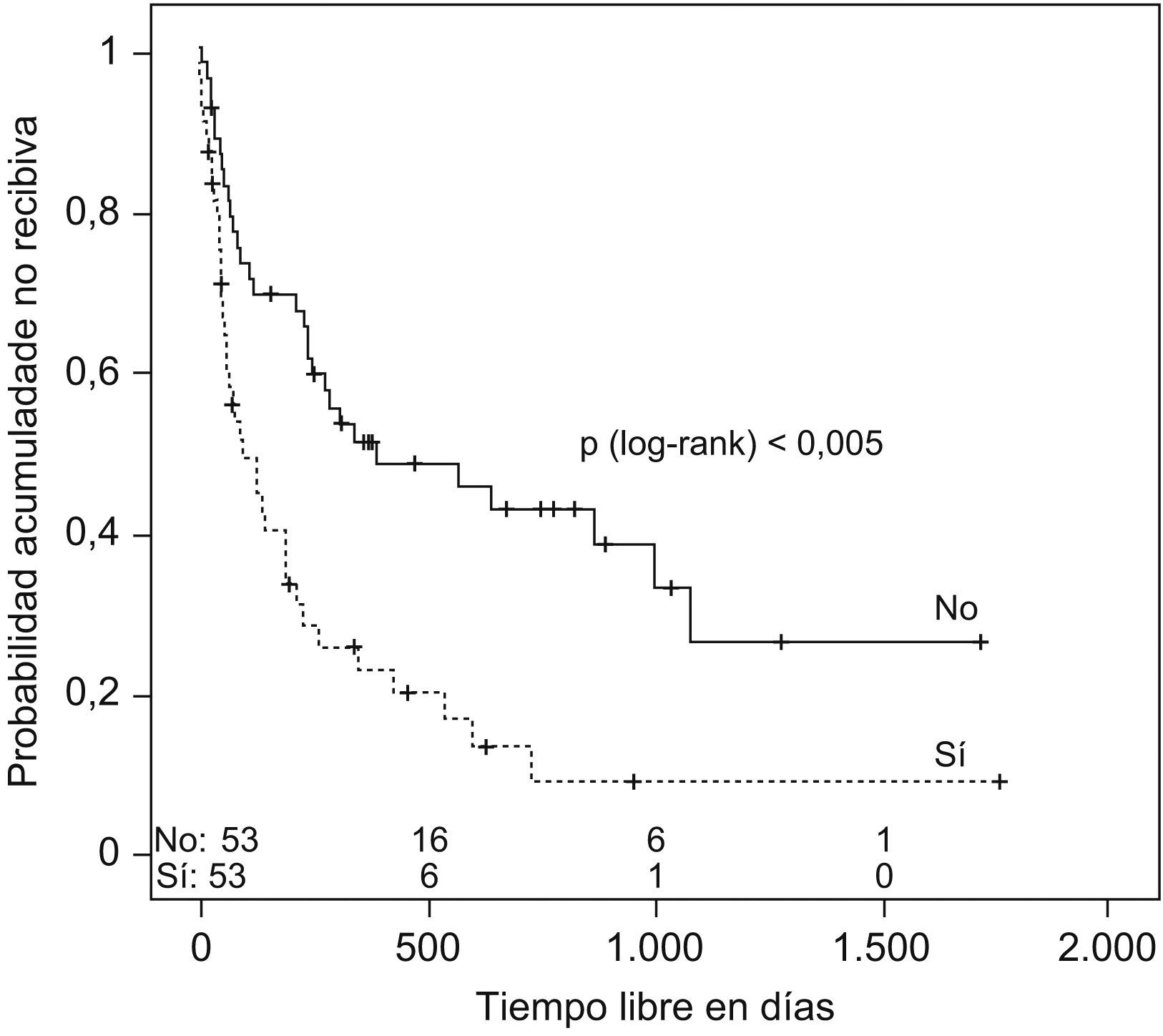
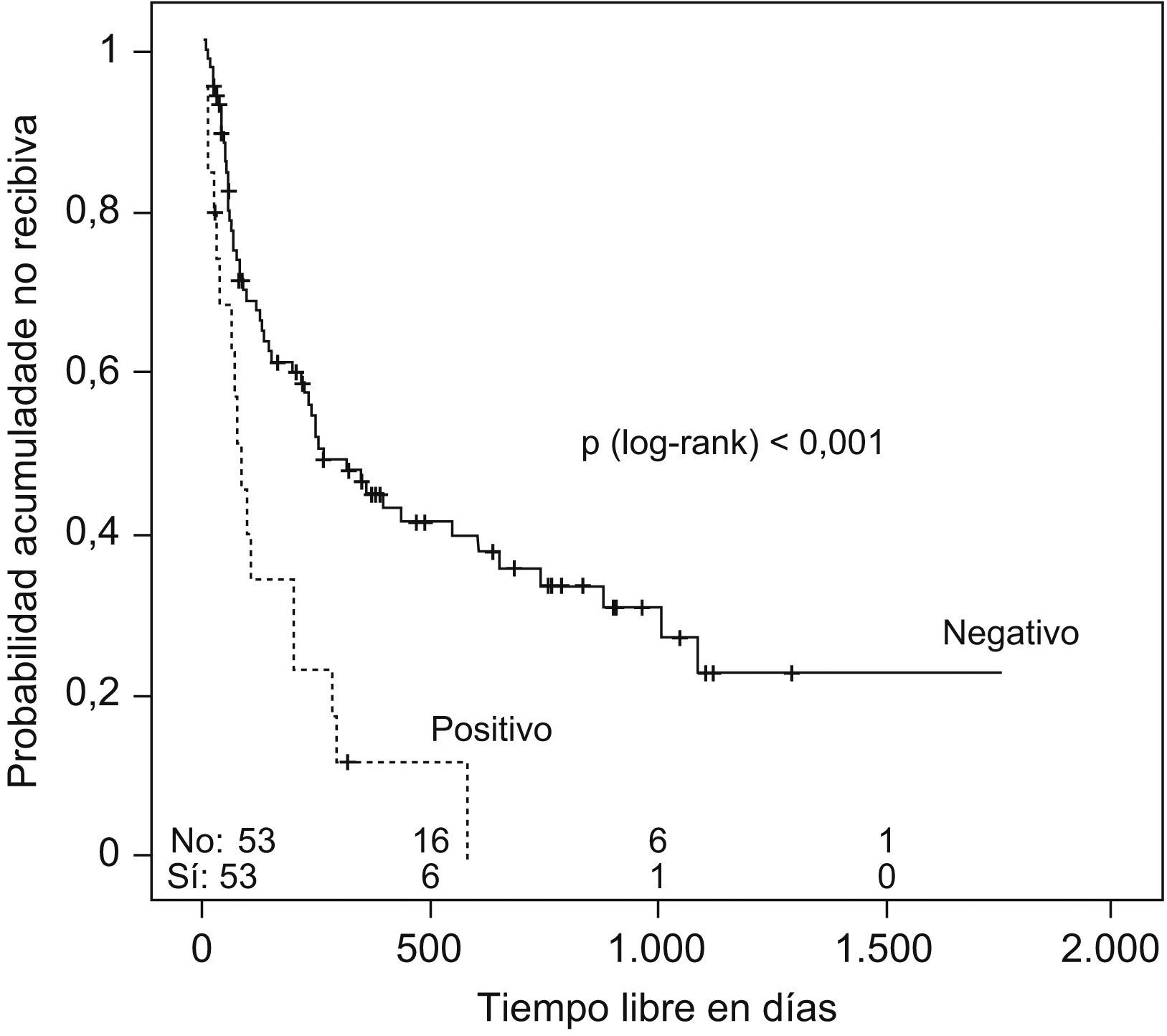
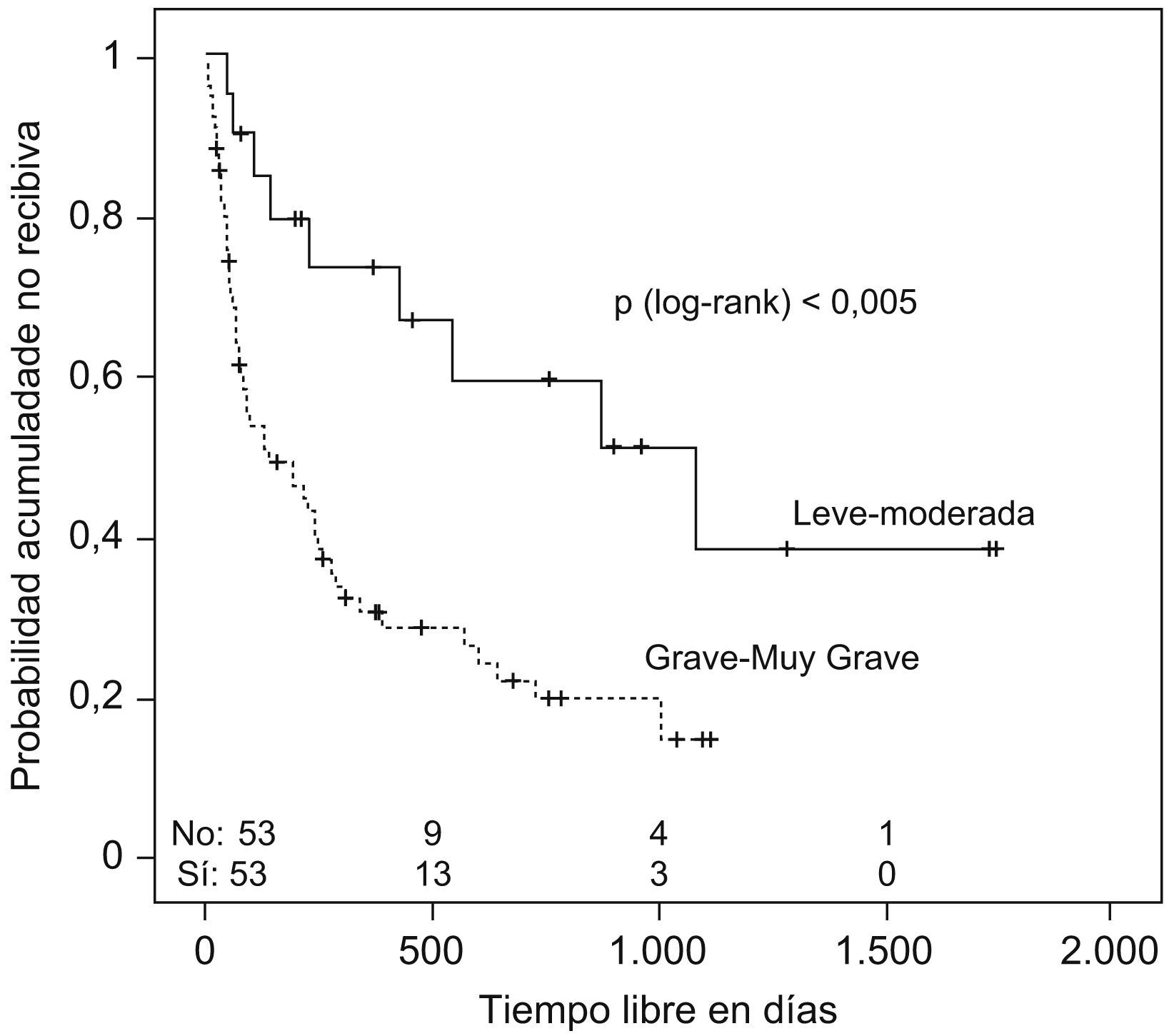
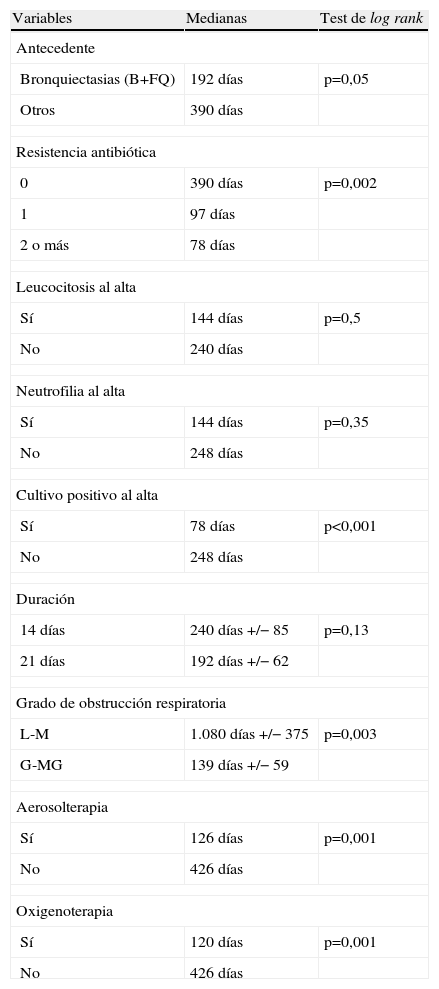
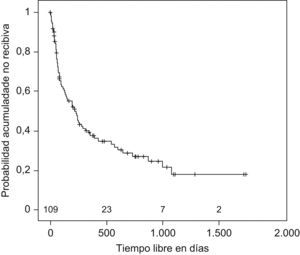
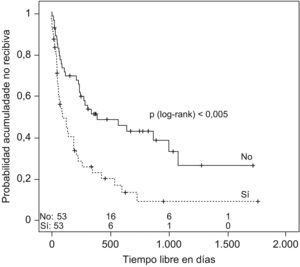
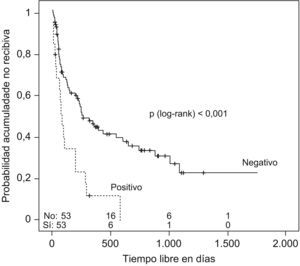
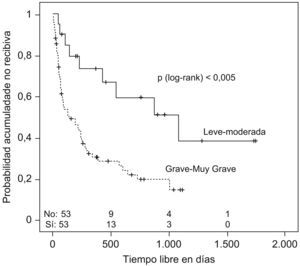
Se estudió el TLR y la posibilidad de identificar factores pronósticos entre las variables estudiadas (tabla 2), y se observó que la mediana de tiempo hasta la recidiva fue de 144 días (ri: 46-384) (fig. 1); el antecedente de bronquiectasias, la presencia de algún tipo de resistencia en el cultivo (fig. 2), estar en tratamiento con oxigenoterapia, aerosolterapia, finalizar el tratamiento con cultivo positivo (fig. 3), así como tener un grado de obstrucción respiratoria G-MG (fig. 4), acortaban el TLR de forma significativa, en algunos casos, como el FEV1, desde casi 3 años a 4 meses.
Asociación de variables al tiempo libre de recidiva
| Variables | Medianas | Test de log rank |
| Antecedente | ||
| Bronquiectasias (B+FQ) | 192 días | p=0,05 |
| Otros | 390 días | |
| Resistencia antibiótica | ||
| 0 | 390 días | p=0,002 |
| 1 | 97 días | |
| 2 o más | 78 días | |
| Leucocitosis al alta | ||
| Sí | 144 días | p=0,5 |
| No | 240 días | |
| Neutrofilia al alta | ||
| Sí | 144 días | p=0,35 |
| No | 248 días | |
| Cultivo positivo al alta | ||
| Sí | 78 días | p<0,001 |
| No | 248 días | |
| Duración | ||
| 14 días | 240 días +/− 85 | p=0,13 |
| 21 días | 192 días +/− 62 | |
| Grado de obstrucción respiratoria | ||
| L-M | 1.080 días +/− 375 | p=0,003 |
| G-MG | 139 días +/− 59 | |
| Aerosolterapia | ||
| Sí | 126 días | p=0,001 |
| No | 426 días | |
| Oxigenoterapia | ||
| Sí | 120 días | p=0,001 |
| No | 426 días | |
B: bronquiectasias; FQ: fibrosis quística; G-MG: grave-muy grave; L-M: leve-moderado.
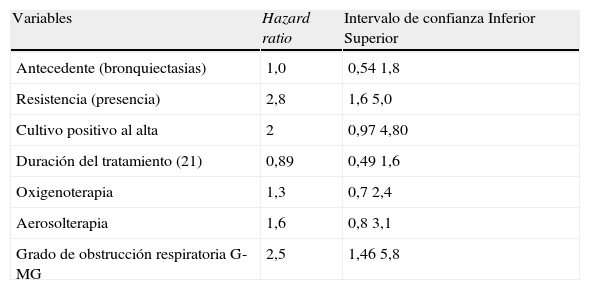
El análisis multivariante (tabla 3), realizado con los 95 episodios que disponían de todas las variables, mostró asimismo que tener algún tipo de resistencia en el cultivo de P. aeruginosa del ingreso casi triplica la probabilidad de recidivar en un tiempo determinado con respecto a los demás pacientes (HR=2,84; IC, 1,6–5,0); tener un FEV1 G-MG, aumenta más del doble esta probabilidad (HR=2,57; IC, 1,14–5,8) y que con una significación de 0,058 finalizar el tratamiento con cultivo positivo casi la duplica (HR=2,0; IC, 0,98–4,08).
Regresión de Cox. Asociación de variables independientes al tiempo libre de síntomas
| Variables | Hazard ratio | Intervalo de confianza Inferior Superior |
| Antecedente (bronquiectasias) | 1,0 | 0,54 1,8 |
| Resistencia (presencia) | 2,8 | 1,6 5,0 |
| Cultivo positivo al alta | 2 | 0,97 4,80 |
| Duración del tratamiento (21) | 0,89 | 0,49 1,6 |
| Oxigenoterapia | 1,3 | 0,7 2,4 |
| Aerosolterapia | 1,6 | 0,8 3,1 |
| Grado de obstrucción respiratoria G-MG | 2,5 | 1,46 5,8 |
G-MG: grave-muy grave.
Al analizar los datos descriptivos de los pacientes que durante el trabajo hemos estudiado, el paciente “tipo” observado que ingresa en nuestro servicio es un varón de edad media, 60 años, diagnosticado de bronquiectasias, con un FEV1 G-MG y, en la mitad de los casos, con oxigenoterapia domiciliara y aerosolterapia con colimicina, al cual tras ingresar en el hospital y ser diagnosticado de infección respiratoria por P. aeruginosa, resistente en la mitad de los casos a algún grupo antibiótico, se le instaura tratamiento con ceftazidima y tobramicina; después de la estabilización, se le deriva al domicilio para completar el ciclo antibiótico y es dado de alta tras 14 días de control; a los 5 meses del alta, reingresa en el hospital por recidiva de la infección.
El estudio de los tratamientos administrados, no permite extraer conclusiones que favorezcan a alguno de ellos, de acuerdo con la bibliografía15–19.
Durante el estudio, sólo reingresaron en el hospital 4 pacientes, lo que confirma la estabilidad de los pacientes al ingreso en nuestro servicio de HAD y la comodidad y la seguridad de los tratamientos.
Como se observa en la tabla 2, el TLR de los pacientes con grado mayor de obstrucción respiratoria; de los tratados por infecciones respiratorias previas por P. aeruginosa, con presencia de resistencias antibióticas; de los que se encuentran en tratamiento con aerosolterapia, y de los que tras tratar una nueva recidiva persisten con cultivo de esputo positivo, se reduce de forma significativa desde algo más de un año a alrededor de 3 meses.
El análisis multivariante muestra que la gravedad en el grado de FEV1 y la presencia de resistencias antibióticas son las variables independientes que indican un pronóstico peor. La oxigenoterapia y la aerosolterapia probablemente dependan de ellas.
Los resultados de este estudio tienen varias limitaciones: por una parte, el hecho de no haber podido aleatorizar a los pacientes para la duración del tratamiento, a pesar de que los 2 grupos fueron estadísticamente comparables, hace que los resultados respecto a esta variable tengan escasa validez, ya que, por lógica, el tratamiento se alargó en los que presentaban peor situación clínica. Asimismo, el hecho que a los últimos pacientes del estudio sólo se realizara un seguimiento de 6 meses, ha podido variar en alguna medida los resultados en el TLR, aunque creemos que esta diferencia tendrá escaso valor, ya que la mediana de recidiva es inferior a 6 meses.
Tras observar la importancia de la presencia de resistencias antibióticas en la probabilidad de recidivar, sería recomendable tomar medidas para evitarlas, como la rotación antibiótica, así como realizar ensayos clínicos que respondan a cuestiones como: cuál sería la duración media aconsejable de los tratamientos, si va a beneficiar en algo alargar el tratamiento a algún tipo de pacientes, hasta cuándo, etc.
Si un objetivo importante en el tratamiento de los pacientes con infección recidivante por P. aeruginosa es la mejora de su calidad de vida, la posibilidad de que la mayor parte del tratamiento parenteral pudiera realizarse en el domicilio, como propugnan algunos autores20,21, parece una buena alternativa. Las unidades de HAD, en funcionamiento desde hace más de 25 años, y distribuidas a lo largo de la geografía española, constituyen una buena alternativa a la hospitalización tradicional en estos pacientes, ya que, una vez estabilizados en el hospital, pueden finalizar el tratamiento en el propio domicilio, para así evitar infecciones nosocomiales, y retornarlos progresivamente a sus actividades diarias, sin olvidarnos del nada desdeñable ahorro sanitario.