Los tumores no definitorios de sida (TNDS) constituyen un grupo muy heterogéneo de neoplasias de importancia creciente en los pacientes con infección por VIH. Habitualmente aparecen en edades más tempranas que en la población general y su presentación suele ser atípica, con grandes masas tumorales o metástasis en el momento del diagnóstico. Su progresión es rápida, con alta tasa de recidivas y difícil manejo, lo que condiciona un peor pronóstico. En su patogénesis influyen el propio VIH, la coinfección por virus oncogénicos y la inmunodepresión. Los TNDS más frecuentes son los relacionados con la infección por el virus del papiloma humano, el carcinoma de pulmón, el hepatocarcinoma y el linfoma de Hodgkin. El tratamiento se basa en 3 pilares fundamentales: el tratamiento de la propia neoplasia, el uso de tratamiento antirretroviral, y la profilaxis y el tratamiento de las enfermedades oportunistas. Los factores protectores más importantes frente a su desarrollo son un recuento de linfocitos CD4+ superior a 500/mm3 y una carga viral indetectable.
Non-AIDS defining malignancies (NADM) are a very heterogeneous group of cancers with increasing importance in subjects with HIV infection. They develop in patients that are younger than general population and their clinical manifestations are usually atypical, with higher tumour grades, more aggressive clinical behaviour and metastatic disease. The outcome is poor, with rapid progression, a high rate of relapse, and a poor response to treatment. There are several factors that influence their development: HIV infection, chronic immunosuppression, and co-infection with some oncogenic viruses. The most frequent NADM are those associated with human papillomavirus infection, lung cancer, hepatic cancer, and Hodgkin lymphoma. Their management is based on three essential points: the treatment of the specific malignancy, the use of antiretroviral therapy, and the prophylaxis and treatment of opportunistic infections. The two factors significantly associated with prevention of NADM are a CD4+ lymphocyte count more than 500/mm3, and an undetectable viral load.
Las neoplasias malignas son, hoy por hoy, una de las principales causas de hospitalización y muerte en la población VIH positiva como consecuencia del uso del tratamiento antirretroviral (TAR) y la disminución de las infecciones oportunistas1–3. En la actualidad puede diagnosticarse un cáncer en el 25-40% de los pacientes, y mientras que en las épocas previas al TAR solo el 10% de las muertes eran de origen tumoral, ahora lo son hasta el 30%, alcanzando tasas entre 1,1 y 1,8 por 1.000 pacientes/año de seguimiento3–5.
Desde las primeras descripciones de la infección por el VIH, una serie de neoplasias indicativas de inmunodeficiencia celular como el sarcoma de Kaposi (SK) y los linfomas no hodgkinianos (LNH), incluidos los linfomas cerebrales primarios, fueron consideradas criterio diagnóstico de sida. Posteriormente se observó que las mujeres VIH+ desarrollaban con más frecuencia neoplasia cervical intraepitelial (CIN) asociada al virus del papiloma humano (VPH) y carcinoma cervical invasivo, de tal forma que el cáncer de cuello uterino forma parte desde 1993 de las enfermedades definitorias de sida. Este grupo lo constituyen los tumores definitorios de sida (TDS), todos ellos relacionados con infecciones virales6,7.
Por otro lado, de forma escasa durante los primeros años y con frecuencia creciente a partir de la introducción del TAR, se han diagnosticado tumores que no son indicativos de inmunodeficiencia y que no siempre tienen origen viral. Estas neoplasias se comportan de forma más agresiva por la coexistencia de la infección por VIH o tienen una incidencia más elevada aunque no presente significación estadística con respecto a la observada en la población no VIH. El conjunto de ellas recibe el nombre de tumores no definitorios de sida (TNDS), y las 2 más importantes son el linfoma de Hodgkin (LH) y la neoplasia de canal anal8,9.
Aunque existen trabajos anteriores, el publicado por Frisch et al.10 es uno de los primeros en los que se describe la asociación entre cáncer y VIH en la era pre-TAR (1978-1996). Entre 366.034 pacientes se diagnosticaron más de 60 tipos diferentes de TNDS, pero solo en 6 se encontró una asociación clara con la inmunodepresión: LH, labio, seminoma, tejidos blandos, pene y pulmón; los más frecuentes, con diferencia, fueron el LH (612 casos) y el carcinoma de pulmón (808 casos). Posteriormente, Herida et al.11 realizaron en Francia un estudio con el objetivo de determinar la incidencia de TNDS antes (P1=1992-1995) y durante la utilización de TAR (P2=1996-1999) comparando los resultados con los observados en la población general durante el mismo periodo de tiempo. El LH y el cáncer de pulmón fueron de nuevo los tumores más frecuentes, sobre todo en P2, donde, por el uso de TAR, el recuento de linfocitos CD4+ fue más elevado. Ante este hallazgo, los autores comentan la posibilidad de que existan otros factores —además de la inmunodepresión— que influyan en el desarrollo de TNDS: la coinfección por otros virus como el virus de Epstein-Barr (VEB) en el caso del LH o el tabaco en el caso del carcinoma de pulmón. Patel et al.9 analizaron de forma prospectiva 2 grandes cohortes (ASD/HOPS) comparando los datos obtenidos con los de la población general en el mismo periodo de tiempo. El estudio incluyó pacientes en todos los estadios de la infección por VIH durante 3 periodos: pre-TAR (1992-1995), TAR temprano (1996-1999) y TAR actual (2000-2003). De forma global se observó una incidencia significativamente más alta que en la población general en las neoplasias de ano, vagina, hígado, pulmón, melanoma, orofaringe, leucemia, carcinoma colorrectal, carcinoma renal y LH. A lo largo de los 3 periodos se observó una clara disminución en los LNH y el SK desde la época pre-TAR a la actual, no se objetivaron cambios en el CIN y se produjo un aumento significativo de las neoplasias anales, de próstata, LH, melanoma y carcinoma colorrectal. En el metaanálisis de Shiels et al.12, que incluyó 18 estudios con un total de 4.797 TNDS, se encontró un aumento significativo de los tumores relacionados con agentes infecciosos (ano, nasofaringe, hepatocarcinoma y LH) y con el tabaco (pulmón, riñón, laringe y estómago).
En estudios realizados en nuestro país se han encontrado datos similares, siendo también el LH, el carcinoma de pulmón y el hepatocarcinoma los TNDS diagnosticados con más frecuencia13–15.
Aunque todavía queda mucho por saber, se puede afirmar que existe una incidencia creciente de TNDS en los pacientes con infección por VIH. Hay algunos cuyo diagnóstico aparece de forma repetida en todas las publicaciones y que claramente tienen una incidencia significativamente más alta que la observada en la población general. Sin embargo, es difícil extraer conclusiones definitivas en este sentido porque los registros de los tumores no son uniformes, la metodología no es la misma en todos los estudios y las características de las neoplasias dependen en muchas ocasiones de la localización geográfica de la población en estudio. En los últimos años se ha observado un mayor número de tumores relacionados con la infección por VPH, el carcinoma de pulmón y el hepatocarcinoma. Sin embargo, y sin lugar a dudas, el más frecuente es el LH, que presenta, desde las primeras series, una incidencia de 3 a 18 veces mayor que la observada en la población general8,9,11,16,17.
EtiopatogeniaNo existe un solo factor responsable de la aparición de neoplasias, definitorias o no de sida, en los pacientes con infección por VIH. El origen es multifactorial, y dentro de los posibles mecanismos implicados en su génesis hay que considerar varios factores, entre los que destaca el propio VIH, la inmunodepresión que su presencia genera y el uso de TAR12,18,19.
El VIH no es un virus oncogénico, y el desarrollo de una neoplasia no puede considerarse directamente relacionado con su presencia20,21. Sin embargo, se han encontrado fragmentos de su genoma en algunos pacientes con LNH, y el gen tat parece estar implicado en el crecimiento de las células del SK. Por todo ello, se considera un agente necesario pero no suficiente para el desarrollo de los tumores que aparecen en estos pacientes22,23.
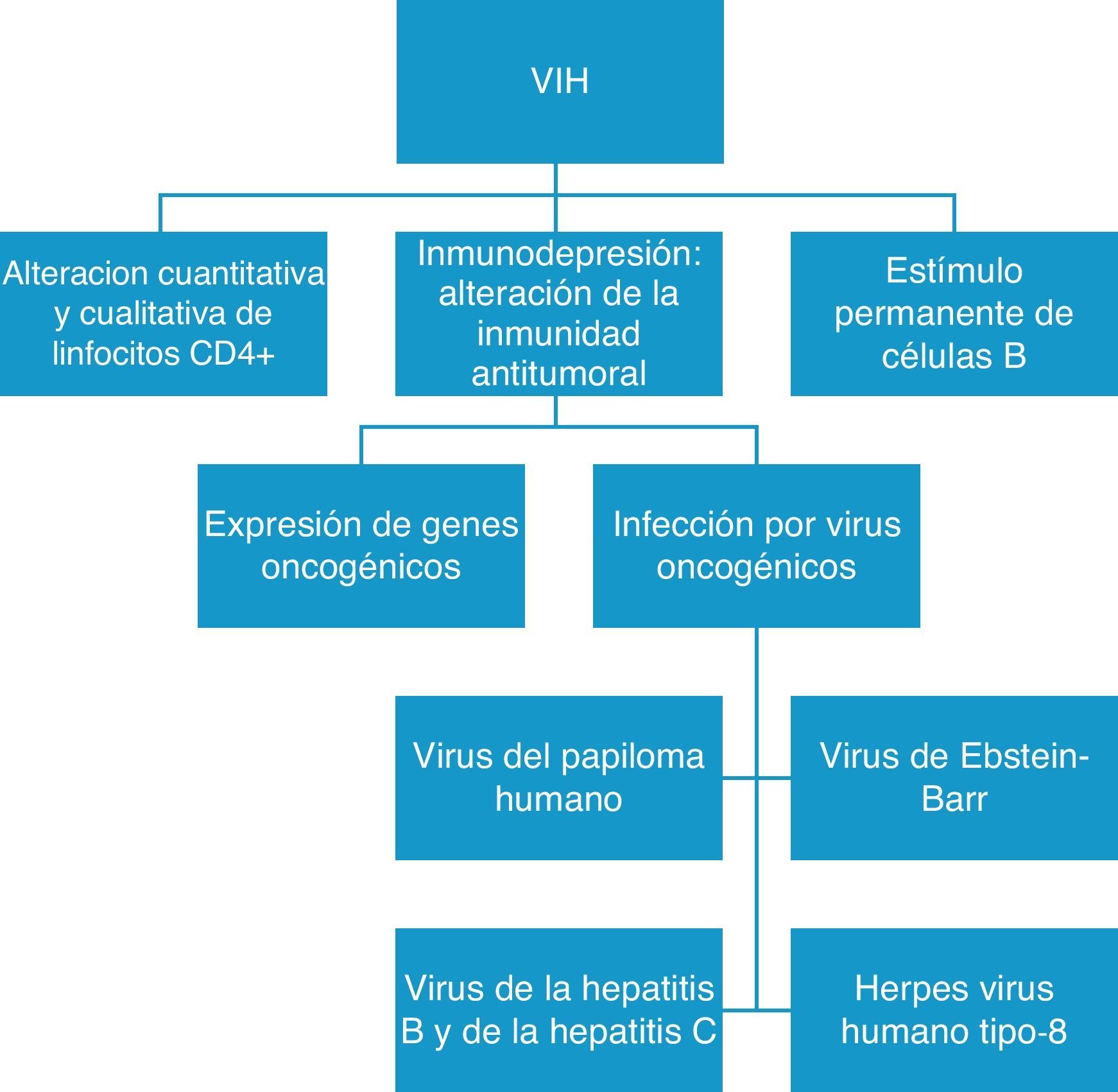
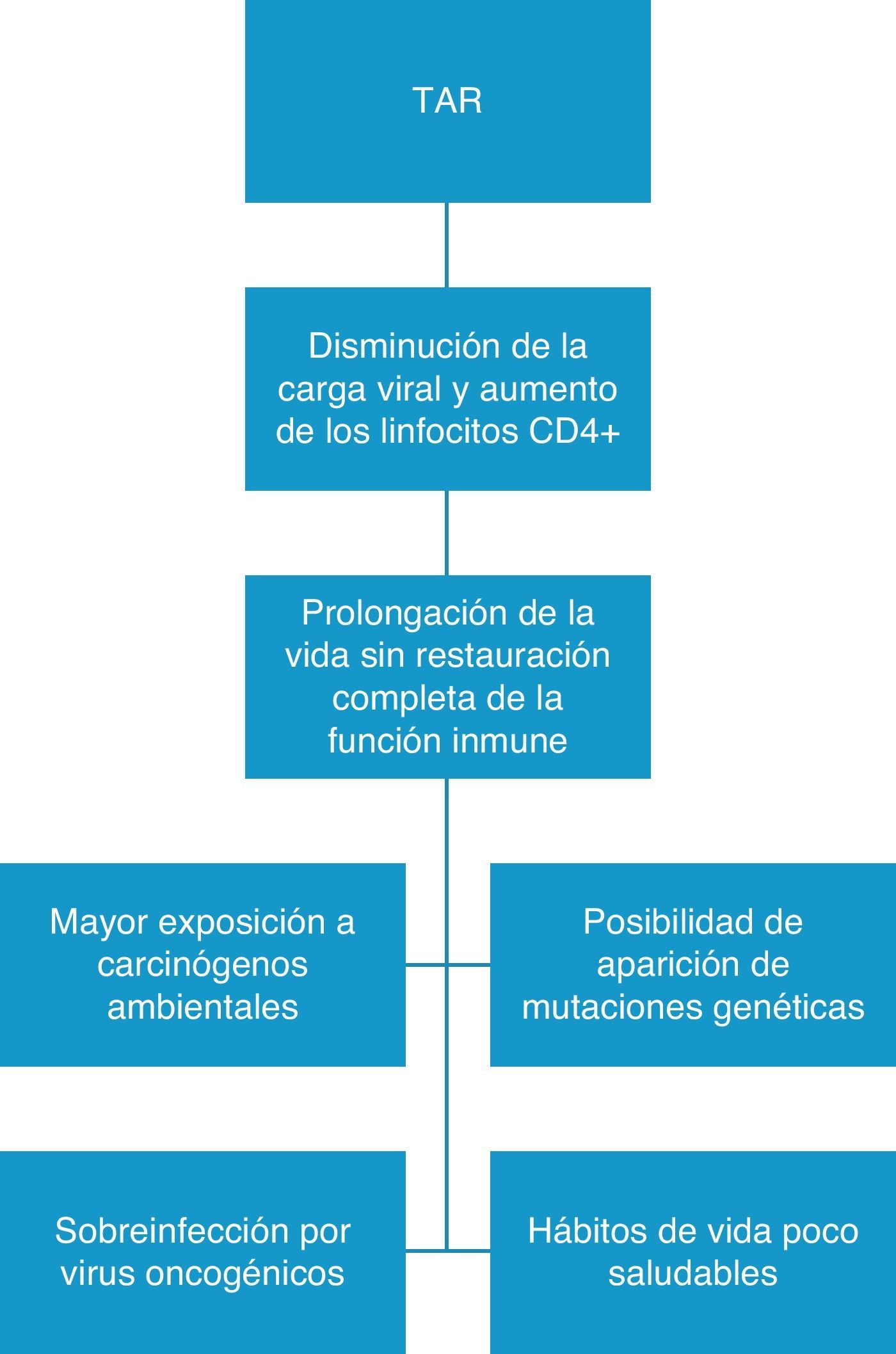
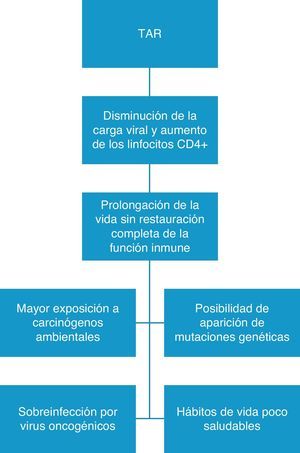
La inmunodepresión y la viremia del VIH no controlada aumentan el riesgo de desarrollar neoplasias, de tal forma que una carga viral indetectable y unos linfocitos CD4+ superiores a 500 por mm3 son factores que protegen del desarrollo de algunos tumores, lo que explicaría por qué con el uso de TAR se ha observado una disminución de los TDS4,12,24–26. Por otro lado, de forma paradójica, el aumento en los TNDS podría deberse, en parte, a la mayor supervivencia de los pacientes como consecuencia del uso de TAR ya que prolonga la vida, pero la función inmune no se restaura completamente (fig. 1). Todo ello condicionaría, en muchos casos, una mayor exposición a carcinógenos ambientales (tabaco, luz ultravioleta), una mayor posibilidad de sobreinfección por virus oncogénicos y un aumento de las posibilidades de aparecer a mutaciones genéticas en pacientes con historia familiar de cáncer.
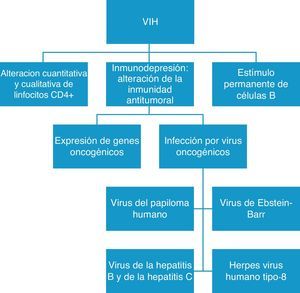
Otro punto importante es que la presencia del VIH origina un estímulo persistente de los linfocitos B, lo que altera la inmunidad antitumoral, facilita la expresión de genes oncogénicos y permite la sobreinfección por virus con capacidad oncogénica9,24,27, como el VEB, el herpes virus humano tipo 8 (HVH-8) o el VPH (fig. 2). Todos estos virus comparten vías de contagio con el VIH, y su evolución está íntimamente relacionada. El HVH-8 es responsable del SK, los linfomas primarios de cavidades y la enfermedad de Castleman, y el VHC y el VHB están relacionados con el desarrollo de hepatocarcinomas. El VEB está presente tanto en los LNH como en los LH asociados al VIH, y se ha visto que existe una relación directa entre la agresividad del linfoma y la carga viral del VEB, de tal forma que los pacientes con enfermedad más agresiva y peor pronóstico tienen cargas virales más elevadas28–30. Un comentario más extenso merecen los VPH, que son virus con ADN de doble cadena y con especial tropismo por las células epiteliales humanas. Los subtipos de alto grado, sobre todo el 16 y el 18, son capaces de inducir transformación maligna en las células epiteliales y están involucrados en el desarrollo de carcinoma de cérvix, de carcinoma anal y en el de otros carcinomas menos frecuentes localizados en la cabeza y el cuello. Los pacientes con VIH e inmunodepresión aclaran con dificultad el VPH una vez que se produce la infección: el virus se integra y desregula el genoma del huésped dando lugar a la transformación maligna27,31,32.
Características generales de los tumores no definitorios de sidaLos TNDS constituyen un grupo muy heterogéneo de neoplasias33–35. Sin embargo, aunque sean de muy diversa estirpe o etiología, comparten una serie de características comunes que son importantes a la hora de establecer un pronóstico y una actitud terapéutica12,33,36,37.
Habitualmente son tumores que aparecen en edades más tempranas que en la población general y su presentación suele ser atípica, con grandes masas tumorales o metástasis en el momento del diagnóstico. Su progresión es rápida, lo que condiciona un peor pronóstico y una alta tasa de recidivas18,38,39.
El manejo es difícil y se ve influido por muchos factores, entre los que destacan como más importantes: la presencia de otras comorbilidades asociadas, la posible existencia de linfadenopatía reactiva que puede conducir a pensar que la neoplasia está en estadios más avanzados, y las interacciones medicamentosas entre los citostáticos y las diferentes pautas de TAR empleadas18.
El tipo de tumor varía, en ocasiones, según la vía de adquisición del VIH, los hábitos de vida y la localización geográfica de los pacientes. Los más importantes y los que aparecen de forma repetida en todas las series son el LH, el hepatocarcinoma, el carcinoma de pulmón y la neoplasia de canal anal9,40,41. Entre los menos frecuentes destacan los carcinomas de laringe, los tumores testiculares, los de mama, los de vulva y el carcinoma de células escamosas de la conjuntiva12,18,33.
Tipos de tumorLinfoma de HodgkinAunque no es criterio diagnóstico de sida, el LH se observa con más frecuencia en los pacientes infectados por el VIH que en la población general para los mismos grupos de sexo y edad (3-18 veces según las series)35,40–44.
Los enfermos con LH no presentan una profunda inmunodepresión, y de forma paradójica a lo que cabría esperar, los casos de LH han aumentado en frecuencia en la era TAR9,11,45,46. Además su incidencia, en algunas series, es mayor a medida que aumentan los linfocitos CD4+, al contrario de lo que sucede con los LNH. Para explicar este hallazgo se ha especulado que existe una posible interrelación entre las células de Reed-Sternberg (R-S) y los linfocitos CD4+ que las rodean: las células de R-S, productoras de citocinas, atraen CD4+ y otras células inflamatorias a su alrededor. Tras ello, estas células CD4+ se activarían y proporcionarían las señales necesarias para la proliferación y la supervivencia de la células malignas, que sería más acusada en los pacientes con un mayor recuento de linfocitos CD4+47.
Las manifestaciones clínicas y el tratamiento son similares a las de la población no VIH, pero tiene unas características diferenciales:
- •
Se presenta en estadios avanzados, III y IV, de la clasificación de Ann Arbor en más del 90% de los casos. Sin embargo, en la actualidad, coincidiendo con la mejoría inmunológica que el uso de TAR proporciona, las manifestaciones clínicas del LH son, en los pacientes menos inmunocomprometidos, similares a las que se observan en la población no VIH47–49.
- •
Los síntomas B, que aparecen en el 50% de la población general, se observan en más del 80% de los LH asociados al VIH.
- •
La afectación extraganglionar es la norma, y en el 50-100% de los casos existe invasión de médula ósea.
- •
Existe afectación mediastínica en menos del 25% de los pacientes. En la población general es la manifestación clínica fundamental (más del 50%).
- •
El patrón histológico es la celularidad mixta en la mayoría de las ocasiones, al contrario que en la población general, que es la esclerosis nodular. Sin embargo, en los últimos años, coincidiendo con el uso de TAR, están comenzando a aumentar los casos de esclerosis nodular.
- •
La relación entre la infección por el VEB y el LH en los pacientes VIH+ es más estrecha, y se detecta en el 78-100% de los casos. En los enfermos sin VIH se objetiva únicamente en el 25-57%.
El TAR ha cambiado el pronóstico de los pacientes con LH e infección por VIH y, de hecho, en diversos trabajos se ha observado una mejoría en los que son tratados con quimioterapias estándar y TAR47,50. Berenguer et al.49, en un estudio multicéntrico prospectivo, analizaron 104 pacientes con LH y compararon su evolución según la utilización o no de TAR (83 vs. 21 casos). Las características basales de ambos grupos fueron similares, pero la supervivencia fue significativamente superior en el grupo de los que recibieron TAR.
No está tan claramente establecido el papel pronóstico de la cifra de linfocitos CD4+, pero el LH aparece en estadios más precoces de la infección por VIH y los enfermos con CD4+ superiores a 200 por mm3 parecen evolucionar más favorablemente. Otros factores de buen pronóstico son: el tipo histológico de esclerosis nodular, la ausencia de enfermedad extraganglionar, la ausencia de síntomas B, el uso de TAR, la negatividad de la tomografía de emisión de positrones (PET) tras los ciclos iniciales de quimioterapia51 y un bajo índice de Hasenclever52, si bien estos 2 últimos parámetros no están claramente estandarizados en la población VIH positiva. En la serie de Berenguer et al.49, el único factor relacionado con la supervivencia fue alcanzar la remisión completa. Se consideran factores de mal pronóstico: tener un diagnóstico previo de sida, la existencia de citopenias pretratamiento y no alcanzar la remisión completa tras el inicio de la quimioterapia, observándose enfermedad residual en el PET tras 2 ciclos de quimioterapia.
Las pautas terapéuticas son las mismas que las empleadas en la población general49,53,54, y en diversos estudios se ha observado que se obtienen tasas similares de eficacia (respuesta completa del 80% y supervivencia libre de progresión del 70-80%). El tratamiento de rescate con quimioterapia y trasplante de precursores hematopoyéticos también depara resultados similares a los observados en la población no inmunodeprimida55. En la actualidad se recomienda utilizar 6-8 ciclos de adriamicina, bleomicina, vinblastina y dacarbacina (ABVD) con un intervalo de 28 días entre el inicio de cada uno de ellos para los estadios avanzados (III y IV) con radioterapia complementaria sobre las áreas tumorales voluminosas, y 2-4 ciclos de ABVD con radioterapia sobre campo afecto para los estadios localizados (I y II)56.
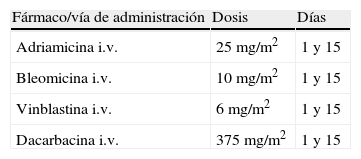
En la tabla 1 se presenta el esquema de tratamiento con ABVD para el LH.
Esquema de tratamiento del linfoma de Hodgkin con la pauta ABVD
| Fármaco/vía de administración | Dosis | Días |
| Adriamicina i.v. | 25mg/m2 | 1 y 15 |
| Bleomicina i.v. | 10mg/m2 | 1 y 15 |
| Vinblastina i.v. | 6mg/m2 | 1 y 15 |
| Dacarbacina i.v. | 375mg/m2 | 1 y 15 |
Se administran 6-8 ciclos con intervalos de 28 días entre el inicio de cada uno de ellos para los estadios III y IV y 2-4 ciclos con el mismo intervalo para los estadios I y II.
Administrar fármacos antieméticos (metoclopramida, ondasentron) i.v. 30 min antes del ciclo y continuar luego por vía oral cada 8h durante 24-48h.
Al igual que en la población general, el carcinoma de pulmón es la causa de muerte de origen tumoral más frecuente en series recientes que analizan la mortalidad de los pacientes con VIH y TNDS57–59. Su incidencia se ha incrementado en los últimos años, y se estima que el riesgo de desarrollarlo es entre 2 y 7 veces más elevado que en la población general3,9,11,12,58,60. Su aparición parece ser más dependiente de la edad, la duración de la infección, la existencia de enfermedad pulmonar previa y el consumo de tabaco que de la inmunodepresión. Aunque la mayoría de los carcinomas de pulmón que se diagnostican en los pacientes con VIH aparecen en fumadores12,36,61,62, algunos autores han encontrado que cuando se ajustan todas las variables, el VIH es un factor de riesgo independiente para el desarrollo de esta neoplasia ya que, entre otras cosas, podría amplificar el efecto carcinogénico del tabaco63,64. La mayoría de los casos aparecen en pacientes más jóvenes que en la población general, con un predominio varón/mujer de 10/1 y con recuentos de linfocitos CD4+ por mm3 entre 150 y 30058,62.
Las manifestaciones clínicas y la evolución no difieren de las observadas en los pacientes VIH negativos y los síntomas iniciales suelen ser tos, disnea, dolor torácico y hemoptisis, aunque con mayor frecuencia presentan ya en el momento del diagnóstico enfermedad local agresiva o metástasis a distancia. Su localización es periférica y generalmente son adenocarcinomas y carcinomas de células grandes. Las pautas de tratamiento también son las mismas que las empleadas en la población general y el pronóstico viene condicionado por las características del tumor y la situación inmunológica del paciente. La operabilidad y la resecabilidad del tumor deberán considerarse con los mismos parámetros que se emplean en la población VIH negativa, y la terapia será agresiva y con fines curativos en los enfermos que mantengan la infección por VIH bien controlada8,18,58,65,66.
Neoplasia analEl carcinoma anal es una neoplasia con importancia creciente que guarda relación con estados crónicos de inmunodeficiencia, y está asociado con los genotipos oncogénicos del VPH, fundamentalmente el 16 y el 18. La precocidad en las relaciones sexuales, las infecciones de transmisión sexual, la coinfección con VIH y la existencia de verrugas genitales o anales favorecen su desarrollo. Estas últimas son la manifestación clínica más frecuente de la infección por VPH y están generalmente originadas por los genotipos 6 y 11, que no tienen carácter oncogénico. Sin embargo, no es excepcional la infección por varios genotipos, lo que sí produciría un aumento en el riesgo de desarrollar NA67–71.
En la era TAR, al contrario de lo que sucede con el SK y el LNH, se ha observado en diferentes estudios un incremento significativo en la incidencia de carcinoma anal9,72. Su prevalencia en los varones homosexuales es 35 veces superior a la observada en la población general, y además presentan un riesgo mayor si tienen infección por los genotipos oncogénicos del VPH. En el 90% de los casos es un carcinoma escamoso y los síntomas son dolor local y tenesmo. En ocasiones pueden detectarse masas o nódulos en la zona anal. La extensión, al igual que en el carcinoma de cérvix, es fundamentalmente local, con afectación de los ganglios inguinales.
El tratamiento de elección, además de la administración de TAR, es la cirugía, aunque también tienen su indicación la radioterapia y la quimioterapia, según la extensión del tumor73,74. Aunque es una enfermedad en la que el diagnóstico precoz condiciona el pronóstico, rara vez se realiza un tacto rectal durante la visita de los pacientes con VIH a sus revisiones periódicas en la consulta. Por ello, habría que estudiar la rentabilidad coste-beneficio de la incorporación, no solo del tacto rectal, sino también de la inspección anal y perianal, de la citología anal y del cribado del VPH para detectar su presencia en todos pacientes VIH+ con y sin síntomas75–78.
Un punto importante en la prevención del cáncer anal es, sin duda, la administración de la vacuna tetravalente frente al VPH (Gardasil®). La Food and Drug Administration aprobó su uso en mujeres y hombres de 9 a 26 años de edad para prevenir el desarrollo de carcinoma de cérvix, verrugas genitales y cáncer anal tanto en varones como en mujeres. Su eficacia, ya demostrada en sujetos inmunocompetentes, está siendo estudiada en pacientes con VIH, con resultados favorables. Si se generaliza su uso, probablemente en unos años se consiga disminuir de forma significativa la infección por VPH y, secundariamente, los tumores que de ella se derivan79–81.
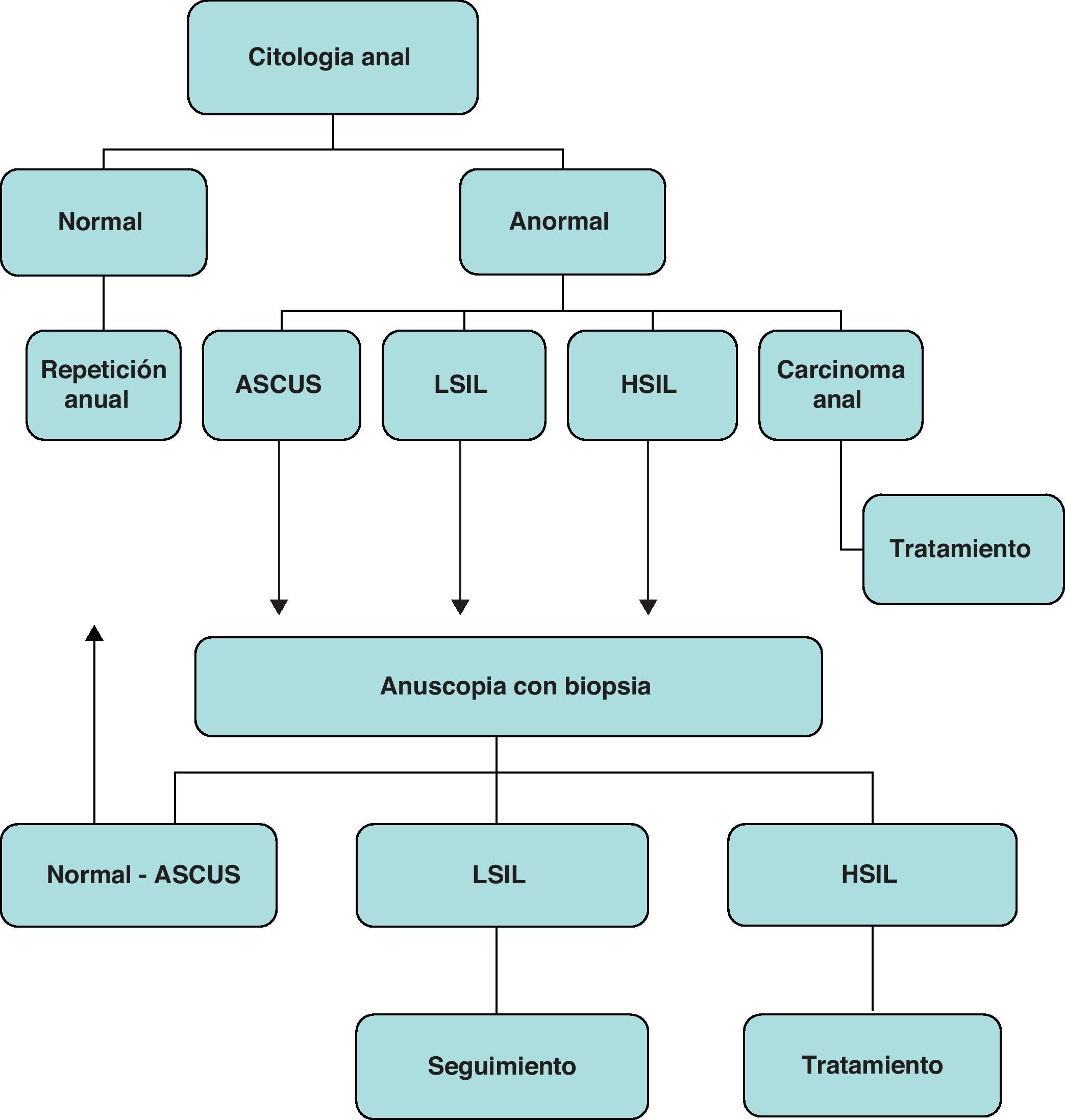
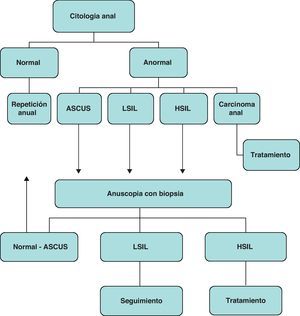
En la figura 3 se esquematiza una propuesta para el diagnóstico y el tratamiento de la displasia anogenital asociada al VPH para cribado del carcinoma anal.
Esquema para el diagnóstico y el tratamiento de la displasia anogenital asociada al virus del papiloma humano para cribado del carcinoma anal en pacientes con infección por VIH (modificado de http://clinicaloptions.com/ccohiv2008). ASCUS: células escamosas atípicas de significado incierto; LSIL: lesión escamosa intraepitelial de bajo grado; HSIL: lesión escamosa intraepitelial de alto grado.
Existen múltiples factores predisponentes para el desarrollo de un hepatocarcinoma, pero los más importantes —y más directamente relacionados con su desarrollo en los enfermos portadores de VIH— son: la infección por el VHB y/o el VHC, la existencia de cirrosis y el consumo de alcohol y tabaco9,12,15. Aunque estos virus comparten los mecanismos de transmisión y conviven en el mismo paciente, antes de la era TAR no parecía haberse incrementado la incidencia del hepatocarcinoma en el colectivo de enfermos infectados por el VIH, probablemente por fallecimiento de los mismos en etapas precoces de la infección30. Sin embargo, en el momento actual las enfermedades oportunistas han disminuido como causa de mortalidad y la hepatopatía ocupa un lugar preponderante dentro de las causas de muerte en todas las series de enfermos con VIH5,69,67,70. Por este motivo, no es de extrañar que en pocos años se prevea un incremento en el diagnóstico de carcinoma hepatocelular en aquellos sujetos en los que el TAR haya conseguido aumentar su supervivencia82-85.
Las manifestaciones clínicas fundamentales son dolor en el hipocondrio derecho (95%), anorexia (30%), pérdida de peso (35%) y fiebre de origen desconocido (30-40%). En la exploración física suelen observarse estigmas de hepatopatía crónica con hepatomegalia (90%) y ascitis (50%)86. El desarrollo del hepatocarcinoma condiciona el pronóstico y conduce al trasplante o a la muerte en muy pocos meses y sin que se les puedan ofrecer buenas perspectivas terapéuticas15,30,70–72,87.
Los enfermos coinfectados por VIH y virus hepatotropos (VHB y/o VHC) deben recibir tratamiento basándose en los mismos criterios y con los mismos medicamentos que los empleados en los que no tienen infección por VIH, ya que es la forma más eficaz de prevenir la aparición del carcinoma hepatocelular88,89. Una vez que se ha desarrollado, debe intentar extirparse en los casos en que el tumor está localizado y es resecable. En los que no se puede realizar una resección quirúrgica, el trasplante hepático, la quimioembolización o la quimioterapia sistémica son las únicas alternativas, aunque es un tumor quimiorresistente90–92. Se han utilizado, con tasas de respuesta del 10%, la doxorubicina, el cisplatino y el fluorouracilo. El sorafenib, un inhibidor oral de cinasa, ha demostrado en un ensayo fase III que prolonga la supervivencia de pacientes sin infección por VIH (10 meses, con un tiempo de progresión de 5,5 meses frente a 2,8 en el grupo placebo)93.
Carcinoma de mamaLos casos de carcinoma de mama publicados en mujeres con infección por el VIH son escasos. Su incidencia no se encuentra incrementada y en la mayoría de las pacientes no existe una inmunosupresión tan profunda como para pensar que su presencia pueda influir en el desarrollo de la enfermedad. Sin embargo, la evolución de las pacientes es peor y el comportamiento del tumor es muy agresivo, con una supervivencia menor a la observada en las mujeres VIH negativas para el mismo grupo de edad94,95.
En varias series que estudian TNDS se observa que el cáncer de mama tiene una frecuencia menor de la esperada9,12,94,96. Este hallazgo sería compatible con la idea de que la activación inmune puede facilitar la carcinogénesis y que, por existir inmunodepresión, se reduce este riesgo. Un interesante estudio de casos-controles de Hessol et al.97 ha encontrado que esta baja incidencia está específicamente ligada a las variantes de VIH con tropismo CXCR4. Este receptor es esencial para la reparación tisular y con frecuencia lo expresan también las células hiperplásicas o neoplásicas de la mama, por lo que su presencia podría tener un cierto papel protector, aunque se necesitan más estudios para confirmar este punto.
La detección precoz se basa, al igual que en el resto de las mujeres, en la autoexploración mamaria y, fundamentalmente, en la realización de mamografía cada 2años a partir de los 50 años. Una vez diagnosticado el cáncer, su tratamiento no difiere del empleado en las mujeres VIH negativas, por lo que si la infección por VIH está controlada, debe realizarse cirugía, radioterapia y/o quimioterapia con fines curativos15,98.
Neoplasias gastrointestinalesAl igual que sucede con el cáncer de pulmón, las neoplasias gastrointestinales son muy frecuentes en la población general. Por ello no es de extrañar que, con el aumento de la supervivencia que se consigue con el TAR, se produzca un incremento de las mismas en la población infectada por VIH y que, como sucede con otras neoplasias, se diagnostiquen en sujetos más jóvenes y con marcadores de mal pronóstico99–102.
El más frecuente en todas las series es el adenocarcinoma colorrectal, y en la mayoría de las ocasiones el diagnóstico se hace en situación clínica muy evolucionada y con metástasis. Otro tumor gastrointestinal de notable importancia es el adenocarcinoma gástrico, que representa el 85% de las neoplasias de esta localización. En los pacientes con infección por VIH suele presentarse como enfermedad diseminada, con una mediana de supervivencia inferior a los 6meses. En la mayoría de los artículos publicados se considera que es una coincidencia diagnóstica más que una relación directa con el VIH, aunque hay casos en los que se considera que la inmunodepresión juega un papel importante en su génesis9,12,18,102.
Neoplasias de vagina y vulvaLos carcinomas de vagina y vulva son mucho menos frecuentes que el de cérvix y su pico de incidencia en la población general se sitúa entre los 60 y los 80 años. De forma excepcional se diagnostican en mujeres menores 45 años, y dentro de estas la mayoría son portadoras de VIH. La neoplasia vulvar intraepitelial y la neoplasia vaginal intraepitelial son precursoras del cáncer de vagina y vulva, y son también más frecuentes en mujeres con infección por VIH. Puesto que la mayoría de las pacientes están asintomáticas o presentan únicamente prurito vulvar o flujo vaginal, es muy importante la exploración ginecológica rutinaria para establecer un diagnóstico precoz69,71,103.
Al igual que en el caso de las lesiones de cérvix, la incidencia y la severidad de las lesiones vulvares y vaginales premalignas se correlacionan con la inmunodepresión. Por ello, además de la escisión quirúrgica de las lesiones, la administración de TAR es fundamental para el control de la enfermedad18,33.
Carcinomas de cabeza y cuelloEl 20% de los tumores de cabeza y cuello están relacionados con la infección por el VPH. Se originan sobre todo en las amígdalas palatinas y linguales, y el serotipo 16 es el que se asocia con un riesgo mayor. Histológicamente son tumores pobremente diferenciados y su pronóstico es mejor que el de los tumores de cabeza y cuello no relacionados con el VPH12,67,104.
Carcinoma de células escamosas de la conjuntivaEs un tumor poco frecuente de etiología multifactorial. La exposición a la luz ultravioleta y la infección por VIH predisponen a su desarrollo. Es más frecuente en África que en los países del hemisferio norte, probablemente por la mayor exposición a la luz solar. La sintomatología fundamental de este tumor es hiperemia y crecimiento conjuntival. El tratamiento de elección es la cirugía con la extirpación total del globo ocular105,106.
Tratamiento de los tumores no definitorios de sidaEl mejor tratamiento de los TNDS es intentar evitar su desarrollo. Es conveniente identificar los individuos susceptibles de padecer un TNDS y planificar estrategias que eviten su aparición (tabla 2). Cuando esto no es posible, el esquema general de tratamiento de los TNDS se basa, al igual que el de los TDS, en 3 pilares fundamentales: el tratamiento de la propia neoplasia, que variará según la naturaleza de la misma; el uso de TAR, y la profilaxis y el tratamiento de las enfermedades oportunistas18,33.
Medidas encaminadas a la prevención y el diagnóstico precoz de algunos de los tumores no definitorios de sida más frecuentes diagnosticados en los pacientes con infección por VIH
| Tipo de tumor | Prevención | Diagnóstico precoz |
| Linfoma de Hodgkin | Biopsia de adenopatías sospechosas | |
| Carcinoma de pulmón | Abandonar el hábito tabáquico | Radiografía de tórax±TC torácica |
| Carcinomas de cabeza y cuello | Abandonar el hábito tabáquico | Consulta precoz a ORL |
| Carcinoma anal | Disminución de exposición sexual al VPH. Vacuna VPH (?) | Inspección y tacto rectal. Anuscopia y citología anual |
| Carcinoma de colon y recto | Colonoscopia±hemorragias ocultas en heces cada 5 años | |
| Carcinoma de vagina y vulva | Disminución de exposición sexual al VPH. Vacuna VPH (?) | Inspección genital y citología anual |
| Carcinoma de mama | Mamografía cada 2 años a partir de los 50 años | |
| Carcinoma de próstata | Tacto rectal±PSA anual a partir de los 45 años | |
| Carcinoma de piel | Disminuir la exposición solar | Examen cutáneo |
| Hepatocarcinoma | Vacuna VHB. Tratamiento VHB y VHC. Disminuir la ingesta de alcohol | α-fetoproteína. Ecografía abdominal |
TC: tomografía computarizada; ORL: otorrinolaringología; VPH: virus del papiloma humano; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; PSA: antígeno prostático específico.
Independientemente de la naturaleza del TNDS, la tendencia actual es proporcionar al enfermo el mismo tipo de tratamiento que en los individuos VIH negativos, siempre que su estado general lo permita. El pronóstico en la mayoría de las ocasiones va a venir determinado por factores relacionados con la propia neoplasia más que por la infección VIH4,49,54,107.
Uso de tratamiento antirretroviralUna terapia antirretroviral óptima con máxima supresión de la carga viral y la prevención y el tratamiento de las infecciones oportunistas son los pilares básicos sobre los que se debe asentar el tratamiento de cualquier TNDS que aparezca en la población con VIH. Se debe administrar el TAR de forma simultánea a la cirugía, la radioterapia o la quimioterapia empleadas, ya que los resultados a largo plazo son mejores y la supervivencia mayor que cuando el paciente no recibe tratamiento108–110. En este sentido, Silverberg et al.107 encontraron que los beneficios de tratar el VIH son más acusados después de 2años y son independientes del tipo de TAR utilizado. No hay que olvidar que la continua aparición de nuevos antirretrovirales y nuevas combinaciones de los mismos obliga a evaluar constantemente las posibles interacciones entre los citostáticos y la TAR111.
Profilaxis de las enfermedades oportunistasTras la administración de quimioterapia y/o radioterapia desciende la cifra total de linfocitos CD4+ en un 30-50% con respecto a la basal, y sus cifras no suelen alcanzar los valores pretratamiento hasta los 6-12meses después de finalizar la quimioterapia. Por ello, se recomienda la utilización sistemática de profilaxis con cotrimoxazol frente a Pneumocystis jiroveci, al menos hasta un mes después de finalizar la quimioterapia, aunque al inicio del tratamiento del TNDS el recuento de linfocitos CD4+ sea superior a 200 por mm3. Es aconsejable también la administración de isoniazida a dosis de 300mg/día a los pacientes en riesgo de desarrollar una enfermedad tuberculosa, como son aquellos con Mantoux positivo o negativo, pero anérgicos, que vayan a recibir quimioterapia o radioterapia112–114.
ConclusionesExiste un aumento de los TNDS en los pacientes con infección por VIH. Estas neoplasias constituyen un grupo muy heterogéneo y comparten una serie de características comunes importantes a la hora de establecer un pronóstico y una actitud terapéutica12,33–37. Habitualmente aparecen en edades más tempranas que en la población general y su presentación suele ser atípica, con grandes masas tumorales o metástasis en el momento del diagnóstico. Su progresión es rápida, con alta tasa de recidivas y manejo difícil, lo que condiciona un peor pronóstico18,38,39.
Su origen es multifactorial, y dentro de los posibles mecanismos implicados en esta génesis hay que considerar varios factores12,18,19: el propio VIH, la coinfección por virus oncogénicos y la inmunodepresión. Una carga viral indetectable y unos linfocitos CD4+ superiores a 500/mm3 son factores protectores frente al desarrollo de neoplasias4,12,21,25,26.
Los TNDS más frecuentes son los relacionados con la infección por el VPH, el carcinoma de pulmón, el hepatocarcinoma y el LH8,9,11,16,17. El mejor tratamiento es la prevención. Es conveniente identificar los individuos susceptibles de padecer un TNDS y planificar estrategias que eviten su aparición. Cuando esto no es posible, el esquema general de tratamiento se basa en 3 pilares fundamentales: el tratamiento de la propia neoplasia, que variará según la naturaleza de la misma; el uso de TAR, y la profilaxis y el tratamiento de las enfermedades oportunistas18,21.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.