Describir el uso de carbapenémicos en pacientes pediátricos hospitalizados fuera de las unidades de cuidados intensivos y oncohematología, y evaluar la adecuación de su prescripción a un protocolo terapéutico.
Pacientes y métodosEstudio retrospectivo observacional, entre enero de 2009 y diciembre de 2010, sobre la utilización de carbapenémicos en niños hospitalizados, por patología infecciosa comunitaria y relacionada con asistencia sanitaria, en el área infantil del Hospital Universitari Vall d’Hebrón, en Barcelona, excluyendo las unidades de cuidados intensivos, neonatología y oncohematología. Se recogieron datos clínicos y de consumo de antibióticos, facilitados por el Servicio de Farmacia.
ResultadosCumplían los criterios de inclusión 51 episodios. En el 31,4% se indicó un carbapenémico como tratamiento empírico inicial; en el resto fue como tratamiento de rescate. Se adecúan a las indicaciones del protocolo el 70,6% de las prescripciones empíricas y el 87,5% de las dirigidas. Globalmente, el 77,6% de las prescripciones de un carbapenémico se ajustaron a las indicaciones del protocolo. En los pacientes con un ingreso previo o una enfermedad de base la prescripción empírica tiene una mejor adecuación. Factores como el diagnóstico al ingreso, la edad o la antibioterapia previa al ingreso no mostraron ninguna tendencia respecto a la indicación empírica de un carbapenémico.
ConclusionesLa existencia de un protocolo de indicaciones de tratamiento con carbapenémicos establecido desde 2007 en el hospital ha permitido unos resultados de adecuación de la prescripción significativamente superiores a los obtenidos en otros estudios.
To describe the use of carbapenems in children hospitalised outside intensive care and onco-haematology units, and assess adherence to a therapeutic protocol.
Patients and methodsA retrospective observational study was conducted on the use of carbapenems between January 2009 and December 2010. The study included children with a community-acquired infectious disease or a health care-associated infectious disease, and who were admitted to paediatric areas of the Vall d’Hebron University Hospital (Barcelona, Spain), other than intensive care, neonatology and onco-haematology units. Clinical data were collected and antibiotic consumption data were provided by the Pharmacy Department.
ResultsA total of 51 episodes fulfilled the inclusion criteria. Carbapenem as initial empirical treatment was indicated in 31.4%, and applied as rescue therapy in the remainder. The instructions of the protocol were adhered to in 70.6% of the empirical and 87.5% of the targeted prescriptions (77.6% overall). A better match was found for empirical carbapenem in patients with a previous admission or underlying condition. Factors such as diagnosis, age or antibiotic use prior to admission did not affect the empirical indication of carbapenem.
ConclusionsThe establishment of a treatment protocol with carbapenem indications in our centre since 2007 has yielded significantly better results on the appropriateness of the prescription than those obtained in other studies.
El objetivo principal de la elección de cualquier antimicrobiano es optimizar su indicación clínica, reduciendo al mínimo sus consecuencias no deseadas (toxicidad, selección de microorganismos patógenos y aparición de resistencias)1,2.
Algunos estudios muestran que más del 50% de las prescripciones de antimicrobianos en el medio hospitalario son inapropiadas3,4, y que hasta el 29% de las de amplio espectro no están justificadas3,5. Esto ha llevado a que diversos organismos profesionales y sociedades científicas hayan publicado recomendaciones para la prevención y la disminución de la resistencia antimicrobiana en los hospitales, en las que se hace hincapié en la necesidad de mejorar el uso hospitalario de los antimicrobianos6,7.
Numerosos estudios avalan la efectividad y la buena tolerabilidad de los carbapenémicos en la población pediátrica para el tratamiento de las infecciones graves8-12. Su amplio espectro de actividad y las características farmacocinéticas hacen que sean los antimicrobianos de elección en el tratamiento empírico de las infecciones en que se sospecha la implicación de microorganismos productores de betalactamasas de espectro extendido (BLEE) o de betalactamasas de tipo AmpC inducible, y en los pacientes que han recibido previamente antimicrobianos de amplio espectro por la posibilidad de haber seleccionado cepas multirresistentes13.
De todos modos, el uso de estos fármacos debe ser razonado, puesto que son el único tratamiento eficaz frente a determinadas bacterias, su uso inadecuado puede inducir la aparición de bacilos gramnegativos no fermentadores multirresistentes y eleva los costes farmacéuticos.
A pesar de la amplia experiencia de uso de los carbapenémicos, hay pocos estudios que describan su prescripción en pacientes pediátricos hospitalizados fuera de las unidades de cuidados intensivos, y que valoren si se ciñe o no a las indicaciones establecidas12,14-17. Por ello, en el Hospital Universitari Vall d’Hebron (Barcelona), como parte del programa de consultoría activa en infectología que se lleva a cabo desde el año 2005, se decidió revisar la utilización de los carbapenémicos en la edad pediátrica y evaluar la adecuación de su prescripción al protocolo de uso de esta familia de antimicrobianos elaborado en 2007 por la Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, conjuntamente con el Servicio de Microbiología, como punto de partida de una adecuada política de prescripción18.
En este momento conocíamos que en nuestro hospital, en los años y las áreas en las que se plantea el estudio, entre los aislamientos de enterobacterias la prevalencia de Escherichia coli BLEE fue del 4,9%, la de Klebsiella pneumoniae BLEE del 13,2% y la de Enterobacter cloacae BLEE e hiperproductor de AmpC del 5,7 y del 22,8%, respectivamente.
Los principales objetivos del presente estudio son: a)describir el uso de carbapenémicos en la población pediátrica hospitalizada por patología infecciosa comunitaria y relacionada con asistencia sanitaria; b)analizar las indicaciones para las cuales se prescriben carbapenémicos en dicha población, y c)evaluar si la prescripción de carbapenémicos se ciñe al protocolo de indicaciones establecido.
Pacientes y métodosEstudio retrospectivo observacional, entre enero de 2009 y diciembre de 2010, sobre la utilización de carbapenémicos en niños hospitalizados, por patología infecciosa de adquisición en la comunidad o relacionada con asistencia sanitaria, en el área infantil del Hospital Universitari Vall d’Hebrón, exceptuando los servicios de cuidados intensivos, neonatología y oncohematología.
Criterios de inclusiónPacientes pediátricos, de entre un mes y 16años de edad, ingresados por enfermedad infecciosa adquirida en la comunidad o relacionada con asistencia sanitaria en el periodo de estudio, a quienes se hubiera prescrito un carbapenémico como tratamiento antimicrobiano empírico o dirigido.
Criterios de exclusiónPacientes en estado crítico, inmunodeprimidos, con enfermedad pulmonar crónica (fibrosis quística o bronquiectasias) o con prescripción de un carbapenémico por sospecha de infección nosocomial. Se definen infección nosocomial, infección comunitaria y relacionada con asistencia sanitaria siguiendo los criterios de los Centers for Disease Control and Prevention de Estados Unidos y las definiciones de Friedman19,20.
Recogida de datosLos datos de consumo de antibióticos, obtenidos a partir de los sistemas automatizados de dispensación ubicados en las unidades de enfermería, fueron facilitados por el Servicio de Farmacia. Se recuperaron de la base de datos de dispensación las prescripciones de carbapenémicos realizadas a los pacientes que cumplían los criterios de inclusión en todas las salas de pediatría, excluyendo los servicios de cuidados intensivos, oncohematología y neonatología, durante el período de estudio. Los datos constaban como número de viales dispensados de cada una de las diferentes formulaciones de los carbapenémicos asignados a cada paciente, por fecha de retirada del armario automatizado.
Se consideró episodio de hospitalización cada uno de los ingresos de los pacientes a quienes se había prescrito un carbapenémico como tratamiento. Se consideró episodio de prescripción de un carbapenémico cada una de las ocasiones en que se evaluó la indicación de este dentro de un episodio de hospitalización.
Los datos de los pacientes se obtuvieron de la historia clínica informatizada del hospital. Se recogieron datos demográficos (nombre, edad, sexo, número de historia clínica), unidad de ingreso, fechas de ingreso y alta, diagnóstico por el cual se prescribió el carbapenémico, motivo de su indicación (empírico o dirigido), tipo de carbapenémico prescrito, duración del tratamiento, efectos adversos (alteraciones clínicas o analíticas), estudios microbiológicos realizados y resultado del antibiograma, modificación del tratamiento antibiótico con carbapenémico tras el resultado del estudio microbiológico, y empleo de antibióticos previos o concomitantes.
Se consideró que la utilización de un carbapenémico era adecuada cuando el motivo de su prescripción, coincidente con la sospecha diagnóstica de ingreso, se ceñía al protocolo de indicaciones establecido por la Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría conjuntamente con el Servicio de Microbiología (tabla 1), y falta de adherencia al protocolo cuando la indicación del carbapenémico se realizó por una razón diferente a las establecidas en dicho protocolo. La falta de adherencia al protocolo se clasificó en 2 categorías: fallo en la indicación del tratamiento empírico o fallo en la indicación del tratamiento dirigido, considerando este último como el prescrito tras un aislamiento microbiológico. Este análisis se llevó a cabo por los profesionales de la Unidad de Patología infecciosa e Inmunodeficiencias de Pediatría.
Protocolo de indicaciones de uso de los carbapenémicos en pediatría
| Indicaciones como tratamiento empírico |
| 1. Sepsis grave por enterobacterias en pacientes colonizados por enterobacterias productoras de BLEE o con hiperproducción de betalactamasas cromosómicas o plasmídicas de tipo AmpC |
| 2. Sepsis grave nosocomial en un paciente en una unidad en situación de brote de enterobacterias productoras de BLEE o con hiperproducción de betalactamasas cromosómicas o plasmídicas de tipo AmpC |
| 3. Nuevo episodio de sepsis/infección grave en pacientes en tratamiento en curso con piperacilina-tazobactam o cefepima y glucopéptidos |
| Indicaciones como tratamiento específico dirigido |
| 1. Infecciones por enterobacterias productoras de BLEE |
| 2. Infecciones por enterobacterias productoras de una betalactamasa inducible de tipo AmpC: Enterobacter spp., Serratia spp., Morganella spp., Citrobacter freundii, Providencia spp., Pantoea agglomerans, Hafnia alvei |
| 3. Infecciones por Acinetobacter baumannii. En caso de resistencia a los carbapenémicos, se tratará con ampicilina-sulbactam |
| 4. Infecciones por bacterias que solo sean sensibles a los carbapenémicos |
La difusión de dicho protocolo se efectuó como parte del programa de consultoría activa en infectología que se lleva a cabo de forma diaria desde el año 2005 en el hospital, por parte de profesionales pertenecientes a la Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría y al Servicio de Microbiología, que realizan una supervisión clínica y establecen recomendaciones en el manejo y la prescripción antimicrobiana de los pacientes ingresados en las áreas del estudio.
Análisis estadísticoSe realizó el análisis descriptivo para cada uno de los parámetros, expresando los resultados en función de su naturaleza: recuento (proporción) para las variables cualitativas y mediana (rango intercuartílico) para las variables cuantitativas.
Se definió como variable dependiente la adecuación del uso de carbapenémicos, se describió mediante proporción (intervalo de confianza del 95% [IC95%]) y se realizó un análisis bivariado comparando su distribución en función de las variables independientes dicotómicas (presencia de una enfermedad de base, ingreso previo y durante el último mes, y antibioterapia previa al ingreso) y categóricas (diagnóstico al ingreso, estratificado en fiebre, sospecha de infección del tracto urinario y abdomen agudo), para lo que se empleó el test de ji al cuadrado. Para la comparación de la distribución de la variable edad en relación a la adecuación del tratamiento se empleó la prueba U de Mann-Whitney, debido a la distribución no normal de la variable cuantitativa. Los datos recogidos se explotaron mediante el programa SPSS, versión 16.0. Se consideró un valor p<0,05 como estadísticamente significativo.
El estudio se remitió a la Subdirección General de Medicamentos de Uso Humano de la Agencia Española de Medicamentos y Productos Sanitarios, fue clasificado como «Estudio posautorización con otros diseños diferentes al de seguimiento prospectivo» (EPA-OD) y lo aprobó el Comité Ético de Investigación.
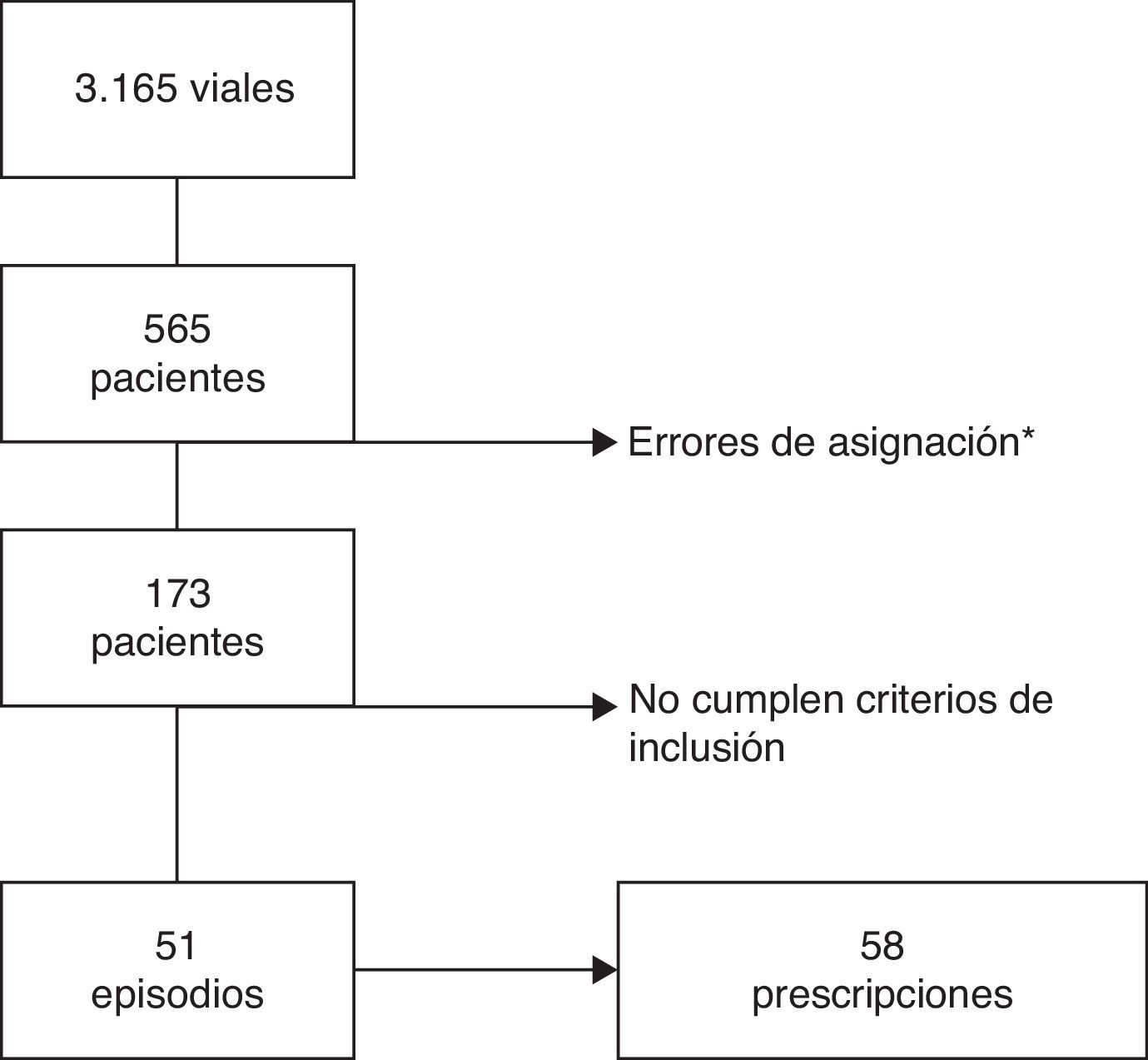
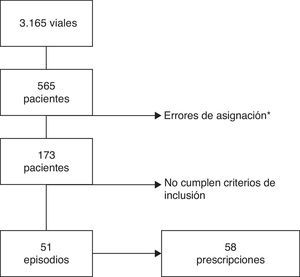
ResultadosDel total de 220 camas del área infantil se incluyeron 97, distribuidas en 5 áreas de hospitalización. Durante el periodo de estudio hubo 8.077 ingresos en dichas áreas, y de ellos, en 51 episodios los pacientes cumplían los criterios de inclusión (0,63% del total de los ingresos). El proceso de selección de los sujetos del estudio se muestra en la figura 1. Finalmente se incluyeron 51 episodios de hospitalización y 58 prescripciones de un carbapenémico.
La mediana de edad de los pacientes incluidos fue de 11meses (rango intercuartílico: 5-62). La distribución por sexo fue de 26niños y 25niñas. Treinta y ocho pacientes (74,5%) presentaban alguna enfermedad de base. El 76,5% habían estado hospitalizados previamente y de ellos el 33,3% en el último mes; en todos los casos se excluyó que el motivo del reingreso tuviese relación con una infección de adquisición nosocomial en el ingreso previo.
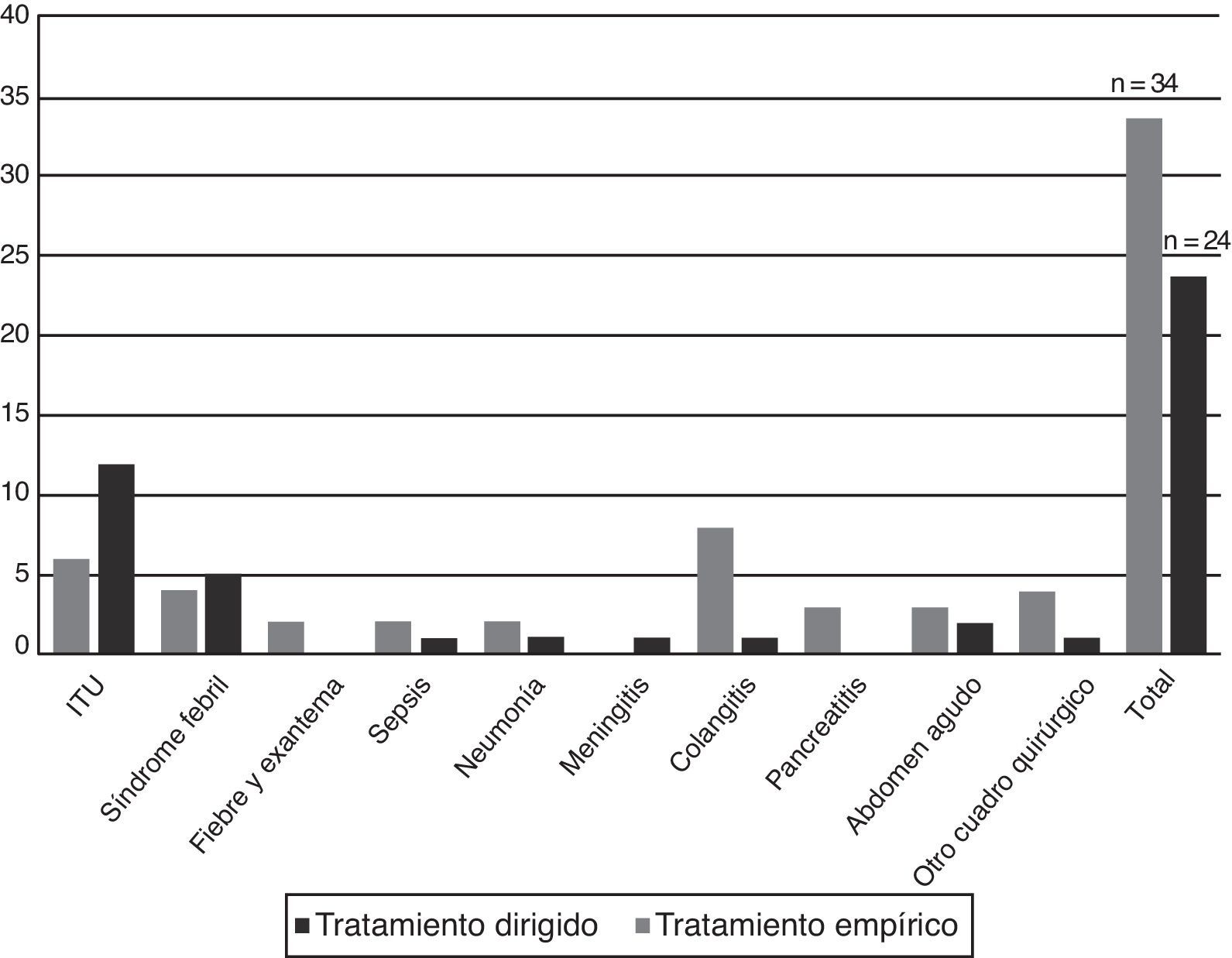
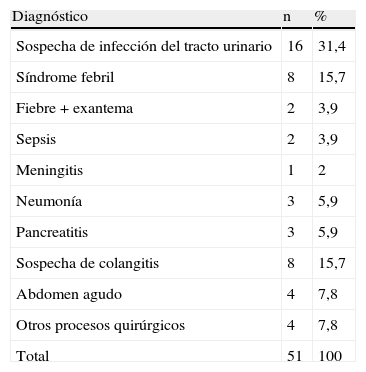
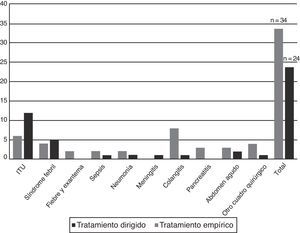
Los diagnósticos al ingreso se describen en la tabla 2; el más frecuente fue la sospecha de infección urinaria (31,4%), seguido de síndrome febril y sospecha de colangitis.
Diagnósticos al ingreso
| Diagnóstico | n | % |
| Sospecha de infección del tracto urinario | 16 | 31,4 |
| Síndrome febril | 8 | 15,7 |
| Fiebre + exantema | 2 | 3,9 |
| Sepsis | 2 | 3,9 |
| Meningitis | 1 | 2 |
| Neumonía | 3 | 5,9 |
| Pancreatitis | 3 | 5,9 |
| Sospecha de colangitis | 8 | 15,7 |
| Abdomen agudo | 4 | 7,8 |
| Otros procesos quirúrgicos | 4 | 7,8 |
| Total | 51 | 100 |
En todos los episodios de hospitalización se inició antibioterapia empírica al ingreso; solo 4pacientes se habían tratado con antibiótico antes del ingreso y este fue modificado. El antibiótico empírico inicial más utilizado fue piperacilina-tazobactam en el 41,1% de los casos, seguido de un carbapenémico en el 31,4%.
De los 51 casos analizados, en 31 se aisló algún microorganismo y en 28 se realizó el antibiograma. Los aislamientos microbiológicos sirvieron para modificar el tratamiento antibiótico en 19pacientes (61,3%).
El carbapenémico utilizado en todos las prescripciones fue meropenem, salvo en un paciente en quien se cambió a imipenem por sospecha de una reacción adversa exantemática. No se registró ningún caso de diarrea asociada a Clostridium difficile.
En el 94,1% de los pacientes la respuesta al tratamiento se consideró como favorable por la mejoría clínica y la negativización de los cultivos (49% casos). Un paciente requirió además reintervención quirúrgica, y en 2 pacientes no consta la evolución final por traslado a otro centro. No hubo fallecimientos.
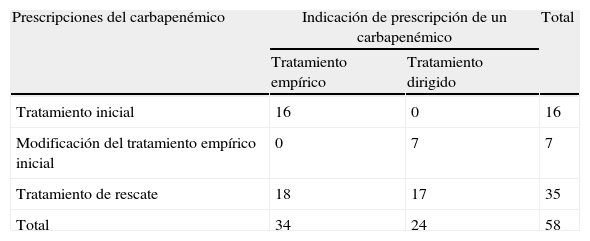
Indicaciones de prescripción del carbapenémico y adecuación al protocoloEn los 51 casos se realizaron en total 58 prescripciones de un carbapenémico, cuyas indicaciones se describen en la tabla 3. En 34 pacientes (58,6%) la prescripción fue como tratamiento empírico, y entre estos el diagnóstico al ingreso más frecuente fue la colangitis. En 24 pacientes (41,4%) la prescripción se realizó de forma dirigida, predominando el diagnóstico de infección del tracto urinario (fig. 2). En el 31,4% (16/51 casos) de los pacientes el antibiótico empírico inicial prescrito fue un carbapenémico. Las indicaciones fueron, en 10 casos, por sepsis/infección grave por enterobacterias en un paciente colonizado por enterobacterias productoras de BLEE, y en 6 por otra causa diferente a las establecidas en el protocolo. Se modificó la prescripción empírica inicial con un carbapenémico en 6 pacientes, mientras que en 10 se mantuvo (3 de forma empírica y 7 dirigida por el resultado del cultivo realizado). En el resto de los pacientes (35; 68,6%) se indicó un carbapenémico como tratamiento de rescate, en 18 (51,4%) de forma empírica y en 17 (48,6%) de forma dirigida.
Número de prescripciones e indicaciones de un carbapenémico en los episodios analizados
| Prescripciones del carbapenémico | Indicación de prescripción de un carbapenémico | Total | |
| Tratamiento empírico | Tratamiento dirigido | ||
| Tratamiento inicial | 16 | 0 | 16 |
| Modificación del tratamiento empírico inicial | 0 | 7 | 7 |
| Tratamiento de rescate | 18 | 17 | 35 |
| Total | 34 | 24 | 58 |
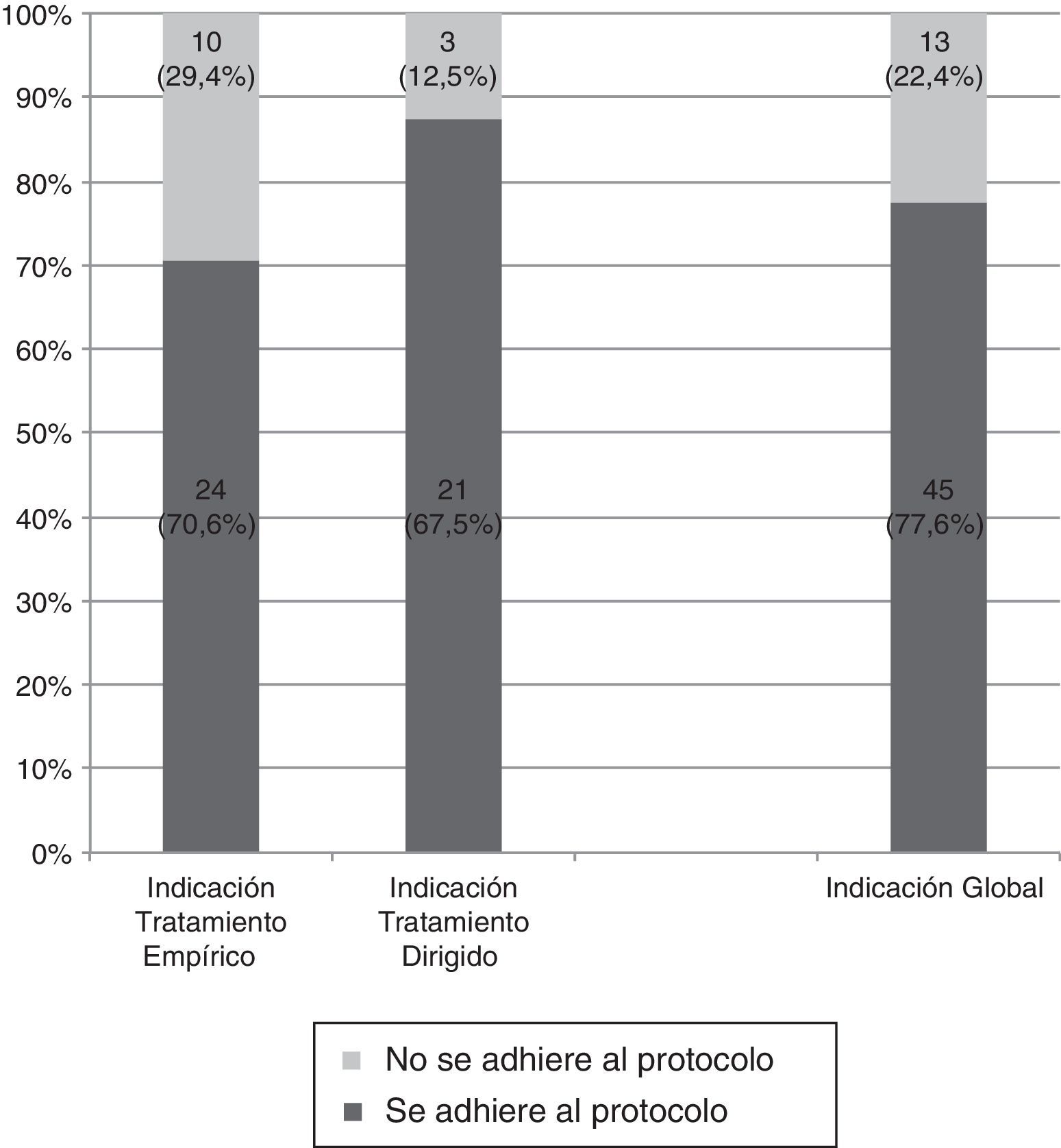
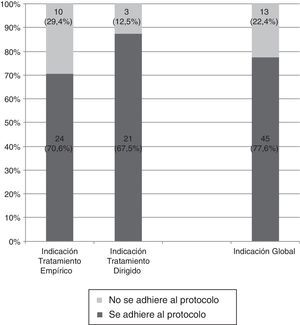
El 70,6% (24/34; IC95%: 52,5-84,9) de las prescripciones como tratamiento empírico se adecuaron a las indicaciones del protocolo, que fueron las siguientes:
- 1
Sepsis grave con sospecha de implicación de enterobacterias en paciente colonizado por enterobacterias productoras de BLEE o con hiperproducción de betalactamasas cromosómicas o plasmídicas de tipo AmpC: 10/24 pacientes (41,7%; IC95%: 22,1-63,4).
- 2
Nuevo episodio de sepsis o infección grave por enterobacterias en paciente en tratamiento con piperacilina-tazobactam, cefepima y glucopéptidos: 14/24 pacientes (58,3%; IC95%: 36,6-77,9).
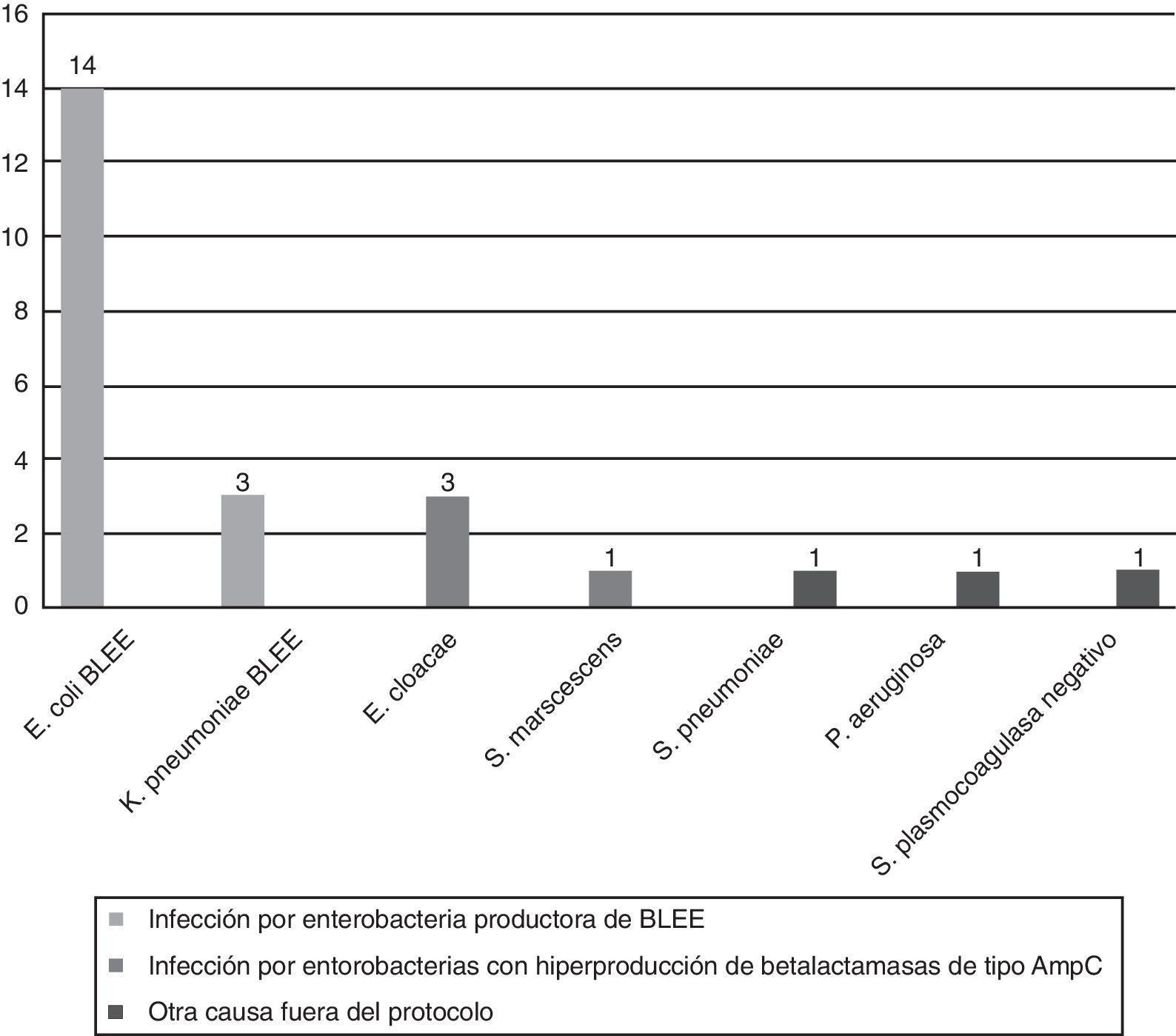
El 87,5% (21/24; IC95%: 67,6-97,3) de las prescripciones como tratamiento dirigido se adecuaron a las indicaciones del protocolo, y fueron las siguientes (fig. 3):
- 1
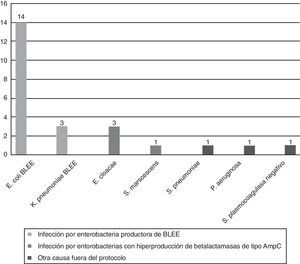
Infección por enterobacterias productoras de BLEE: 17/21 casos (80,9%; IC95%: 58,1-94,6).
- 2
Infección por enterobacterias hiperproductoras de betalactamasas de tipo AmpC: 4/21 casos (19,1%; IC95%: 0,5-41,9).
El 77,6% (IC95%: 64,7-87,5) del total de las prescripciones de un carbapenémico se ajusta a las indicaciones del protocolo, mientras que el 22,4% (IC95%: 12,5-35,3) no lo cumplen (fig. 4). Este porcentaje se mantuvo en los 31 pacientes en que se obtuvo un aislamiento microbiológico; en 25 de ellos (80,6%) la indicación del carbapenémico se ajustó al protocolo para el microorganismo aislado, mientras que en 6 (19,4%) no fue adecuado.
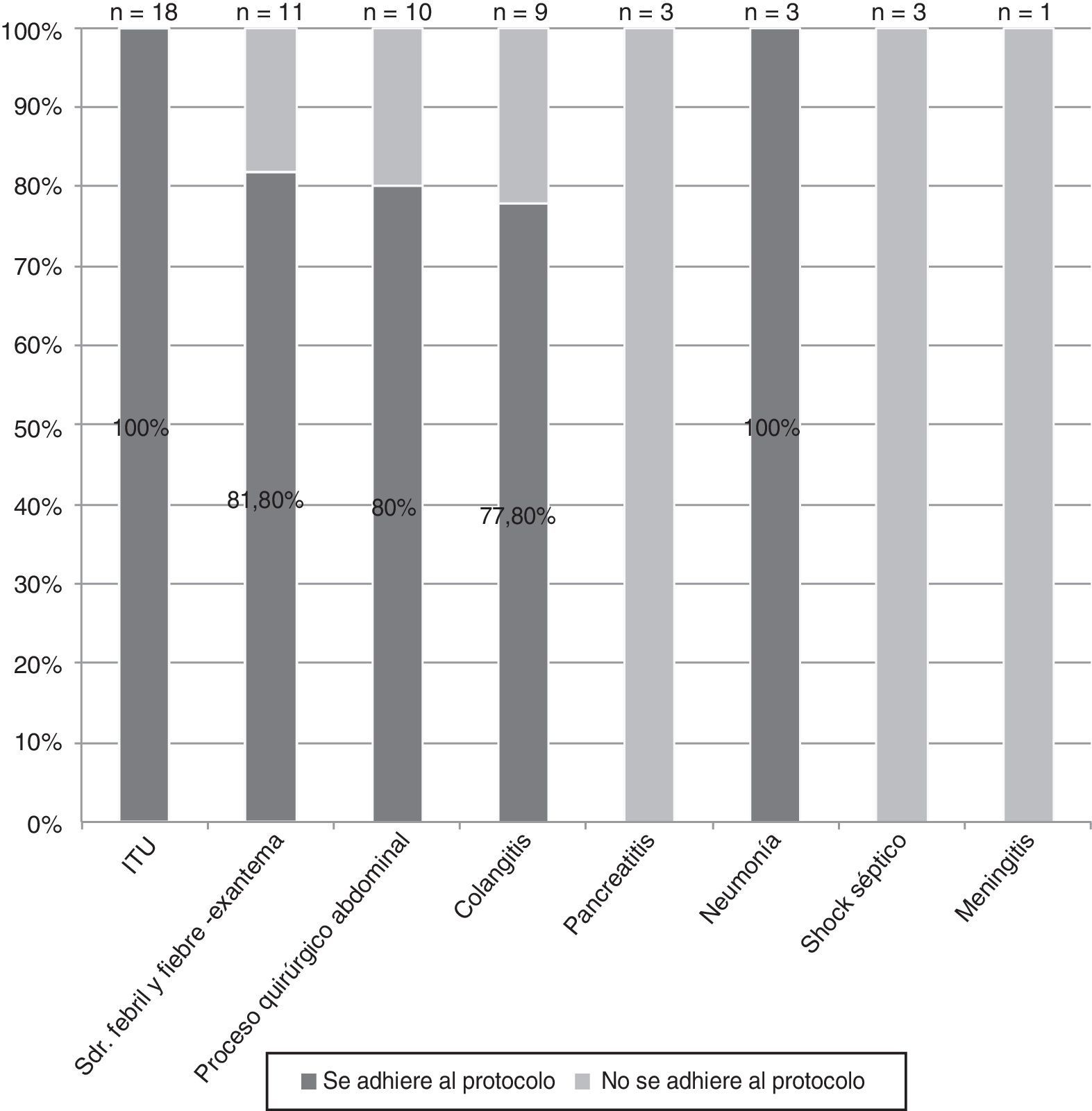
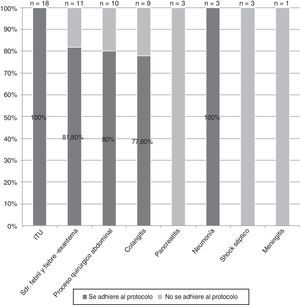
Según el diagnóstico de sospecha variaron los porcentajes de adecuación entre el 100% en la infección del tracto urinario y el 0% en los cuadros de pancreatitis, meningitis y shock séptico (fig. 5).
La estancia mediana en el grupo de no adecuación al protocolo fue de 14 días (RIC:37), mientras que en el grupo con adecuación fue de 10 días (RIC:11) (p=0,53).
Variables relacionadas con el fallo de prescripción para tratamiento empíricoLa existencia de un ingreso previo, así como si este se había producido en el mes anterior a la administración del carbapenémico, resultaron asociarse a la adecuación de la prescripción de forma estadísticamente significativa (p=0,009 y p=0,014, respectivamente). En el caso de la presencia de una enfermedad de base la asociación fue marginalmente significativa (p=0,065); no pudo analizarse el riesgo de prescripción inadecuada de un carbapenémico por cada enfermedad debido a la falta de potencia estadística del estudio por el pequeño tamaño de su muestra. La antibioterapia previa al ingreso y los diagnósticos al ingreso no mostraron ninguna relación con la adecuación de la indicación empírica.
La mediana de edad en el grupo con una adecuada prescripción empírica del carbapenémico fue de 14meses (rango intercuartílico: 6,25-60,8), mientras que en el grupo con tratamiento inadecuado fue de 58,5meses (rango intercuartílico: 24,3- 171,5). A pesar de ello, estas diferencias resultaron marginalmente significativas (p=0,067).
DiscusiónA lo largo del tiempo, y en distintos ámbitos geográficos, se ha comprobado que la utilización de antimicrobianos en el medio hospitalario es mejorable en el 30 al 50% de los casos21,22. Por ello, hace años se desarrollaron los programas institucionales de optimización de tratamientos antimicrobianos (PROA)23. Recientemente, los datos de una encuesta nacional muestran que solo el 40% de los 78 hospitales españoles incluidos en ella realizaban algún tipo de medida dirigida a la mejora de la utilización de los antimicrobianos, y de ellos solo el 13% incluían las unidades pediátricas en su ámbito de actuación24.
El primer paso para la optimización de los tratamientos antimicrobianos es el conocimiento del consumo en la institución de que se trate, y el segundo la evaluación de la prescripción y la planificación de las intervenciones a realizar.
Para determinar si un tratamiento es adecuado debe establecerse un patrón de referencia con el cual comparar la calidad de las prescripciones, considerando como tal las guías o protocolos del propio hospital. En nuestro estudio se empleó el protocolo de uso de carbapenémicos desarrollado por la Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, conjuntamente con el Servicio de Microbiología, en el año 200718.
Los resultados de nuestro estudio muestran que la mayoría de las prescripciones de un carbapenémico se realizaron de forma empírica (58,6% de los casos). El problema de la indicación de los carbapenémicos como tratamiento empírico radica en el riesgo de su sobreutilización, con el consiguiente aumento de las resistencias y del gasto farmacéutico. Sin embargo, la adecuación de los tratamientos empíricos al protocolo de indicaciones en nuestro estudio fue del 70,6%.
En los pacientes con el antecedente de un ingreso previo resultó mejor la adecuación de la prescripción empírica de carbapenémico; en la mayoría de los casos, en relación con el conocimiento de la colonización de estos pacientes por microorganismos multirresistentes. Aunque el porcentaje de adecuación de la prescripción empírica fue mayor en los pacientes con una enfermedad de base, esta relación no resultó significativa. La edad y la antibioterapia previa al ingreso no mostraron ninguna tendencia respecto a la adecuación de la indicación del carbapenémico. Tampoco el análisis por diagnósticos al ingreso fue significativo, a pesar de que en algunos casos, como en las infecciones del tracto urinario, el 100% de las prescripciones de un carbapenémico empírico se adecuaran al protocolo de indicaciones.
Entre las prescripciones de un carbapenémico realizadas como tratamiento dirigido, el porcentaje de adecuación al protocolo fue mayor: el 87,5% de los casos. El alto porcentaje de aislamientos microbiológicos obtenidos en el estudio (60,8%) representa una situación favorable para mejorar el uso de los antimicrobianos.
La adecuación del tratamiento por diagnósticos demuestra que aquellos para los que se detectaron más fallos de seguimiento del protocolo fueron los procesos quirúrgicos abdominales, la colangitis, la pancreatitis, la sepsis y la meningitis.
Las infecciones abdominales supusieron el 53% de las prescripciones de un carbapenémico de forma empírica al ingreso (23% colangitis, 21% abdomen agudo u otro proceso quirúrgico, 9% pancreatitis). Respecto a la infección intraabdominal, la mayoría de las publicaciones y guías recomiendan un régimen antibiótico de amplio espectro en las infecciones intraabdominales complicadas graves o con factores de riesgo, por presencia de comorbilidad u otros factores relacionados con fracaso terapéutico (días de estancia hospitalaria, tratamiento antibiótico previo…)25-27. Esto se debe a que, hasta hace poco tiempo, las enterobacterias productoras de BLEE se observaban exclusivamente en los pacientes con infecciones nosocomiales, pero en la actualidad hay un aumento en las infecciones adquiridas en la comunidad25, tal y como se pone de manifiesto en nuestro estudio (en 17 pacientes [33,3%] la infección estaba causada por una enterobacteria productora de BLEE). En estos momentos, para la población adulta, el tratamiento empírico con un carbapenémico se recomienda en la infección intraabdominal grave de origen comunitario y postoperatorio, incluyendo las infecciones de la vía biliar, con factores de riesgo de mala evolución, aunque no hay suficiente evidencia para la elección de estos como opción preferente de primera línea26,27. En la edad pediátrica las guías solo incluyen los carbapenémicos como una opción terapéutica, entre otros regímenes antimicrobianos, en los casos de infección intraabdominal complicada como la apendicitis perforada con peritonitis, sin establecer otros factores de riesgo para su indicación ni considerar las infecciones de la vía biliar26.
Una limitación del presente estudio es la falta de datos para valorar la gravedad de la infección intraabdominal, aunque ninguno de nuestros pacientes requirió ingreso en la unidad de cuidados intensivos. En los resultados se consideró una prescripción adecuada cuando la indicación se adecuó al protocolo establecido, realizándose estas prescripciones de forma empírica inicial en los pacientes colonizados por enterobacterias productoras de BLEE y como tratamiento de rescate en los tratados previamente con piperacilina-tazobactam, pues siguiendo las indicaciones de nuestro protocolo, este sería el tratamiento antimicrobiano empírico indicado inicialmente en la apendicitis aguda complicada grave28.
En cuanto a la pancreatitis aguda, la indicación de profilaxis antibiótica es un tema controvertido. Los resultados de los últimos metaanálisis publicados muestran que la administración profiláctica de antibióticos no previene la infección ni reduce la mortalidad de la pancreatitis aguda grave necrosante, salvo con imipenem, con el cual se encuentra una reducción significativa del riesgo de infección29,30. Por ello, aunque los estudios realizados carecen de suficiente potencia, algunas guías de práctica clínica31 siguen recomendando la profilaxis antibiótica con carbapenémicos en la pancreatitis aguda necrosante, pues consideran que, a pesar de que su administración no reduce la mortalidad, el riesgo de infección es menor. En los casos de pancreatitis aguda incluidos en nuestro estudio se indicó tratamiento con meropenem desde el momento del ingreso, y se evaluaron como no cumplimiento del protocolo de indicaciones. Solo uno de ellos presentó necrosis y requirió finalmente ingreso en el servicio de cuidados intensivos.
Tras la revisión de la literatura, consideramos que los casos de pancreatitis aguda grave necrosante deberían incluirse en las indicaciones empíricas de empleo de un carbapenémico29-31, mientras que no hay suficiente evidencia en la edad pediátrica para realizar esta indicación, como primera opción de tratamiento, en las infecciones abdominales graves26.
Hemos encontrado limitaciones a la hora de comparar los resultados de nuestro trabajo sobre el consumo de carbapenémicos en patología infecciosa comunitaria con la literatura publicada. Hay muy pocas publicaciones sobre la adecuación del uso de fármacos en la edad pediátrica, y no hemos encontrado ninguna que analice la prescripción de carbapenémicos en las infecciones adquiridas en la comunidad fuera de las unidades de cuidados intensivos.
A pesar de que ya en el año 2007 desarrollamos el protocolo de uso de carbapenémicos, que se considera una medida no restrictiva o de ayuda a la prescripción dentro de los PROA23, y de que estas medidas son de las más importantes por su mejor aceptación por parte de los profesionales y por su potencial eficacia a largo plazo, no se habían realizado estudios sobre el consumo de carbapenémicos similares al nuestro previamente a la instauración del protocolo. Esto no nos permite analizar diferencias ni valorar estrictamente la eficacia de tales medidas de intervención sobre la utilización de los carbapenémicos. No obstante, el hecho de obtener en nuestro estudio un mejor resultado en cuanto a la adecuación de la prescripción de carbapenémicos (un 77,6%) en comparación con otras publicaciones21,22 lo atribuimos, por una parte, a la existencia de un protocolo de indicaciones establecido, y por otra a la realización de una consultoría de infectología activa en nuestro hospital. Además, las dificultades encontradas a la hora de recuperar los datos de consumo de carbapenémicos en la base de farmacia ponen de manifiesto la necesidad de realizar una revisión del control y de la dispensación de este grupo de antimicrobianos para futuros análisis de farmacovigilancia.
A pesar de las limitaciones de nuestro estudio, nos ha permitido describir el uso y evaluar la adecuación de la prescripción de carbapenémicos en las infecciones adquiridas en la comunidad y en las relacionadas con asistencia sanitaria en la edad pediátrica, así como abordar la revisión de ciertos puntos del protocolo de indicaciones, como es la indicación empírica de carbapenémicos en los casos de pancreatitis aguda necrosante, planteando la necesidad de realizar futuras intervenciones específicas.
Como conclusión, queremos destacar que la existencia de un protocolo de indicaciones de tratamiento con carbapenémicos establecido desde el año 2007 en el hospital influye en los buenos resultados obtenidos en nuestro estudio en cuanto a la adecuación de la prescripción (un 77,6%) de este grupo de antimicrobianos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.