El objetivo de este estudio es evaluar la eficacia de los tratamientos más utilizados en infecciones odontogénicas en niños y adolescentes aplicando criterios farmacocinéticos/farmacodinámicos (PK/PD).
MétodosSe han simulado las curvas de concentración plasmática libre-tiempo a partir de parámetros farmacocinéticos medios de amoxicilina, amoxicilina-ácido clavulánico, cefuroxima axetilo, espiramicina, clindamicina, azitromicina y metronidazol. Para los antibióticos con actividad dependiente del tiempo, se ha calculado el tiempo durante el cual las concentraciones permanecen por encima de la concentración inhibitoria mínima (CIM90) de los microorganismos (T>CIM). Para los antimicrobianos con actividad dependiente de la concentración, se ha calculado el cociente entre el área bajo la curva y la CIM90 (ABC/CIM90).
ResultadosCon amoxicilina-ácido clavulánico (80 mg/kg/día) se han obtenido índices de eficacia adecuados frente a los microorganismos estudiados (T > CIM > 40%), excepto para Veillonella spp. Clindamicina (40 mg/kg/día) también ha presentado índices PK/PD adecuados frente a la mayoría de los patógenos, excepto Lactobacillus, Actinobacillus actinomycetemcomitans, Peptostreptococcus resistente a penicilina y Eikenella corrodens. Con dosis altas de amoxicilina los resultados no han sido satisfactorios frente a varias especies bacterianas. Con azitromicina y metronidazol no se han alcanzadovalores adecuados frente a la mayoría de patógenos(ABC/CIM90 < 25).
ConclusiónEl tratamiento empírico más adecuado en infecciones odontogénicas en niños y adolescentes es amoxicilina-ácido clavulánico en altas dosis de amoxicilina, aunque se puede utilizar como alternativa clindamicina. Sería conveniente confirmar estos resultados mediante ensayos clínicos, para cuyo diseño y evaluación podría ser de gran utilidad la aplicación de estudios PK/PD.
The objective of this study was to evaluate the efficacy of the most commonly used antimicrobial treatments in odontogenic infections in children and adolescents on the basis of pharmacokinetic/ pharmacodynamic (PK/PD) criteria.
MethodsUnbound drug plasma concentration-time curves were simulated with mean population pharmacokinetic parameters of amoxicillin, co-amoxiclav, cefuroxime axetil, spiramycin, clindamycin, azithromycin, and metronidazole. For drugs showing time-dependent antibacterial killing, the time above MIC90 of the pathogens studied was calculated (T > MIC). For drugs with concentration-dependent bactericidal activity, the area under theconcentration-time curve (AUC)/MIC90 ratio was calculated.
ResultsAdequate efficacy indexes (T > MIC > 40%) against all the microorganisms examined with the exception of Veillonella spp. were obtained with co-amoxiclav (80 mg/kg/day). Clindamycin (40 mg/kg/day) obtained adequate PK/PD indexes except for Lactobacillus, Actinobacillus actinomycetemcomitans, penicillin-resistant Peptostreptococcus, and Eikenella corrodens. High-dose amoxicillin yielded unsatisfactory results against many bacterial species. Azithromycin and metronidazole showed inadequate efficacy indexes against the majority of pathogens studied (AUC/MIC90 < 25).
ConclusionWhen antibiotic therapy is needed for odontogenic infections in children and adolescents, the most active empirical therapeutic choice is co-amoxiclav with high doses of amoxicillin. Clindamycin can be used as an alternative option. These results should be confirmed in clinical trials, in which the PK/PD approach could be useful for the design and assessment of results.
En España, el elevado consumo de antibióticos y la rápida incorporación de nuevas moléculas antimicrobianas al arsenal terapéutico han contribuido a que la tasa de resistencia antimicrobiana sea una de las más altas de la Unión Europea, especialmente en el ámbito comunitario1–3.
Diferentes estudios demuestran que los odontólogos de diferentes países prescriben antibióticos, tanto con fines terapéuticos como profilácticos, de forma inadecuada4–8. En España durante el año 2005, el 12,4% de los antibióticos se utilizaron para el tratamiento de infecciones odontológicas. La prescripción de antibióticos en estos casos la llevan a cabo en su mayor parte odontólogos (62%) y médicos generales (36%). Los hábitos de prescripción más frecuentes incluyen antibióticos betalactámicos (sobre todo amoxicilina sola o con ácido clavulánico) y macrólidos (mayoritariamente espiramicina), y es la suma de las dos familias, aproximadamente el 93% del total de las prescripciones9.
Sin embargo, el tratamiento antibiótico no está indicado en todas las afecciones bucodentales. Así, en las caries sin complicaciones y en las infecciones dentarias localizadas no es necesaria la utilización de antibioterapia sistémica. La caries es la enfermedad dental más prevalente en población pediátrica10, y es significativamente superior en población inmigrante que en población autóctona11–13, tanto en dentición temporal como permanente. La pulpitis y los abscesos periapicales, como complicaciones de la caries, son frecuentes en niños y jóvenes. Si el proceso infeccioso está localizado en la pulpa o en los tejidos inmediatamente adyacentes, la terapia antibiótica tampoco está indicada. En los niños, sin embargo, estos procesos infecciosos pueden difundirse rápidamente y dar lugar a la aparición de celulitis. En estos casos sí es necesario recurrir a la antibioterapia sistémica junto con el tratamiento del diente causal. Otra patología frecuente en la etapa infantil son los traumatismos dentarios. La exposición del tejido pulpar y la lesión de los tejidos periapicales como consecuencia del traumatismo pueden requerir la utilización de un agente antimicrobiano, como medida preventiva o como tratamiento coadyuvante del proceso infeccioso. Con respecto a las enfermedades periodontales, la mayoría de los procesos en niños y adolescentes son periodontitis agudas y agresivas; en estos casos se recomienda la combinación de tratamiento antibiótico y tratamiento local (raspado).
Dada la importancia que tiene el uso racional de antibióticos en todas las disciplinas médicas, y con el propósito de optimizar el uso de estos fármacos y asegurar que se administre el antibiótico indicado en las dosis e intervalos adecuados, y de evitar la aparición de cepas bacterianas resistentes, se han introducido los "índices de eficacia"14 como parámetros que tienen en consideración las propiedades tanto farmacocinéticas como farmacodinámicas de los antibióticos.
En la actualidad, las recomendaciones acerca de la utilización de los antibióticos en el tratamiento o la profilaxis de infecciones odontogénicas no pueden basarse en ensayos clínicos, ya que éstos son muy escasos en odontología15,16. En un trabajo publicado en 2005 se evaluó el tratamiento antibiótico en odontoestomatología en adultos aplicando criterios farmacocinéticos/farmacodinámicos17,18. En la población pediátrica, debido a la escasez de datos publicados, es difícil hacer una evaluación de los tratamientos, a pesar de que la pulpitis y los abscesos periapicales como complicaciones de la caries, la pericoronaritis y la periodontitis de comienzo temprano en período prepuberal y juvenil pueden requerir cobertura antibiótica como medida coadyuvante. Por todo ello, en este estudio se han aplicado criterios PK/PD con el objetivo de evaluar la eficacia de los tratamientos más utilizados en infecciones orales odontogénicas en niños.
MétodosSe realizó una búsqueda bibliográfica utilizando la base de datos Medline para conocer los valores de CIM90 o, en su defecto, la concentración más alta del rango de sensibilidades de los microorganismos más frecuentemente aislados en las diferentes infecciones odontogénicas en población infantil y juvenil. Se incluyeron: a) Streptococcus mutans, Streptococcus del grupo viridans, Actynomyces gerencseriae y Lactobacillus fermentum (llamados iniciadores de la caries), que junto a Bifidobacterium y Veillonella se aíslan en las caries infantiles19,20; b) Actinobacillus, Tannerella y Porphyromonas gingivalis aislados en el paso de gingivitis a periodontitis incipiente21, y c) Streptococcus del grupo viridans, Peptostreptococcus, Prevotella, Porphyromonas, Fusobacterium, Eikenella, Capnocytophaga y Campylobacter rectus, que junto con los anteriores, son los microorganismos más frecuentemente aislados en pulpitis, abscesos periapicales, pericoronaritis y periodontitis22,23.
Se evaluó la eficacia de siete antibióticos: amoxicilina, con o sin ácido clavulánico (AMOX, AMOX-CA), cefuroxima axetilo (CROX-AX), espiramicina (SPR), clindamicina (CLI), azitromicina (AZI) y metronidazol (MTR). Los fármacos se dividieron en dos grupos: a) aquellos que tienen actividad antimicrobiana dependiente del tiempo (amoxicilina, cefuroxima axetilo, espiramicina y clindamicina), cuya eficacia depende del tiempo durante el cual las concentraciones están por encima de la CIM de la bacteria causante del proceso infeccioso, y b) los antibióticos que poseen actividad dependiente de la concentración (azitromicina y metronidazol), en los que la velocidad y la magnitud de su acción bactericida aumenta proporcionalmente al incrementarse las concentraciones.
Para cada antibiótico y pauta de dosificación se simularon las curvas de concentración plasmática libre-tiempo a partir de los parámetros farmacocinéticos pediátricos de los antibióticos obtenidos de la literatura científica (tabla 1)24. Las concentraciones plasmáticas máximas (Cmáx) obtenidas con cada una de las simulaciones se presentan en la tabla 2
Parámetros farmacocinéticos medios en niños de los antibióticos estudiados24
| Vd/F (l) | Ka (h−1) | Ke (h−1) | Fu | |
| AMOX/AMOX-CA | 1,41 | 1,73 | 0,56 | 0,8 |
| CROX-AX | 0,72 | 0,43 | 0,5 | 0,6 |
| CLI | 0,9 | 1,51 | 0,244 | 0,16 |
| MTR | 0,66 | 4,07 | 0,083 | 0,8 |
AMOX: amoxicilina; AMOX-CA: amoxicilina-ácido clavulánico; CROX-AX: cefuroxima axetilo; CLI: clindamicina; MTR: metronidazol; Vd/F: volumen de distribución; Ka: constante de absorción; Ke: constante de eliminación; Fu: fracción libre.
Valores de concentración plasmática máxima (Cmáx) obtenidos tras simular los niveles plasmáticos de los antibióticos en niños
| Posología* | Cmáx (mg/l) | |
| AMOX/AMOX-CA | 40 mg/kg/día • 8 h | 5,58 |
| 80 mg/kg/día • 8 h | 11,17 | |
| CROX-AX | 30 mg/kg/día • 12 h | 7,22 |
| 30 mg/kg/día • 8 h | 5,33 | |
| 40 mg/kg/día • 12 h | 9,71 | |
| 40 mg/kg/día • 8 h | 7,10 | |
| CLI | 25 mg/kg/día • 6 h | 6,69 |
| 40 mg/kg/día • 6 h | 10,70 | |
| 25 mg/kg/día • 8 h | 7,80 | |
| 40 mg/kg/día • 8 h | 12,48 | |
| MTR | 15 mg/kg/día • 8 h | 14,55 |
| 35 mg/kg/día • 8 h | 34,11 |
AMOX: amoxicilina; AMOX-CA: amoxicilina-ácido clavulánico; CROX-AX: cefuroxima axetilo; CLI: clindamicina; MTR: metronidazol.
En el caso de los antimicrobianos de actividad dependiente del tiempo, se utilizó como índice de eficacia PK/PD el tiempo durante el cual las concentraciones plasmáticas permanecen por encima de la concentración inhibitoria mínima una vez que se ha alcanzado el estado estacionario, expresado como porcentaje del intervalo de dosificación (T > CIM). Este cálculo se llevó a cabo utilizando el programa DERIVE25, introduciendo parámetros farmacocinéticos poblacionales medios en población pediátrica. Se considera que el valor del parámetro que predice eficacia es adecuado cuando T > CIM es mayor del 40% para penicilinas y del 50% para el resto de antibióticos26.
Para los antimicrobianos con actividad dependiente de la concentración se calculó el cociente ABC/CIM90; ABC es el área bajo la curva concentración plasmática-tiempo en 24 h. El ABC de azitromicina y metronidazol se obtuvo a partir de simulaciones realizadas con el programa WinNonlin27 siguiendo un modelo monocompartimental con absorción y eliminación de primer orden. Para conseguir eficacia con este tipo de antibióticos en infecciones no graves en pacientes inmunocompetentes, es necesario alcanzar un valor de ABC/CIM90 superior a 2 5 26.
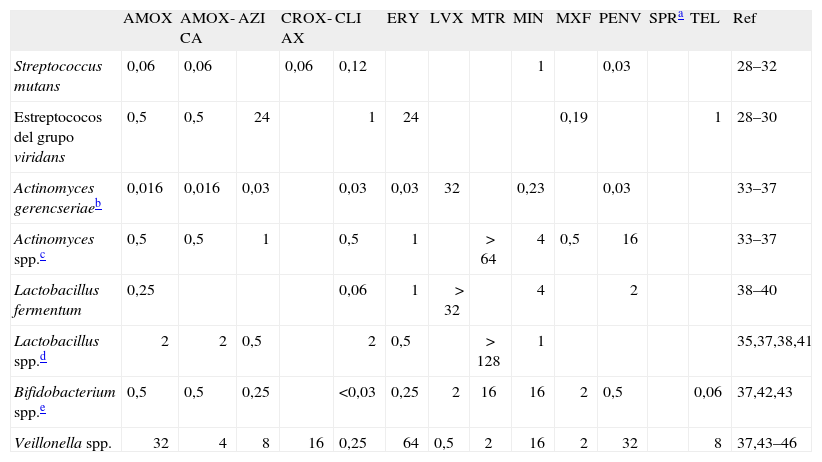
ResultadosLos valores de CIMg90 de los antimicrobianos utilizados en niños frente a los microorganismos iniciadores y productores de caries infantil se muestran en la tabla 328–46. En la tabla 422,33,34,47–57 se presentan los valores de los microorganismos aislados en casos de gingivitis y periodontitis incipiente y en la tabla 522,33–35,52-56,58–64 las CIM90 frente a las especies aisladas en pulpitis, abscesos periapicales, pericoronaritis y periodontitis.
CIM90 (mg/l) de los antibióticos utilizados en niños frente a cada uno de los microorganismos iniciadores (Streptococcus mutans, Actinomyces gerencseriae, Lactobacillus fermentum) y productores de caries infantil
| AMOX | AMOX-CA | AZI | CROX-AX | CLI | ERY | LVX | MTR | MIN | MXF | PENV | SPRa | TEL | Ref | |
| Streptococcus mutans | 0,06 | 0,06 | 0,06 | 0,12 | 1 | 0,03 | 28–32 | |||||||
| Estreptococos del grupo viridans | 0,5 | 0,5 | 24 | 1 | 24 | 0,19 | 1 | 28–30 | ||||||
| Actinomyces gerencseriaeb | 0,016 | 0,016 | 0,03 | 0,03 | 0,03 | 32 | 0,23 | 0,03 | 33–37 | |||||
| Actinomyces spp.c | 0,5 | 0,5 | 1 | 0,5 | 1 | > 64 | 4 | 0,5 | 16 | 33–37 | ||||
| Lactobacillus fermentum | 0,25 | 0,06 | 1 | > 32 | 4 | 2 | 38–40 | |||||||
| Lactobacillus spp.d | 2 | 2 | 0,5 | 2 | 0,5 | > 128 | 1 | 35,37,38,41 | ||||||
| Bifidobacterium spp.e | 0,5 | 0,5 | 0,25 | <0,03 | 0,25 | 2 | 16 | 16 | 2 | 0,5 | 0,06 | 37,42,43 | ||
| Veillonella spp. | 32 | 4 | 8 | 16 | 0,25 | 64 | 0,5 | 2 | 16 | 2 | 32 | 8 | 37,43–46 |
AMOX: amoxicilina; AMOX-CA: amoxicilina-ácido clavulánico; AZI: azitromicina; CLI: clindamicina; CROX-AX: cefuroxima axetilo; ERY: eritromicina; LVX: levofloxacino; MTR: metronidazol; MIN: minociclina; MXF: moxifloxacino; PENV; penicilina V; SPR: espiramicina; TEL: telitromicina; CIM: concentración inhibitoria mínima.
CIM90 (mg/l) de los antibióticos utilizados en niños frente a cada uno de los microorganismos aislados en el paso de gingivitis a periodontitis incipiente
| AMOX | AMOX-CA | AZI | CROX-AX* | CLI | ERY | LVX | MTR | MIN | MXF | PENV | SPR* | TEL | Ref. | |
| Actinobacillus actinomycetemcomitans** | 32 | 1,5 | 3,6 | 8 | 16 | 2 | 256 | 0,38 | 0,03 | 1 | > 32 | 47–50 | ||
| Tannerella forsythensis*** | 0,12 | 1,8 | 0,12 | 2 | 0,25 | 0,12 | 0,5 | 33,34,51 | ||||||
| Porphyromonas gingivalis | 16 | 2 | 1,2 | 0,03 | 0,25 | 1 | 2 | 2 | 0,5 | 0,12 | 1 | 0,06 22,47,52-57 | ||
Para las siglas de los fármacos, véase la tabla 3.
CIM90 (mg/l) de los antibióticos utilizados en niños frente a los microorganismos aislados en pulpitis, abscesos periapicales, pericoronaritis y periodontitis
| AMOX | AMOX-CA | AZI | CROX-AX | CLI | ERY | LVX | MTR | MIN | MXF | PENV | SPR | TEL | Ref. | |
| Estreptococos del | 1 | 1 | PS 0,12 | 4 | 0,5 | PS 0,06 | 8 | > 128 | PS 0,5 | 0,5 | 0,25 | 0,5 | 0,5 | 22,52,53, |
| grupo viridans | PR 16 | PR 2 | PR 2 | 58,59 | ||||||||||
| Peptostreptococcus | 0,25 | 0,25 | 2 | 16 | PS 0,5 | PS 8 | PS 1 | 64 | PS 2 | 0,12 | 2 | 2 | 0,06 | 22,33,52, |
| spp. | PR 2 | PR 64 | PR 8 | PR 4 | 53,60-62 | |||||||||
| Prevotella | 16 | 2 | 1 | PS 0,01 | PS 1 | 4 | 2 | PS 0,12 | 1 | 32 | 0,1 | 1 | 22,52-56, | |
| intermedia | PR 0,06 | PR 32 | PR 8 | 58,59 | ||||||||||
| Porphyromonas | 16 | 2 | 1 | 0,03 | 0,25 | 1 | 2 | 2 | 0,5 | 0,12 | 0,2 | 0,06 | 22,52-56, | |
| gingivalis | 58,59 | |||||||||||||
| Fusobacterium | 8 | 2 | 4 | 0,12 | 64 | 4 | 8 | PS 1 | 0,25 | 1 | 16 | 32 | 22,52-56, | |
| nucleatum | PR 2 | 58,59 | ||||||||||||
| Tannerella forsythensis* | 0,12 | 0,12 | 2 | 0,25 | 0,12 | 0,5 | 33,34 | |||||||
| Campylobacter rectus** | 1 | 0,12 | 0,12 | 0,5 | 1 | 1 | 2 | 0,12 | 2 | 23 | ||||
| Eikenella corcorrodens*** | 2 | 0,5 | 16 | 16 | > 16 | 32 | 0,015 | > 128 | 1 | 0,06 | 8 | 2 | 23,35,44 | |
| Capnocytophaga spp. | > 64 | 1 | 0,5 | 32 | 1 | 2 | 0,03 | > 32 | 0,38 | > 64,00 | 23,63,64 |
Para las siglas de los fármacos, véase la tabla 3.
PR: cepas resistentes a penicilina; PS: cepas sensibles a penicilina.
La tabla 6 presenta los índices PK/PD referidos tanto a los microorganismos iniciadores como a los aislados en la caries infantil. Tras la administración de amoxicilina, sola o junto con ácido clavulánico en dosis de 80 mg/kg/día en tres dosis, se consigue mantener las concentraciones de fármaco libre por encima de la CIM de los microorganismos iniciadores y productores de caries dental durante más del 40% del intervalo de dosificación (T > CIM > 40%), con la excepción de Veillonella spp. (32%). Con cefuroxima axetilo se han obtenido índices adecuados en el caso de S. mutans. Sin embargo, este antibiótico no alcanza valores adecuados frente a Veillonella spp. (0%). Con la administración de clindamicina, en dosis de 40 mg/kg/día en tres o cuatro dosis, se alcanzan valores de T > CIM > 40%, incluyendo Veillonella spp., pero no para Lactobacillus (0%). Con los antibióticos de actividad dependiente de la concentración (azitromicina y metronidazol) no se alcanzan valores adecuados (ABC/CIMg90 < 25) para la mayoría de los microorganismos. No se han podido calcular los índices de eficacia de espiramicina debido a que en la búsqueda bibliográfica no se han encontrado datos farmacocinéticos en población pediátrica.
Índices de eficacia PK/PD frente a los microorganismos iniciadores y productores de caries infantil
| Antibiótico | ||||||||||||||||
| AMOX | AMOX-CA | CROX-AX | SPR** | CLI | AZI | MTR | ||||||||||
| Posología* | 40 mg/kg/día • 8 h | 80 mg/kg/día • 8 h | 40 mg/kg/día • 8 h | 80 mg/kg/día • 8 h | 30 mg/kg/día • 12 h | 30 mg/kg/día • 8 h | 40 mg/kg/día • 12 h | 40 mg/kg/día • 8 h | 25 mg/kg/día • 6 h | 40 mg/kg/día • 6 h | 25 mg/kg/día • 8 h | 40 mg/kg/día • 8 h | 10 mg/kg/día • 24 h | 15 mg/kg/día • 8 h | 35 mg/kg/día • 8 h | |
| Streptococcus mutans (iniciador) | 100 | 100 | 100 | 100 | > 50 | > 50 | > 50 | > 50 | 26 | 70 | 31 | 60 | ||||
| Estreptococos grupo viridans | 69 | 85 | 69 | 85 | 26 | 70 | 31 | 60 | 0,2 | |||||||
| Actinomyces gerencseriae (iniciador) | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 113,0 | |||||||
| Actinomyces spp. | 69 | 85 | 69 | 85 | 84 | 100 | 71 | 100 | 4 | 4 | 8 | |||||
| Lactobacillus fermentum (iniciador) | 85 | 100 | 100 | 100 | 100 | 100 | 8 | 2 | 4 | |||||||
| Lactobacillus spp. | 32 | 52 | 32 | 52 | 0 | 0 | 0 | 0 | 8 | 2 | 4 | |||||
| Bifidobacterium spp. | 69 | 85 | 69 | 85 | 100 | 100 | 100 | 100 | 15 | 14 | 32 | |||||
| Veillonella spp. | 0 | 0 | 7 | 32 | 0 | 0 | 0 | 0 | 100 | 100 | 100 | 100 | 0,5 | 110 | 256 | |
¿ T > CIM > 40-50% o ABC/CIM90 > 25.
□ T > CIM < 40-50% o ABC/CIM90 < 25.
Para las siglas de los fármacos, véase la tabla 3.
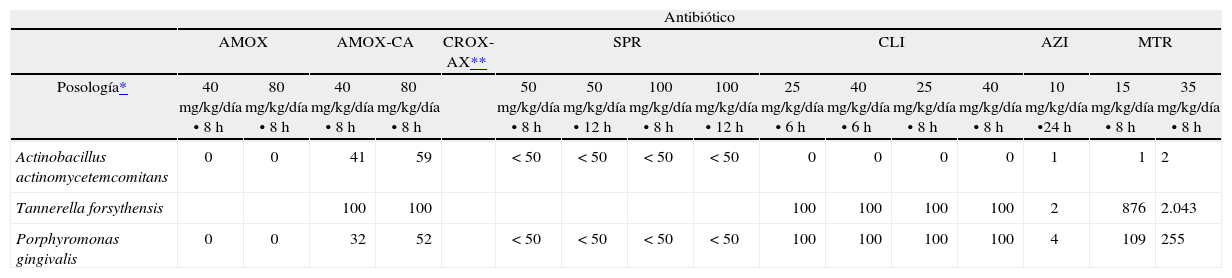
En la tabla 7 se recogen los índices PK/PD para los microorganismos involucrados en el paso de gingivitis a periodontitis incipiente. Con las dosis más altas de amoxicilina (80 mg/kg/día) no se alcanza el punto de corte establecido para el índice de eficacia (T > CIM < 40%). Es necesario administrar amoxicilina-ácido clavulánico en dosis altas (80 mg/kg/día en tres dosis) para conseguir valores de T > CIM mayores al 40%. Clindamicina (dosis de 25 mg/kg/día y superiores) y metronidazol (dosis de 15 mg/kg/día y superiores) presentan índices adecuados frente a Tannerella forsythensis y Porphyromonas gingivalis, pero no frente a A. actinomycetemcomitans.
Índices de eficacia PK/PD frente a los microorganismos aislados en el paso de gingivitis a periodontitis incipiente
| Antibiótico | ||||||||||||||||
| AMOX | AMOX-CA | CROX-AX** | SPR | CLI | AZI | MTR | ||||||||||
| Posología* | 40 mg/kg/día • 8 h | 80 mg/kg/día • 8 h | 40 mg/kg/día • 8 h | 80 mg/kg/día • 8 h | 50 mg/kg/día • 8 h | 50 mg/kg/día • 12 h | 100 mg/kg/día • 8 h | 100 mg/kg/día • 12 h | 25 mg/kg/día • 6 h | 40 mg/kg/día • 6 h | 25 mg/kg/día • 8 h | 40 mg/kg/día • 8 h | 10 mg/kg/día •24 h | 15 mg/kg/día • 8 h | 35 mg/kg/día • 8 h | |
| Actinobacillus actinomycetemcomitans | 0 | 0 | 41 | 59 | < 50 | < 50 | < 50 | < 50 | 0 | 0 | 0 | 0 | 1 | 1 | 2 | |
| Tannerella forsythensis | 100 | 100 | 100 | 100 | 100 | 100 | 2 | 876 | 2.043 | |||||||
| Porphyromonas gingivalis | 0 | 0 | 32 | 52 | < 50 | < 50 | < 50 | < 50 | 100 | 100 | 100 | 100 | 4 | 109 | 255 | |
¿ T > CIM > 40-50% o ABC/CIM90 > 25.
□ T > CIM < 40-50% o ABC/CIM90 < 25.
Para las siglas de los fármacos, véase la tabla 3.
En la tabla 8 se muestran los índices PK/PD para los microorganismos facultativos, anaerobios y capnófilos aislados en infecciones odontogénicas supuradas e infecciones periodontales. Sólo con amoxicilina-ácido clavulánico en dosis de 80 mg/kg/día en tres veces se obtienen índices de eficacia PK/PD adecuados frente a todos los microorganismos (T > CIM > 40% del intervalo de dosificación). Clindamicina en dosis de 40 mg/kg/día en tres o cuatro veces también presenta índices de eficacia adecuados excepto para Eikenella (0%) y Peptostreptococcus resistente a penicilina (0%).
Índices de eficacia PK/PD frente a los microorganismos aislados en infecciones odontogénicas e infecciones periodontales
| Antibiótico | ||||||||||||||||
| AMOX | AMOX-CA | CROX-AX | SPR** | CLI | AZI | MTR | ||||||||||
| Posología* | 40 mg/kg/día • 8 h | 80 mg/kg/día • 8 h | 40 mg/kg/día • 8 h | 80 mg/kg/día • 8 h | 30 mg/kg/día • 12 h | 30 mg/kg/día • 8 h | 40 mg/kg/día • 12 h | 40 mg/kg/día • 8 h | 25 mg/kg/día • 6 h | 40 mg/kg/día • 6 h | 25 mg/kg/día • 8 h | 40 mg/kg/día • 8 h | 10 mg/kg/día • 24 h | 15 mg/kg/día • 8 h | 35 mg/kg/día • 8 h | |
| Estreptococos del | 52 | 69 | 52 | 69 | < 50 | < 50 | < 50 | < 50 | 84 | 100 | 71 | 100 | PS 30 | 2 | 4 | |
| grupo viridans | PR 0 | |||||||||||||||
| Peptostreptococcus spp. | 85 | 100 | 85 | 100 | 0 | 0 | 0 | 0 | PS 84 | PS 100 | PS 71 | PS 100 | 2 | 3 | 8 | |
| PR 0 | PR 0 | PR 0 | PR 0 | |||||||||||||
| Prevotella intermedia | 0 | 0 | 33 | 52 | 100 | 100 | 100 | 100 | 4 | 110 | 255 | |||||
| Porphyromonas gingivalis | 0 | 0 | 33 | 52 | 100 | 100 | 100 | 100 | 4 | 110 | 255 | |||||
| Fusobacterium spp. | 0 | 7 | 33 | 52 | 100 | 100 | 100 | 100 | 1 | 27 | 64 | |||||
| Tannerella forsythensis | 100 | 100 | 100 | 100 | 100 | 100 | 876 | 2.044 | ||||||||
| Campylobacter rectus | 52 | 69 | 100 | 100 | 100 | 100 | 100 | 100 | 219 | 511 | ||||||
| Eikenella corrodens | 32 | 52 | 69 | 85 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 4 | |
| Capnocytophaga spp. | 0 | 0 | 52 | 69 | 0 | 0 | 0 | 0 | 20 | 64 | 26 | 55 | 7 | 7 | 16 | |
¿ T > CIM > 40-50% o ABC/CIM90 > 25.
□ T > CIM < 40-50% o ABC/CIM90 < 25.
Para las siglas de los fármacos, véase la tabla 3.
PR: cepas resistentes a penicilina; PS: cepas sensibles a penicilina.
En este estudio se ha evaluado la eficacia de los tratamientos más utilizados en infecciones orales odontogénicas en niños aplicando criterios PK/PD, lo que puede ayudar a establecer las opciones terapéuticas más adecuadas en función de la racionalidad y eficiencia, como se recomienda en el documento de consenso sobre el tratamiento antimicrobiano de las infecciones bacterianas odontogénicas65. En este documento se indica que la infección odontogénica debe ser abordada desde tres ámbitos terapéuticos que son complementarios entre sí: a) el tratamiento etiológico odontológico, que frecuentemente incluirá actuaciones quirúrgicas de mayor o menor envergadura; b) el tratamiento sistémico de soporte, que abarca el tratamiento sintomático del dolor, el control de la inflamación, medidas físicas, hidratación, control de la temperatura, equilibrio de la glucemia, etc., y c) por último, debe ser aplicado un tratamiento antimicrobiano con criterios de racionalidad y eficiencia.
Ante la sospecha de un posible proceso infeccioso en atención primaria, antes de iniciar el tratamiento antibiótico se recomienda confirmar la existencia de infección, localizarla, conocer los microorganismos posiblemente implicados, con o sin confirmación microbiológica, conocer las resistencias bacterianas del área geográfica, determinar la necesidad o no de tratamiento antibiótico y, en caso de que esté indicado, administrar el antibiótico más adecuado para el tipo y la localización de la infección diagnosticada, teniendo presente la situación fisiopatológica del paciente y la gravedad del proceso, ajustando la dosis y la duración del tratamiento66. Se define el antibiótico ideal65 como aquel que presente actividad frente a los microorganismos implicados en el proceso infeccioso, adecuados parámetros farmacocinéticos (buena penetración y difusión en el lugar de la infección), buena tolerancia, pocos efectos adversos y una posología que pueda facilitar el cumplimiento del tratamiento. Pese a que no se citan, los índices PK/PD se presentan como un instrumento para optimizar la eficacia clínica y microbiológica, minimizar la presión selectiva para el desarrollo de resistencias y determinar un régimen posológico adecuado67.
El hecho de que las infecciones tras procesos odontológicos sean habitualmente polimicrobianas y que en la práctica habitual no se lleve a cabo un cultivo, aislamiento e identificación de los microorganismos implicados hace recomendable establecer un tratamiento que abarque los microorganismos más frecuentemente aislados. Sobre la base de los resultados obtenidos en este estudio, el tratamiento de elección en infecciones odontogénicas en población pediátrica sería amoxicilina-ácido clavulánico en altas dosis de amoxicilina (80 mg/kg/día), debido a que se obtienen índices de eficacia adecuados para el tratamiento de infecciones odontológicas tanto asociadas a complicaciones de la caries (pulpitis, abscesos periapicales), como a pericoronaritis y periodontitis juvenil. Los mejores resultados obtenidos con amoxicilina-ácido clavulánico frente a amoxicilina podrían explicarse por la implicación de cepas productoras de betalactamasas en estas infecciones. En un estudio reciente sobre el perfil de resistencia a los antibióticos habitualmente utilizados en odontología en España68, se describe que entre las cepas aisladas en procesos odontogénicos, el 54,1% de Prevotella spp., el 38,9% de Fusobacterium nucleatum, el 30% de Capnocytophaga spp. y el 10% de Veillonella spp. son productores de betalactamasas. En el citado trabajo, los autores también concluyen que amoxicilina-ácido clavulánico es el antibiótico más activo frente a todas las especies aisladas, y el metronidazol es el siguiente antibiótico más activo después de amoxicilina-ácido clavulánico en el caso de anaerobios. En nuestro estudio, los índices de eficacia de metronidazol obtenidos frente a la mayoría de anaerobios son adecuados, aunque los valores de ABC/CMI90 obtenidos muestran que no resultaría eficaz frente a Peptostreptococcus, especie no evaluada por Maestre et al68.
Clindamicina es la alternativa a amoxicilina-ácido clavulánico hoy en día, salvo para el tratamiento de jóvenes con periodontitis agresiva, debido a que en estos casos Actinobacillus es el microorganismo más prevalente. A la vista de los resultados obtenidos en niños y adolescentes, queda patente que no se dispone de alternativas antimicrobianas suficientes que puedan utilizarse con garantías en casos de alergia a antibióticos betalactámicos o efectos adversos que exijan cambio de medicación.
Entre las limitaciones de este estudio, destaca, por un lado, el limitado número de estudios farmacocinéticos de los antibióticos en la población objeto de estudio, por lo que las simulaciones se han realizado con datos farmacocinéticos obtenidos de estudios con tamaños de muestra reducidos. Por otro lado, la variabilidad farmacocinética interindividual es elevada en este grupo de pacientes y podría haber variaciones importantes dependiendo de la edad del niño.
Otro aspecto que hay que tener en cuenta es que los parámetros PK/PD se han establecido a partir de los niveles plasmáticos de los antibióticos y no en función de las concentraciones en el foco o en el fluido gingival. No se han encontrado datos en la literatura científica sobre concentraciones de antibióticos en fluido gingival en población pediátrica, pero hay algunos datos en adultos. Amoxicilina alcanza aproximadamente la misma concentración en plasma y en fluido gingival69. Azitromicina70,71 y clindamicina72 alcanzan concentraciones más altas en la zona gingival que en plasma. En el caso de metronidazol, algunos autores han encontrado concentraciones más elevadas, pero en otros estudios los niveles han sido similares a los descritos en plasma73,74. En cualquier caso, Mouton et al75 explican en un artículo publicado recientemente que los valores de los índices de eficacia farmacocinéticos/farmacodinámicos que se utilizan actualmente se obtienen a partir de las concentraciones plasmáticas y que sería inadecuado inferir efectos similares de concentraciones tisulares o locales.
En nuestro estudio sólo se han incluido formulaciones convencionales administradas en dosis pediátricas. Sin embargo, en la actualidad se están comercializando nuevas formulaciones de liberación sostenida que presentan resultados prometedores en odontología. Es el caso de la nueva formulación de amoxicilina-ácido clavulánico 2.000/ 125 mg, cuya eficacia ha sido recientemente evaluada en adultos18,76. No hay formulaciones pediátricas de liberación sostenida ni estudios farmacocinéticos realizados en niños, por lo que no se han incluido en el estudio. No obstante, es necesario mencionar la importancia que puede tener en los próximos años el desarrollo de estas nuevas formulaciones que permitan mantener las concentraciones plasmáticas de los antibióticos por encima del punto de corte PK/PD establecido en cada caso, minimizando el número de administraciones diarias, mejorando el cumplimiento y disminuyendo los problemas relacionados con el uso de antibióticos.
En conclusión, en el caso de que esté indicado recurrir a la antibioterapia para el tratamiento de infecciones odontológicas en población pediátrica, entre las opciones terapéuticas disponibles en la actualidad, se recomienda la utilización de amoxicilina-ácido clavulánico en altas dosis de amoxicilina, aunque se puede utilizar como alternativa clindamicina. Por último, cabe decir que sería conveniente llevar a cabo ensayos clínicos que pudieran confirmar los resultados obtenidos. Sin embargo, la probabilidad de que se realicen ensayos clínicos en infecciones odontogénicas en población pediátrica es muy baja, de ahí, el gran interés de este tipo de simulaciones para obtener parámetros PK/PD indicativos de la eficacia de los tratamientos antimicrobianos.