La gripe estacional supone un desafío anual para los sistemas sanitarios debido a factores como la cocirculación de 2 subtipos de gripe A junto con otros 2 linajes de gripe B, la variación antigénica de estos virus, que escapan a la inmunidad natural y a la conferida por las vacunas, sumados al impacto que produce la gripe en la morbimortalidad. Las vacunas frente a la gripe están disponibles desde hace más de 70 años y han ido evolucionando en su formulación, fabricación y administración. Las recomendaciones de vacunación se centran en las personas con mayor probabilidad de enfermedad grave y son recomendaciones progresivamente más amplias, clásicamente basadas en las vacunas inactivadas, pero con una importancia creciente de vacunas vivas atenuadas. Entre las vacunas inactivadas van estando disponibles mejoras desde las vacunas adyuvadas y virosomales a las de administración intradérmica, de cultivo celular o las tetravalentes. La efectividad vacunal globalmente es del 65%, pero varía en función de las características de la vacuna, del virus, de la población y del objetivo que se persigue prevenir, yendo desde menos del 10% hasta casi el 90%. Los retos futuros son formulaciones que confieran una protección más extensa y duradera, así como el incremento de coberturas vacunales, especialmente en grupos como embarazadas y sanitarios o la población pediátrica.
Seasonal influenza is an annual challenge for health-care systems, due to factors such as co-circulation of 2 influenza A subtypes jointly with 2 influenza B lineages; the antigenic drift of these virus, which eludes natural immunity, as well as immunity conferred by vaccination; together with influenza impact in terms of morbidity and mortality. Influenza vaccines have been available for more than 70 years and they have progressed in formulation, production and delivery route. Recommendations on vaccination are focused on those with a higher probability of severe disease, and have a progressively wider coverage, and classically based on inactivated vaccines, but with an increasing importance of attenuated live vaccines. More inactivated vaccines are becoming available, from adyuvanted and virosomal vaccines to intradermal delivery, cell-culture or quadrivalent. Overall vaccine effectiveness is about 65%, but varies depending on characteristics of vaccines, virus, population and the outcomes to be prevented, and ranges from less than 10% to almost 90%. Future challenges are formulations that confer more extensive and lasting protection, as well as increased vaccination coverage, especially in groups such as pregnant women and health-care professionals, as well as being extended to paediatrics.
Las epidemias estacionales de gripe ocurren cada año producidas por variantes menores de los tipos A y B, de forma que en la infancia casi nadie escapa a estas infecciones que dejan inmunidad protectora exclusivamente frente a la cepa de virus infectante1–3. La norma es que los individuos sufran varios episodios gripales a lo largo de su vida. En cada uno de ellos se produce una respuesta inmune frente a las cepas que han infectado a un individuo, pero más acusada frente a la primera que le infectó, fenómeno descrito como pecado original antigénico gripal4. Podría indicarse como regla general que la gripe es una infección vírica estacional de mayor morbilidad en niños y personas jóvenes y mayor mortalidad en pacientes con enfermedades crónicas o ancianos5. Se estima que en Europa la mortalidad por gripe podría oscilar entre 8 por 100.000 habitantes y, en casos de epidemia estacional grave, podría alcanzar los 44 por 100.0006.
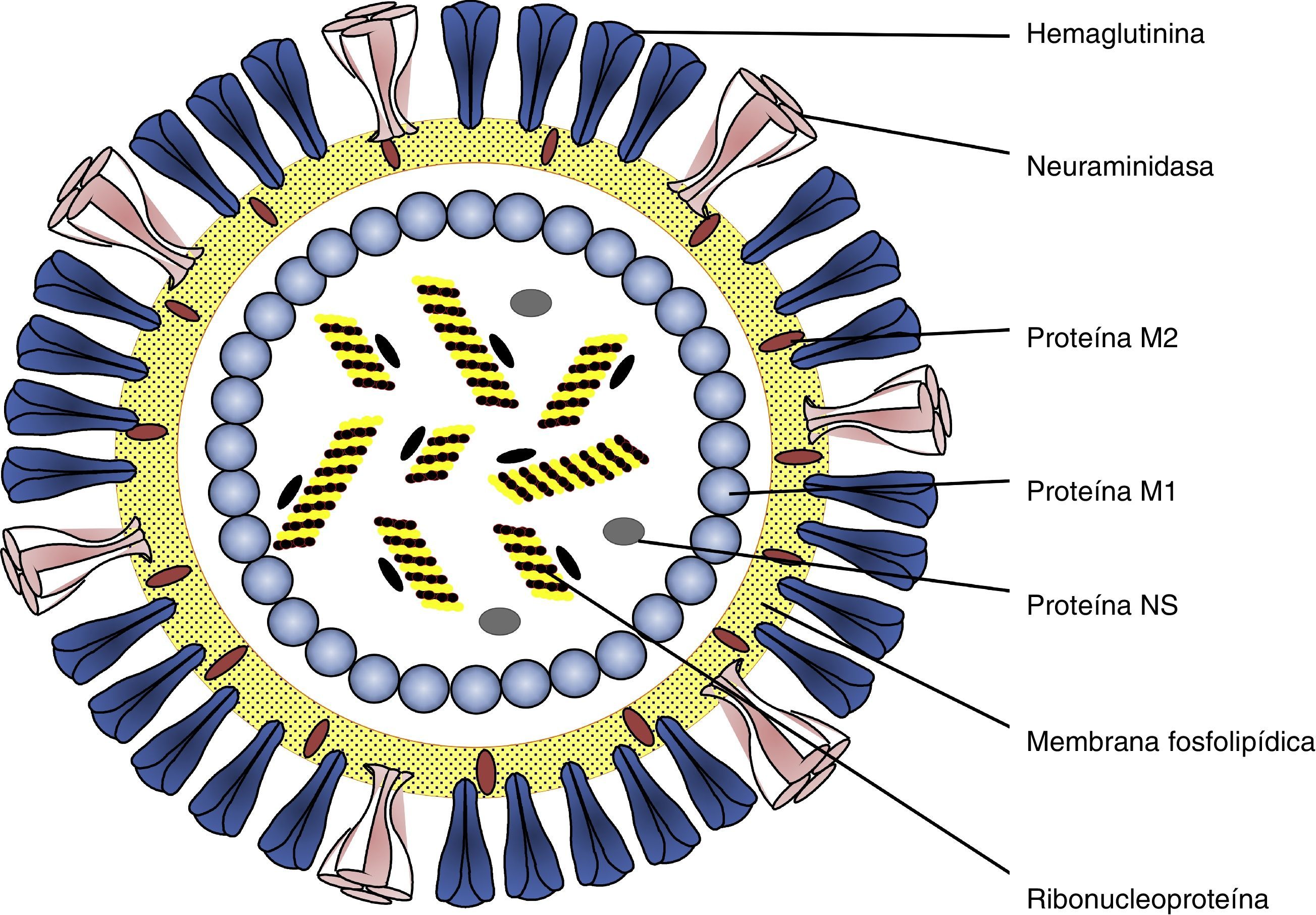
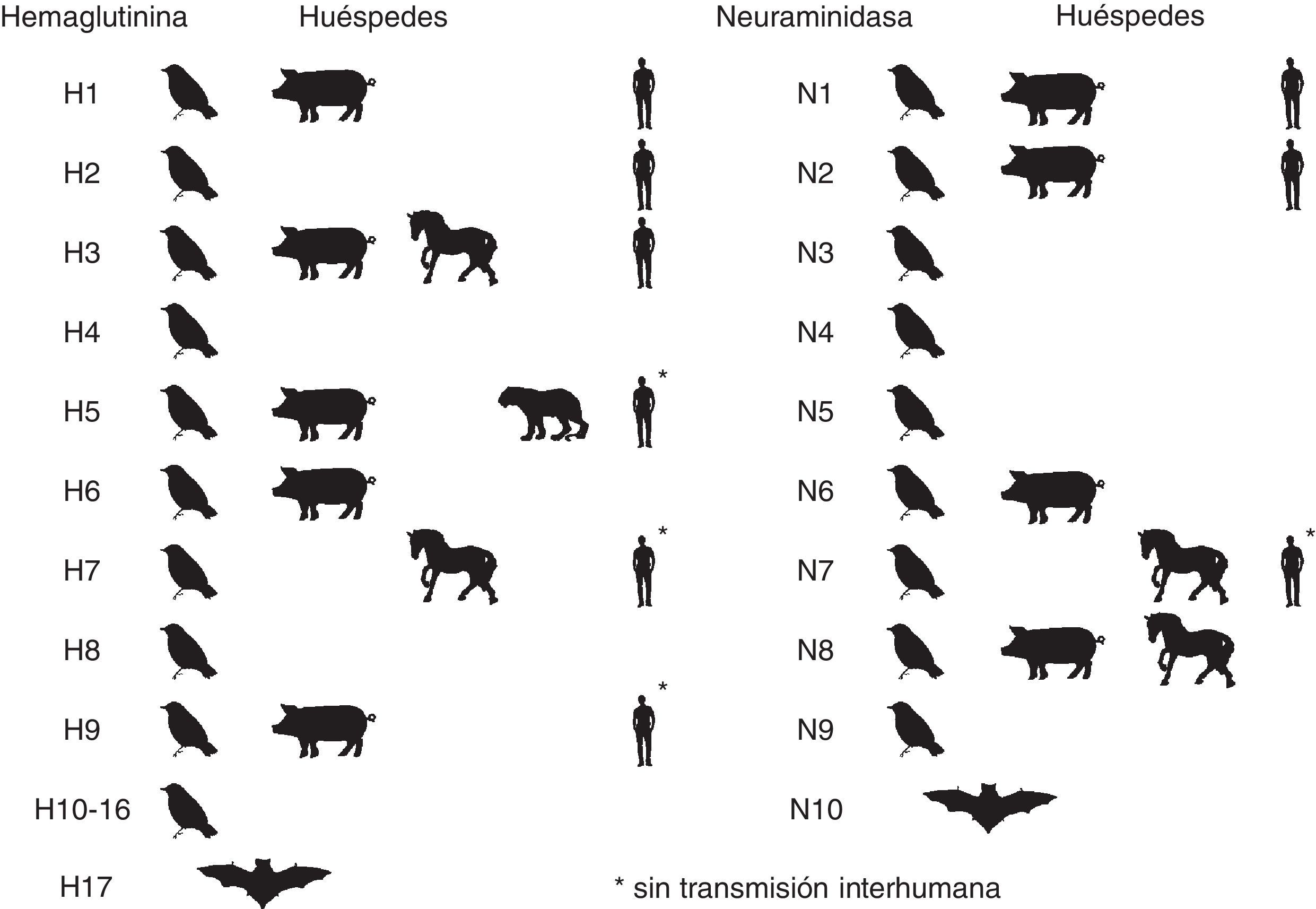
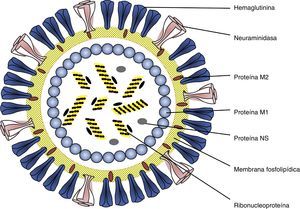
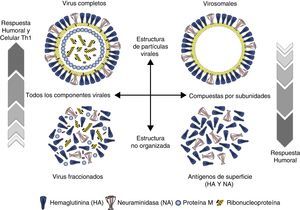
Etiología y epidemiologíaLos virus de la gripe mantienen su virulencia en la población humana gracias a su poder de evolución y su variabilidad antigénica en forma de variantes mayores y menores. Pertenecen a la familia Ortomyxoviridae virus con ARN monocatenario segmentado y espículas de hemaglutinina (HA) y neuraminidasa (NA) (fig. 1) que incluye géneros de virus de animales y humanos. El tipo A incluye distintos subtipos que responden a las combinaciones de los 17 tipos de HA y los 10 tipos de neuraminidasa NA descubiertos7,8 (H1N1, H2N2, H3N2, H5N1, H7N1, etc.). Desde el descubrimiento de los virus de la gripe solo 3 subtipos (H1N1, H2N2 y H3N2) han tenido una circulación sostenida y constante en población humana, ocasionando pandemias que coincidían con su emergencia (fig. 2). Las variantes mayores o «saltos antigénicos» solo ocurren en los virus de la gripe A y son responsables de la gripe pandémica. Estas variaciones se deben a la emergencia en la población de un subtipo nuevo de virus de la gripe A con un tipo nuevo y distinto de HA al difundido hasta entonces entre la población, frente al cual no hay inmunidad. Pueden producirse por reordenamiento genético entre 2 cepas de subtipos diferentes que infectan a un mismo huésped. Las cepas parentales pueden ser virus animales y humanos. Si el nuevo subtipo es capaz de infectar y transmitirse entre humanos de manera mantenida, eficaz y constante, tiene potencial pandémico. Otro mecanismo puede ser el salto de especie desde un huésped animal al hombre y continuar luego la transmisión interhumana. Los virus de la gripe tienen la facultad de franquear la barrera de especie desde los animales hasta el hombre, aunque la mayoría de las veces no se continúe la transmisión interhumana del virus.
Desde el descubrimiento del virus de la gripe A en 1933 se han descrito 3 subtipos pandémicos con distintos orígenes. Los virus H1N1 responsables de la pandemia de la gripe española de 1918 eran de origen fundamentalmente aviar. La pandemia de gripe asiática por el subtipo H2N2 se produjo en 1957 por un recombinante aviar y tuvo un periodo muy breve de estacionalización, ya que en 1968 fue sustituido por el subtipo H3N2, responsable de la llamada gripe de Hong Kong, originado también por reordenamiento genético con genes de la HA de origen aviar. Sus variantes menores continúan actualmente circulando y causando epidemias anuales. En 1977 apareció en la antigua Unión Soviética un subtipo H1N1 (A/USSR/90/77) no pandémico con genes distintos al de la pandemia de 1918. Este virus cocirculó en las epidemias estacionales con las variantes menores del subtipo H3N2 de 1968 y obligó al desarrollo de vacunas trivalentes de gripe (con 2 subtipos, H1 y H3, de virus A y una cepa B). La aparición en 2009 del virus pandémico de origen porcino H1N1pdm, responsable de la llamada pandemia de gripe A, eliminó por completo la circulación humana de aquel subtipo H1N1 ruso cuyo origen no está suficientemente aclarado9.
Los virus de la gripe producen epidemias estacionales en los meses fríos con una duración aproximada de entre 7 y 10 semanas10. Dichas epidemias están producidas tanto por virus de la gripe A como B o por ambos tipos que circulan simultáneamente. Los virus de la gripe A tras su aparición pandémica (subtipos nuevos) se estacionalizan y evolucionan de forma paulatina en las sucesivas ondas estacionales al infectar a huéspedes humanos11. Una de las consecuencias biológicas de dicho proceso es la deriva antigénica, responsable de los cambios antigénicos de las variantes menores, que se seleccionan cuando confieren al virus una ventaja evolutiva en su circulación humana12, haciendo que la inmunidad frente a esa variante no sea extensible a las posteriores. Las variantes menores dentro de un mismo subtipo reciben nombres diferentes en los que se refleja su origen geográfico y año de aparición (p. ej. A/California/7/2009 H1N1pdm, A/St. Petesbourg/100/2013 H1N1pdm).
Estas variaciones ocurren también en el virus de la gripe B, más antiguo desde el punto de vista filogenético y más adaptado a la especie humana. Los virus de la gripe B que hasta el inicio de los 70 solo experimentaban variaciones menores y cada varios años, iniciaron una divergencia antigénica que se hizo muy patente a partir de los 90 con la circulación de 2 linajes diferentes de virus de la gripe B (linaje Victoria y linaje Yamagata), cada uno con sus variantes menores diferenciadas. La inmunidad entre estos 2 linajes de gripe B no guarda una correlación protectora suficiente.
El virus de la gripe C no experimenta variación antigénica similar y solo es responsable de casos esporádicos respiratorios de vías altas, sin potencial pandémico ni epidémico estacional.
Vacunación de gripe y respuesta inmuneRecomendaciones de vacunaciónLa vacunación de gripe anual es la medida más utilizada y efectiva para prevenir la aparición de la enfermedad y limitar su difusión entre colectivos con riesgo de complicaciones7. La mayoría de los países desarrollados cuenta con programas de vacunación anual y recomendaciones parecidas (tabla 1). En las pasadas 4 décadas los esfuerzos de control sobre la enfermedad se centraron en aquellos grupos en los que la aparición de posibles complicaciones, como consecuencia de la infección gripal, podían ser graves o incluso mortales. Las personas de cualquier edad que padecían una enfermedad crónica subyacente fueron las primeras y más universales dianas poblacionales, seguidas de las personas >65 años, por la posibilidad de enfermedad encubierta y fragilidad biológica.
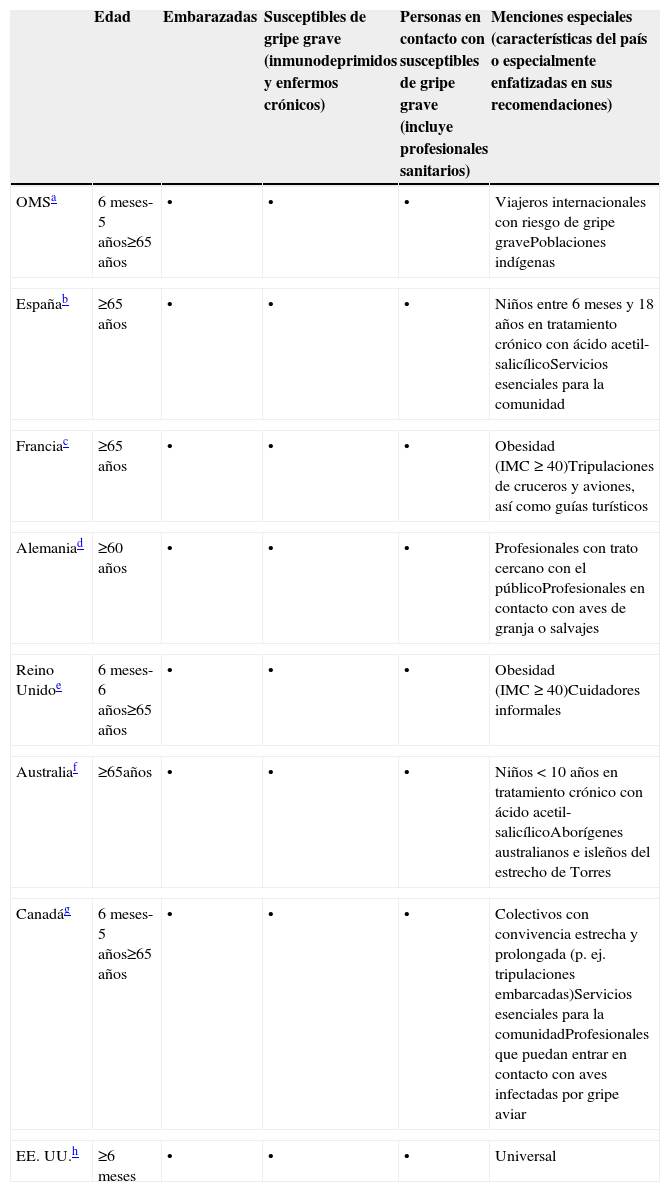
Recomendaciones oficiales de vacunación antigripal de la Organización Mundial de la Salud (OMS) y de diversos países
| Edad | Embarazadas | Susceptibles de gripe grave (inmunodeprimidos y enfermos crónicos) | Personas en contacto con susceptibles de gripe grave (incluye profesionales sanitarios) | Menciones especiales (características del país o especialmente enfatizadas en sus recomendaciones) | |
|---|---|---|---|---|---|
| OMSa | 6 meses-5 años≥65 años | • | • | • | Viajeros internacionales con riesgo de gripe gravePoblaciones indígenas |
| Españab | ≥65 años | • | • | • | Niños entre 6 meses y 18 años en tratamiento crónico con ácido acetil-salicílicoServicios esenciales para la comunidad |
| Franciac | ≥65 años | • | • | • | Obesidad (IMC ≥ 40)Tripulaciones de cruceros y aviones, así como guías turísticos |
| Alemaniad | ≥60 años | • | • | • | Profesionales con trato cercano con el públicoProfesionales en contacto con aves de granja o salvajes |
| Reino Unidoe | 6 meses-6 años≥65 años | • | • | • | Obesidad (IMC ≥ 40)Cuidadores informales |
| Australiaf | ≥65años | • | • | • | Niños<10 años en tratamiento crónico con ácido acetil-salicílicoAborígenes australianos e isleños del estrecho de Torres |
| Canadág | 6 meses-5 años≥65 años | • | • | • | Colectivos con convivencia estrecha y prolongada (p. ej. tripulaciones embarcadas)Servicios esenciales para la comunidadProfesionales que puedan entrar en contacto con aves infectadas por gripe aviar |
| EE. UU.h | ≥6 meses | • | • | • | Universal |
Strategic Advisory Group of Experts (SAGE) on Immunization. Vaccines against influenza - WHO position paper. Noviembre 2012.
Recomendaciones de vacunación antigripal, temporada 2014-2015. Ponencia de Programa y Registro de Vacunaciones. Ministerio de Sanidad, Servicios Sociales e Igualdad.
Grippe Saisonnière 2014-2015. Direction Générale de la Santé. Ministère des Affaires Sociales, de la Santé et des Droits des Femmes.
Recommendations of the Standing Committee on Vaccination (Ständige Impfkommission, STIKO) en el Robert Koch Institute. Agosto 2014.
Annual Flu Program. Public Health England. United Kingdom Government. Última actualización: 27 de marzo de 2015.
Paulatinamente la edad para la recomendación de la vacuna antigripal se ha reducido, aproximándose a los 50 años como una estrategia más conservadora para cubrir una mayor parte de la enfermedad crónica subyacente, no conocida ni sospechada, por encima de esa edad13. La vacunación está asociada con una reducción de las enfermedades respiratorias relacionadas con la gripe así como de consultas médicas en todos los grupos etarios. También reduce las hospitalizaciones y la muerte en personas de alto riesgo, la otitis media en niños y el absentismo laboral en adultos.
En Estados Unidos existen recomendaciones oficiales de vacunación universal de gripe a partir de los 6 meses de edad y en Canadá son tan amplias que abarcan prácticamente a toda la población. En Europa los documentos de recomendaciones sobre vacunación gripal que se elaboran periódicamente utilizan 2 criterios principales para las poblaciones diana: la existencia de enfermedad crónica o de afecciones o estados que hagan más vulnerable al individuo ante una gripe y el criterio de edad, con recomendaciones específicas a partir de determinadas edades que son distintas para cada país14.
En España las indicaciones que usan los criterios de enfermedad crónica y otras condiciones de vulnerabilidad aumentada ante gripe son similares a las de otros países, e incluyen desde hace años a las gestantes15. El criterio de edad oscila entre comenzar a los 60 o a los 65 años, según las diferentes comunidades autónomas.
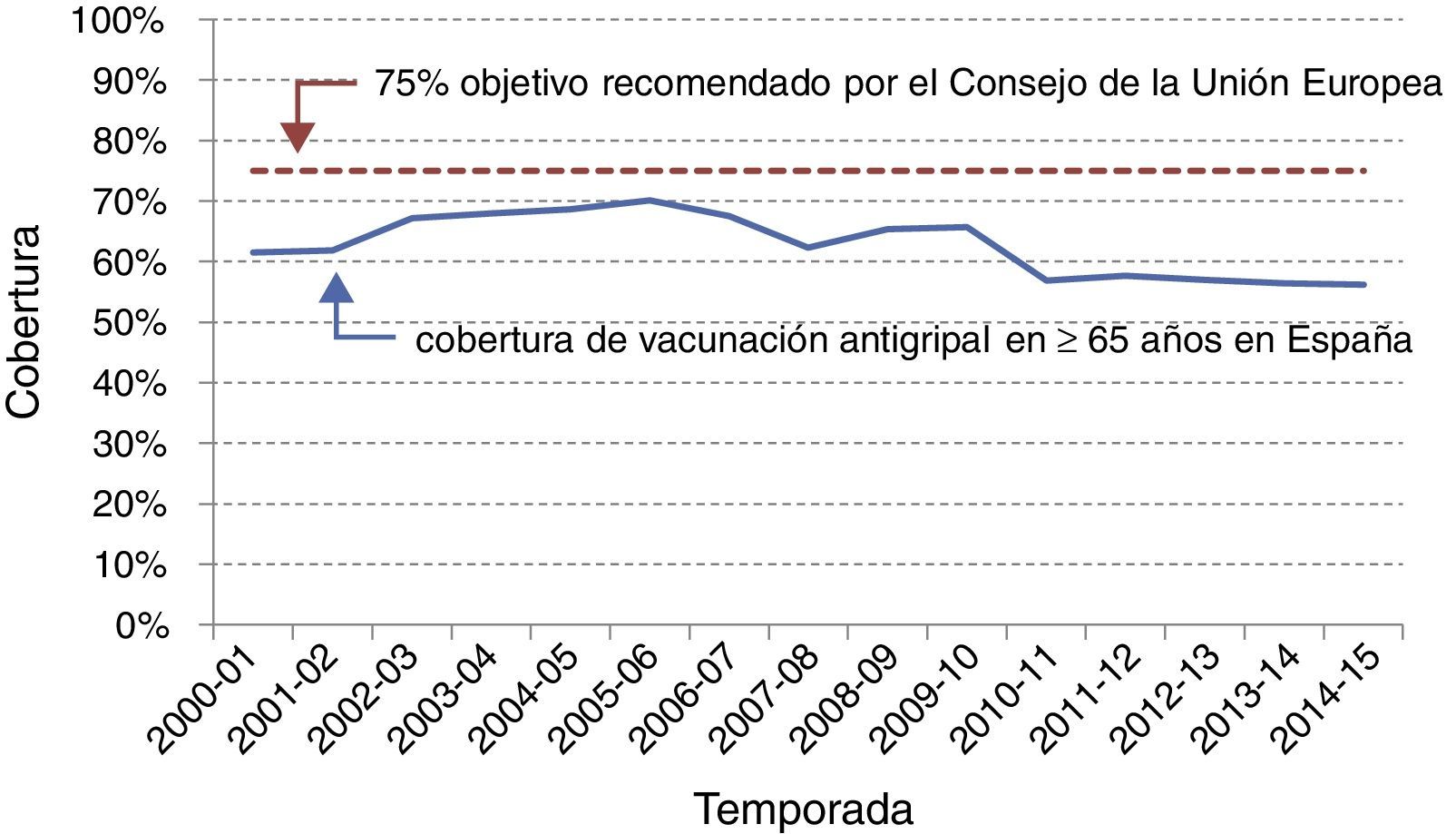
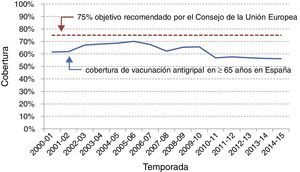
A pesar de que existen variaciones importantes entre las diferentes comunidades autónomas españolas con políticas vacunales propias, España es uno de los países de Europa con coberturas de vacunación gripal más elevadas en los mayores (fig. 3), solo por detrás de Holanda y Reino Unido y en niveles similares a Irlanda, Italia y Francia14. La estimación de la cobertura en otros grupos poblacionales (enfermos crónicos, embarazadas, etc.) es más compleja y no siempre está disponible, pero en general se alcanzan peores coberturas que en los mayores.
Inmunidad natural e inmunidad conferida por la vacunaLa infección natural de la gripe confiere inmunidad de por vida frente a la variante menor responsable2. Aunque no se conocen completamente todos los mecanismos que influyen en ella, la respuesta celular juega un papel importante al respecto. La protección conferida por la respuesta humoral anti-HA es de larga duración, sin embargo, las variaciones menores del virus limitan la duración de la protección conferida que, según la importancia de la deriva antigénica, se ha cifrado entre 1 y 5 años. Tras la infección natural aparecen anticuerpos protectores frente a la HA y la NA, así como otros frente a la nucleoproteína del virus y la proteína M, específicos de tipo y no estrictamente protectores. Las IgA secretoras son una defensa importante frente a la infección a nivel mucoso que impide la infección. Los Ac. anti-HA neutralizan la infectividad del virus, mientras los anti-NA limitan su difusión en el tracto respiratorio.
En la gripe A, la respuesta humoral está influida durante toda la vida por la primera experiencia antigénica. Las infecciones por subtipos distintos ocasionan una nueva respuesta primaria y cada infección nueva por variantes menores de un mismo subtipo produce, además, una respuesta anamnésica frente a la primera cepa que infectó al individuo.
En la vacunación frente a la gripe la respuesta inmune es distinta, ya que los Ac. que se producen están fundamentalmente dirigidos contra la HA, son neutralizantes con, en general, una menor respuesta de base celular o frente a otros elementos del virus distintos de la HA. Los Ac. dirigidos contra proteínas internas del virus (M2e, NA, M) pueden contribuir al aclaramiento viral vía opsonización o por respuesta celular mediada por Ac., que puede tener efecto en la difusión sistémica del virus.
El porcentaje de población protegida tras la vacunación anual disminuye con el tiempo sin que se pueda precisar con exactitud qué personas continúan protegidas al cabo de un año, por lo que se recomienda la vacunación anual incluso en los supuestos en que la formulación de los virus que componen la vacuna sea igual a la del año anterior.
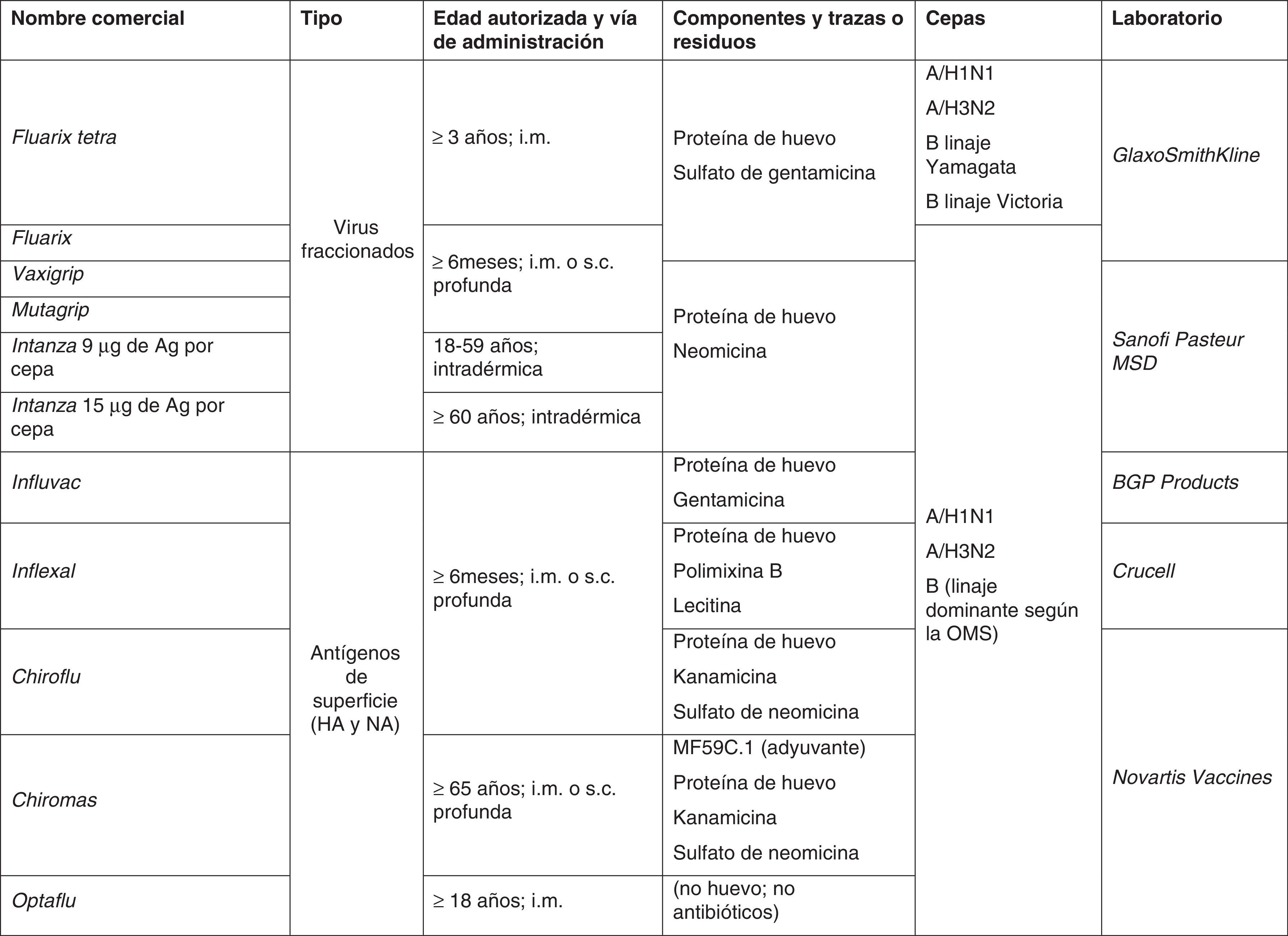
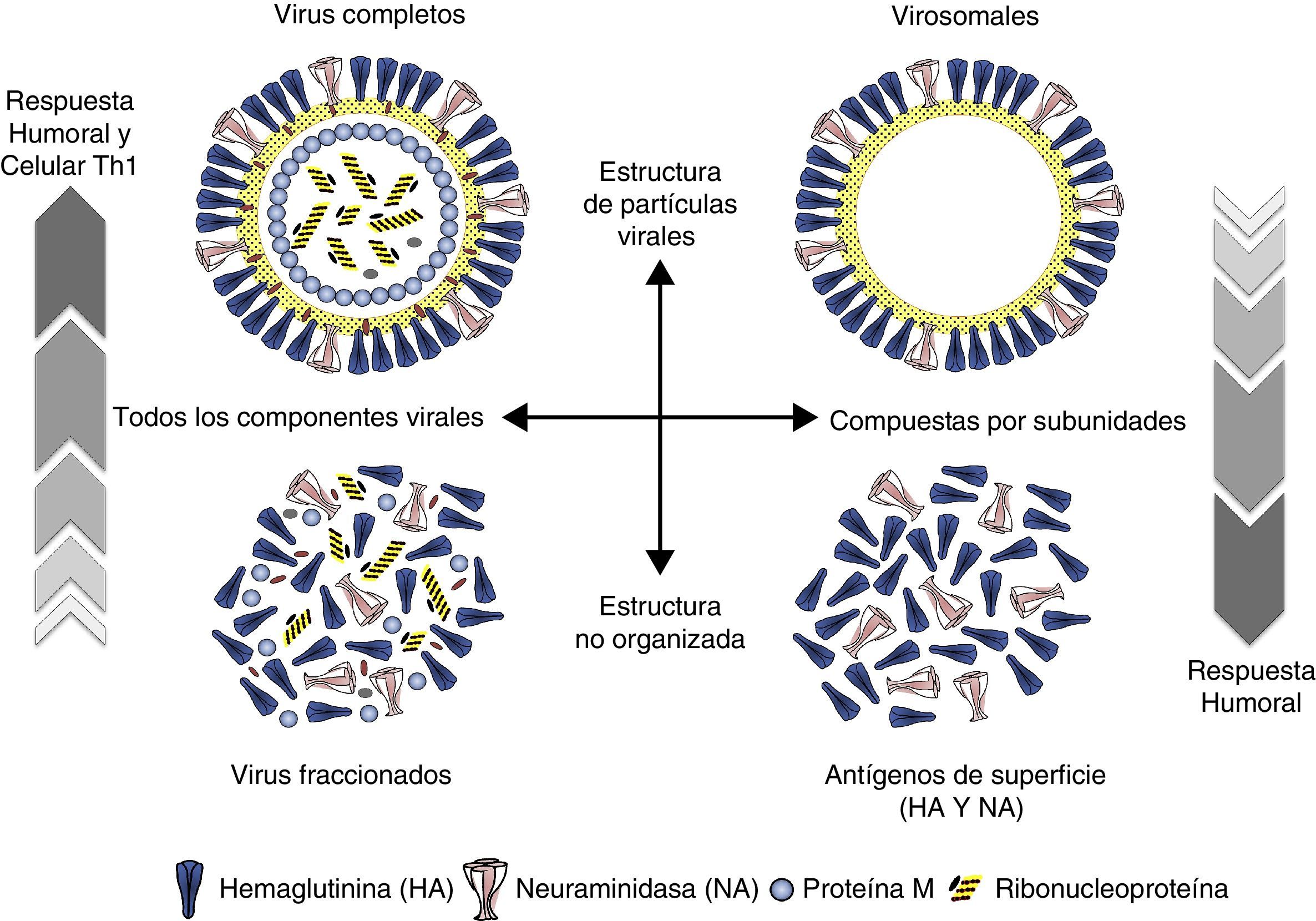
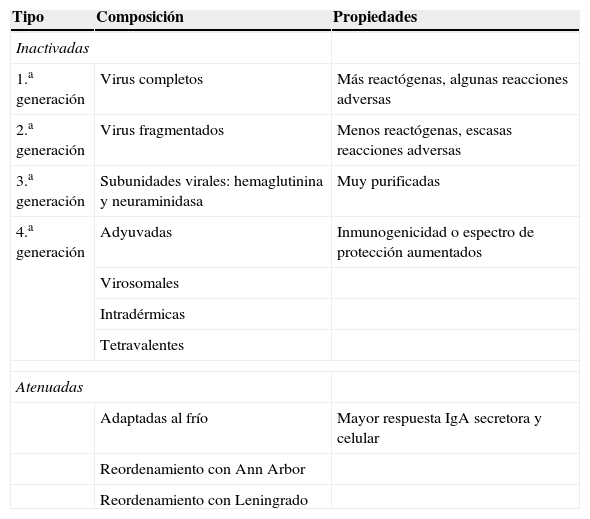
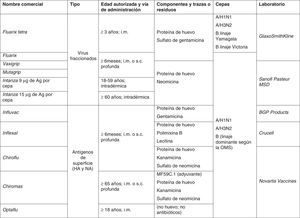
Tipos de vacunas frente a la gripeLas vacunas de gripe se clasifican de manera general en 2 grandes grupos: vacunas de virus inactivados (VVI) y de virus vivos atenuados (VVA) (tabla 2). En general en Europa, con la excepción de Rusia y recientemente algún otro país como Reino Unido y Alemania, tienen más aplicación clínica las vacunas de gripe inactivadas. La mayoría de vacunas que se emplean en los países europeos con programas específicos de vacunación, incluida España, utilizan vacunas inactivadas en cualquiera de sus formulaciones: virus enteros, fraccionados o vacunas de subunidades. En general todas ellas tienen un rango de edad de utilización desde los 6 meses en adelante con algunas excepciones (fig. 4).
Tipos de vacunas antigripales
| Tipo | Composición | Propiedades |
|---|---|---|
| Inactivadas | ||
| 1.a generación | Virus completos | Más reactógenas, algunas reacciones adversas |
| 2.a generación | Virus fragmentados | Menos reactógenas, escasas reacciones adversas |
| 3.a generación | Subunidades virales: hemaglutinina y neuraminidasa | Muy purificadas |
| 4.a generación | Adyuvadas | Inmunogenicidad o espectro de protección aumentados |
| Virosomales | ||
| Intradérmicas | ||
| Tetravalentes | ||
| Atenuadas | ||
| Adaptadas al frío | Mayor respuesta IgA secretora y celular | |
| Reordenamiento con Ann Arbor | ||
| Reordenamiento con Leningrado | ||
Las VVI antigripales disponibles se pueden clasificar en distintas categorías en función de su composición antigénica y del sistema de preparación empleado. Las primeras desarrolladas fueron las vacunas con virus enteros compuestas por suspensiones purificadas de viriones completos inactivados. Posteriormente se desarrollaron las vacunas con virus fraccionados aprobadas por vez primera en 1968 en EE. UU. Son suspensiones purificadas de viriones fraccionados por la acción de detergentes que se han aplicado de forma diferente según los países productores: Tween80-éter y tri(n-butyl) fosfato en EE. UU.; Triton N101, CTAB (cetyl trimethyl ammonium bromide) y Tween80-éter en Europa y desoxicolato sódico en Australia. Estas vacunas contienen la HA, la NA y parte de la nucleoproteína y proteína M. Más tarde se obtuvieron las vacunas de subunidades o vacunas de antígenos superficiales. Son vacunas obtenidas por fraccionamiento y purificación diferencial zonal, que contienen solo los antígenos de superficie unidos por sus extremos lipófilos. Se acepta que estas últimas son menos reactógenas que las vacunas de virus fraccionados o las de virus enteros (fig. 5).
En todas las VVI la valoración farmacológica se hace indicando los microgramos de HA del virus que contienen. La mayoría de las vacunas de gripe inactivadas contienen 15μg de HA de cada cepa de virus de la vacuna. Por tanto, una vacuna trivalente contiene 45μg de HA. La excepción han sido las vacunas monovalentes pandémicas de 2009 y las prepandémicas animales, que solo contienen un virus en su formulación.
Sobre este concepto básico del diseño primitivo de las vacunas, en los últimos 15 años se han ido añadiendo modificaciones para mejorar su antigenicidad (fidelidad y similitud con las cepas salvajes) y su inmunogenicidad (respuesta celular o frente a heterovariantes) mediante el uso de adyuvantes, la vehiculización virosomal o la vía de administración intradérmica.
Vacuna de gripe adyuvadaLas vacunas adyuvadas surgen para incrementar la respuesta inmune tras la vacunación de gripe, los adyuvantes se usan desde hace tiempo también en otras vacunas además de las de gripe. A los antígenos gripales de la formulación vacunal se incorpora una sustancia que incrementa la respuesta inmunitaria. El más experimentado y de seguridad probada en vacunas de gripe es el MF5916, una emulsión con un bajo contenido oleoso, no viscosa y fácil de inyectar. El aceite es el escualeno, sustancia que se encuentra en las plantas y en el hígado de diversas especies animales, incluido el ser humano. El escualeno es un componente natural de las membranas celulares, un producto intermedio en la vía de la biosíntesis para la producción de las hormonas esteroideas humanas y un precursor sintético directo del colesterol. El MF59 contiene también 2 surfactantes no iónicos, Tween 80 y Span 85, que sirven para estabilizar de manera óptima las gotas de la emulsión del MF59. Este adyuvante induce la secreción de citocinas, aumentando el reclutamiento de células inmunitarias en el lugar de inyección, lo cual permite una mayor captación del antígeno por los monocitos en el sitio de inyección y finalmente su diferenciación hacia células dendríticas, que constituyen el tipo celular de referencia para el cebado de los linfocitos T sin activación previa16,17.
La vacuna adyuvada induce una respuesta inmune de larga duración de las células de memoria17, niveles elevados de anticuerpos protectores17–19 y un mayor grado de inmunización cruzada20 y se ha ensayado su efectividad en niños21,22. Otro probado inmunodayuvante en gripe es el AS03, recientemente ensayado en niños23. A pesar de ello, no hay publicaciones que demuestren la posibilidad de obviar la vacunación anual, ni siquiera aunque la formulación de virus de la vacuna sea idéntica a la del año precedente.
Vacuna de gripe virosomalLas vacunas virosomales están elaboradas utilizando compuestos fosfolípidicos (fosfatidilcolina y fosfatidiletanolamina) para formar vesículas bilaminares de 150nm de diámetro en las que se disponen la HA y la NA del virus vacunal. Esta formulación permite tener vacunas que imitan la estructura y disposición de las de virus enteros (fig. 5) sin el componente reactógeno de las proteínas internas del virus, pero simulando viriones completos que modifican la vía de procesamiento del antígeno, lo cual se traduce en una inmunogenicidad reforzada24,25.
Vacuna de gripe intradérmicaUna barrera para la vacunación gripal en algunas personas estriba en el rechazo a agujas e inyecciones. Beckton Dickinson desarrolló un sistema de microinyección capaz de administrar un tipo de VVI de subunidades en la dermis mediante una microaguja de solo 1,5mm de longitud. Esta vía permite que el antígeno del virus entre en contacto directo con las células dendríticas de la piel y las de Langerhans, lo que se traduce en una inmunogenicidad reforzada ya que son responsables del procesamiento y presentación del Ag al sistema inmune26. Con la vacunación intradérmica se observa una reactogenicidad diferente a la de la administración clásica subcutánea o intramuscular, con mayor proporción de reacciones eritematosas mayores de 5cm de diámetro durante más de 3 días y fiebre mayor de 24 h (0,2 vs. 0% y 1,5 vs. 0%, respectivamente)27.
Este tipo de vacuna intradérmica ha impulsado la investigación sobre su posible autoadministración. Existen 2 formulaciones diferentes en la cantidad de antígeno hemaglutinante, una de 15μg para personas mayores de 60 años y otra con 9μg indicada para personas de 18 a 59 años28.
Vacuna tetravalente de gripeDesde 2004 se hizo evidente la dificultad de predecir la dominancia de uno de los 2 linajes existentes de virus B (Yamagata y Victoria) que aparecieron a finales de los 80. La diferencia antigénica es tal, que la inmunización frente a una cepa de uno de los 2 linajes no produce suficiente respuesta cruzada frente al otro y su deriva antigénica es distinta. Además, la prevalencia de estos 2 linajes varía anualmente, de una región geográfica a otra y hay años que circulan los 2 linajes en la misma estación gripal. Estos factores hacen que algunos años la cepa estacional B dominante no coincida con la incluida en la vacuna. Dicho fenómeno se conoce como discordancia o mismatch antigénico y es el principal responsable de la disminución de eficacia de la vacuna. La inclusión en la vacuna estacional de 2 cepas de gripe B, una de cada linaje, incrementa la protección y resuelve el problema apuntado. Estos hechos han dado recientemente lugar a la producción y desarrollo de una vacuna tetravalente con 2 cepas B y 2 cepas A (una del subtipo H1 pospandémico y otra del subtipo H3) en lugar de la mayoría de las trivalentes actuales. Recientemente se han autorizado estas vacunas tetravalentes que, según algunos modelos, podrían aumentar la protección frente a la gripe B entre un 18 y un 19%, según el rango de edad29.
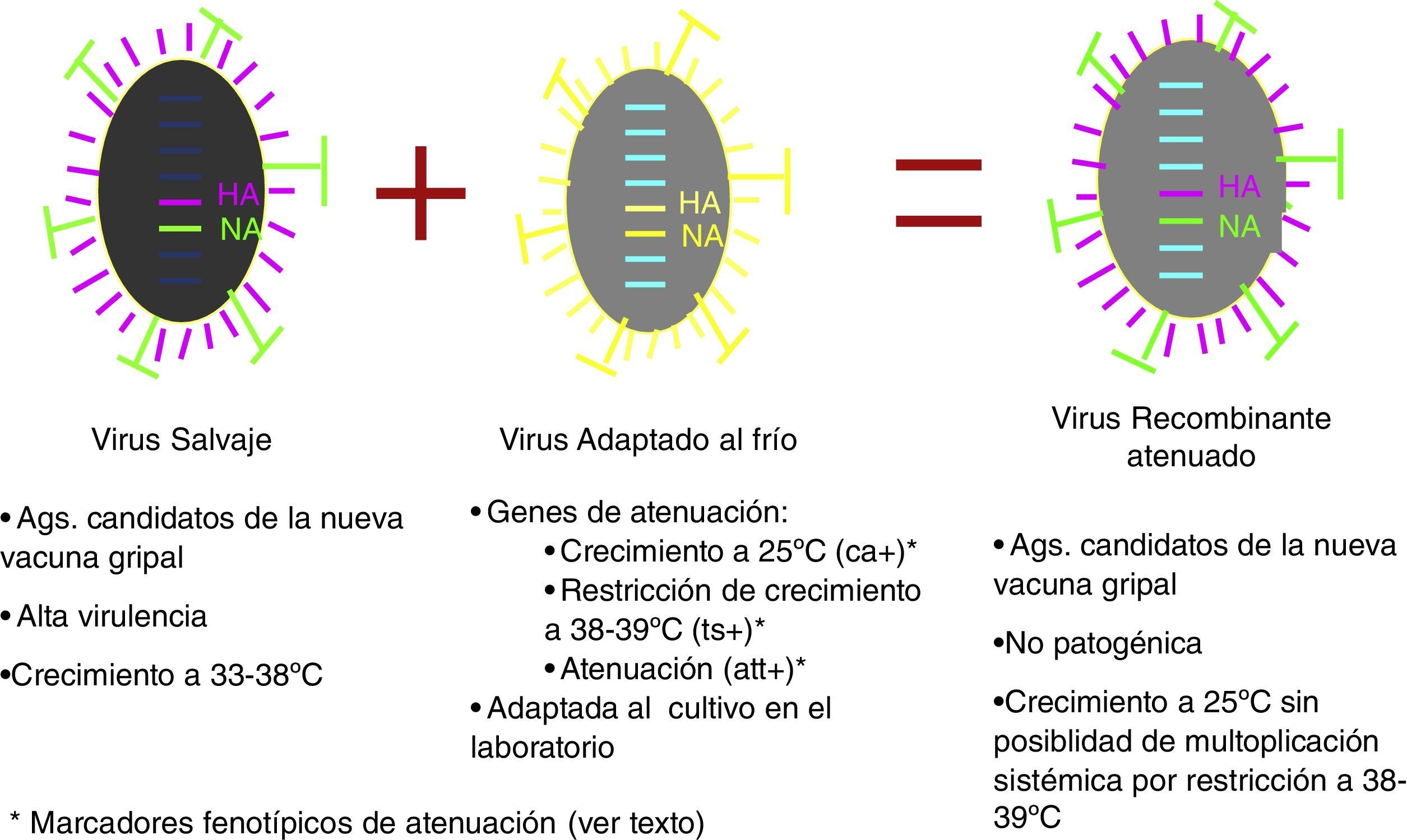
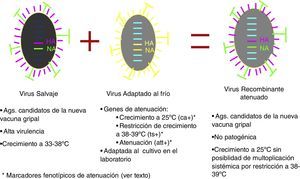
Vacunas de gripe atenuadasEl otro grupo conceptualmente diferente de vacunas lo constituyen las vacunas fabricadas con virus vivos atenuados. Los mecanismos de atenuación responden a 3 características fenotípicas de los virus utilizados en su fabricación: virus gripales capaces de multiplicarse a 25°C temperatura restrictiva para el crecimiento de los virus salvajes (marcador fenotípico cold adapted [ca+]). La segunda característica es la capacidad restringida (>2log10) de crecer a 38-39°C (marcador fenotípico temperature sensible [ts+]) y la tercera característica fenotípica es su atenuación (marcador fenotípico attenuation [att]), definido como la replicación restringida en el tracto respiratorio inferior de animales de experimentación. Los virus así obtenidos, administrados por instilación nasal, se multiplican activamente en el tracto respiratorio superior, induciendo una buena respuesta inmunitaria secretoria sin posibilidad de difundir al resto del organismo. En España y Europa se encuentran autorizadas estas vacunas; las ventajas que aporta su uso son la inducción de una respuesta inmunitaria a nivel de mucosas próxima al modelo de infección natural30, una administración intranasal «no agresiva», junto al potencial beneficio de reducción de la diseminación de virus en el contexto epidémico, al impedir la multiplicación mucosa del virus (fig. 6)31,32.
Los primeros ensayos clínicos se publicaron en la década de los 7033,34 y se llevaron a cabo en casi 54.000 niños en los que las reacciones adversas significativas fueron poco prevalentes, con una aceptable eficacia vacunal. A través de estos estudios quedó probado que era posible obtener, de forma estable y protocolizada, cepas recombinantes que incorporasen, por una parte, varios genes de una cepa donante con atenuación por restricción del rango de temperatura de crecimiento y, por otra, los genes codificantes de la HA y NA de las cepas salvajes causantes de cada epidemia estacional35,36. Las cepas que proporcionan los genes de crecimiento restringido a baja temperatura son la A/Leningrad/134/17/57 (H2N2) y la B/USSR/60/69 y las americanas A/Ann Arbor/6/60 (H2N2) y B/Ann Arbor/1/66 (tabla 2). Todas ellas poseen los marcadores fenotípicos de atenuación en los que participan distintas mutaciones de segmentos de RNA que no codifican ni la HA ni la NA del virus.
Elaboración de las vacunas de gripeEn el mes de febrero de cada año la OMS toma la decisión sobre las cepas que deben componer la vacuna que se administrará el invierno siguiente (8 meses después de dicha decisión). Los productores de vacuna reciben las cepas de virus gripal que han sido aisladas en embriones de pollo y las hacen crecer como mínimo 3 veces a una baja multiplicidad de infección para asegurarse de que el efecto de dilución elimine trazas de microorganismos o agentes que puedan haber pasado con la semilla vacunal. Desde 1971 se obtienen recombinantes de nuevas cepas a partir de cepas parentales de alta eficacia de crecimiento y de cepas que tienen los antígenos seleccionados para la vacuna. El resultado de estos procesos se traduce en la obtención por reordenamiento genético de virus gripales de alta eficacia de replicación con los antígenos adecuados para la vacunación. Estos son utilizados como semilla para elaborar vacunas. Tras la incubación para obtener virus, se enfrían hasta 4°C y se extrae el líquido alantoideo; esta operación se lleva a cabo eliminando todos los embriones muertos o contaminados mediante el examen luminoso de las características vitales de cada embrión. Los pooles obtenidos procedentes de la extracción de todos los líquidos alantoideos de una cepa vacunal necesitan ser clarificados primero e inactivados después mediante formaldehído o beta-propiolactona. La mayoría de las vacunas se produce utilizando como sustrato de crecimiento del virus el embrión de pollo. Aproximadamente cada huevo inoculado es capaz de producir 45μg de virus vacunal.
En años recientes se han producido vacunas que utilizan distintos sustratos celulares de distintos orígenes (células de mamíferos MDCK, Vero, insectos SPf, etc.). El virus así crecido no presenta trazas de albúmina aviar y, dado que no tiene que adaptarse al crecimiento en huevo, no sufre cambios en la glicosilación de la HA. Las poblaciones víricas que se producen son más parecidas a la cepa salvaje. La OMS hizo recomendaciones al respecto en la temporada 2013-2014, ya que la cepa del subtipo H3 que recomendó como semilla para la elaboración de vacuna debía ser similar a la obtenida en cultivo celular37.
Otro aspecto destacable es la mayor flexibilidad y capacidad de producción de vacuna celular en caso de necesidades incrementadas (pandemia, desabastecimientos por imposibilidad de crecimiento en huevo, etc.). El uso de biorreactores en los que se hace un cultivo celular continuo del virus evita la previsión y compra anticipada de huevos embrionados que limitan el proceso de fabricación. Por otra parte, las líneas celulares empleadas han sido objeto de numerosos tests para comprobar su restricción al crecimiento de otros virus. Además, el uso de células que pueden crecer en ausencia de suero bovino o fetal hace que no alberguen sustancias derivadas de origen animal o humano.
Efectividad de las vacunas actualesDebido a la deriva antigénica, la vacuna antigripal es de facto una nueva vacuna cada temporada con las incertidumbres consiguientes en términos de eficacia y efectividad. Las pruebas de eficacia de la vacunación antigripal se realizan mediante ensayos clínicos que deben realizarse cada año en alrededor de 200 sujetos sanos. En estos ensayos se mide la respuesta inmune humoral frente a las cepas vacunales, con el fin de comprobar que las vacunas cumplen los requerimientos de la Agencia Europea del Medicamento (European Medicines Agency [EMA])38. En adultos entre 18 y 59 años se exige que las vacunas confieran títulos de Ac. anti-HA superiores a 1:40 en al menos el 70% de los vacunados, tasas de seroconversión de al menos el 40% de los vacunados y un incremento en el título de Ac. anti-HA de al menos 2,5. En mayores de 65 años los requerimientos en seroprotección son de al menos el 60%, los de seroconversión son del 30% y el incremento del título de al menos 2. Los criterios de la EMA están en revisión ya que no se han definido criterios, por ejemplo, para niños ni para vacunas atenuadas.
La efectividad vacunal (EV) de la vacuna antigripal tiene una alta variabilidad en función de aspectos relacionados con la vacuna, como la similitud entre las cepas vacunales y las circulantes salvajes, el tipo de vacuna (atenuada o inactivada), la presencia de adyuvantes o la vía de administración. Además, existen también 3 aspectos fundamentales no directamente relacionados con la vacuna en sí: el virus (su transmisibilidad, su virulencia, su comportamiento epidemiológico), el individuo (edad, comorbilidad, riesgo de exposición) y el objetivo de prevención perseguido (diagnóstico confirmado, enfermedad clínica, complicaciones o fallecimientos)39.
En los últimos años han proliferado los metaanálisis y revisiones sistemáticas sobre la EV frente a la gripe. La EV global, con independencia de los factores expuestos anteriormente, se estima en el 65%40. Esto significa que en epidemias estacionales, en las que la tasa de ataque en no vacunados se estima alrededor del 10%, de cada 30 personas, 3 podrían padecer la gripe; vacunando a esas 30 personas se prevendrán 2 episodios de gripe (número necesario de pacientes a tratar [NNT]=15), pero una de cada 30 padecerá la gripe a pesar de estar vacunada.
Por grupos de edad, en los niños la EV de las vacunas inactivadas es del 48-49%, con escasa variación en función de la existencia o no de un mismatch entre cepas vacunales y circulantes durante la temporada gripal. Las vacunas vivas atenuadas tienen una EV en niños que es globalmente del 80%. Este porcentaje oscila entre el 60% para proteger frente a cepas diferentes de las vacunales y el 88% para prevenir de la gripe en temporadas con buena concordancia entre cepas vacunales y circulantes. En particular, en los niños en los que se recomienda el uso de vacunas atenuadas, entre los 24 y 59 meses, se ha observado que la EV de las vacunas atenuadas dobla la de las vacunas inactivadas41. Como consecuencia, también se encuentra una mejor relación de coste-efectividad para el uso de vacunas atenuadas que para las inactivadas en esta edad42.
La EV de las vacunas inactivadas en adultos sanos, con edades entre 16-18 y 59-65 años, según los estudios, oscila en función de la existencia de mismatch en la temporada. La EV para prevenir gripe confirmada por laboratorio fue del 62-75% en temporadas con buena concordancia entre cepas vacunales y circulantes, si bien fue inferior, del 50-51%, en temporadas con discrepancias43,44. Cuando se evalúa la EV para prevenir síndrome gripal, la inespecificidad de esta medida hace caer la EV hasta el 16% en algunos estudios.
En el tercer grupo de edad, los mayores de 65 años, la EV es inferior que en edades más jóvenes, lo que ha generado cierta controversia respecto a la protección que confieren las vacunas en este grupo de edad45. Esta controversia es fruto de que el rango de valores de la EV en diferentes estudios presenta gran variabilidad, con algunos valores muy bajos. Dicha variabilidad se explica en gran medida por el objetivo de prevención que se persiga medir en el estudio. Se estima que la EV real es superior al 60%. Para facilitar la medición del resultado (padecer la gripe) que se persigue prevenir se utilizan aproximaciones que introducen, en mayor o menor medida, un sesgo de información. El sesgo de información disminuye la estimación de la EV y aumenta el error tipo β del estudio, es decir, aumenta la probabilidad de no encontrar un efecto beneficioso de la vacunación aun cuando este sí existe. Así, la EV frente a la gripe confirmada por laboratorio es del 49% (IC 95%: 33-62), disminuye al 39% (IC 95%: 35-43) para prevenir síndrome gripal y cae hasta el 28% (IC 95%: 26-30) para prevenir complicaciones46.
A pesar de esta dilución del efecto que dificulta encontrar beneficios de la vacunación para prevenir complicaciones, cuando se analizan casos hospitalizados de gripe, el hecho de estar vacunado es un signo independiente de buen pronóstico, con una EV del 58% para prevenir la gravedad en los hospitalizados (ingreso en UCI o muerte). En el grupo de mayores de 65 años la EV para prevenir la gravedad es aún mayor, del 85%47.
Otro resultado que se mide en diversos estudios de la EV es la muerte por todas las causas. La gran inespecificidad que conlleva haría esperar valores de EV por debajo del 20%, sin embargo muchos estudios encuentran una EV del 50-70% frente a la muerte por todas las causas. Se ha propuesto que estos resultados también son fruto de un sesgo introducido por una mayor cobertura vacunal en sujetos con mayor esperanza de vida, ya que aquellos sujetos más enfermos tienen menos probabilidad de ser vacunados48. Algunos autores han realizado correcciones metodológicas que les han permitido estimar una EV frente a la muerte por todas las causas de en torno al 5%, lo cual es un valor mucho más plausible49.
Una mención especial merecen los estudios de «test negativo». Estos estudios son una variante de los estudios de casos y controles, en los que se reclutan pacientes con síndrome gripal y se les realiza diagnóstico microbiológico de gripe. Se compara la cobertura vacunal entre los que tienen resultado positivo y negativo; de esta comparación se obtiene una OR de la que se calcula la EV como (1-OR) × 100. Los diseños de «test negativo» son muy eficientes en consumo de recursos, incluso en muchas ocasiones emplean redes de vigilancia preexistentes, lo que ha hecho aumentar exponencialmente el número de publicaciones desde el año 2007. Como contrapartida, están sujetos a numerosos sesgos. La población de referencia o la vacuna utilizada afectan a la generalización de los resultados. El uso de métodos estadísticos inadecuados afecta a la validez. Los criterios de diagnóstico clínico y, especialmente, los aspectos que afecten a la sensibilidad y especificidad del diagnóstico microbiológico (toma de muestra, técnica empleada, etc.) pueden introducir un sesgo de clasificación no diferencial, cuyo efecto es acercar la OR a 1, es decir, al 0% de EV. Cuando algún aspecto relacionado con el diagnóstico microbiológico es heterogéneo, puede introducir incluso sesgos de clasificación diferencial, invalidando los resultados. La consecuencia es una gran heterogeneidad de valores de EV: durante la temporada 2011-2012 la EV osciló entre el −31 y el 71% en 12 estudios diferentes50, lo que es difícilmente explicable por motivos exclusivamente relacionados con la vacuna. En conclusión, estos diseños son la herramienta más eficiente para el estudio de la EV actualmente51, pero deben interpretarse con cautela.
Además de las diferentes EV por edad, resulta de interés conocer la EV en los grupos a los que se recomienda la vacuna de forma prioritaria y que pueden presentar peculiaridades. Uno de estos grupos prioritarios son las embarazadas. En síntesis, los estudios disponibles indican que la EV para prevenir síndrome gripal en embarazadas es modesta pero significativa, del 24% (IC 95%: 11-34)43. La EV para prevenir gripe confirmada en los recién nacidos de madres vacunadas es del 41% (IC 95%: 7-63) y su riesgo de hospitalización por síndrome gripal se redujo en un 39% (IC 95%: 16-55)52. Lejos de suponer un riesgo para la gestación, los abortos y las muertes fetales se observaron con menor frecuencia en mujeres vacunadas, con una EV de 40 y 45%, respectivamente43.
El otro grupo prioritario y con peculiaridades evidentes respecto a EV es el de inmunodeprimidos. En adultos VIH positivos, mientras la EV para prevenir gripe confirmada por laboratorio fue del 85%, para prevenir síndrome gripal es del 60%53, comparable a la de adultos sanos y sin diferencias en la aparición de efectos adversos. En niños VIH positivos la evidencia sobre el uso de vacunas inactivadas es escasa, con EV bajas: del 11% para prevenir gripe confirmada por laboratorio. Ocurre algo similar con respecto a pacientes oncológicos inmunodeprimidos: mientras en adultos se observa protección frente a síndrome gripal y frente a mortalidad (de hasta el 58% según estudios)54, en niños se carece de estudios de EV clínica, aunque se ha visto que sí son capaces de desarrollar marcadores analíticos de respuesta inmune55. Si bien la evidencia aún es escasa, los programas de vacunación en estos grupos se fundamentan en la seguridad, que sí se ha demostrado, y en las graves consecuencias de la infección gripal, por lo que la evaluación del riesgo beneficio es favorable a la vacuna.
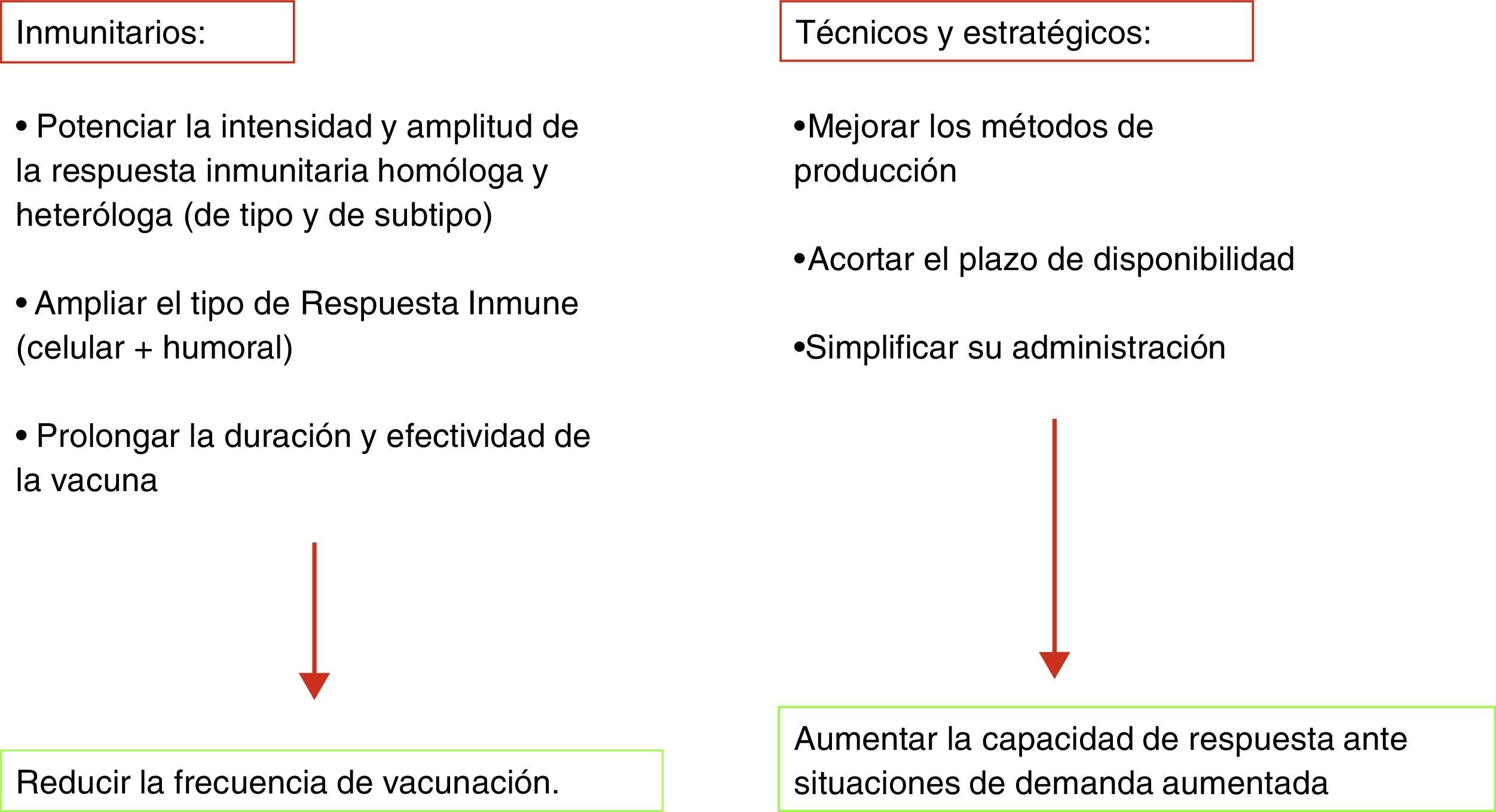
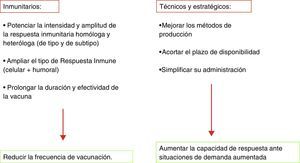
Retos de futuroLas circunstancias clínico-epidemiológicas asociadas a la gripe son únicas y confieren peculiaridades irrepetibles tanto en la formulación de la vacuna como en el hecho de la vacunación. La gripe es una enfermedad de difícil, si no imposible, erradicación. Distintos factores y circunstancias que se exponen en la tabla 3 lo impiden. Cualquier vacuna con semejantes condicionantes y complejidad en su fabricación y aplicabilidad, probablemente, no tendría la difusión que tienen actualmente las vacunas contra la gripe. Sin embargo, la enorme morbilidad de la gripe, el potencial tremendo de alteración social que suponen las epidemias anuales de gripe y su impacto sobre la mortalidad general, justifican por sí solos la existencia de una vacuna con las limitaciones anteriormente expuestas6,7. Aunque la vacuna de la gripe es la medida sanitaria más eficaz para prevenir la gripe epidémica o pandémica, su concepción básica tiene más de 70 años y son necesarias mejoras que en los últimos años se han ido produciendo, pero que no han dado lugar a una vacuna ideal o universal de gripe (tabla 4).
Características, factores y circunstancias que impiden la erradicación de la gripe
| • Zoonosis con amplio reservorio animal |
| • Salto de barrera de especie |
| • Existencia de distintos virus A y B sin relación antigénica |
| • Inmunidad natural específica de cepa y, mucho menor, de subtipo |
| • Elevada contagiosidad |
| • Necesidad de vacunación annual |
| • Senescencia inmune en el huésped humano |
Vacuna de gripe quasi-ideal
| • Producción y disponibilidad flexible |
| • Segura y bien tolerada |
| • Inmunogénica con dosis bajas de Ag |
| • Respuesta inmune amplia con protección cruzada frente a la deriva antigénica (variantes menores) |
| • Respuesta heterosubtípica |
| • Protectora frente a enfermedad grave |
| • Persistencia de la respuesta inmune |
| • Aplicable en diferentes rangos de edad y condición clínica |
La respuesta inmune del individuo frente a la gripe no se conoce en sus aspectos más finos: la equiparación entre Ac. neutralizantes e inhibidores de la HA, el papel de otros Ac. en la respuesta adaptativa, el alcance de la inmunidad celular, las respuestas cruzadas o heterólogas entre e intrasubtipos o entre variantes menores de un mismo subtipo. Son aspectos que deben entenderse completamente para lograr vacunas de gripe mejores. La demostración de que las células plasmáticas de algunos individuos pueden generar Ac. frente a todos los subtipos de HA conocidos abre serias posibilidades de lograr respuestas más amplias con vacunas distintas frente a la gripe56,57 (fig. 7).
Hace algo más de una década se iniciaron experimentos con otras dianas para fabricar una vacuna gripal que se aproximara lo más posible a una vacuna universal que no quedara desfasada por las variaciones anuales y polianuales del virus. Una de dichas dianas ha sido la proteína M2. Esta proteína constituye un canal iónico que determina la acidificación interior del virus en la célula infectada, paso previo para la decapsidación del virus y la síntesis de nuevos viriones. La proteína M2 posee una región externa de 23 aminoácidos (M2e) muy conservada en los diferentes subtipos y variantes menores desde el descubrimiento de los virus gripales en 1933. Sin embargo, existen pocas moléculas de la proteína M2 en la estructura del virus de la gripe: solo 12 o 14 moléculas por virión. Por ello, se ha tratado de obtener mediante procedimientos que produzcan más cantidad de esta proteína. En células epiteliales se observa mayor expresión de esta proteína, lo que podría constituir una aproximación mejor. Así mismo, se ha combinado con proteínas del core del virus de la hepatitis B con objeto de dotarla de mayor poder inmunógeno. Otras aproximaciones han supuesto la combinación de M2e con HA. Uno de los problemas para la aplicación universal de las vacunas basadas en la M2e es que su composición es distinta para los virus A y los B, por lo que una vacuna basada en esta diana tendría que llevar ambos componentes.
Otras dianas inmunizantes exploradas en los últimos años han sido las proteínas internas del virus de la gripe: nucleoproteína y la proteína matriz M1. Ambas estructuras, específicas para cada virus A o B, están muy conservadas en los linajes A y B, su deriva antigénica es mucho menor que la de la HA y estimulan mejor que la HA la respuesta inmunitaria celular, base de una respuesta celular sólida y amplia. Además de estas dianas se han ensayado otras combinaciones antigénicas elaboradas a partir de virus quimera que incorporan epítopos conservados del tallo de la HA de distintos subtipos, solo o combinados con otras proteínas internas PB1 y otras del complejo polimerasa del virus no específicas de subtipo58.
Antes de conseguir una vacuna universal de gripe existen otros retos de futuro en la vacunación gripal. Uno de ellos es alcanzar los objetivos de cobertura vacunal de gripe fijados por la OMS que inciden de manera concreta sobre el aumento de las coberturas vacunales en distintos colectivos. Es importante que se amplíe especialmente en embarazadas y personas jóvenes con enfermedades crónicas. La vacunación en la embarazada extiende su protección al recién nacido durante un periodo (<6 meses) en el que la vacunación de gripe no está indicada59. También se debe insistir en la necesidad del aumento de coberturas en sanitarios por su posible papel como difusores de la infección en el contexto hospitalario y por el ejemplo que ello supone para los usuarios.
Otro gran reto lo constituye el debate sobre la vacunación de gripe en niños, recomendación ya adoptada en EE. UU., Canadá y Reino Unido, Estonia, Polonia, Letonia, Eslovenia, Finlandia, Austria, Malta y Eslovaquia en Europa13. Los argumentos a favor han sido ya apuntados en publicaciones60,61 y recomendaciones de organismos internacionales30. Sin embargo, la no disponibilidad en España de una vacuna atenuada y las posiciones en la comunidad científica pediátrica respecto a la complejidad de los calendarios infantiles vigentes hacen que esa recomendación no se haya formulado todavía. A pesar de ello, se debe extremar la necesidad de vacunar anualmente con vacuna inactivada a niños con enfermedades crónicas que los hagan propensos a complicaciones graves y hospitalización.
Las estimaciones que se mencionaban al principio de esta revisión, asumiendo una población de 500 millones, darían para Europa un rango entre 44.000 y 220.000 muertes dependiendo de la gravedad de cada epidemia. A pesar de la enorme oferta descrita en vacunas y vacunación gripal, el mayor desafío es su administración efectiva: solo la vacunación anual y constante de gripe puede limitar esas cifras.
Conflicto de interesesROL ha participado en consultoría científica para A. Zeneca, Esteve, GSK, Novartis, Roche y Sanofi Pasteur y honorarios por ponencias científicas de Abbott, BioMerieux, Baxter, Esteve, GSK, Roche y Sanofi Pasteur. ST ha recibido honorarios por ponencias científicas de GlaxoSmithKline y Sanofi Pasteur MSD.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.