N. meningitidis es una de las principales bacteriascausantes de meningitis y de sepsis y supone un problema importante de salud pública. La enfermedad, que puede tener un curso fulminante, tiene una elevada mortalidad y puede dejar secuelas graves, incluso en los casos de tratamiento médico aparentemente óptimo. La quimioprofilaxis puede evitar casos secundarios entre quienes están en estrecho contacto con los enfermos, pero dado que los casos secundarios representan sólo el 1-2% del conjunto de enfermedades meningoco¿cicas, la quimioprofilaxis tiene poco interés en la lucha contra la mayor parte de las formas endémicas y epidémicas. Teniendo en cuenta que al menos el 5-15% de los niños y adultos jóvenes son portadores, la lucha contra las enfermedades meningoco¿cicas basada en la eliminación quimioterapéutica de la colonización nasofaríngea es prácticamente imposible. Por consiguiente, la inmunización es el único medio racional de combatir esta enfermedad.
N. meningitidis is a major cause of meningitis and septicemia and a major public health problem in many countries. The disease, that can be fulminant, has a high mortality and may cause serious sequelae, even in cases of apparently optimal medical treatment. Chemoprophylaxis may prevent secondary cases among those in close contact with the ill, but, since secondary cases represent only 1%-2% of all meningococcal disease, chemoprophylaxis has a small impact when fighting most of endemic and epidemic forms. Given that al least 5% -15% of children and young adults are carriers, the fight against meningococcal disease based on chemotherapeutic elimination of nasopharyngeal colonization is virtually impossible. Therefore, immunization is the only rational way to combat this disease.
La enfermedad meningocócica es una infección grave y potencialmente mortal producida por Neisseria meningitidis. Se trata de una enfermedad de declaración obligatoria del sistema EDO de notificación que continúa siendo un problema importante de salud pública y con un gran impacto económico1. Además, es fuente de alarma social debido a la rapidez con la que evoluciona y a sus devastadoras consecuencias, ya que entre el 12 y el 19% de los supervivientes presentan secuelas permanentes: neurológicas (sordera y parálisis) o por amputaciones2,3.
A pesar de los grandes avances en el conocimiento de las rutas patogénicas implicadas, así como de la disponibilidad de recientes innovaciones en el marco de la prevención, esta enfermedad continúa suponiendo una de las mayores causas de morbimortalidad en el mundo con una incidencia global de 500.000 casos anuales y 50.000 muertes4.
Los serogrupos B y C son responsables del nivel endémico de enfermedad meningocócica en la mayoría de los países occidentales donde supone la causa más frecuente de muerte por sepsis, mientras que el serogrupo A cursa con brotes epidémicos cíclicos en África. La mayor incidencia de la enfermedad meningocócica durante la infancia se detecta entre los 6 meses y los 2 años de vida en forma de septicemia y/o meningitis. La sepsis meningocócica comienza de manera brusca, con fiebre, escalofríos, malestar, postración y exantema que puede ser urticarial, maculopapular o petequial. En los casos fulminantes, aparecen en pocas horas púrpura, coagulación intravascular diseminada (CID), conmoción y coma (síndrome de Waterhouse-Friderichsen); pudiendo causar la muerte hasta en un 10-15% de los casos a pesar de instaurarse un tratamiento antibiótico apropiado5,6.
La vacunación es la estrategia de prevención más efectiva para el control de la enfermedad meningocócica, si bien la disponibilidad de vacunas frente a ciertos serogrupos, sólo ha sido posible recientemente.
EtiologíaEl agente causal de la enfermedad meningocócica es un diplococo gram negativo: Neisseria meningitidis. N.meningitidis dispone de una cápsula polisacárida compuesta de ácido siálico que constituye su principal factor de virulencia, al proteger a la bacteria de la fagocitosis y de la opsonización. En el momento actual, su composición bioquímica determina el serogrupo del meningococo, de los que hay descritos 12, aunque la enfermedad invasora está originada principalmente por seis (A, B, C, W135, X e Y). La mayoría de ellos son endémicos, con prevalencias variables en función del clima y de las distintas regiones geográficas, aunque todos pueden producir epidemias.
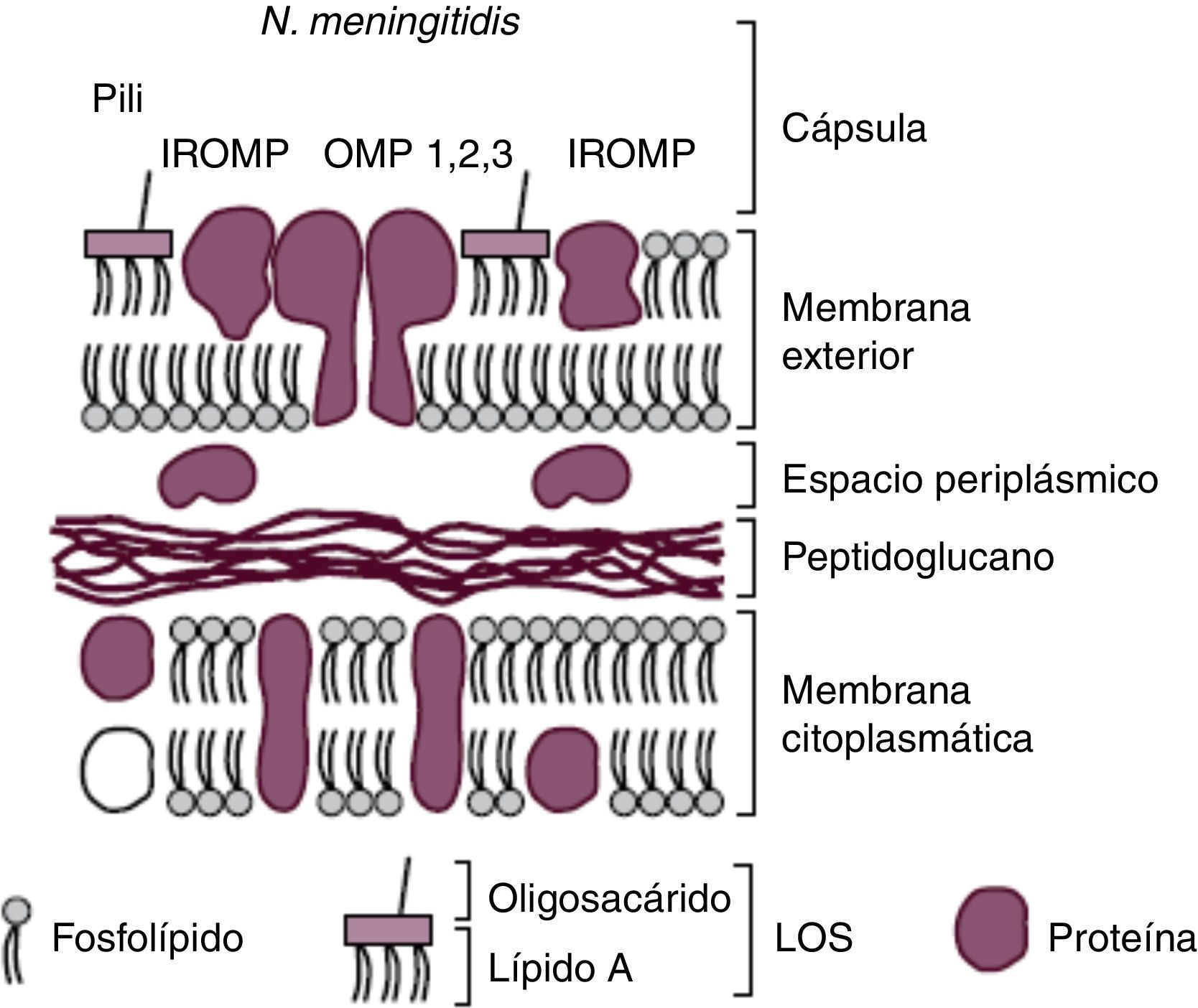
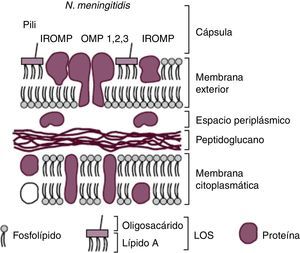
Características morfológicas y factores de virulenciaEl conocimiento de la estructura del meningococo (fig. 1) ha permitido identificar todos aquellos componentes responsables de su virulencia y que en muchos casos han sido diana de los diferentes candidatos vacunales diseñados. Su membrana citoplasmática está rodeada por el espacio periplásmico que la separa de la pared celular, la cual está compuesta por una fina, pero rígida, capa de peptidoglucano y por la membrana externa. Esta última, a su vez, está dividida en una capa interior compuesta por fosfolípidos (fosfatidiletanolamina, fosfatidilglicerol, cardiolipina y fosfatidato) y una capa exterior formada en su mayoría por el lipooligosacárido (LOS) que actúa como una endotoxina. El LOS está constituido por lípido A y oligosacárido.
Esquema de la cubierta de N. meningitidis. Reproducción de Moraga F. Enfermedad Meningocócica: Pasado, presente y futuro7.
La membrana externa se encuentra repleta de distintos tipos de proteínas (OMP (1, 2, 3), outermembrane protein). Las OMP actúan principalmente como porinas, (PorB y PorA) regulando el flujo de nutrientes y productos metabólicos, y como sistemas de adhesión: pili o fimbrias, proteínas de opacidad (Opa y Opc) y adhesinas menores (NhhA (homóloga hia A de Neisseria), App (proteína de adhesión y penetración), MspA (proteasa serina A meningocócica) y NadA (adhesina A de Neisseria)). Esta última interacciona con las células epiteliales, y su contribución a la virulencia es indiscutible ya que se expresa aproximadamente en el 50% de las cepas productoras de enfermedad y sólo en alrededor del 5% de los aislamientos de personas sanas.
Rodeando a la pared de algunas cepas de N. meningitidis como en el caso del meningococo serogrupo B puede encontrarse una cápsula externa polisacarídica que le confiere la capacidad de producir enfermedad invasiva al facilitar la transmisión, la diseminación y la supervivencia. Gracias a la cápsula la bacteria pasa desapercibida al sistema inmunitario por incluir en su composición ácido 5-N-acetilneuramínico [NANA] similar al presente en células nerviosas humanas.
La clasificación de meningococo en serotipos y serosubtipos se realiza en función de la reactividad inmunológica de las proteínas de su membrana externa (PME): PorB (proteínas clase 2 o PorB2 y clase 3 o PorB3) y PorA (proteínas clase 1), respectivamente, y en inmunotipos (L1-L12) según la reactividad de los anticuerpos monoclonales a los lipopolisacáridos (LPS) de dicha membrana.
El tipado molecular del meningococo que define los complejos clonales se realiza mediante las técnicas Multi Locus Enzyme Electrophoresis (MLEE) y Multi Locus Sequence Typing (MLST). La utilización de MLEE permitió la clasificación de la mayoría de las cepas patógenas en linajes hipervirulentos (ET-37, ET-5, cluster A4, linaje 3 y subgrupos I, III, IV-1), aunque actualmente el patrón de referencia es el tipado mediante MLST, que compara las secuencias de nucleótidos y clasifica los linajes anteriores en complejos clonales (ST-11, ST-32, ST-8, ST41/44, ST-1, ST-5 y ST-4, respectivamente). Esta nueva metodología de tipado molecular de meningococo, agrupándolos en complejos clonales, permite estimar la relación genética de los clones de meningococo, la naturaleza de sus cambios evolutivos y su potencial para causar epidemias independientemente del serogrupo8.
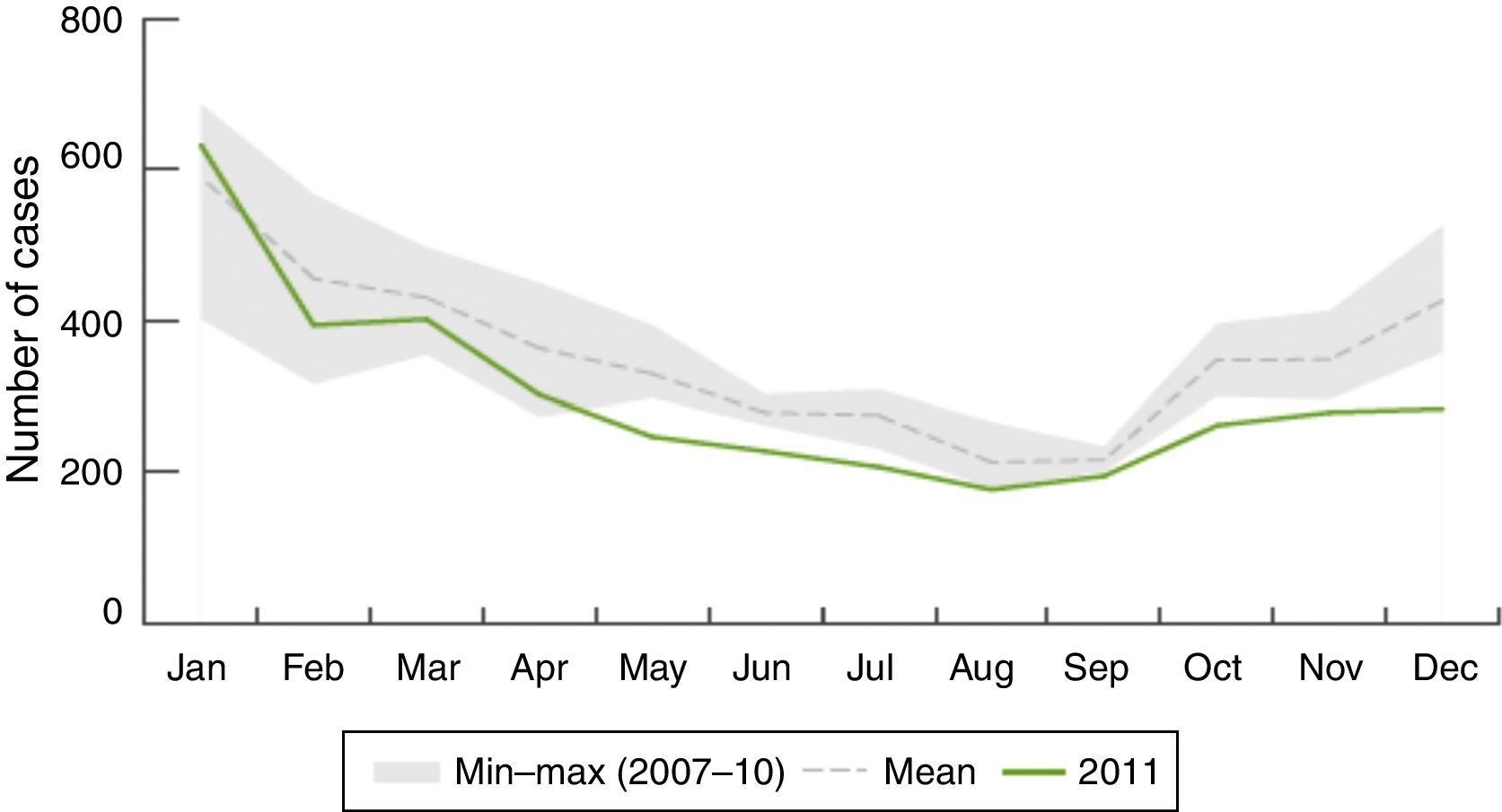
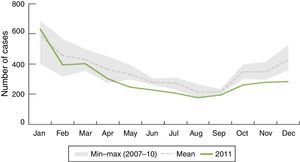
EpidemiologíaDistribución geográfica y estacionalLa enfermedad meningocócica se caracteriza por su estacionalidad, la mayor parte de los casos se registran en invierno y al principio de la primavera (fig. 2).
Distribución estacional: número de casos confirmados de enfermedad meningocócica por mes en Europa durante el año 20119.
La epidemiología de la enfermedad varía según el área geográfica y el serogrupo 10:
- •
El serogrupo A es responsable de las grandes epidemias en África.
- •
Los serogrupos B y C predominan en países industrializados, siendo los responsables de la mayoría de los casos en Europa y el continente americano.
- •
El serogrupo W135 provoca epidemias como la de Arabia Saudí y, posteriormente, las aparecidas en países del cinturón africano, y es el serogrupo más frecuente actualmente en Argentina.
- •
El serogrupo Y es la causa más común de enfermedad meningocócica en Estados Unidos y Colombia y es muy frecuente en Canadá e Israel.
- •
El serogrupo X ha producido epidemias en Ghana y algún otro país africano.
La razón de la distribución diferente de los serotipos a nivel mundial es desconocida, aunque se sabe que las diferencias inmunitarias en la población y los factores ambientales juegan un papel fundamental11.
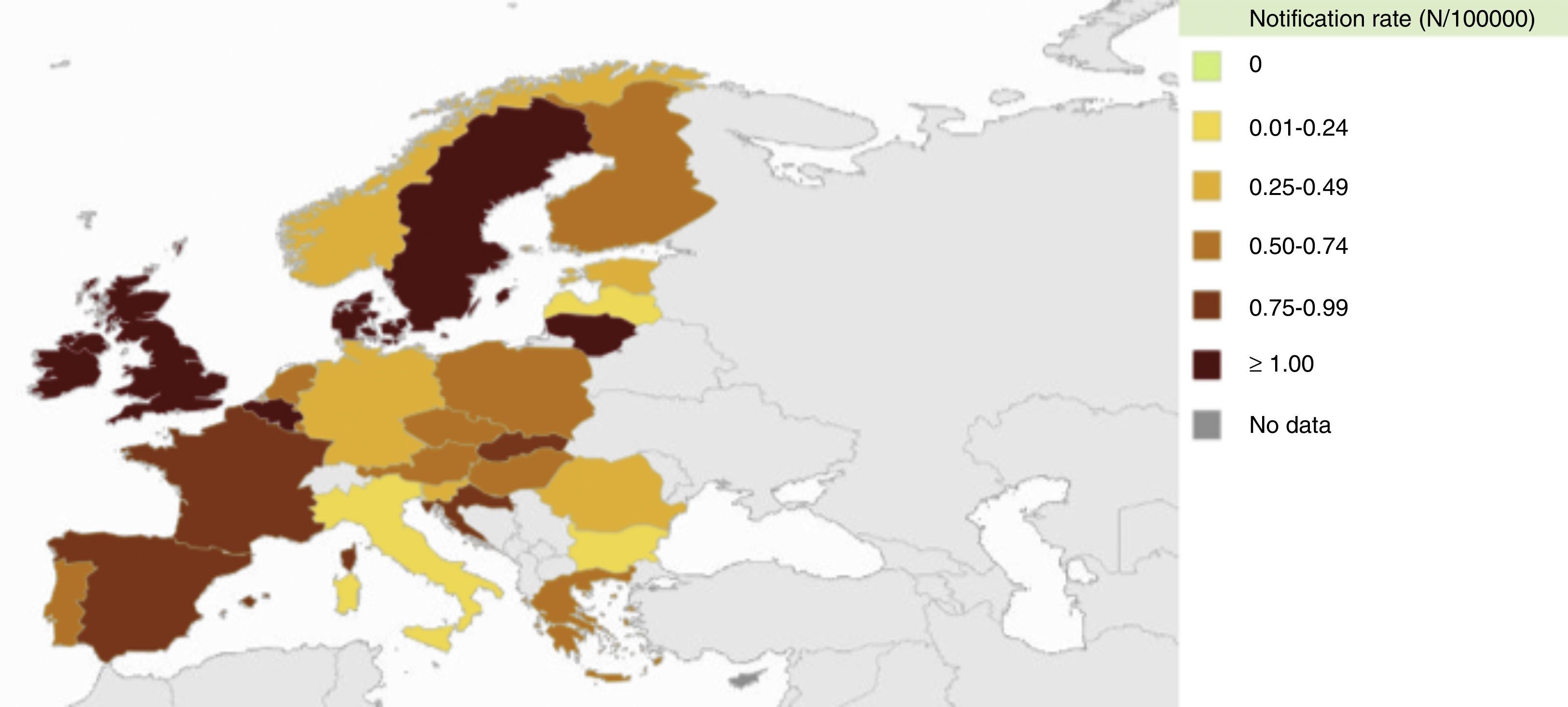
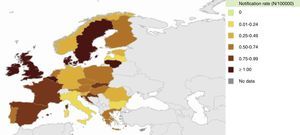
La enfermedad meningocócica en EuropaSegún datos del Centro para el Control y la Prevención de Enfermedades de Europa (ECDC), la incidencia de la enfermedad meningocócica en Europa oscila de 0,15 a 2,76 casos por 100.000 habitantes en el año 2012 (fig. 3). Los serogrupos que predominan en esta región son el B y el C. No obstante, en la última década la incidencia de enfermedad meningocócica invasiva ha mostrado una reducción importante debido a la incorporación de las vacunas antimeningocócicas conjugadas C en el calendario de vacunación infantil sistemática en muchos países. Por ello, el serogrupo B es el que actualmente predomina en Europa (fig. 4). Este serogrupo suele causar ondas epidémicas de ciclo largo.
Incidencia de la enfermedad meningocócica en Europa en 2012. Datos del European Centre for Disease Prevention and Control 12.
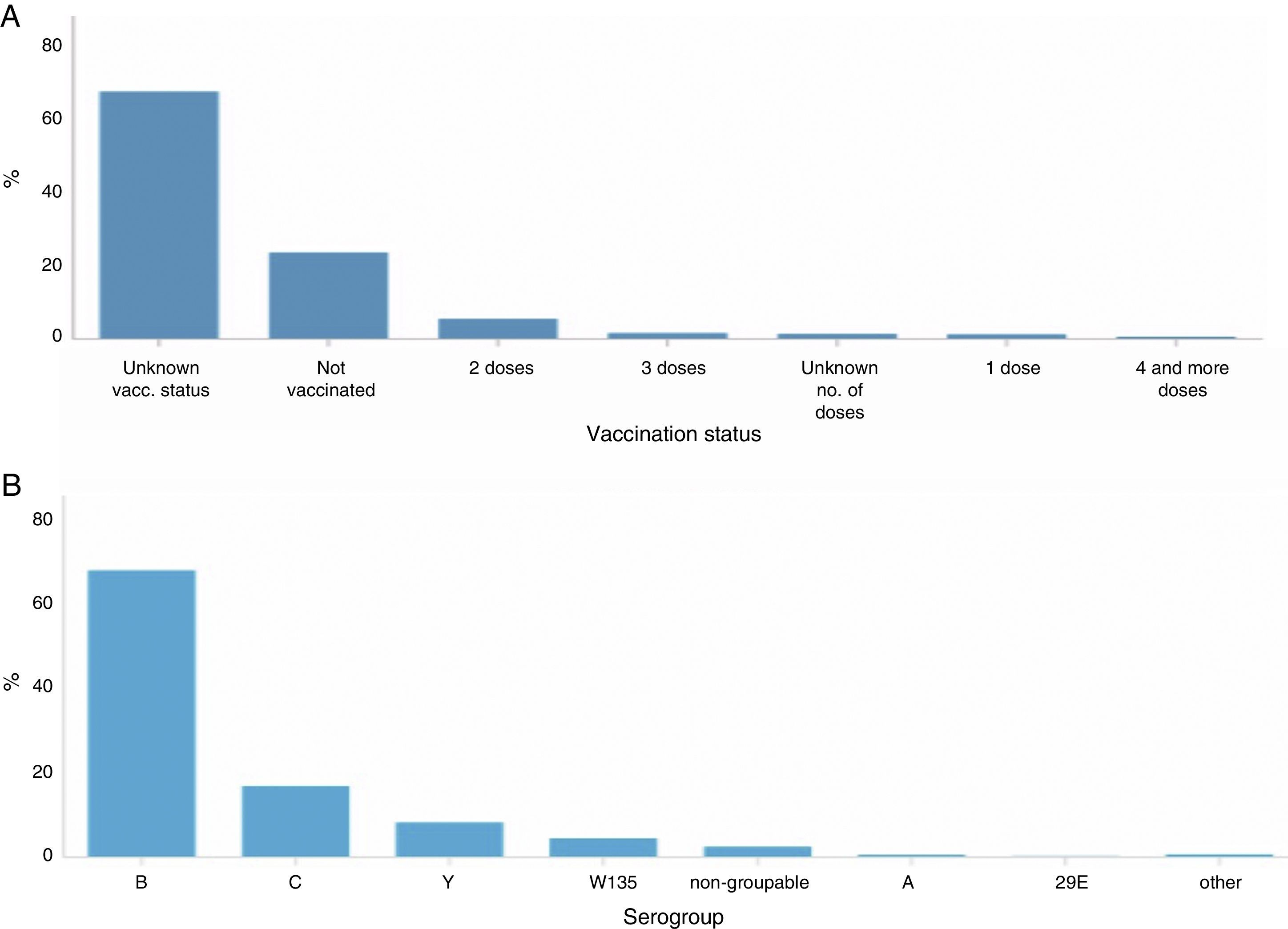
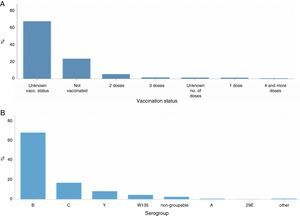
A) Estado vacunal y B) serogrupo, en pacientes con enfermedad meningocócica en Europa, 201212.
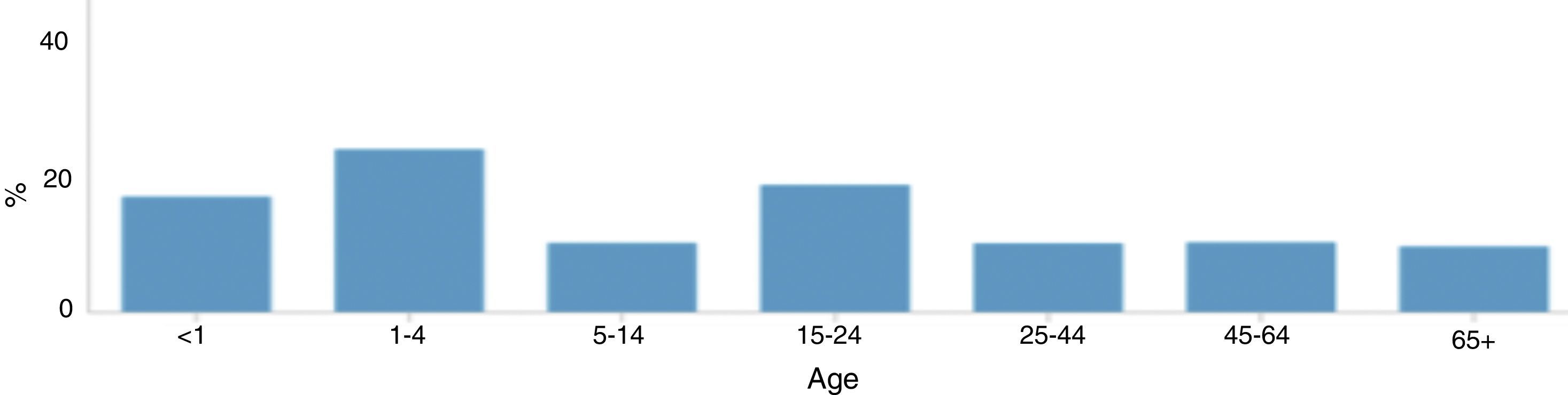
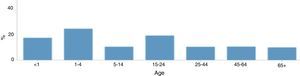
La incidencia de la enfermedad meningocócica varía con la edad, las tasas más altas se observan en niños menores de 4 años (4,08 casos por 100.000 habitantes notificados en Europa en 2012) y vuelven a aumentar en la adolescencia y a principios de la edad adulta (1,16 casos por 100.000 habitantes) (fig. 5). En niños menores de 4 años se identificó una mayor prevalencia en varones que en mujeres, sin embargo estas diferencias no se detectaron en los demás grupos de edad.
Distribución de la enfermedad meningocócica en Europa por grupos de edad, 201212.
En nuestro país, la enfermedad meningocócica es una entidad de declaración obligatoria a las autoridades sanitarias. Los casos se notifican, de manera individualizada con periodicidad semanal y acompañados de una serie de datos epidemiológicos al Sistema de Enfermedades de Declaración Obligatoria (EDO) a través de la Red Nacional de Vigilancia Epidemiológica (RENAVE), siguiendo el protocolo de vigilancia acordado en el seno del Consejo Interterritorial del Sistema Nacional de Salud13.
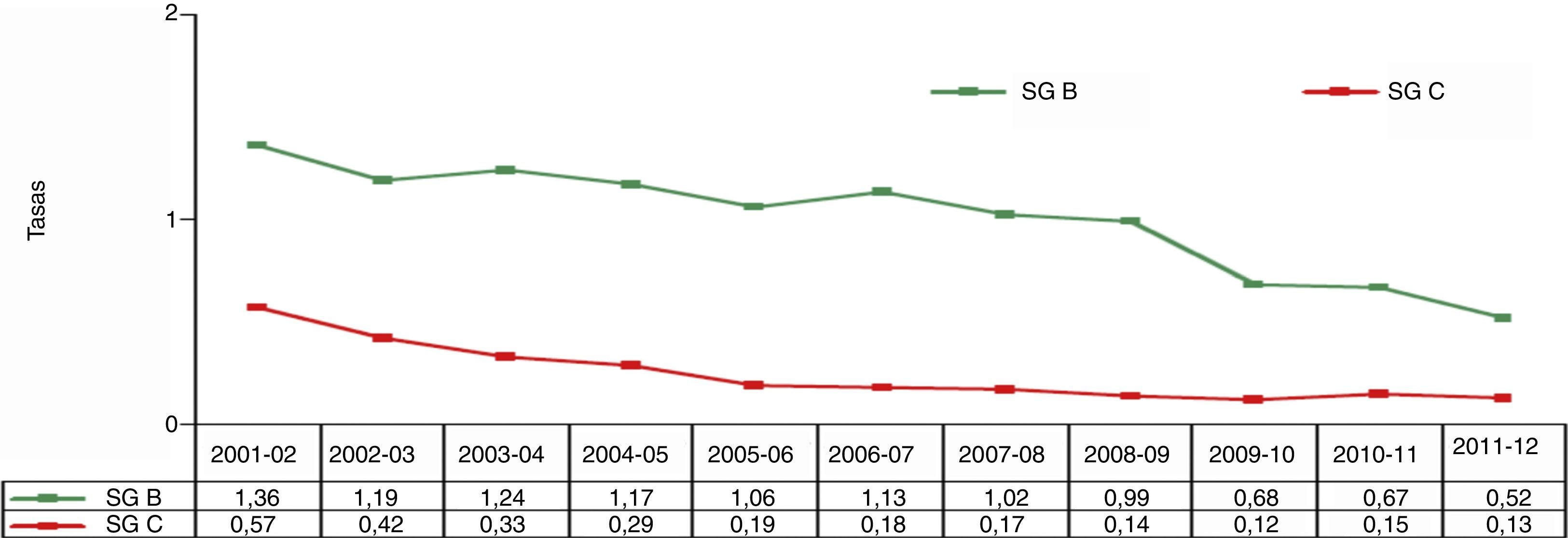
En España, la incidencia de la enfermedad meningocócica responde al mismo patrón descrito para el resto de Europa. En la temporada 2011-2012 se observó la tasa más baja de los últimos 12 años (fig. 6). Este descenso, acentuado a partir del año 2008, se ha debido tanto a una disminución de casos por serogrupo C, especialmente en las temporadas de 2001 a 2005, como al descenso mantenido de los casos por serogrupo B a lo largo del periodo de tiempo analizado. La disminución de la incidencia de la enfermedad causada por el serogrupo C se debe a la introducción en el calendario de vacunación infantil de la vacuna conjugada en el año 2000, mientras que el descenso de la enfermedad por serogrupo B se asocia con los cambios cíclicos que afectan a la evolución de la enfermedad a largo plazo. Esta naturaleza cíclica obliga a mantener una vigilancia estrecha que permita generar datos para utilización potencial de vacunas basadas en formulaciones diferentes así como monitorizar el impacto de intervenciones con dichas vacunas.
Evolución de las tasas de incidencia de enfermedad meningocócica B y C13.
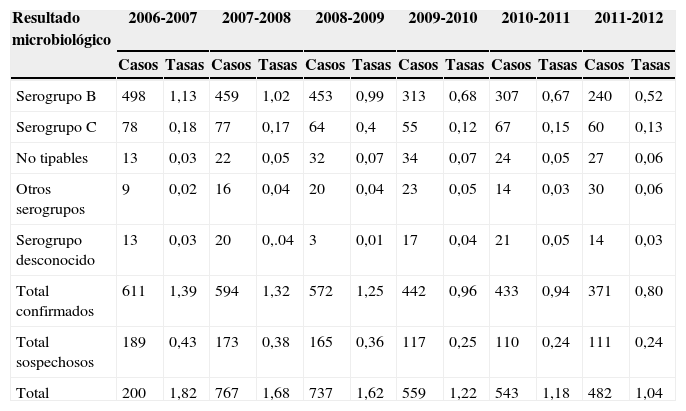
En la temporada 2011-2012, se declararon un total de 482 casos de enfermedad meningocócica a la RENAVE, 371 de ellos (un 77%) eran casos confirmados, lo que supone una tasa de incidencia de 0,80 por 100.000 habitantes. De estos casos, el 65% (240 casos) fueron causados por el serogrupo B (tabla 1). En la temporada 2012-2013 la tasa ha descendido hasta 0,68/100.000, con un total de 318 casos.
Casos y tasas de enfermedad meningocócica en España por 100.000 habitantes según el diagnóstico microbiológico. Temporadas seleccionadas: 2006-2007 a 2011-201213
| Resultado microbiológico | 2006-2007 | 2007-2008 | 2008-2009 | 2009-2010 | 2010-2011 | 2011-2012 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Casos | Tasas | Casos | Tasas | Casos | Tasas | Casos | Tasas | Casos | Tasas | Casos | Tasas | |
| Serogrupo B | 498 | 1,13 | 459 | 1,02 | 453 | 0,99 | 313 | 0,68 | 307 | 0,67 | 240 | 0,52 |
| Serogrupo C | 78 | 0,18 | 77 | 0,17 | 64 | 0,4 | 55 | 0,12 | 67 | 0,15 | 60 | 0,13 |
| No tipables | 13 | 0,03 | 22 | 0,05 | 32 | 0,07 | 34 | 0,07 | 24 | 0,05 | 27 | 0,06 |
| Otros serogrupos | 9 | 0,02 | 16 | 0,04 | 20 | 0,04 | 23 | 0,05 | 14 | 0,03 | 30 | 0,06 |
| Serogrupo desconocido | 13 | 0,03 | 20 | 0,.04 | 3 | 0,01 | 17 | 0,04 | 21 | 0,05 | 14 | 0,03 |
| Total confirmados | 611 | 1,39 | 594 | 1,32 | 572 | 1,25 | 442 | 0,96 | 433 | 0,94 | 371 | 0,80 |
| Total sospechosos | 189 | 0,43 | 173 | 0,38 | 165 | 0,36 | 117 | 0,25 | 110 | 0,24 | 111 | 0,24 |
| Total | 200 | 1,82 | 767 | 1,68 | 737 | 1,62 | 559 | 1,22 | 543 | 1,18 | 482 | 1,04 |
El ser humano es el único reservorio conocido de Neisseria meningitidis y la orofaringe, la principal fuente de propagación, ya que los enfermos dejan de ser transmisores a las 24 horas de iniciado el tratamiento14. Diversos estudios muestran que, en situaciones no epidémicas, en torno a un 10% de la población general es portadora asintomática de N. meningitidis en la nasofaringe, y esta proporción se acerca al 100% en poblaciones cerradas o semicerradas (ej. residencias de estudiantes)15,16. La colonización asintomática del tracto respiratorio superior por N.meningitidis es un hecho frecuente en personas sanas, en niños mayores de 5 años y especialmente en los adolescentes (hasta un 25%) y jóvenes; es decir, grupos de edad que curiosamente no son los que registran las mayores tasas de incidencia de la enfermedad. Por lo tanto, parece claro que mantener un hábito de vida “comensal” con el huésped representa una ventaja para el microorganismo en términos de supervivencia y diseminación de la especie.
Las cepas de meningococos aisladas en portadores son genéticamente muy diversas, y muchas o no expresan la cápsula, que parece ser necesaria para la invasión, o constitucionalmente carecen de ella. Por el contrario, la diversidad observada en los aislados clínicos es mucho menor, ya que solo una pequeña parte de las cepas, conocidas como cepas o clones, hipervirulentas o hiperinvasoras, producen enfermedad meningocócica. El estado de portador constituye un proceso inmunizante y la colonización por especies de Neisseria no patógenas como la N.lactámica estimula la formación de anticuerpos protectores frente a N.meningitidis17.
Mecanismo de transmisiónLa transmisión del meningococo se produce de persona a persona, ya sea a partir de portadores asintomáticos o de enfermos, a través del contacto con la saliva o las secreciones respiratorias del tracto respiratorio superior (gotitas de Pflügge). Se considera que el contacto directo es el único medio de difusión, dada la fragilidad del germen fuera del organismo humano donde sobrevive unos segundos, precisando de un contacto estrecho y prolongado con la fuente de infección18. Por eso, los contactos estrechos de los casos tienen un riesgo mayor de enfermedad meningocócica. La transmisión indirecta por objetos contaminados es prácticamente inexistente. No se considera que exista riesgo en compartir vasos o cigarrillos. No se transmite por el suministro de agua, piscinas ni por el contacto rutinario en aulas, comedores o aseos.
Periodos de incubación y transmisibilidadEl periodo de incubación es habitualmente de tres o cuatro días, pero puede variar entre uno y diez días. Las personas que no desarrollan la enfermedad en los siete días posteriores a la colonización pueden permanecer como portadores asintomáticos. No se conoce con exactitud el período de transmisión pero se acepta que puede suceder mientras persista el estado de portador, que tiene una duración muy variable (de semanas a meses), dependiendo del serogrupo y probablemente también de la cepa.
Susceptibilidad individualLa enfermedad únicamente ocurre de forma esporádica e impredecible, e incluso en el contexto de grandes epidemias sólo afecta a una relativa baja proporción de las personas en riesgo; sin embargo, el meningococo es bastante común en la población general, de modo que una gran mayoría de la gente lo portará en algún momento de su vida, de manera completamente asintomática, en la nasofaringe y sólo en un pequeño porcentaje de casos el meningococo logrará invadir el torrente sanguíneo y causar enfermedad, ya sea en forma de meningitis, sepsis o ambas. En nuestro medio, hasta un 10% fallecerá y aproximadamente un tercio presentará secuelas graves (amputaciones, sordera, déficits neurológicos permanentes…).
Identificar los factores que determinan estas diferencias entre individuos ha sido y continúa siendo un reto para la comunidad científica19. Algunas cepas son más virulentas por varios factores20 entre los que destaca su cápsula polisacárida que protege el meningococo frente a la bacteriólisis mediada por complemento, por lo que los afectos de una deficiencia del componente terminal del complemento (C5-9), de C3 o de properdina, y los que tienen asplenia anatómica o funcional son más susceptibles. También ser fumador, infecciones virales u otras situaciones que originen daño en el epitelio nasofaríngeo facilitan la colonización.
Hoy día existen evidencias científicas que apuntan a la importancia de la genética del huésped en dicha variabilidad interindividual, y recientemente nuestro grupo ha identificado que diferencias en la dotación genética del gen CFH (factor H del complemento) explican una diferente susceptibilidad a la enfermedad21 (Proyecto EUCLIDS – www.genvip.org/www.euclids-project.eu).
PrevenciónLa estrategia de prevención más efectiva para el control de la enfermedad meningocócica es la vacunación en aquellos serogrupos para los que existe vacuna disponible. No obstante ante un caso de enfermedad está indicada la quimioprofilaxis con antibióticos (rifampicina y ciprofloxacino) con el fin de evitar la infección secundaria.
QuimioprofilaxisEl objetivo de la quimioprofilaxis es reducir el riesgo de adquirir la enfermedad invasiva erradicando el estado de portador en el grupo de contactos. Los antibióticos administrados como quimioprofilaxis deben eliminar el portador nasofaríngeo y administrarse lo antes posible, ya que si han pasado más de 14 días desde el inicio de la enfermedad en el caso índice, es posible que la quimioprofilaxis tenga poco o ningún efecto beneficioso. Comparada con placebo la eficacia de la rifampicina para erradicar el estado de portador es del 77% (IC95%: 70-83%) después de una semana, y del 75% (IC95%: 62-84%) después de cuatro22. También son efectivas la ceftriaxona y el ciprofloxacino22. Aunque puede tardar más, ya se observó recolonización después de 3 meses de la quimioprofilaxis23.
Dado que los casos secundarios pueden aparecer varias semanas después del contacto con el caso índice, la vacunación antimeningocócica puede ser un gran apoyo a la quimioprofilaxis cuando un brote es causado por un serogrupo del que se dispone de vacuna. Sin embargo, no se recomiendan los programas de quimioprofilaxis masiva para el control de grandes brotes de la enfermedad. Diversos factores hacen esta medida poco viable y con pocas probabilidades de éxito, como son múltiples fuentes de exposición, el prolongado riesgo de exposición, problemas logísticos y un elevado coste. La vacunación con la vacuna conjugada frente a meningoco C reduce la prevalencia de portadores. Aun no se conoce con certeza si es por reducir la duración del estado de portador o por disminuir la tasa de adquisición. Este es el motivo del importante efecto indirecto de la campaña de vacunación.
Vacunas antimeningocócicasLos primeros ensayos de vacunas frente a N. meningitidis se realizaron a principios del siglo pasado sin éxito, ya que se utilizaban las bacterias enteras y aparecían reacciones adversas graves. En 1933 se demostró el poder inmunógeno de los polisacáridos capsulares de las bacterias capsuladas (primero para los neumococos), y en 1996 se inició el camino para la obtención de vacunas antimeningocócicas eficaces y seguras basadas en el aislamiento y la purificación de los polisacáridos capsulares, que inducían la producción de anticuerpos protectores frente a la enfermedad por cepas de meningococo del mismo serogrupo vacunal.
A partir de ese momento se obtuvieron las vacunas de primera generación4,24:
El proceso de desarrollo frente al serogrupo B30 demostró que el polisacárido capsular era poco inmunógeno y que podía inducir fenómenos autoinmunitarios, y por este motivo se iniciaron nuevas líneas de investigación para obtener vacunas frente a este serogrupo. La variante más exitosa consistió en la administración de vesículas de membrana externa, que sin embargo tenían baja capacidad inmunógena en niños y reactogenicidad elevada, pero además eran únicamente capaces de inducir protección especifica para serosubtipos concretos.
A partir del año 2000 se introdujeron las vacunas de segunda generación, es decir, las polisacáridas anteriores conjugadas con una proteína, y así se obtuvieron dos monovalentes (C y A) y una tetravalente (A, C, W135 e Y). Posteriormente han ido apareciendo distintos preparados comerciales siguiendo esta estrategia:
- •
vacuna polisacárida A/C no conjugada
- •
vacunas antimeningocócicas C conjugadas: dos con CRM197 y una con toxoide tetánico
- •
vacunas antimeningocócicas A/C/W135/Y conjugadas: una con CRM197 y otra con toxoide tetánico
- •
vacuna antimeningocócica B multicomponente (4CmenB, Bexsero®)
- •
vacuna antimeningocócica A conjugada con toxoide tetánico (MenAfriVac®, comercializada en África)
Esta última ha sido la de más reciente incorporación, implementada en los países del cinturón africano de la meningitis con excelente efectividad.
Las vacunas antimeningocócicas frente al serogrupo B de segunda generación son de tipo proteico, obtenidas por DNA recombinante. La primera y única aprobada hasta ahora en Europa es una vacuna de proteínas expresadas en la superficie e identificadas por vacunología inversa31: la vacuna multicomponente 4CMenB (Bexsero®, Novartis), que esta compuesta por tres antígenos proteicos subcapsulares (proteína ligadora de factor H – fHbp, adhesina de superficie de Neisseria (NadA) y proteína ligadora de heparina (NHBA) junto con una vesícula de membrana externa32,33. La selección de sus antígenos se ha realizado basándose en su baja variabilidad, su expresión en la superficie bacteriana y la inducción de anticuerpos bactericidas34. Más recientemente otra vacuna proteica recombinante bivalente basada en un antígeno de superficie común (rLP2086) ha sido aprobada por la FDA americana para su uso en adolescentes (Trumenba®, Pfizer)35. Esta nueva generación de vacunas, diseñadas y licenciadas específicamente frente al serogrupo B, pueden constituir sin embargo la primera generación de vacunas panmeningocócicas, ya que los antígenos que contienen están presentes también en otros serogrupos de Neisseria distintos del serogrupo B. Este potencial de protección cruzada ha sido demostrado in vitro para la vacuna 4CmenB (Bexsero), con tasas de neutralización cruzada de hasta un 80% para otros serogrupos distintos del B.
a) Incorporación de las vacunas antimeningocócicas en los calendarios infantiles
La Organización Mundial de la Salud (OMS) recomienda que los países con una tasa endémica de enfermedad meningocócica invasiva alta o moderada, y aquellos con epidemias frecuentes, introduzcan programas de vacunación a gran escala, ya sea mediante la vacunación sistemática infantil, con actividades de inmunización suplementarias en situación de brote o a través de servicios privados de vacunación. La estrategia de vacunación y el tipo de vacuna dependerán de la epidemiologia de la enfermedad meningocócica en el país, por lo que se requiere disponer de datos aceptables de vigilancia epidemiológica (carga de enfermedad, morbilidad, mortalidad), y también de recursos económicos36. Aunque en algunos países se han usado vacunas antimeningocócicas de polisacáridos, en los programas de vacunación universal (China, Arabia Saudí, Siria) son preferibles las vacunas conjugadas, por la inmunidad de grupo que generan a través de la eliminación de portadores nasofaríngeos, y porque además son más inmunógenas que las primeras, sobre todo en los niños menores de 2 años. Cuando se usa este tipo de vacunas, una de las estrategias recomendadas es vacunar masivamente a todos los sujetos de 9 meses a 18 años de edad, e introducir la vacuna frente a meningococo en el calendario de vacunaciones sistemáticas infantil. En función de los datos de vigilancia epidemiológica pueden incluirse otros grupos de edad en las campañas de vacunación masiva37. Éste sería el caso del cinturón africano de meningitis, donde la población diana para las campañas de vacunación masiva con la vacuna conjugada frente al serogrupo A es la comprendida entre 1 y 29 años de edad. En los países con una tasa endémica baja, la OMS recomienda la vacunación solamente de los grupos de riesgo, como los niños y los adultos que residen en comunidades cerradas, las personas con algún tipo de inmunodeficiencia y los viajeros a regiones de alta endemia36.
b) Estrategias de vacunación frente a meningococo
El control de la enfermedad meningocócica a través de la vacunación puede lograrse mediante diferentes estrategias:
- 1)
La vacunación directa de la población más vulnerable (vacunación en el lactante).
- 2)
La protección de la población a través del control de diseminación y transmisión de la enfermedad mediante la erradicación de portadores (vacunación en el adolescente).
- 3)
La protección pasiva de la población vulnerable a través de la vacunación en embarazadas (para tratar de proteger a los lactantes más pequeños y que todavía no han podido recibir la vacuna o desarrollar una respuesta protectora a tiempo).
Cada estrategia tiene ventajas y limitaciones, que en el caso de la vacunación de la embarazada radican en la escasa información disponible, restringida prácticamente al uso de las formas polisacáridas de vacuna antimeningocócica.
La vacuna que ha logrado un implementación más amplia y rápida en Europa ha sido por razones epidemiológicas, la vacuna frente al meningococo C. En la Unión Europea, dependiendo de cada país, se utilizan tres estrategias38,39:
- •
vacunación en el primer año de vida (se comenzó vacunando con 3 dosis en la serie primaria, cambiando con posterioridad a 2 dosis más un refuerzo en el segundo año (2+1)
- •
vacunación en el segundo año de vida (0+1)
- •
administración de una dosis en la adolescencia (0+1+1).
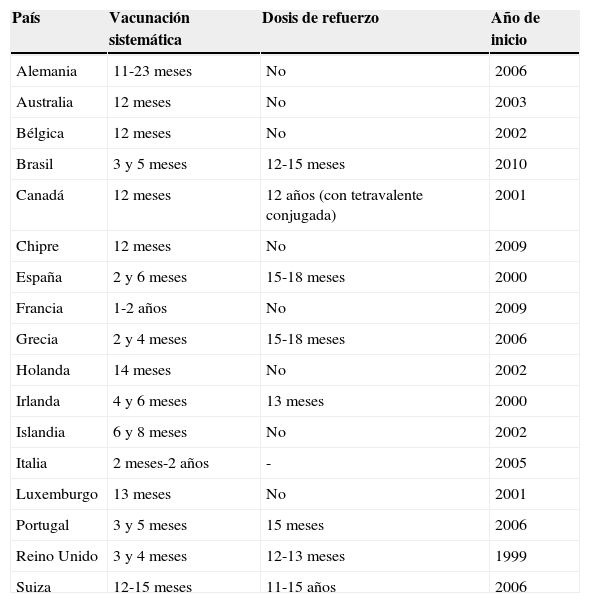
En general, los países con tasas de incidencia más elevadas en la edad infantil introdujeron la primo vacunación en el primer año de vida, mientras que países con tasas de incidencia más bajas vacunan en mayores de 12 meses (tabla 2). La implementación de estos programas de vacunación con MenC cambió la epidemiología de la enfermedad, sobre todo en aquellos países en que, además de introducir las vacunas en el calendario sistemático, realizaron un catch-up amplio con alta cobertura, independientemente de la estrategia de vacunación utilizada.
Edad de vacunación con vacuna antimeningocócica C conjugada en diversos países europeos
| País | Vacunación sistemática | Dosis de refuerzo | Año de inicio |
|---|---|---|---|
| Alemania | 11-23 meses | No | 2006 |
| Australia | 12 meses | No | 2003 |
| Bélgica | 12 meses | No | 2002 |
| Brasil | 3 y 5 meses | 12-15 meses | 2010 |
| Canadá | 12 meses | 12 años (con tetravalente conjugada) | 2001 |
| Chipre | 12 meses | No | 2009 |
| España | 2 y 6 meses | 15-18 meses | 2000 |
| Francia | 1-2 años | No | 2009 |
| Grecia | 2 y 4 meses | 15-18 meses | 2006 |
| Holanda | 14 meses | No | 2002 |
| Irlanda | 4 y 6 meses | 13 meses | 2000 |
| Islandia | 6 y 8 meses | No | 2002 |
| Italia | 2 meses-2 años | - | 2005 |
| Luxemburgo | 13 meses | No | 2001 |
| Portugal | 3 y 5 meses | 15 meses | 2006 |
| Reino Unido | 3 y 4 meses | 12-13 meses | 1999 |
| Suiza | 12-15 meses | 11-15 años | 2006 |
En 2012, el Comité de Vacunación del Reino Unido (JCVI)40 recomendó cambiar a una estrategia 1+1+1 y en la adolescencia administrar la dosis a los 13-14 años (en base a que el nivel de colonización por meningococo era bajo antes de los 12 años aumentando posteriormente), similar a la pauta actualmente realizada en España, y sustentado en la baja circulación de la enfermedad a través de control de portadores. Con esta misma filosofía, parece razonable plantearse la utilización de vacunas más polivalentes en los niños mayores y adolescentes, que permitan un control más amplio de la enfermedad meningocócica a través de la erradicación de portadores y por tanto diseminadores de la enfermedad, en la edad en la que la tasa de portadores es más elevada. La utilización de estas pautas en el marco de salud publica estará supeditada a los estudios fármaco-económicos, y en el momento actual, las vacunas conjugadas polivalentes ACWY están restringidas a los viajeros a zonas endémicas y grupos concretos de alto riesgo.
c) Vacunas frente a meningococo B
El diseño de una vacuna eficaz frente al meningococo B ha sido una tarea muy compleja41. Durante más de 3 décadas se han seguido diferentes estrategias (tabla 3) con el propósito de conseguir una vacuna universal frente al serogrupo B del meningococo:
- •
Estrategia 1: el polisacárido capsular
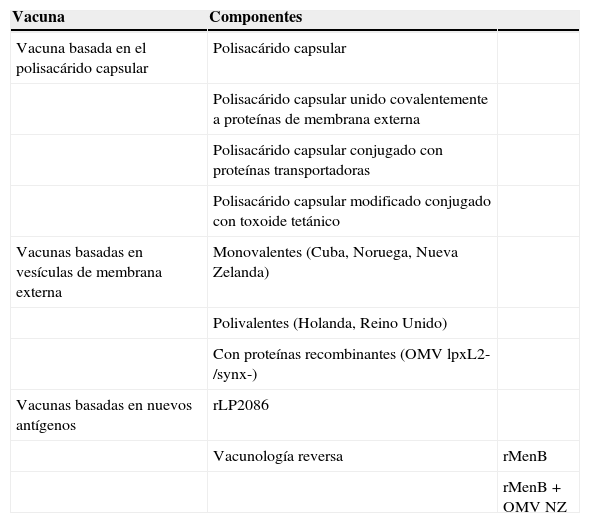
Estrategias de desarrollo vacunal frente al meningococo B
| Vacuna | Componentes | |
|---|---|---|
| Vacuna basada en el polisacárido capsular | Polisacárido capsular | |
| Polisacárido capsular unido covalentemente a proteínas de membrana externa | ||
| Polisacárido capsular conjugado con proteínas transportadoras | ||
| Polisacárido capsular modificado conjugado con toxoide tetánico | ||
| Vacunas basadas en vesículas de membrana externa | Monovalentes (Cuba, Noruega, Nueva Zelanda) | |
| Polivalentes (Holanda, Reino Unido) | ||
| Con proteínas recombinantes (OMV lpxL2-/synx-) | ||
| Vacunas basadas en nuevos antígenos | rLP2086 | |
| Vacunología reversa | rMenB | |
| rMenB + OMV NZ |
El primer intento de formulación de una vacuna frente al meningococo B se centró en el empleo del polisacárido capsular, tal y como se ha logrado con los demás serotipos, cuya inmunoprofilaxis se basa en la conjugación de dicho polisacárido con una proteína transportadora. Sin embargo, el polisacárido capsular del meningococo B presenta en su estructura un ácido siálico similar al presente en las células neuronales embrionarias humanas, concretamente, un polímero alfa 2-8 ligado al ácido N-acetilneuramínico que hace posible, por un lado, generar autoinmunidad y, por otro, inducir un fenómeno de tolerancia inmunitaria. De hecho, la inmunogenicidad de la primera vacuna desarrollada fue muy limitada.
Con el propósito de avanzar en el desarrollo de la vacuna, el polisacárido capsular se unió covalentemente a proteínas de membrana externa (OMP) pero tras los estudios in vivo las IgM detectadas presentaban vida media corta y poca avidez.
El paso siguiente se centró en la conjugación del polisacárido con proteínas transportadoras, como por ejemplo toxoide tetánico; el resultado no fue mucho más alentador ya que se puso de manifiesto tolerancia inmunológica a los glucopéptidos siálicos de la cápsula. Finalmente, previo a la conjugación se modificó también el polisacárido capsular, y aunque en este caso se encontró capacidad inmunógena en ratones, su empleo quedó limitado por poseer actividad generadora de autoanticuerpos.
- •
Estrategia 2: vesículas de membrana externa
La siguiente generación de vacunas se centró en las proteínas de membrana externa42. Estas proteínas se formularon como vesículas de membrana externa (OMV) que además incluían lipopolisacárido, proteínas periplásmicas y fosfolípidos.
De las diferentes proteínas de membrana externa que posee el meningococo B la porina A es la que ha demostrado mayor capacidad antigénica, sin embargo existen muchos tipos de porina A con capacidad antigénica específica frente a las distintas cepas de la bacteria. Esa especificidad hace muy útiles estas vacunas frente a cepas concretas de meningococo (“vacunas a la carta”), pero no para la prevención de la enfermedad de manera universal. Basándose en este tipo de formulación se desarrollaron 2 vacunas para el control de sendas epidemias en Noruega y Cuba, sin embargo esas formulaciones presentan una gran limitación, no protegen frente a la enfermedad a niños menores de 4 años donde se detectan las tasas de incidencia mayores.
Siguiendo en la misma línea de trabajo se preparó una vacuna basada en la cepa causante de una gran epidemia en Nueva Zelanda entre los años 1991 y 2001. Los resultados obtenidos tras la administración de esta vacuna fueron bastante esperanzadores ya que tras la tercera dosis de vacuna se logró una adecuada respuesta humoral en un 53% de los lactantes de edades comprendidas entre 6 y 8 semanas, en un 74-76% de los niños de edades comprendidas entre los 6 meses y los 12 años y en un 96% de los adultos que la recibieron. Los resultados mejoraron tras la administración de la dosis de recuerdo. Esta vacuna se ha utilizado en Nueva Zelanda hasta el año 2008, y se han publicado datos preliminares de efectividad de un 80% (52,5-91,6%) en niños de 6 meses a 5 años de edad, y de 84,8% (59,4-94,3%), para niños de 6 meses a 3 años de edad42.
Para aumentar la cobertura de la vacuna se diseñó un nuevo preparado hexavalente que incluía 6 porinas A (incluidas las de la cepa de Nueva Zelanda) repartidas en 2 vesículas de membrana externa. Los resultados tras la administración de la vacuna en niños de edades comprendidas entre las 8 semanas y los 8 años dependieron, en gran medida, del tipo de porina A que expresase el serosubtipo de meningococo, encontrándose precisamente la menor respuesta inmunitaria para los serotipos más comunes. Otra conclusión importante que se derivó de este estudio es la dificultad de la vacuna para lograr inmunidad a largo plazo ya que a los 32-42 meses de edad los niños presentaban valores de anticuerpos similares a los que tenían antes de la administración de la primera dosis de vacuna. Se logró un discreto incremento en la cobertura de la vacuna al incluir en la formulación una tercera vesícula con 3 porinas adicionales. El paso siguiente ha sido combinar distintas vesículas, algunas con porina A y otras con proteínas de membrana minoritarias y lipopolisacáridos. Las limitaciones de este tipo de vacunas radican en el propio proceso de preparación, ya que para la extracción del lipopolisacárido tóxico se emplean agentes tensoactivos que pueden eliminar también antígenos de superficie esenciales. Además, la cobertura de la vacuna siguió siendo limitada. Por otro lado, la limitada persistencia de la respuesta inmunitaria conllevaría la necesidad de administración de numerosas dosis de vacuna. Más recientemente se ha desarrollado un prototipo basado en OMV de una cepa modificada genéticamente, de momento sólo ensayada en adultos.
- •
Estrategia 3: rLP2086
La identificación de la lipoproteína de membrana externa LP2086 (GNA1870), conocida también como proteína de unión del factor H humano (fHbp), supuso un gran avance en la búsqueda de la vacuna universal frente al meningococo B. Esta lipoproteína es una proteína de superficie que se expresa en casi todas las cepas aisladas de meningococo B y se ha visto que es capaz de generar anticuerpos en humanos. La LP2086 es la responsable de reclutar factor H del complemento en la superficie de la bacteria provocando la desregulación del complemento, logrando aumentar la supervivencia de la bacteria en un 50%.
De acuerdo con las secuencias de aminoácidos de la lipoproteína, LP2086 puede clasificarse en 2 subfamilias, A y B, de forma que en la vacuna recombinante, rLP2086, se ha incluido un miembro de cada familia con el fin de extender su cobertura a todas las cepas de meningococo B43. Esta vacuna bivalente ha sido aprobada el pasado mes de octubre por la agencia reguladora americana (FDA) bajo el nombre comercial de Trumenba® (Pfizer). Esta vacuna está indicada para la prevención de enfermedad meningocócica invasiva causada por el serotipo B en pacientes de 10 a 25 años de edad. La pauta de vacunación comprende 3 dosis administradas según el esquema 0, 2, 6 meses. Fuera de este rango de edad, su desarrollo clínico no se ha completado aun, y en particular, en lactantes menores de 1 año, su elevada reactogenicidad (en forma de fiebre fundamentalmente) obligó a la suspensión del desarrollo clínico para esta población44.
En cuanto a la eficacia, la vacuna ha sido aprobada en EE. UU. basándose en su respuesta inmune medida por la actividad bactericida del suero contra cuatro de las cepas del serogrupo B más prevalentes en EE. UU. La efectividad clínica de la vacuna aún no ha sido confirmada.
- •
Estrategia 4: vacunología reversa o inversa:
La vacunología reversa o inversa parte de la secuencia genómica del microorganismo para identificar aquellos antígenos que puedan llegar a ser candidatos vacunales45,46. Esta secuencia es estudiada mediante un software bioinformático específico que analiza marcos abiertos de lectura (ORF, Open Reading Frames), es decir, genes conocidos y fragmentos de ADN que potencialmente pueden codificar diferentes tipos de proteínas de expresión de la superficie de la bacteria (aun sin conocer su función, regulación, etc.), estableciendo aquellas regiones que pueden tener ciertas funciones. Así, se consigue predecir los antígenos que tienen más probabilidades de ser candidatos para la formulación de una vacuna. Tras la selección de estos antígenos, se formulan las vacunas con ellos y se testan en modelos animales, para desarrollar posteriormente la vacuna final que pasará al desarrollo clínico.
El empleo de esta técnica permitió diseñar con éxito la única vacuna universal frente al meningococo B, y que ya ha sido autorizada por procedimiento centralizado por la Unión Europea, por la FDA americana y las agencias australiana o canadiense, entre otras.
De estos 28 antígenos detectados, 3 fueron finalmente incluidos en la composición final de la vacuna. Los 3 antígenos que cumplieron estos criterios fueron NHBA o GNA2132 (el antígeno de unión a la heparina de Neisseria, Neisserial heparin-binding antigen), fHbp o GNA1870 (proteína de unión al factor H, factor H binding protein) y NadA o GNA1994 (adhesina de Neisseria A, Neisserial adhesin A). Además, también se incluyeron los antígenos GNA1030 y GNA2091 porque indujeron inmunidad protectora en algunos ensayos y se fusionaron con NHBA y fHbp, respectivamente. Los antígenos incluidos en la vacuna tienen sus funciones en la bacteria, concretamente:
- •
NadA: existen 5 variantes (Nad1-Nad5). Su función es promover la adhesión e invasión de las células epiteliales del huésped, por lo que puede tener un papel importante en los portadores de la enfermedad. Además, se une a las células dendríticas derivadas de los monocitos y a los macrófagos, lo que puede mejorar la respuesta inmune del NadA tras su ingestión y presentación a los linfocitos. Así, la creación de anticuerpos específicos contra esta proteína puede interferir en la colonización y, por tanto, prevenir el estado de portador, aunque se desconoce todavía el impacto real sobre la condición de portador.
- •
fHbp: esta lipoproteína se une al inhibidor de la vía alternativa al complemento del huésped (Factor H), evadiendo así la acción del complemento y aumentando la supervivencia de la bacteria. In vitro se ha visto que se une también a la enterobactina siderófora de la bacteria. Bloquear esta lipoproteína mejoraría la capacidad de nuestro sistema inmune para eliminar el microorganismo.
- •
NHBA: es una lipoproteína de superficie de N. meningitidis, objetivo de proteasas humanas y meningoco¿cicas que, in vitro, se une a la heparina. En ausencia de la cápsula bacteriana, su unión a la heparina mejora la supervivencia de la bacteria en el suero humano y podría facilitar su unión a tejidos del huésped. No obstante, este antígeno es aún poco conocido.
- •
OMVnz: las vesículas OMV proceden de una cepa epidémica de Nueva Zelanda, NZ 98/254 (B:4:P1.7-2,4), y fueron utilizadas para la creación de vacunas para hacer frente a una epidemia en ese país. Sin embargo, su protección es muy específica, ya que se debe principalmente a su antígeno inmunodominante PorA, que es muy variable. Su inclusión en la vacuna 4CMenB incrementa su inmunogenicidad además de ofrecer protección para las cepas que expresan el serosubtipo de PorA P1.4.
El desarrollo clínico que permitió la aprobación del 4CMenB (Bexsero®) incluyo más de 8000 lactantes, niños, adolescentes y adultos47. En función del desarrollo clínico se puede afirmar que el perfil de seguridad del Bexsero® es adecuado. En lactantes y niños menores de 2 años, las reacciones adversas locales y sistémicas más comúnmente observadas fueron el dolor agudo a la presión y eritema en el lugar de inyección, fiebre e irritabilidad. En los estudios clínicos en lactantes, la fiebre se manifestó más frecuentemente cuando 4CMenB se coadministraba con las vacunas sistemáticas que cuando se administraba sola. Cuando 4CMenB se administró sola la frecuencia de aparición de fiebre fue similar a la asociada con las vacunas sistemáticas administradas durante los ensayos clínicos. Cuando apareció la fiebre, normalmente siguió un patrón predecible y autolimitado (inicio a las 6 horas, pico al segundo día, cese al tercer día), clínicamente poco significativo, y se puede prevenir con la administración profiláctica de paracetamol.
En un estudio realizado con un panel de 1.052 cepas de MenB de 5 países europeos (EU5: Alemania, Francia, Inglaterra y Gales, Italia y Noruega) se ha estimado que un 73-87% serían cubiertas por 4CMenB. Los datos obtenidos en un estudio similar en España muestran una cobertura potencial del 69%, solo ligeramente inferior a la observada en el estudio EU5. Esta diferencia puede estar relacionada con una distribución diferente de las líneas clonales de meningococo asociadas a casos clínicos en España47.
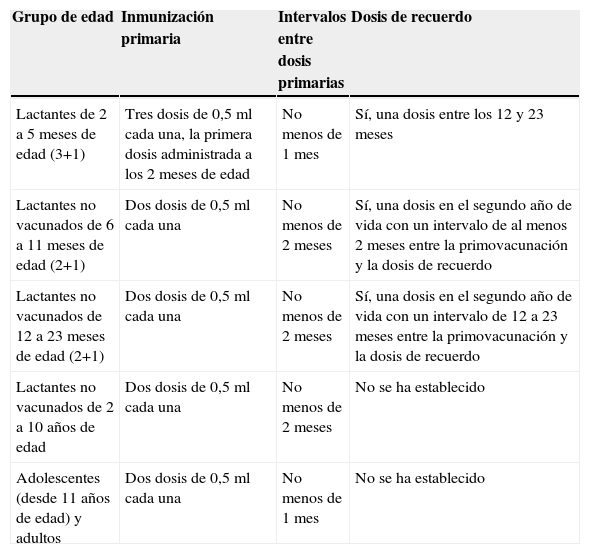
Bexsero® está indicado para la inmunización activa de individuos a partir de 2 meses de edad frente a la enfermedad meningocócica invasiva causada por Neisseria meningitidis grupo B. La vacuna se administra mediante inyección intramuscular profunda, preferiblemente en la zona anterolateral del muslo en niños o en la zona del músculo deltoide del brazo en pacientes mayores. El número de dosis de vacuna a administrar depende del grupo de edad considerado tal y como se recoge en la tabla 4.
Pautas vacunales propuestas para Bexsero®
| Grupo de edad | Inmunización primaria | Intervalos entre dosis primarias | Dosis de recuerdo |
|---|---|---|---|
| Lactantes de 2 a 5 meses de edad (3+1) | Tres dosis de 0,5ml cada una, la primera dosis administrada a los 2 meses de edad | No menos de 1 mes | Sí, una dosis entre los 12 y 23 meses |
| Lactantes no vacunados de 6 a 11 meses de edad (2+1) | Dos dosis de 0,5ml cada una | No menos de 2 meses | Sí, una dosis en el segundo año de vida con un intervalo de al menos 2 meses entre la primovacunación y la dosis de recuerdo |
| Lactantes no vacunados de 12 a 23 meses de edad (2+1) | Dos dosis de 0,5ml cada una | No menos de 2 meses | Sí, una dosis en el segundo año de vida con un intervalo de 12 a 23 meses entre la primovacunación y la dosis de recuerdo |
| Lactantes no vacunados de 2 a 10 años de edad | Dos dosis de 0,5ml cada una | No menos de 2 meses | No se ha establecido |
| Adolescentes (desde 11 años de edad) y adultos | Dos dosis de 0,5ml cada una | No menos de 1 mes | No se ha establecido |
En enero de 2013 la Comisión Europea autorizó por procedimiento centralizado la vacuna frente a la enfermedad invasora por meningococo de serogrupo B, Bexsero®, de la Compañía Farmacéutica Novartis and Diagnostics S.L. bajo la indicación de protección activa frente a enfermedad invasora por meningococo de serogrupo B en personas ≥ 2 meses de edad.
Esta vacuna está disponible en Alemania, Francia, Portugal, República Checa, Italia, Reino Unido, Irlanda, Grecia, Austria, Polonia y Hungría, así como en países fuera de la UE como Estados Unidos, Australia o Canadá. En algunos de estos países también se ha aprobado la inclusión de la vacuna en los programas nacionales o regionales de inmunización, como Reino Unido, Alemania (Saxonia), Italia (Basilicata, Puglia y Toscana), República Checa, Australia y Canadá (Quebec).
La situación en España es diferente: El 5 de abril de 2013 la Agencia Española del Medicamento en el Informe de utilidad terapéutica de la vacuna meningocócica del grupo B, Bexsero®, aprueba la vacuna pero la restringe la vacuna a su Uso Hospitalario. Justifican tal decisión en la ausencia de datos de eficacia clínica con la vacuna, en la incidencia contenida de enfermedad meningocócica por serogrupo B, y permanecen a la espera de obtener datos de efectividad post-autorización.
La Ponencia de Programas y Registro de Vacunaciones reconoce el importante avance que supone disponer de una vacuna frente a la enfermedad meningocócica por serogrupo B y la ventaja que en términos de salud pública podría suponer su utilización en un programa poblacional si así se considerara. De hecho afirman que con la vacunación sistemática podrían prevenirse 631 casos en menores de 5 años de edad y 4.784,3 años de vida perdidos ajustados por discapacidad en los próximos 5 años48. Sin embargo teniendo en cuenta la información disponible y la situación epidemiológica, en el momento actual las autoridades sanitarias españolas no consideran justificada la inclusión de esta vacuna en el calendario sistemático de vacunaciones. En este momento las indicaciones financiadas estarían restringidas a los siguientes grupos poblacionales48,49:
- •
Personas con deficiencia de properdina o con deficiencias de factores terminales del complemento (incluyendo las que reciben o van a recibir eculizumab).
- •
Personas con asplenia o disfunción esplénica grave (anemia de células falciformes) y en aquellos con resección quirúrgica programada.
- •
Personas que han sufrido un episodio de EMI (inicialmente se contemplaba más de un episodio pero basándose en estudios que demuestran que el haber padecido un episodio incrementa el riesgo de padecer episodios posteriores.
- •
Personal de laboratorio (técnicos de laboratorio y microbiólogos) que trabaje con muestras que potencialmente puedan contener N. meningitidis.
El procedimiento de actuación en el supuesto de brotes o casos aislados de enfermedad meningocócica por serogrupo B, descrito en dicho documento indica lo siguiente:
- •
En agrupaciones de casos o brotes, definidos por la aparición de dos o más casos confirmados de enfermedad meningocócica por serogrupo B que cumplan además las dos características siguientes:
- –
en la misma institución, organización o grupo social.
- –
en un periodo de tiempo ≤ 4 semanas.
- –
- •
En brotes comunitarios, definidos como aparición de tres o más casos confirmados de enfermedad meningocócica por serogrupo B que cumplan además las dos características siguientes:
- –
en un ámbito comunitario definido.
- –
en un periodo de tiempo ≤ 3 meses.
- –
- •
Situaciones de hiperendemia, definida por la aparición gradual y potencialmente duradera de un clon cubierto por la vacuna en un área geográfica.
- •
Otras situaciones particulares en las que la autoridad sanitaria establezca la necesidad de vacunación.
Esta decisión ha contado con la desaprobación y crítica unánimes por la comunidad científica. Si bien es cierto que al igual que en otros países europeos, la incidencia de la enfermedad meningocócica B en España se encuentra en su nivel más bajo en las últimas décadas, no es menos cierto que esa incidencia es casi la mismo que la registrada para la enfermedad meningocócica causada por el serogrupo C en 2001, cuando se introdujo en el programa de inmunización nacional la vacuna conjugada antimeningocócica frente a este serogrupo. Además, la mortalidad y la morbilidad asociada permanecen en tasas estables e inaceptablemente altas, más aún cuando se dispone de una herramienta preventiva. Si el mismo criterio se hubiera adoptado en su día respecto a la vacunación frente a meningococo C, todavía estarían falleciendo niños y adolescentes como consecuencia de esta enfermedad. El enfoque de “esperar y ver” no creemos, al igual que las sociedades científicas y expertos más representativos de nuestro país, que sea el planteamiento correcto en el caso de una enfermedad impredecible, dinámica y agresiva como es la enfermedad meningocócica.50,51
ConclusionesLa prevención primaria de la enfermedad meningocócica es esencial para el control de la misma teniendo en cuenta su elevada morbi-mortalidad a pesar de instaurarse a tiempo el tratamiento óptimo ya que la incidencia de cepas resistentes a los antibióticos va en aumento y que la administración de quimioprofilaxis a los contactos a veces es compleja y su efectividad limitada.
Las campañas de vacunación antimeningocócica han tenido éxito en España y en otros países para reducir los incrementos de la incidencia producidos por los serogrupos incluidos en las vacunas disponibles. La llegada de una nueva generación de vacunas conjugadas polivalentes, vacunas de antígenos proteicos, y próximamente mixtas, obliga a adaptar las estrategias de vacunación en función del escenario epidemiológico y los recursos disponibles. Tanto para la toma de decisiones como su seguimiento posterior, será esencial mantener un eficiente sistema de vigilancia, que permita detectar precozmente cualquier cambio en la incidencia de la enfermedad y establecer las ajustes necesarios en las estrategias de prevención y control.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion