En los países occidentales están comercializadas dos vacunas de la varicela atenuadas derivadas de la cepa OKA: Varilrix® de GlaxoSmithKline (cepa OKA/RIT) y Varivax® de Merck Sharp and Dohme (cepa OKA/Merck). Por el momento en España la vacunación antivaricela solo está incluida en el calendario oficial de vacunaciones para su administración a los adolescentes que no hayan padecido la enfermedad. Dados los buenos resultados obtenidos en Navarra y Madrid con la administración universal de la vacuna a la población infantil, de cara al futuro sería conveniente la inclusión de la vacuna en el calendario de vacunaciones sistemáticas, administrando dos dosis a los 15-18 meses de edad.
La eficacia protectora de la vacuna atenuada frente al herpes zóster ha sido evaluada en el «Shingles Prevention Study». A corto plazo (0-4 años) la vacuna disminuye en un 53% la incidencia de herpes zóster, en un 66% la de neuralgia posherpética y en un 61% la carga de la enfermedad en las personas de 60 o más años inmunocompetentes. Otro estudio ha demostrado la eficacia protectora en las personas de 50 a 59 años. Con el tiempo la eficacia protectora disminuye pero se mantiene a niveles aceptables, sobre todo para la neuralgia posherpética y la carga de la enfermedad.
Muy recientemente se han publicado los resultados de un ensayo clínico controlado (fase III) efectuado en 18 países para evaluar la eficacia protectora de la vacuna inactivada de subunidades (glicoproteína E) adyuvada con el adyuvante AS01B. La vacuna reduce de forma significativa la incidencia de herpes zóster a corto plazo (3,2 años) en las personas de 50 o más años. Es de destacar que la protección vacunal no disminuye con la edad en el momento de la vacunación, oscilando entre el 96,8 y el 97,9% en todos los grupos de edad.
In Western countries, two attenuated varicella vaccines derived from the OKA strain are licensed: Varilrix® GlaxoSmithKline (OKA/RIT strain) and Varivax® Merck Sharp and Dohme (OKA/Merck strain). Currently, in Spain, varicella vaccination is only included in the Ministry of Health, Social Services and Equality official vaccination calendar for administration in adolescents who have not had the disease. Given the good results obtained in Navarra and Madrid with universal administration of the vaccine in children, it would be desirable to include the vaccine in the routine immunization schedule, with the administration of two doses at 15-18 months of age in the future.
The protective efficacy of the attenuated herpes zoster vaccine was evaluated in the Shingles Prevention Study, which showed that in the short term (0-4 years) the vaccine reduced the incidence of herpes zoster by 53%, post-herpetic neuralgia by 66%, and the disease burden in immunocompetent persons aged ≥60 years by 61%. Another study demonstrated protective efficacy in persons aged 50-59 years. Over time, the protective efficacy decreases, but remains at acceptable levels, especially for post-herpetic neuralgia and the disease burden.
Recently, the results of a controlled clinical trial (phase III) conducted in 18 countries to assess the protective efficacy of the inactivated subunit vaccine (glycoprotein E) adjuvanted with the adjuvant AS01B were published. The study inferred that the vaccine significantly reduced the incidence of herpes zoster in the short term (3.2 years) in people aged ≥50 years. Vaccine protection did not decrease with age at vaccination, ranging between 96.8% and 97.9% in all age groups.
El virus de la varicela zóster (VVZ) es un alfa-herpes virus que causa dos enfermedades en la especie humana: la varicela que es la infección primaria, y el herpes zóster, ocasionado por la reactivación endógena de los virus que persisten de forma latente en los ganglios de las raíces sensoriales dorsales o craneales después de la infección primaria1,2. Esta reactivación se produce, por lo general, al disminuir la inmunidad celular frente al virus por diferentes causas (inmunosenescencia ligada a la edad y enfermedades que deprimen la inmunidad celular) mientras se mantiene la inmunidad humoral1,2. La infección latente se produce en la mayoría de los primoinfectados por el virus, pero solo el 25-30% de los infectados desarrollan el herpes zóster en algún momento de su vida1–4.
En la actualidad se dispone de vacunas de virus vivos atenuados para la prevención de estas dos enfermedades: la «vacuna atenuada de la varicela»5 para la prevención de la infección primaria por el VVZ y la «vacuna atenuada frente al herpes zóster»6,7 para la prevención de la reactivación endógena clínica por el VVZ latente en los ganglios sensoriales de las raíces dorsales o craneales de los individuos previamente infectados por el virus4. Una vacuna inactivada de subunidades (glicoproteína E), adyuvada con el adyuvante AS01B, para la prevención del herpes zóster está en fase avanzada de investigación7.
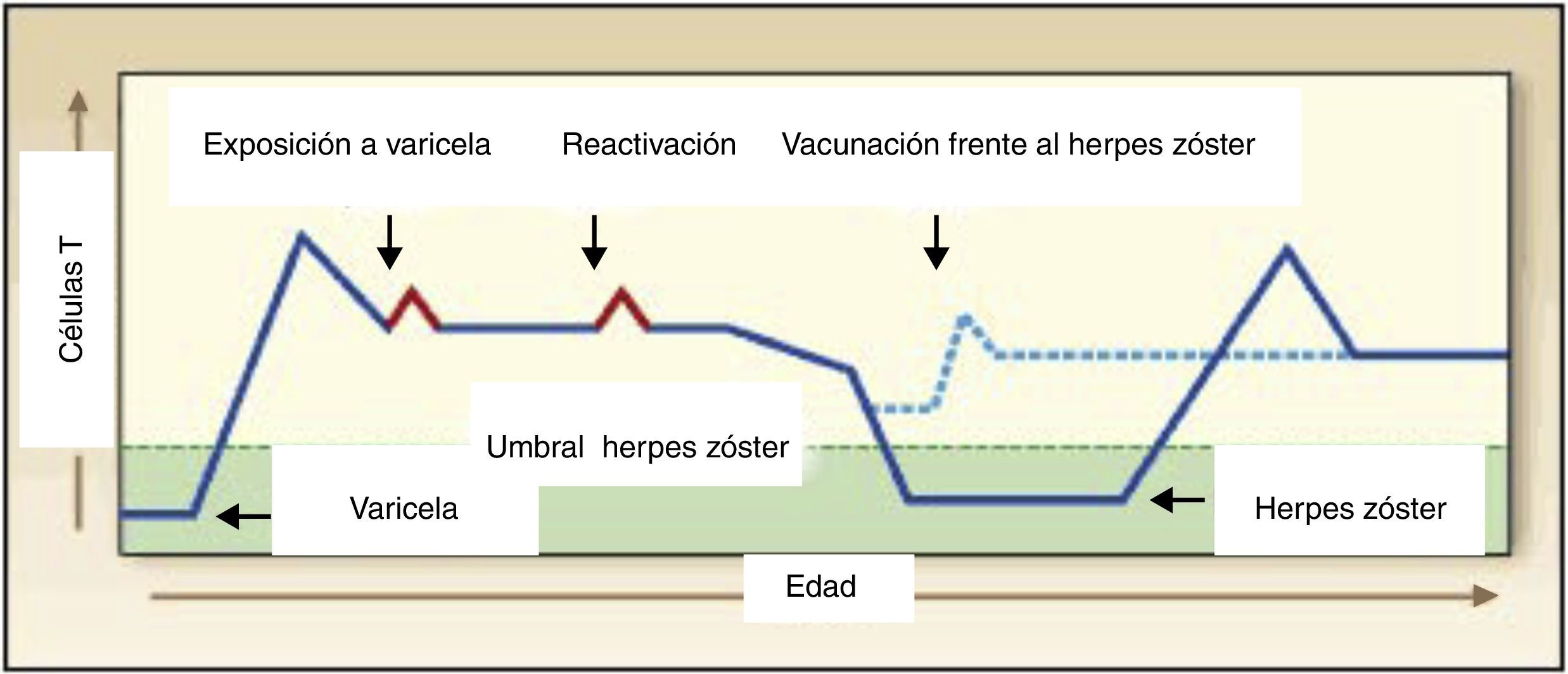
Historia natural de la infección por el virus de la varicela zósterPara comprender el mecanismo de acción de las vacunas frente a la varicela y frente al herpes zóster, es fundamental conocer la historia natural de la infección por el VVZ (fig. 1)8–12.
Tras la infección primaria por el VVZ (varicela) el sistema inmunitario del huésped infectado responde a las glicoproteínas de superficie del virus con respuestas humorales y celulares13. Estos antígenos estimulan a los linfocitos B y T vírgenes, produciendo una proliferación clonal de linfocitos B y T sensibilizados frente al VVZ12,13. Los linfocitos B sensibilizados (células plasmáticas) producen anticuerpos del tipo IgM en la fase aguda e IgG a partir de las tres semanas del inicio de la infección12,13. Los linfocitos Tc producidos en la fase aguda son en gran parte los responsables de la resolución en forma favorable de la enfermedad12,13.
También se producen linfocitos B y T de memoria12–14. Los primeros, con el soporte de los linfocitos Th de memoria, son los encargados de la producción continuada de anticuerpos IgG específicos frente a la infección durante muchos años, probablemente durante toda la vida y son los responsables de la protección frente a la varicela clínica en caso de futuras exposiciones al virus salvaje12–14. Los linfocitos Tc de memoria se encargan de mantener el virus en estado de latencia en los ganglios sensoriales de las raíces nerviosas sensoriales dorsales o craneales12–14. Hoy en día se sabe que los virus también infectan y se mantienen latentes en las neuronas de los ganglios sensoriales entéricos (fig. 2)15–18. Precisamente, la disminución de la inmunidad celular específica frente al VVZ, ya sea como consecuencia de la edad o por el padecimiento de una enfermedad que deprime el sistema inmunitario celular, abre el camino para que los virus latentes se reactiven y a través de los nervios correspondientes lleguen a la piel y den lugar al cuadro clínico del herpes zóster10–19. El dolor que a menudo acompaña a las vesículas se debe a la inflamación de los ganglios sensoriales ocasionada por los virus reactivados11.
Rutas potenciales tomadas por el VVZ durante su ciclo vital.
Fuente: Gershon et al.16.
El herpes zóster, la infección secundaria producida por el VVZ, ocurre cuando la inmunidad celular específica frente a este virus desciende por debajo de unos niveles que impiden el mantenimiento de la latencia del virus (fig. 3)10–19.
Inmunidad celular específica frente al VVZ según la edad en personas inmunocompetentes.
*Medida mediante el test de proliferación linfocítica.
Fuente: Levin et al.17.
La evidencia científica disponible parece indicar que la inmunidad frente al VVZ es reforzada periódicamente bien por la exposición al virus salvaje o como consecuencia de una reactivación silenciosa del virus latente, lo que no daría lugar al cuadro clínico de herpes zóster, pero reforzaría la inmunidad celular frente a este virus (fig. 3)9–20.
A pesar de todos estos hipotéticos refuerzos, los estudios que han medido la evolución con la edad de la inmunidad celular específica frente al VVZ (proliferación de linfocitos Tc sensibilizados, producción de interferon-γ), han puesto de manifiesto un declive progresivo con la edad de la inmunidad celular específica al VVZ en los individuos inmunocompetentes (fig. 3)21,22. Este descenso se correlaciona de forma estrecha con el incremento de la incidencia de herpes zóster según la edad19,21,22.
Las vacunas antivaricela atenuada3,5 y frente al herpes zóster (atenuada e inactivada)6,7,23 pueden modificar la historia natural de la infección por el VVZ12.
La vacuna antivaricela atenuada es de bajo contenido antigénico (< de 2.000 unidades formadoras de placa –ufp–) y tiene por objeto la prevención de la infección por el VVZ, reduciendo la incidencia de la enfermedad, igual que las demás vacunas comercializadas hasta el momento para la prevención de las enfermedades inmunoprevenibles3,5. Administrada a los niños que todavía no han entrado en contacto con el virus, desencadena una respuesta inmunitaria humoral y celular parecida a la de la infección natural, aunque de menor intensidad, que los va a proteger frente al padecimiento de la enfermedad clínica en futuros contactos con el virus5.
La vacuna frente al herpes zóster atenuada es la misma vacuna de la varicela atenuada, pero con contenido antigénico mucho más elevado (más de 18.000 ufp)7. Su objetivo es la reducción de la incidencia y de la gravedad del herpes zóster. Administrada en los individuos previamente infectados por el VVZ incrementa la inmunidad celular específica frente a la infección y modifica la historia natural de la enfermedad, reduciendo o eliminando el riesgo de reactivación de los virus latentes en los ganglios sensoriales5. Lo mismo ocurre con la nueva vacuna inactivada de subunidades (glicoproteína E) adyuvada con AS01B23.
La observación de que la incidencia y gravedad del herpes zóster se incrementan con el deterioro progresivo de la inmunidad celular específica frente al VVZ que se produce al aumentar la edad (fig. 3)19,21,22 junto con la constatación de que las recidivas de herpes zóster son muy poco frecuentes en los individuos inmunocompetentes, posiblemente porque la reactivación del virus que causa la enfermedad da lugar a un refuerzo de la inmunidad celular que los protege frente a posteriores episodios de herpes zóster24–26, condujo a Levin a formular la hipótesis de que la vacunación de los ancianos inmunocompetentes con la vacuna antivaricela atenuada, podría incrementar la inmunidad celular específica frente al VVZ y reducir la incidencia y gravedad de la enfermedad en los individuos vacunados24–27. Dado que las respuestas inmunitarias en las personas mayores están disminuidas, desde el primer momento se consideró que la carga antigénica de la vacuna debía ser incrementada considerablemente para obtener resultados significativos28.
El primer enunciado de la hipótesis ha sido confirmado por varios estudios de inmunogenicidad que han demostrado que la vacunación de los ancianos inmunocompetentes con la vacuna de la varicela atenuada de elevada potencia antigénica (>19.400 ufp por dosis) incrementa la inmunidad humoral y celular específica frente al VVZ24–27. La vacuna induce incrementos significativos de los niveles medios de anticuerpos antiVZ específicos, los índices de proliferación linfocítica, la frecuencia de células respondedoras T específicas y la secreción de interferon-γ en las personas mayores26–29. El segundo ha sido probado en dos ensayos clínicos controlados, el primero realizado por Oxman et al. en personas inmunocompetentes de más de 60 años de Estados Unidos (Shingles Prevention Study)30, y el segundo por Schmader et al. en personas inmunocompetentes de 50 a 59 años residentes en América del Norte y Europa31.
La vacuna HZ/su de subunidades adyuvada con el adyuvante AS01B también ha confirmado los dos enunciados de la hipótesis formulada por Levin, habiéndose observado incrementos de los niveles de inmunidad celular de alrededor de 9 veces32,33 y eficacias protectoras frente al herpes zóster cercanas al 100%33,34.
Vacunación frente a la varicelaCarga de la enfermedadLa varicela es una enfermedad de padecimiento universal. La mayoría de las infecciones cursan en forma clínica aparente con diferentes grados de intensidad, aunque se estima que un 5% pueden cursar de forma asintomática35,36.
La incidencia anual equivale, pues, en la práctica, a la cohorte de recién nacidos después de descontar el 5% de casos asintomáticos3. En España, en la época prevacunal, se declaraban unos 300.000 casos al año de promedio, pero es probable que la incidencia real fuera mayor y se aproximara a la cohorte de recién nacidos (unos 400.000 casos al año)3.
No se dispone de datos sobre la incidencia específica por edades de la varicela a nivel nacional en España. Según los datos de incidencia disponibles en algunas Comunidades Autónomas y los resultados de las encuestas seroepidemiológicas, la infección por el virus de la varicela sería de adquisición precoz afectando predominantemente a los niños de edad preescolar y escolar37–42.
En un estudio efectuado por Salleras et al40 en 1996, en muestras representativas de la población infantil y adulta de Cataluña, el 85% de los niños de 5 a 9 años de edad ya había padecido la enfermedad40. En este mismo estudio se puso de manifiesto la existencia de un vacío de inmunidad de alrededor del 5% en el grupo de edad de 15 a 34 años, que desaparece a partir de los 35 años, lo que es indicativo de que un pequeño, aunque significativo, porcentaje de casos de la enfermedad ocurren en la edad adulta, período en el que son más frecuentes las complicaciones40. Un estudio efectuado más recientemente, en el año 2002, proporcionó resultados similares41. Un reciente estudio efectuado en el País Vasco ha mostrado resultados semejantes42.
Tradicionalmente se consideraba que la varicela era una enfermedad infecciosa transmisible propia de la infancia, de carácter universal y muy benigna, con poca o nula transcendencia sanitaria3,43. Cuando se han analizado las complicaciones y muertes relacionadas con la enfermedad se ha visto que las cosas no son tan simples44–46.
La mayoría de los casos se dan en niños sanos y curan espontáneamente sin complicaciones. No obstante, aunque con poca frecuencia, algunos casos se complican y dan lugar a una cierta morbilidad hospitalaria y mortalidad. Las complicaciones más frecuentes son las sobreinfecciones bacterianas (estreptococos y estafilococos sobre todo) de la piel, los pulmones (neumonías) y los huesos, la deshidratación, el síndrome de Reye (a menudo asociado con la administración de aspirina), la encefalitis, la ataxia cerebelosa, la hepatitis, la glomerulonefritis y la artritis5,46,47.
En los adultos las complicaciones son mucho más frecuentes48. De hecho, una varicela padecida en la edad adulta es 25 veces más probable que presente un curso grave que una varicela padecida en la edad infantil36. En un brote de varicela que afectó a 28 inmigrantes mejicanos que trabajaban en un matadero de pollos en una población de la frontera entre Estados Unidos y Méjico, el 28% de los afectados padecieron formas graves de la enfermedad y tuvieron que ser hospitalizados49,50. Los adultos inmigrantes procedentes de países tropicales tienen especial riesgo de contraer la enfermedad, tal como queda demostrado en este brote. En una encuesta epidemiológica efectuada en los inmigrantes compañeros de trabajo o de residencia de los afectados, se encontró que el 20% eran susceptibles a la enfermedad, tasa mucho más elevada que la observada en los trabajadores nacidos en Estados Unidos (3%)49,50.
En un estudio efectuado en Arabia Saudita entre los trabajadores sanitarios extranjeros que eran contratados por primera vez en el país, se encontró que el 23% de los trabajadores asiáticos, el 16% de los sudafricanos y el 13% de los procedentes de Oriente Medio eran susceptibles a la varicela. En cambio, solo el 9% de los procedentes de países occidentales era seronegativo51.
En los individuos inmunodeprimidos (por ejemplo, en los leucémicos que contraen la enfermedad mientras están sometidos a radioterapia o quimioterapia y en los pacientes que tienen deprimida la inmunidad celular) la varicela suele ser muy grave y adoptar la forma generalizada. Antes de la introducción de la quimioterapia antivírica específica la letalidad en estos casos oscilaba entre el 7 y el 28%52,53.
Por último, hoy en día se sabe que la infección contraída durante el primero o segundo trimestre del embarazo puede provocar el síndrome de la varicela congénita (lesiones cicatrizales de la piel, anomalías oculares, deformaciones del paladar, retraso mental y muerte precoz en el período neonatal)54. Este síndrome es muy poco frecuente (se han publicado relativamente pocos casos en la bibliografía) y puede producirse también por el padecimiento del zóster durante el embarazo (un 7% de los casos publicados). El análisis de los resultados de 5 grandes estudios prospectivos publicados en la bibliografía permite estimar que el 2% de los fetos de las gestantes susceptibles infectadas durante el primero o segundo trimestre del embarazo desarrollaron el síndrome de la varicela congénita54. En Estados Unidos se estiman en unas 2.000 las gestantes infectadas anualmente, lo cual permite predecir en ausencia de vacunación una incidencia de 40 niños afectados por el síndrome cada año, aunque muchos de ellos no son diagnosticados correctamente54. También reviste especial gravedad la varicela perinatal cuando la madre contrae la enfermedad en los últimos días de la gestación y la contagia al feto, que carece de inmunidad pasiva transplacentaria54.
En la población sana, las tasas más elevadas de hospitalizaciones y de muertes se registran en los adultos y en los lactantes43,46,55,56.
Según Coplan et al., antes de la introducción de la vacunación se producían más de 11.000 hospitalizaciones al año por varicela en Estados Unidos57. Cerca del 30% ocurrían en adultos de 20 o más años, colectivo en el que ocurrían menos del 5% del total de casos. El coste total anual de estas hospitalizaciones era de unos 161 millones de dólares al año, la tercera parte de los cuales correspondían a la hospitalización de adultos57. Lopez et al. en un estudio efectuado recientemente en base a las mismas fuentes ha estimado en unas 10.600 las hospitalizaciones por varicela en Estados Unidos en la época prevacunal (1988-1995)58.
Una investigación reciente efectuada por Gil et al.59 en base a los datos del CMBD ha estimado que de promedio se producen unas 1.500 hospitalizaciones al año por varicela en España, el 41% de las cuales corresponden a adolescentes y adultos.
En otro artículo anterior60 los mismos autores estimaron que la varicela es responsable de unos 6.350 días de hospitalización al año en España, de los cuales 3.333 corresponden a adolescentes y adultos. El coste anual es de 1,7 millones de euros, de los cuales 500.000 corresponden a las personas de ≥10 años.
En los países en los que todavía no se ha introducido la vacunación universal, la mortalidad como consecuencia de las complicaciones de la varicela es importante, sobre todo en los lactantes, en los niños inmunodeprimidos y en los adultos5,46,61.
En Estados Unidos, antes de la incorporación de la vacuna de la varicela al calendario de vacunaciones sistemáticas, durante el período 1980-1990, se observa que las tasas más elevadas de letalidad se daban en los adultos (17 por 100.000 casos) y en los lactantes (7 por 100.000 casos)61. En las edades escolar y preescolar, en las que se dan la mayor parte de los casos de la enfermedad, la letalidad era muy baja. En los años 80 del pasado siglo en Estados Unidos los lactantes y los adultos tenían 10 y 24 veces más probabilidades de morir como consecuencia de las complicaciones de la varicela si la contraían que los niños en edad preescolar de 1 a 4 años61.
Un estudio efectuado por Nguyen et al.62 en 2005 encontró que en Estados Unidos, en la época prevacunal ocurrían un promedio de 145 muertes al año (tasa de 0,56 por millón de habitantes). La varicela figuraba como causa básica en 105 de ellos y como causa contribuyente en los cuarenta restantes. El 33,61% de estas muertes ocurrían en niños de menos de 10 años, el 8,71% en adolescentes y jóvenes de 10 a 19 años, el 48,64% en adultos de 20 a 49 años y el 24,76% en adultos de 50 o más años. Los casos en la edad adulta eran pocos, pero como las complicaciones eran relativamente frecuentes, las muertes por varicela en adultos suponían los 2/3 del total de muertes.
En España durante el período 1999-2000, se han registrado un promedio de 15 muertes por varicela al año, el 1% de los casos ingresados en el hospital (Gil et al.)60. El 90,3% ocurrió en personas de 10 o más años. Tomando el promedio de 15,5 muertes al año, la tasa anual de mortalidad por varicela sería de 0,37 por millón de habitantes. Es probable que esta tasa infraestime la mortalidad real a la vista de los datos de Estados Unidos que se acaban de mencionar. Aplicando la tasa de Estados Unidos a la población española, el número de muertes por varicela al año en España sería de 23, el 73,4% de los cuales ocurrirían en adultos.
Vacunas frente a la varicelaLa primera vacuna de virus vivos atenuados para prevenir la varicela (cepa OKA) fue desarrollada por Takahashi en 197463. Esta vacuna fue registrada, en Japón, en 1987 para uso exclusivo en pacientes inmunodeprimidos, y comercializada por el laboratorio japonés Biken. En 1988 fue autorizada para uso en niños sanos en Japón y Corea del Sur63,64.
A finales de los años setenta, SmithKline-RIT en Bélgica y Merck Sharp and Dohme en Estados Unidos, adquirieron la concesión para la fabricación de la vacuna, e iniciaron los estudios de inmunogenicidad y eficacia protectora para su registro en Europa y Norteamérica, respectivamente.
A partir de 1984, la vacuna de GlaxoSmithKline (cepa OKA/GSK) ha sido registrada en numerosos países europeos, entre ellos España, para uso exclusivo en inmunodeprimidos y pacientes de alto riesgo. En la actualidad está registrada en España para uso general niños a partir de los 12 meses, en adolescentes y adultos.
La vacuna Merck Sharp and Dohme (cepa OKA/Merck) fue registrada en Estados Unidos en 1995 para uso en niños y adultos sanos. En España está registrada también para uso general en niños y adultos.
La inmunogenicidad de la vacuna contra la varicela varía en función del colectivo de población vacunada. Los mejores resultados se obtienen en los niños sanos65,66. En los niños inmunodeprimidos y en los adultos la inmunogenicidad es menor, y por lo general, se requieren 2 dosis administradas con un intervalo de 1-2 meses para alcanzar porcentajes de seropositividad similares a los de los niños sanos5,43.
Los resultados de los diferentes estudios realizados en niños en Europa y Asia (cepa OKA/SK-Bio)67–72 y Estados Unidos (cepa OKA/Merck)73–77 han sido bastante similares. De todas formas, como se han utilizado técnicas diferentes para la medición de anticuerpos, los resultados no son del todo comparables.
En estudios efectuados en adultos suizos y enfermeras inglesas con la cepa OKA/SK-Bio de primera formulación con una sola dosis se obtuvieron tasas de seroconversión del 9069 y del 94%78 respectivamente.
En los adolescentes de 12 a 17 años las tasas de seroconversión con la vacuna de GSK reformulada fueron del 92,1% con una sola dosis y del 100% con dos dosis en un estudio efectuado en Checoslovaquia79, y del 94,3% con una dosis y del 100% con dos dosis en un estudio efectuado en el sudeste asiático80. En otro estudio efectuado en este mismo ámbito geográfico en jóvenes de 13 a 29 años, las tasas de seroconversión fueron del 94,9% con una dosis y del 100% con dos dosis81.
En los adolescentes≥13 años y en los adultos sanos vacunados en Estados Unidos con las diferentes formulaciones de la cepa OKA/Merck la tasa de seroconversión global, medida con el test de FAMA, fue del 78% después de la administración de una dosis, y del 99% tras la administración de 2 dosis a intervalos de 4 a 8 semanas82. No se observaron diferencias en las tasas de seroconversión según la edad82,83. Un año después, el 97% de los adolescentes y adultos vacunados con 2 dosis mantenían títulos de seropositividad 0,3≥U76.
La administración de una segunda dosis de vacuna en niños da lugar a una respuesta inmunitaria incrementada que, a su vez, se correlaciona con una mejora de la protección conferida por la vacuna en comparación con la administración de una sola dosis84,85. En un estudio comparativo Kuter et al.86 observaron que la administración de una segunda dosis 3 meses después de la primera proporciona niveles más elevados de inmunogenicidad medida como la proporción de sujetos con títulos ≥5 de unidades gp ELISA y también en términos de títulos geométricos medios. Lo mismo se observa con la administración de dos dosis de la vacuna cuádruple (sarampión, rubéola, parotiditis y varicela) comercializada en Estados Unidos, pero no en España, o con una primera dosis de varicela seguida de una segunda de vacuna cuádruple87,88. Lo mismo se ha observado con la administración de dos dosis separadas de 4 a 8 semanas en adolescentes y adultos89.
Sólo se han efectuado dos estudios experimentales para la evaluación de la eficacia protectora de la vacuna de la varicela, ambos en niños saños90,91.
En el ensayo clínico controlado efectuado en los Estados Unidos por Weibel et al.90, en niños sanos con la cepa OKA-Merck con lotes que contenían dosis elevadas de inmunógeno (8.700 ufp por dosis) la eficacia protectora frente a cualquier forma de enfermedad clínica fue del 100% durante el primer año, y descendió al 97% el segundo año y al 95% al quinto90,92–94.
En el estudio de Varis et al.91, efectuado en 1992 en niños sanos de Finlandia con la cepa OKA/SK-Bio, la eficacia a los 30 meses de los lotes con títulos elevados de inmunógeno (de 10.000 a 15.850 ufp por dosis) fue del 88%, aunque los casos registrados en los niños vacunados fueron muy leves, con exantema papular o muy pocas vesículas y sin fiebre. Solo en uno de estos casos, el niño presentó fiebre y 30 vesículas. En los vacunados con los lotes de bajas concentraciones de inmunógeno (de 630 a 1.260 ufp.), la eficacia protectora sobre cualquier forma de enfermedad clínica fue mucho menor (55%)91. En este grupo los casos en vacunados fueron también leves, si bien un 30% presentó fiebre.
La mayoría de los estudios efectuados para investigar el valor de la vacuna de la varicela en la protección frente a la enfermedad clínica han sido de tipo observacional. Estos estudios en realidad no miden la eficacia (valor protector en condiciones experimentales) sino la efectividad (protección en las condiciones sanitarias usuales de aplicación de la vacuna)3.
Los estudios observacionales de evaluación de la efectividad después de la comercialización de la vacuna de la varicela en los Estados Unidos. (cepa OKA/Merck) han ofrecido resultados muy prometedores, y han demostrado que esta vacuna es muy efectiva, sobre todo en la prevención de la varicela de intensidad normal o grave95.
En todos los estudios efectuados (tabla 1) se ha calculado la protección frente a todas las formas de varicela, incluidas las leves (<50 lesiones) y frente a las formas moderadas o graves de la enfermedad. La efectividad ha oscilado entre el 83 y el 95% en la prevención de todas las formas de la enfermedad y entre el 97 y 100% en la prevención de las formas moderadas o graves de la varicela96–101.
Principales estudios de efectividad de la vacuna de la varicela después de su comercialización
| Autor/Año publicación | Vacuna | País | Diseño del estudio | Efectividad | |||
|---|---|---|---|---|---|---|---|
| En la prevención de todas las formas de varicela | En la prevención de la varicela moderada o grave (> 50 lesiones) | ||||||
| % | IC 95% | % | IC 95% | ||||
| Izurieta HS et al.96, 1997 | OKA/Merck | EE. UU. | Cohortes histórico | 86 | 73-92 | 100 | 96-100 |
| Clements A et al.97, 1999 | OKA/Merck | EE. UU | Cohortes prospectivo | 83 | 69-91 | 100 | - |
| Vázquez M et al.99, 2001 | OKA/Merck | EE. UU | Casos y controles | 85 | 78-90 | 97 | 93-99 |
| Galil K et al.100, 2002 | OKA/Merck | EE. UU | Estudio de cohortes prospectivo | 79 | 66-8 | 95 | 84-98 |
| Tugwell BD et al.101, 2004 | OKA/Merck | EE. UU | Estudio de cohortes prospectivo | 72 | 3-87 | - | - |
| Passwell JH et al.104, 2004 | OKA/GSK | Israel | Cohortes histórico | 92 | 91-93 | - | - |
| Sheffer R et al105, 2005 | OKA/GSK | Israel | Casos y controles | 88 | 77-99 | 100 | - |
No obstante, como señalan algunos autores102–104 es probable que estos resultados puedan estar sesgados como consecuencia de la exposición de los vacunados al virus salvaje con el consiguiente efecto booster, ya que en los Estados Unidos los primeros años después de la introducción de la vacunación las coberturas vacunales fueron relativamente bajas (12% en 1996, 25% en 1997 y 43% en 1998) y el virus salvaje todavía circuló intensamente durante el período 1996-2000.
Los niveles de efectividad demostrada por la vacuna antivaricela cepa OKA/GSK en Israel, país donde esta vacuna fue registrada para uso general en la población infantil el año 1999, aunque todavía no ha sido incluida en el calendario de vacunaciones sistemáticas, han sido semejantes a los encontrados en estudios observacionales efectuados en Estados Unidos. La efectividad en la prevención de todas las formas clínicas de varicela ha sido del 92% en el estudio de cohortes histórico de Paswell et al.104 y del 88% en el de casos y controles de Sheffer et al.105 (tabla 1). En este último estudio la efectividad en la prevención de las formas graves de varicela (≥50 lesiones) fue del 100%.
La vacuna ha demostrado también ser efectiva en la profilaxis postexposición cuando se administra en los primeros días después de la exposición a los contactos no vacunados de niños enfermos (tabla 2)98,106,107.
Principales estudios de efectividad de la vacuna de la varicela administrada como profilaxis postexposición
| Autor/Año publicación | Vacuna | País | Diseño del estudio | Ámbito del estudio | Efectividad | |||
|---|---|---|---|---|---|---|---|---|
| En la prevención de todas las formas de varicela | En la prevención de la varicela moderada o grave (> 50 lesiones) | |||||||
| % | IC 95% | % | IC 95% | |||||
| Salzman MB et al.106 1998 | OKA/Merck | EE. UU. | Contactos familiares | Hermanos en hogares familiares | 42 | - | 88 | - |
| Watson B et al.98 2000 | OKA/Merck | EE. UU. | Cohortes prospectivo | Residentes en una residencia de niños sin hogar | 95 | 82-99 | 100 | - |
| Brotons M et al.107 2010 | OKA/MerckOKA/GSK | España | Cohortes prospectivo | Contactos familiares de un caso de varicela | 62,3 | 47,8-74,9 | 79,4 | 66,4-88,9 |
La administración de dos dosis en la pauta preexposición incrementa considerablemente la efectividad vacunal en comparación con la pauta de una sola dosis108–110.
La mejor indicación de la efectividad de la vacunación de la varicela la proporciona el descenso espectacular en la incidencia de la enfermedad (impacto) observado en Estados Unidos después de la introducción de la vacunación universal el año 1995103,111–114.
Los CDC de Atlanta establecieron un sistema de vigilancia activa de la varicela mediante médicos centinela en tres condados de Texas, California y Pensilvania115. En estos condados las coberturas vacunales alcanzadas el año 2000 oscilaron entre el 73,6 y el 83% en los niños de 19 a 35 meses de edad y la incidencia de varicela se redujo entre el 73,6 y el 83,8%. El descenso de la incidencia se produjo no solo en las cohortes de niños vacunados, sino también en las cohortes no vacunadas y en los adultos, indicando que se produjo inmunidad de grupo como consecuencia de la vacunación.
También se produjo un importante descenso en los ingresos hospitalarios por complicaciones de la varicela. En el estudio de Davis56 antes citado, las tasas de incidencia estimada de hospitalización para todas las edades descendieron de 0,5 por 10.000 en 1993 a 0,1 por 10.000 en el año 2001 (fig. 4). El descenso fue mayor en las cohortes vacunadas, pero también se observó en las cohortes no vacunadas y en los adultos, aunque en menor proporción. En el estudio antes citado de Lopez et al.58 la disminución es similar a la observada por Davis et al.56. Es de destacar que ambos estudios se realizaron durante los años en los que se administraba una sola dosis de varicela.
Incidencia estimada de hospitalizaciones por varicela y coberturas vacunales en Estados Unidos 1993-2001.
Fuente: Davis et al.57.
Por último, también ha sido importante el impacto de la vacunación sobre la mortalidad por varicela en Estados Unidos en los últimos 10 años, habiendo pasado las cifras totales de muertes por varicela (causa básica y causa contribuyente) de 145 anuales durante el período 1990-1994 a 57 anuales durante el período 1999-2001 (fig. 5) con un descenso del 66% (tasas de 0,56 por millón en 1990-1994 y de 0,23 por millón en 1999-2001). El año 2007 el número de muertes (causa básica) se había reducido a 13, todas menos una ocurrieron en adultos116.
Mortalidad por varicela en Estados Unidos 1990-2001.
Fuente: Nguyen et al.63.
Se debe reconocer que como consecuencia de la vacunación universal de la población infantil, las tasas actuales de mortalidad a causa de la varicela en Estados Unidos son sensiblemente más bajas que las de los países que no han adoptado la estrategia de vacunación universal117–122.
Recomendaciones de vacunaciónLa vacuna de la varicela se introdujo en el calendario de vacunaciones sistemáticas de Estados Unidos el año 1995. El impacto de la vacunación universal fue muy importante, habiéndose producido una gran reducción de la morbilidad y la mortalidad por varicela en este país44,45. En Europa la mayor parte de los países no siguieron esta estrategia, centrando las recomendaciones en la vacunación de los adolescentes y adultos susceptibles123–128.
En España se adoptó la estrategia de la vacunación selectiva de los adolescentes que no hayan padecido la enfermedad durante la infancia129. La idea fue mantener la inmunidad conferida por la infección salvaje durante la edad infantil y proteger con la vacunación solo a los adolescentes que durante la infancia no habían entrado en contacto con el virus. También se pretendía evitar un posible incremento de los casos de varicela en la edad adulta y de herpes zóster en la edad adulta y en la vejez como consecuencia de la disminución de la circulación del virus por la vacunación universal y la disminución de la inmunidad celular en los adultos previamente infectados por el virus salvaje. En aquel momento muchos expertos formularon hipótesis en este sentido20,130.
En dos Comunidades Autónomas, Madrid y Navarra, se adoptó la estrategia de la vacunación universal, al principio con una dosis y posteriormente con dos dosis. Los resultados en términos de reducción de la incidencia de la enfermedad han sido espectaculares, semejantes a los de Estados Unidos129.
Por otro lado, no parece haberse confirmado la hipótesis de que al disminuir la circulación del virus salvaje en la edad infantil se incrementarían los casos de herpes zóster en la edad adulta129. Algunos estudios de casos y controles han encontrado resultados que avalan estas hipótesis131,132, pero otros no18,125. Algunos estudios descriptivos126–128 han mostrado un incremento de la incidencia de herpes zóster en los últimos años, pero los expertos lo atribuyen principalmente a un mayor número de personas inmunodeprimidas en la edad adulta como consecuencia de nuevos tratamientos agresivos contra el cáncer y el consecuente mayor incremento de la esperanza de vida en mala salud de estos pacientes133. El hecho de que se haya demostrado que la incidencia de herpes zóster ya se incrementó en Estados Unidos antes del inicio de la vacunación universal iría también en contra del efecto negativo de la vacunación en la población infantil sobre la incidencia de herpes zóster en la edad adulta133.
Por todo ello, parece conveniente cambiar en España la estrategia de vacunación selectiva de los adolescentes por la de la vacunación universal de la población infantil (dos dosis), dados los buenos resultados obtenidos en las Comunidades Autónomas que han vacunado y que no ha sido probado el efecto negativo de dicha estrategia en la incidencia de herpes zóster en adultos y ancianos129.
Hasta que la estrategia no se modifique, la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH) recomienda llevar a cabo la vacunación de los adolescentes con dos dosis separadas por un intervalo mínimo de 1-2 meses en las escuelas y de los adultos en los centros de atención primaria y en su lugar de trabajo, con el fin de conseguir coberturas vacunales elevadas. Las mujeres en edad fértil no embarazadas deben someterse a un cribado serológico y, en su caso, a la vacunación en los centros de planificación familiar, al realizar visitas periódicas al ginecólogo134. En los adolescentes no se recomienda el cribado serológico previo a la vacunación. Se aconseja vacunar a los niños cuyos antecedentes sean negativos o desconocidos (historia clínica y/o recuerdo de los padres)129,135,136.
También se recomienda de forma especial la vacunación de los adultos con mayor riesgo de contraer la enfermedad por estar en contacto frecuente con niños: personal sanitario; contactos familiares susceptibles de pacientes inmunodeprimidos; personas que viven o trabajan en ámbitos donde existe gran facilidad de transmisión del VVZ (por ejemplo, guarderías, escuelas); mujeres no embarazadas en edad de procrear; inmigrantes procedentes de países tropicales, etc.129.
De cara al futuro parece conveniente estudiar el cambio de la estrategia de vacunación selectiva de los adolescentes por la de la vacunación universal de la población infantil (dos dosis separadas por un intervalo mínimo de 1-2 meses), dados los buenos resultados con esta estrategia en las dos Comunidades Autónomas de España (Madrid, Navarra) que la han adoptado. En caso de adoptar esta estrategia se debería mantener la vacunación selectiva de los adolescentes hasta que alcance esta edad la cohorte de niños vacunados en la edad infantil objeto de la vacunación universal.
Vacunación frente al herpes zósterCarga de la enfermedadEl herpes zóster y sus complicaciones constituyen un importante problema de salud pública. La carga de la enfermedad es semejante en todos los países desarrollados4–7,38,133,137,138.
La incidencia y la gravedad del herpes zóster aumentan con la edad. Estudios efectuados en España estiman que la incidencia global es de alrededor de 4 por 1.000 personas año, si bien, se eleva a 10-11 por 1.000 en las de 60 o más años38,137. Más del 50% de las personas que padecen herpes zóster tienen más de 60 años y se producen complicaciones en alrededor de la mitad de las personas de edades avanzadas que padecen la enfermedad. El 50% de los individuos que llegan a los 85 años de edad sin haber padecido el herpes zóster, lo padecerán durante los años que sobrevivan a partir de esta edad138. La complicación más frecuente es la neuralgia posherpética, un dolor de origen neuropático que aparece o persiste más allá de los 3 meses después de la curación del exantema vesicular dermatómico139. La desarrollan alrededor del 15% de los casos ocurridos en personas de 50 o más años, aunque llega al 17,5% en los mayores de 70 años138. El dolor ocasionado por esta complicación puede llegar a ser prolongado y debilitante reduciendo la calidad de vida del paciente139. El tratamiento con aciclovir reduce la gravedad y la duración de herpes zóster, pero no es eficaz en la prevención de la neuralgia posherpética6,138,139.
Los principales factores de riesgo de padecer herpes zóster son la edad avanzada (la inmunidad celular disminuye con la edad), las enfermedades que cursan con inmunodepresión de la inmunidad celular (incluida la infección por VIH y el sida, las neoplasias malignas hematológicas, el transplante de médula ósea y el lupus eritematoso sistémico), los tratamientos prolongados con inmunodepresores o corticoides y la quimioterapia anticancerosa)6,138.
Es de destacar que a pesar de que el riesgo de padecer herpes zóster es muy elevado en los pacientes con disminución de la inmunidad celular, a consecuencia de padecer una patología o de ser sometidos a tratamientos inmunosupresores, estos pacientes representan por lo general menos del 10% de los casos. En el estudio de Yawn et al.133 solo el 8% de los casos se dieron en pacientes inmunodeprimidos. En la serie de casos de Salleras et al. esta proporción fue del 4%139.
Otros factores de riesgo identificados en algunos estudios son el trauma físico en el dermatoma involucrado, el estrés psicológico y la depresión, la raza blanca, los antecedentes familiares de padecimiento de la enfermedad, factores genéticos y ciertas condiciones médicas crónicas subyacentes (rinitis alérgica, EPOC, cardiopatía coronaria, depresión mental, diabetes mellitus, bocio, hiperlipidemia, hipertensión, hipotiroidismo y osteoartritis)138.
Por último, artículos recientes apuntan la hipótesis de que el hiperparatiroidismo y la infección previa por citomegalovirus pueden ser importantes factores de riesgo de herpes zóster138.
Vacunas frente al herpes zósterLa vacuna viva atenuada frente al herpes zóster de elevado contenido antigénico (Zostavax®) fue comercializada en Estados Unidos el año 2006 y posteriormente lo ha sido en Europa140,141. Una vacuna inactivada adyuvada con AS01B (HZ/su) está en fase avanzada de investigación, pero todavía no ha sido registrada para su comercialización32,142.
Vacuna atenuadaEl ensayo clínico controlado de Oxman et al24 «Shingles Prevention Study», diseñado primariamente para evaluar la eficacia protectora de la vacuna, incluyó un subestudio de inmunogenicidad que ha demostrado que la vacunación refuerza de forma importante la inmunidad humoral y celular frente al virus de la varicela zóster. Antes de la vacunación el estado inmunitario era semejante en los sujetos incluidos en el grupo a vacunar y en el que iba a recibir el placebo. A las 6 semanas los títulos y contajes se habían doblado en los sujetos vacunados en comparación con los del grupo control, sin que se superpusieran los intervalos de confianza, lo que da significación estadística a las diferencias143. En el mismo estudio se ha confirmado que la respuesta inmunitaria celular disminuye con la edad, pero en todos los grupos de edad los vacunados presentaron contajes de IFN-γ ELISPOT sensiblemente más elevados que los sujetos del grupo control. En este y otros estudios ha quedado demostrado que las vacunas vivas atenuadas de alto contenido antigénico son capaces de reforzar la inmunidad celular y, en consecuencia, reducir la susceptibilidad al padecimiento de la enfermedad143.
La eficacia protectora de la vacuna atenuada frente al herpes zóster ha sido evaluada en el «Shingles Prevention Study» efectuado en 22 centros del «Veterans Administration Affairs» de Estados Unidos. Este estudio, dirigido por Oxman et al.24, incluyó un total de 38.456 personas de más de 60 años inmunocompetentes, distribuidas aleatoriamente en dos grupos: el grupo de intervención (n=19.254), que recibió una dosis subcutánea de la vacuna y el grupo de control (n=19.247), que recibió un placebo.
El estudio demostró que, a corto plazo (0-4 años), la vacuna atenuada de elevado contenido antigénico (24.600 ufp) disminuye en un 51,3% (IC 95%; 44,2-57,6) la incidencia de herpes zóster y en un 66,5% (IC 95%; 47,5-79,2) la de la neuralgia posherpética en las personas de 60 o más años (tabla 3). Pero lo que es más importante es que la carga de la enfermedad se reduce en un 61,1% (IC 95%; 51,1-69,1). En las personas más mayores, de 70 o más años, la eficacia protectora frente a la ocurrencia de herpes zóster es menor que en las personas de 60 a 69 años, pero se mantiene la eficacia en la reducción de la carga de la enfermedad y, sobre todo, en la prevención de la neuralgia posherpética24.
Persistencia de la eficacia vacunal estimada de la vacuna atenuada frente al herpes zóster según el tiempo transcurrido desde la vacunación
| Período de tiempo de seguimiento (años) | Eficacia vacunal | ||
|---|---|---|---|
| En la reducción de la incidencia de herpes zósterEstimación puntual (IC 95%) | En la reducción de la incidencia de neuralgia posherpéticaEstimación puntual (IC 95%) | En la reducción de la carga de la enfermedadEstimación puntual (IC 95%) | |
| SPS*Años 0,0-4,0 | 51,3 (44,2-57,6) | 66,5 (47,5-79,2) | 61,1 (51,1-69,1) |
| STPS**Años 3,3-7,8 | 39,6 (18,2-55,5) | 60,1 (-9,8-86,7) | 50,1 (14,1-71,0) |
| LTPS***Años 4,7-11,6 | 21,1 (10,9-30,4) | 35,4 (8,8-55,8) | 37,3 (26,7-46,4) |
IC: Intervalos de confianza.
Un resultado final de gran interés ha sido que «la puntuación de la gravedad media de la enfermedad» ha sido inferior en los casos de herpes zóster ocurridos en el grupo vacunado que en los ocurridos en el grupo que recibió el placebo, en especial en las personas de más de 70 años. Además, la duración media del dolor fue más corta en los pacientes que habían sido vacunados que en el grupo placebo (21 versus 24 días, p<0,005). Ello significa que en los casos en los que la vacuna no ha sido capaz de prevenir la enfermedad, sí lo ha sido en la reducción de su gravedad24.
Una subencuesta (7.320 vacunados y 6.250 controles) siguió a los participantes desde los 3,3 a los 7,8 años de la randomización para evaluar la persistencia de la eficacia vacunal (Short-Term Persistence Study) a medio plazo144. Por último, otro subestudio, recientemente finalizado, ha evaluado la persistencia de la eficacia desde los 4,7 a los 11,6 años de la randomización (Long-Term Persistence Study)145.
El Short-Term Study144 demostró que la eficacia de la vacuna se mantiene a medio plazo, si bien en niveles algo más bajos, sobre todo en la prevención del herpes zóster (tabla 3).
Por último, el Long-Term Persistence Study ha demostrado que la protección vacunal persiste a largo plazo (4,7 a 11,6 años), si bien la eficacia vacunal disminuye, especialmente en la prevención del herpes zóster (21,1% IC 95%; 10,9-30,4). En la prevención de la neuralgia posherpética y de la carga de la enfermedad la disminución es menor (35,4% IC 95%; 8,8-55,8 para la neuralgia posherpética y 37,3% IC 95%; 26,7-46,4 en la reducción de la carga de la enfermedad)145,146.
En ensayo clínico aleatorizado doble ciego efectuado por Schmader et al.31 en el que participaron 22.439 personas de 50 a 59 años de América del Norte y Europa ha demostrado también la eficacia y seguridad de la vacuna en este grupo de edad (tabla 3). La eficacia en la prevención del herpes zóster ha sido, incluso, algo mayor (69,8% IC 95% 54,1-80,6) que la encontrada para las personas de 60 o más años en el estudio de Oxman et al. (51,3% IC 95% 44,2-57,6).
En base a los resultados del estudio de Oxman et al.24, la vacuna frente al herpes zóster (Zostavax®) fue registrada en Estados Unidos el año 2006 para su administración para la prevención del herpes zóster y la neuralgia posherpética en las personas de ≥60 años. El comité de expertos en vacunaciones del CDC recomendó su administración a las personas inmunocompetentes de este grupo de edad (una sola dosis por vía subcutánea)140. Posteriormente lo fue para las personas inmunocompetentes de 50 a 59 años, aunque por el momento el Advisory Committee On Immunization Practices no la recomienda para este grupo de edad.
En la Unión Europea la vacuna Zostavax® fue registrada poco después para las personas de ≥50 años, pero hasta el año 2013 no han estado disponibles dosis de la vacuna refrigeradas para la vacunación de la población141. Este año algún país ha incluido la vacuna en las recomendaciones oficiales. Inglaterra ha lanzado recientemente una campaña nacional para la vacunación progresiva de las cohortes de 60 a 70 años. En Francia el Haut Conseil de la santé publique ha recomendado recientemente por unanimidad la financiación de los adultos de 65 a 74 años. El primer año después de la inclusión de la vacuna en el calendario de vacunaciones de la población adulta ha recomendado la realización de un catch-up en el grupo de edad de 75 a 79 años. Igual que en Inglaterra, se recomienda la administración de una sola dosis por vía subcutánea.
La vacuna comercializada en Europa se conserva refrigerada y se administra por vía subcutánea, preferiblemente en la región deltoidea (viales de 0,65ml que contienen un mínimo de 19.400 ufp.
La vacuna está contraindicada en las mujeres embarazadas y en los pacientes con tuberculosis activa no tratada, inmunodeficiencia primaria y adquirida, tratamiento con fármacos inmunosupresores, corticoides sistémicos o terapia con corticoides de reemplazamiento. Los tratamientos con corticoides por vía tópica, nasal o intraauricular no contraindican la vacunación140. La vacuna puede administrarse de forma concomitante con la vacuna de la gripe inactivada y con la vacuna neumocócica 23-valente. Los pacientes con historia previa de herpes zóster pueden ser vacunados sin ningún problema, igual que los pacientes afectos de enfermedades crónicas140.
La vacuna frente al herpes zóster es la primera vacuna que no se administra para prevenir la ocurrencia de una infección, sino para reducir la probabilidad de reactivación de una infección ocurrida anteriormente, cuyo agente se ha mantenido latente en el cuerpo humano4. En España todos los adultos se pueden beneficiar de esta vacuna, ya que prácticamente el 100% de la población ha sido infectada por el virus antes de los 40 años de edad4,138.
La vacuna frente al herpes zóster es un instrumento preventivo que puede contribuir en el futuro a mejorar la calidad de vida de las personas mayores, un colectivo cada vez más numeroso, que pide de forma acuciante intervenciones que incrementen su salud y calidad de vida. Los gobiernos de los países desarrollados así lo han entendido y las intervenciones dirigidas a la población anciana figuran en los primeros lugares de la lista de prioridades de los planes de salud. Es de esperar que una vez comercializada en nuestro país se dé a esta vacuna la prioridad que le corresponde entre las intervenciones preventivas a ofrecer a las personas de edad avanzada, igual que ha hecho en Estados Unidos y recientemente en Inglaterra y Francia. En el establecimiento de las necesidades de administración de la vacuna, serán muy importantes los resultados de los estudios coste-efectividad4,138.
Mientras tanto, la SEMPSPH recomienda la vacunación con una sola dosis subcutánea de las personas de 50 o más años, siempre bajo criterio médico y como indicación del facultativo que atiende normalmente al paciente, prestando especial atención a los pacientes con factores de riesgo de padecer el herpes zóster y sus complicaciones138.
Vacuna inactivada adyuvadaUna vacuna inactivada de subunidades (glicoproteína E) obtenida por recombinación genética y adyuvada con el adyuvante AS01B está en fase avanzada de investigación (estudios en fase 1 y 2 de seguridad e inmunogenicidad). La vacuna (2 dosis separadas por un intervalo de 2 meses) ha sido ensayada en adultos sanos y en enfermos inmunodeprimidos (infectados por el virus del sida y sometidos a trasplantes hematopoyéticos autólogos)32,142,147. Tanto en los adultos sanos como en los inmunodeprimidos la vacuna ha mostrado buenos niveles de seguridad y de inmunogenicidad32,142,147.
Muy recientemente se han publicado los resultados de un ensayo clínico controlado (fase III) efectuado en 18 países para evaluar la eficacia protectora del producto vacunal (vacuna HZ/su de GSK Vaccines adyuvada con AS01B, dos dosis con un intervalo de 2 meses)34,35. En el estudio han participado 15.411 personas de 50 o más años (7.698 en el grupo de vacunados y 7.713 en el grupo placebo). Durante el período de seguimiento de 3,2 años se confirmaron 6 casos de herpes zóster en el grupo de vacunados y 270 en el grupo de control (tasa de incidencia de 0,3 versus 9,1 por 1.000 personas/año). Las reacciones adversas leves en el lugar de la inyección fueron más frecuentes en el grupo vacunado que en el grupo que recibió placebo (17% versus 3,2%)34,35. No se observaron diferencias significativas en la incidencia de reacciones sistémicas entre ambos grupos34,35.
Del estudio se infiere que la vacuna HZ/su reduce de forma significativa la incidencia de herpes zóster a corto plazo (3,2 años) en las personas de 50 o más años. Es de destacar que la protección vacunal no disminuye con la edad en el momento de la vacunación, oscilando entre el 96,8 y el 97,9% en todos los grupos de edad (tabla 4).
Eficacia protectora frente al primer episodio o único episodio de herpes zóster de la vacuna inactivada de subunidades adyuvada con AS01B
| Grupo de edad | Efectividad vacunal* | |
|---|---|---|
| % | IC 95% | |
| 50-59 | 96,6 | (89,6-99,3) |
| 60-69 | 97,4 | (90,1-99,7) |
| ≥70 | 97,9 | (87-9-100) |
| ≥50 | 97,2 | (93,7-99) |
Modified vaccinated cohort: excluye las personas que no recibieron a segunda dosis y las que el diagnóstico de confirmación se recibió dentro de los 30 días siguientes a la aplicación de la segunda dosis.
Fuente: Lal et al.34.
Hasta el momento no se ha establecido un correlato inmunitario de protección frente al herpes zóster, pero es bien conocido que la inmunidad celular (células T CD4+y CD8+) juega un papel muy importante en la prevención de la reactivación del VVZ latente en los ganglios de las raíces sensoriales dorsales. Los resultados de este estudio confirman que el adyuvante AS01B ejerce un efecto booster sobre las células de memoria específica de VVZ, dando lugar a un refuerzo de la inmunidad celular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion