Validar un modelo sencillo de riesgo para predecir bacteriemia (5MPB-Toledo) en los pacientes atendidos en los servicios de urgencias hospitalarios (SUH) por un episodio de infección.
MétodosEstudio observacional de cohortes prospectivo y multicéntrico de los hemocultivos (HC) obtenidos en 74 SUH españoles en los pacientes adultos (≥18 años) atendidos por infección desde el 1 de octubre de 2019 hasta el 29 de febrero de 2020. Se analizó la capacidad predictiva del modelo con el área bajo la curva (ABC) de la característica operativa del receptor (COR) y se calculó el rendimiento diagnóstico de los puntos de corte (PC) del modelo elegidos con los cálculos de la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo.
ResultadosSe incluyeron 3.843 episodios de HC extraídos. De ellos, se consideraron como bacteriemias verdaderas 839 (21,83%) y como HC negativos 3.004 (78,17%). Entre los negativos, 172 (4,47%) se consideraron contaminados. Se categorizó a los pacientes en bajo (0-2 puntos), moderado (3-5 puntos) y alto (6-8 puntos) riesgo, con una probabilidad de bacteriemia de 1,5, 16,8 y 81,6%, respectivamente. El ABC-COR del modelo tras remuestreo fue de 0,930 (IC 95%: 0,916-0,948). El rendimiento diagnóstico del modelo con un PC≥5 puntos consigue una sensibilidad del 94,76% (IC 95%: 92,97-96,12), especificidad del 81,56% (IC 95%: 80,11-82,92) y un valor predictivo negativo del 98,24% (IC 95%: 97,62-98,70).
ConclusiónEl modelo 5MPB-Toledo es de utilidad para predecir bacteriemia en los pacientes atendidos en el SUH por un episodio de infección.
To validate a simple risk score to predict bacteremia (MPB5-Toledo) in patients seen in the emergency departments (ED) due to infections.
MethodsProspective and multicenter observational cohort study of the blood cultures (BC) ordered in 74 Spanish ED for adults (aged 18 or older) seen from from October 1, 2019, to February 29, 2020.
The predictive ability of the model was analyzed with the area under the Receiver Operating Characteristic curve (AUC-ROC). The prognostic performance for true bacteremia was calculated with the cut-off values chosen for getting the sensitivity, specificity, positive predictive value and negative predictive value.
ResultsA total of 3.843 blood samples wered cultured. True cases of bacteremia were confirmed in 839 (21.83%). The remaining 3.004 cultures (78.17%) were negative. Among the negative, 172 (4.47%) were judged to be contaminated. Low risk for bacteremia was indicated by a score of 0 to 2 points, intermediate risk by 3 to 5 points, and high risk by 6 to 8 points. Bacteremia in these 3 risk groups was predicted for 1.5%, 16.8%, and 81.6%, respectively. The model's area under the receiver operating characteristic curve was 0.930 (95% CI, 0.916-0.948). The prognostic performance with a model's cut-off value of ≥ 5 points achieved 94.76% (95% CI: 92.97-96.12) sensitivity, 81.56% (95% CI: 80.11-82.92) specificity, and negative predictive value of 98.24% (95% CI: 97.62-98.70).
ConclusionThe 5MPB-Toledo score is useful for predicting bacteremia in patients attended in hospital emergency departments for infection.
Se define como bacteriemia la presencia de bacterias en la sangre, que se pone de manifiesto por el aislamiento de estas en los hemocultivos (HC)1. A pesar de las nuevas técnicas de detección rápida (del ADN del patógeno o por aplicación de espectrometría de masas), los HC permiten el diagnóstico etiológico de la infección, aportan información sobre la sensibilidad del microorganismo y favorecen la optimización del tratamiento antimicrobiano2–4.
Recientemente, se ha comprobado que alrededor del 15% de los pacientes que se atienden en los servicios de urgencias hospitalarios (SUH) españoles se diagnostican de un proceso infeccioso. En su atención inicial, se toman muestras para estudios microbiológicos en un 43% de los casos. Entre ellos, predomina la extracción de HC, que se lleva a cabo en el 14,6% de los pacientes atendidos con sospecha o confirmación de infección en los propios SUH5. La rentabilidad diagnóstica de estos es muy variable (2-20%)6,7, mientras que los considerados «HC contaminantes» pueden alcanzar tasas del 30-50% de los aislamientos8. Por otro lado, los HC con aislamiento significativo en pacientes dados de alta desde urgencias (BPAU) pueden representar un 3-5% de los extraídos en el SUH9. Estos hechos representan verdaderos problemas, al conllevar un incremento de las pruebas diagnósticas realizadas, la estancia hospitalaria, los costes y la administración de tratamientos antibióticos innecesarios o, en su caso, altas improcedentes en los casos de BPAU6,9,10.
Asimismo, la incidencia de bacteriemia comunitaria ha aumentado hasta 1-2/1.000 atenciones en los SUH y a 6-10 episodios/1.000 ingresos hospitalarios desde dicho servicio6,7. La etiología se debe a bacterias grampositivas en un 30-45%, gramnegativas en un 55-70% y anaerobias sobre el 1-3%6–10. Esta proporción puede cambiar, si la incidencia de los HC contaminantes fuera excesiva, a favor de las grampositivas8. Con relación a las bacteriemias verdaderas (BV) o significativas, en cuanto al foco, la infección del tracto urinario con el 45-55% y el foco respiratorio (10-25%) son los más frecuentes, mientras que la bacteriemia con foco desconocido se sitúa alrededor del 10% en el SUH. De forma global, las bacterias aisladas con mayor frecuencia son Escherichia coli, Staphylococcus aureus y Streptococcus pneumoniae6,7,10.
La mortalidad a los 30 días de los pacientes con BV se ha cifrado entre el 10-25%, superior al resto de pacientes con enfermedad infecciosa. Esta, se relaciona con la gravedad de la situación clínica, el foco primario y las características de los pacientes (edad, comorbilidad, etc.)6,7,11.
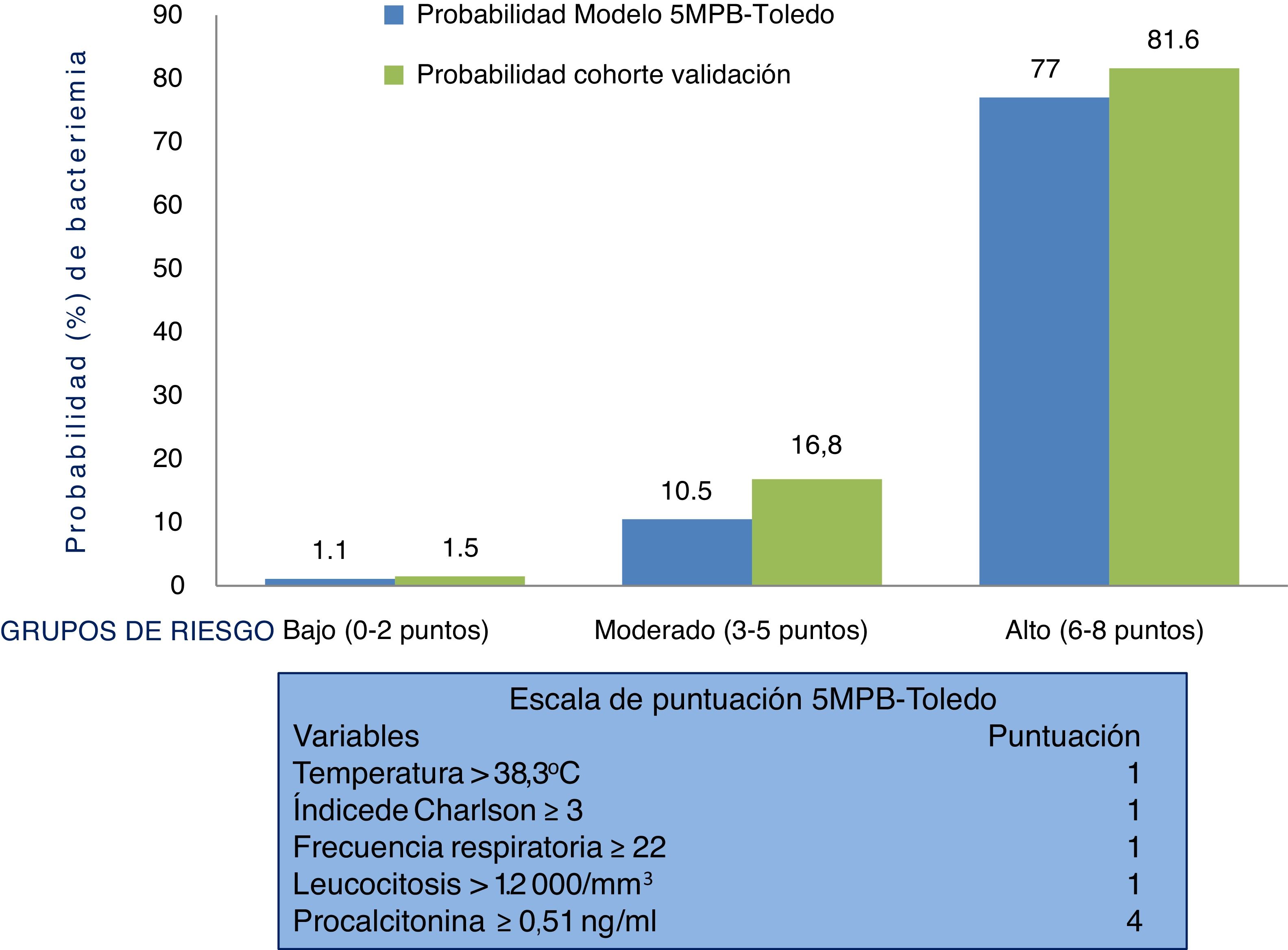
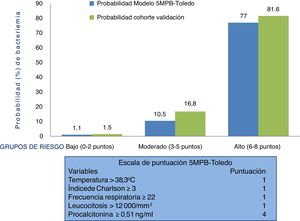
Por todo ello, la sospecha y confirmación de la BV tiene un relevante significado diagnóstico, pronóstico y obliga a cambiar algunas de las decisiones más importantes a tomar en el SUH. Entre otras, indicar el alta o ingreso, extraer los HC y administrar el antimicrobiano adecuado y precozmente12. En este sentido, elaborar modelos predictivos de BV identificables en los SUH que ayuden a evitar altas improcedentes e ingresos innecesarios, y sus consecuencias, se ha convertido en el objetivo de muchos autores, que incluyen, en distintas escalas propuestas, variables clínicas, epidemiológicas y analíticas13–19. Recientemente, se ha publicado un estudio donde se ha presentado un modelo predictivo de bacteriemia con 5 variables (modelo de 5 variables predictivas de bacteriemia de Toledo [5MPB-Toledo])20. Este incluye la temperatura >38,3°C (un punto), el índice de Charlson ≥3 (un punto), una frecuencia respiratoria de ≥22 respiraciones por minuto (un punto), un recuento de leucocitos >12.000/mm3 (un punto) y una concentración de procalcitonina (PCT)≥0,51ng/ml (4 puntos). Así, se categoriza a los pacientes en bajo (0-2 puntos), moderado (3-5 puntos) y alto (6-8 puntos) riesgo, con una probabilidad de bacteriemia del 1,1, 10,5 y 77%, respectivamente. El área bajo la curva de la característica operativa del receptor (ABC-COR) del modelo tras remuestreo fue excelente, de 0,946 (IC 95%: 0,922-0,969)20.
El objetivo de este estudio fue realizar una validación externa del modelo predictivo de bacteriemia (5MPB-Toledo) en los pacientes atendidos por infección en los SUH. Y, secundariamente, analizar el rendimiento predictivo de los puntos de corte de la escala.
Pacientes y métodosDiseño del estudioObservacional, multicéntrico, prospectivo, descriptivo y analítico de los HC extraídos en 74 SUH españoles en los pacientes adultos (≥18 años) atendidos por sospecha clínica de algún proceso infeccioso a los que se realizó un seguimiento durante 30 días, y tras este periodo mantuvieron el diagnóstico de infección.
Sitio del estudioLos centros participantes pertenecen al grupo INFURG-SEMES (Grupo de Infecciones de la Sociedad Española de Medicina de Urgencias y Emergencias) (anexo 1).
Periodos del estudio y población incluidaDesde el 1 de octubre de 2019 al 29 de febrero de 2020 se incluyeron por oportunidad (cuando los investigadores estuvieron de guardia) los HC obtenidos de aquellos pacientes diagnosticados clínicamente de un proceso infeccioso en los que, como condición, también se registraron los datos de las 5 variables del modelo 5MPB-Toledo (temperatura, índice de Charlson, frecuencia respiratoria, recuento de leucocitos y la concentración de PCT). Se excluyeron los pacientes de pediatría y obstetricia-ginecología. La indicación de la solicitud de los HC se llevó a cabo según el criterio del médico responsable.
Definiciones, técnicas y métodos establecidos para las muestrasLa extracción de los HC se realizó por la técnica estándar por venopunción percutánea. En cada paciente se realizaron 2 extracciones separadas entre sí en el tiempo (y asegurando que los sitios de venopunción eran diferentes). En el caso de sospecha de endocarditis se obtuvieron 3 parejas de HC. Por cada extracción (HC) se inocularon 2 botellas (BD BACTEC®): una con medio para aerobiosis y otra para anaerobiosis. Según protocolo, el tiempo de incubación de los HC fue de 5-7 días, excepto en los casos de sospecha de endocarditis, brucelosis o a petición del médico responsable donde se prolongó hasta 30 días.
Se definió como bacteriemia verdadera (o significativa) el aislamiento de bacterias habitualmente patógenas en uno o los 2 HC con un cuadro clínico compatible, y como HC contaminado el aislamiento en una sola botella de HC de Staphylococcus coagulasa-negativo (ECN), Bacillus spp., Streptococcus del grupo viridans, Micrococcus spp., Propionibacterium spp., Corynebacterium spp., y otros bacilos grampositivos cuando se interpretó la ausencia de significado clínico en estos casos (confirmado según la historia y/o el criterio del médico responsable y/o microbiología). En otros casos, al existir 2 HC positivos y una significación clínica atribuida a ellos (especialmente en inmunodeprimidos o en portadores de catéteres vasculares o tras pruebas invasivas), sí se consideró BV y se trató con antibióticos.
Para los biomarcadores se adoptaron como valores de referencia y metodología los utilizados en otros estudios del grupo INFURG-SEMES de forma consensuada. Para la proteína C reactiva (PCR) con método de determinación por inmunoanálisis enzimático cuantitativo: 0-8mg/l, con una sensibilidad de 1mg/l. Para la PCT por inmunoanálisis cuantitativo de electroquimioluminiscencia con valores de referencia: <0,5ng/ml, con una sensibilidad de 0,02ng/ml.
Variables recogidasLa variable resultado fue la existencia de bacteriemia verdadera. Con relación a las variables independientes recogidas, se registraron datos sociodemográficos (edad, sexo e institucionalización), la toma de antibióticos en las 72h previas y/o los 3 meses anteriores, el ingreso en el mes previo y la existencia de comorbilidades (enfermedad tumoral sólida u oncohematológica, hepatopatía, nefropatía, diabetes mellitus, enfermedad cardiaca crónica o cerebrovascular, enfermedad pulmonar obstructiva crónica, arterial periférica o del tejido conectivo, estado de inmunosupresión, tratamiento con corticoides e infección por el virus de la inmunodeficiencia humana). Se calculó el índice de Charlson21 (y dicotomizado ≥3 puntos) y la situación funcional (índice de Barthel22 y dicotomizado ≤60).
Asimismo, se registraron datos clínicos y de gravedad: temperatura (Tª) en grados centígrados (°C), alteración de la consciencia definida con <15 puntos en la escala del coma de Glasgow (ECG), presión arterial sistólica (PAS), criterios de sepsis, sepsis grave o shock séptico y las variables que los definen según la conferencia de expertos de sepsis de 200123. Se aplicaron los criterios de selección pronóstica de pacientes en las definiciones del quick Sepsis Related Organ Failure Assessment (qSOFA)≥2 y las variables que la constituyen según la tercera conferencia de consenso de sepsis (SEPSIS-3)24. Se incluyeron variables de evolución y destino: días de clínica previa, destino inicial de los pacientes, días de estancia hospitalaria, reconsulta en el SUH en los 30 días posteriores y la mortalidad hospitalaria y a los 30 días. Finalmente, con relación a las analíticas, se registró el recuento de leucocitos (así como leucocitosis >12.000/mm3, leucopenia <4.000/mm3 o cayados >10%), concentración de PCR en mg/l (dicotomizado para ≥9mg/l y para ≥21mg/l) y la de PCT en ng/ml (dicotomizado para los PC elegidos según estudios previos de ≥0,43, ≥0,51 y ≥1ng/ml)8,20,25.
Análisis estadísticoSe utilizaron medias y sus desviaciones estándar (DE) para las variables cuantitativas, y números absolutos y porcentajes para las cualitativas. Se utilizaron las pruebas de Chi-cuadrado o exacta de Fisher, la t de Student y la U de Mann-Whitney, según fueran aplicables, para investigar la relación entre la existencia de BV frente a HC negativos (contaminados y los que no tuvieron ningún aislamiento) y las variables independientes (y aquellas que se dicotomizaron). Se consideró significativo un valor de p<0,05, los contrastes fueron bilaterales. Se realizó un análisis descriptivo (números absolutos y porcentajes) de ambos grupos (BV frente a HC negativos) con relación al tipo de patógeno encontrado globalmente y un análisis diferenciado según fuera el aislamiento de bacterias grampositivas, gramnegativas o anaerobias, así como en función del foco o diagnóstico clínico realizado en el SUH.
En primer lugar, para el análisis del comportamiento de la escala primigenia en la muestra de este trabajo, se construyó un sistema de puntuación de riesgo en el que se asignó una puntuación a cada variable del modelo 5MPB-Toledo según el diseño original20. La puntuación de riesgo de cada paciente se calculó sumando los puntos de cada factor presente. Así, los sujetos se dividieron entre grupos de riesgo bajo, moderado y alto, en función de las probabilidades predichas del modelo. La capacidad de discriminación del modelo predictivo se analizó calculando el ABC-COR y su intervalo de confianza al 95% (IC 95%). Se evaluó la calibración del modelo mediante la prueba de bondad de ajuste de Hosmer-Lemeshow. Posteriormente, se validó internamente el resultado obtenido mediante un análisis de remuestreo (bootstrapping) con 1.000 remuestreos y se calculó el ABC-COR y su IC 95%. Los errores estándar de las ABC se calcularon por métodos no paramétricos. Del mismo modo, en determinados subgrupos de especial interés clínico, se analizó el rendimiento del modelo a través de sus ABC-ROC e IC 95%. Además, se utilizó un gráfico tipo boxplots para mostrar la dispersión y la relación de las distintas puntuaciones de la escala con la probabilidad de presentar BV.
En segundo lugar, se determinó el punto de corte (PC) de los resultados del modelo (de 1 a 8) con mayor capacidad diagnóstica que maximizaba la diferencia entre la tasa de verdaderos positivos y falsos positivos mediante el índice de Youden. Así, se calculó el rendimiento diagnóstico de estos PC del modelo elegidos con los cálculos de la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CP+) y el coeficiente de probabilidad negativo (CP−) para cada resultado estudiado, así como sus IC 95% por métodos binomiales exactos y por el de Taylor para los CP.
En todos los contrastes, se rechazó la hipótesis nula con error α menor a 0,5. El análisis estadístico se realizó con los paquetes IBM-SPSS® Statistics 22 para Windows y STATA 12.0.
Consideraciones éticasEl estudio ha seguido todos los protocolos y normas de nuestros centros e internacionales (Declaración de Helsinki) para la utilización de los datos de los pacientes que se codificaron para asegurar la confidencialidad de los mismos. El estudio fue evaluado y aprobado por el Comité Ético de Investigación Clínica (CEIC) del Complejo Hospitalario Universitario de Toledo (n.°: 398/2109), así como por los CEIC/CEIm de referencia de los centros participantes. Todos los pacientes dieron su consentimiento escrito para participar en el estudio.
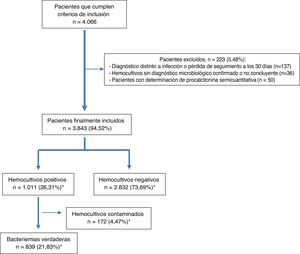
ResultadosDurante el periodo de estudio, se seleccionaron por oportunidad 4.066 pacientes que cumplían con los criterios de inclusión. De estos, se excluyeron 223 (36 casos al no tener un diagnóstico microbiológico confirmado en los HC, 137 por perderse su seguimiento o cambiar a otro diagnóstico durante los 30 días tras su visita al SUH y 50 por tener determinación semicuantitativa de la PCT). Finalmente, se incluyeron 3.843 pacientes de los que se obtuvieron, al menos, 2 parejas de HC. La edad media de los pacientes fue de 67 (DE: 19) años con un rango entre 18 y 101 años. El 59,5% (2.287) tenían más de 65 años y 2.346 eran varones (61%).
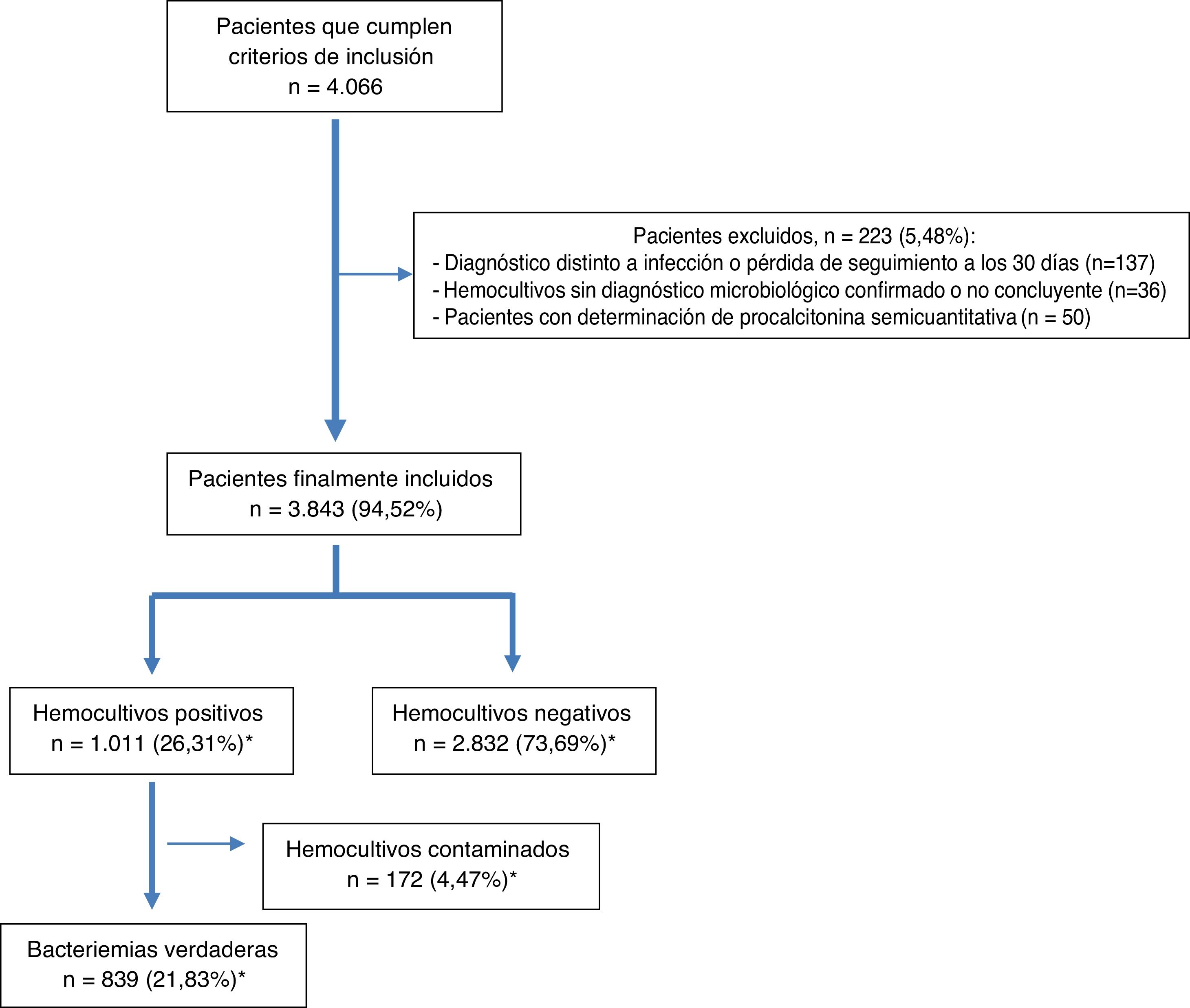
Tras el estudio microbiológico, 2.832 (73,69%) HC fueron negativos y en 1.011 (26,31%) se obtuvieron aislamientos, de los que fueron considerados como HC contaminados 172 (4,47%) y BV 839 (21,83%) (en 13 ocasiones, 1,27%, polimicrobianas). El diagrama de flujo de inclusión de episodios se muestra en la figura 1.
Finalmente, cabe señalar que 70 (8,34%) de las BV fueron clasificadas como BPAU en pacientes dados de alta directamente tras la valoración en el SUH o tras haber permanecido en observación unas horas.
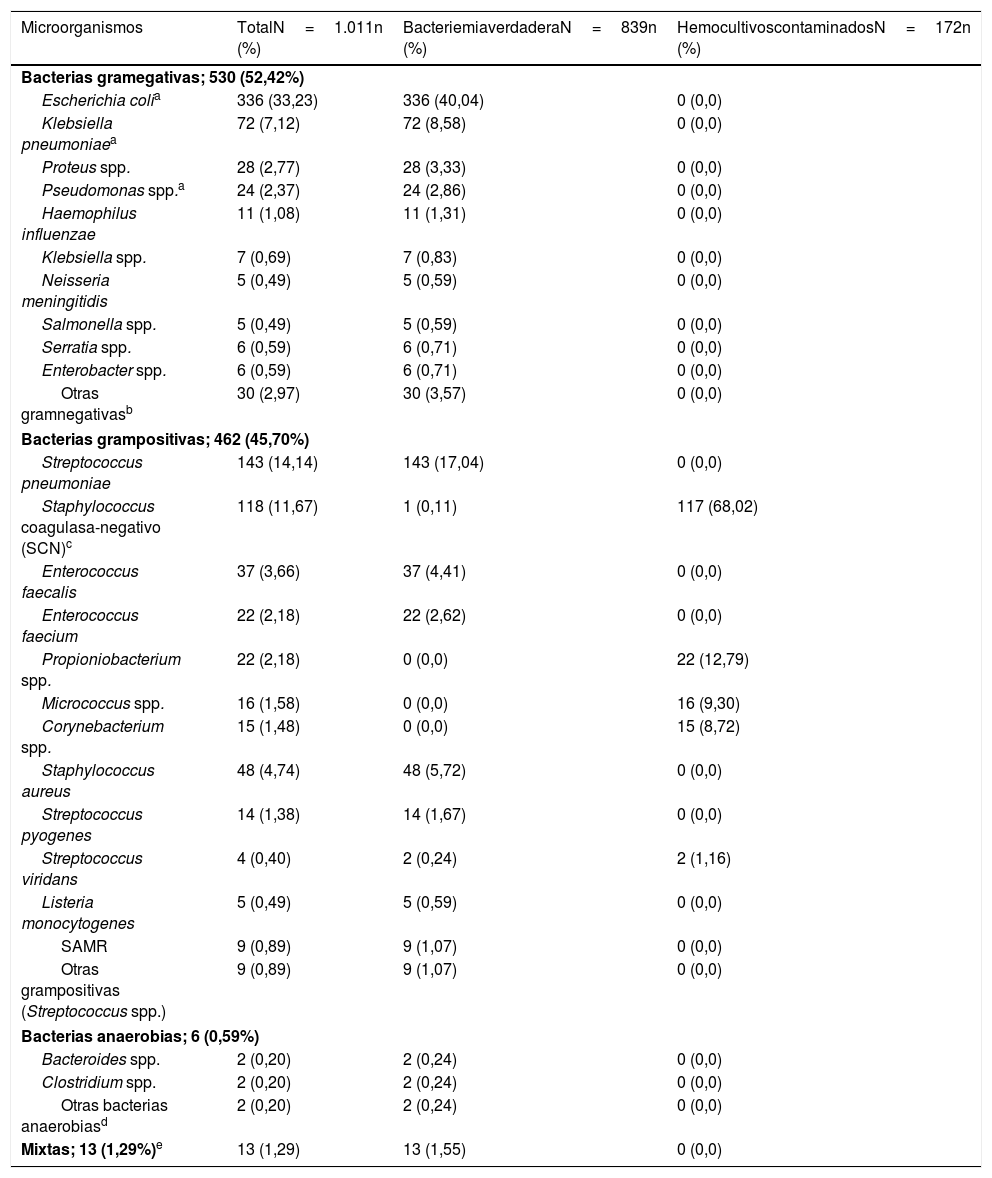
La etiología agrupada y por microorganismos de las BV y de los HC contaminados se expone en la tabla 1. Los aislamientos más frecuentes en las BV fueron Escherichia coli con/sin betalactamasas de espectro extendido (BLEE) (336/839; 40,04%) y Streptococcus pneumoniae (143/839 casos; 17,04%). Por su parte, Escherichia coli fue también el patógeno más frecuente aislado de las BPAU (31/70; 44,29%). En relación con los HC contaminados, los más frecuentes fueron Staphylococcus coagulasa-negativo (117/172; 68,02%).
Características microbiológicas de la muestra global en función del tipo de aislamiento (bacteriemia verdadera frente a hemocultivos contaminados)
| Microorganismos | TotalN=1.011n (%) | BacteriemiaverdaderaN=839n (%) | HemocultivoscontaminadosN=172n (%) |
|---|---|---|---|
| Bacterias gramegativas; 530 (52,42%) | |||
| Escherichia colia | 336 (33,23) | 336 (40,04) | 0 (0,0) |
| Klebsiella pneumoniaea | 72 (7,12) | 72 (8,58) | 0 (0,0) |
| Proteus spp. | 28 (2,77) | 28 (3,33) | 0 (0,0) |
| Pseudomonas spp.a | 24 (2,37) | 24 (2,86) | 0 (0,0) |
| Haemophilus influenzae | 11 (1,08) | 11 (1,31) | 0 (0,0) |
| Klebsiella spp. | 7 (0,69) | 7 (0,83) | 0 (0,0) |
| Neisseria meningitidis | 5 (0,49) | 5 (0,59) | 0 (0,0) |
| Salmonella spp. | 5 (0,49) | 5 (0,59) | 0 (0,0) |
| Serratia spp. | 6 (0,59) | 6 (0,71) | 0 (0,0) |
| Enterobacter spp. | 6 (0,59) | 6 (0,71) | 0 (0,0) |
| Otras gramnegativasb | 30 (2,97) | 30 (3,57) | 0 (0,0) |
| Bacterias grampositivas; 462 (45,70%) | |||
| Streptococcus pneumoniae | 143 (14,14) | 143 (17,04) | 0 (0,0) |
| Staphylococcus coagulasa-negativo (SCN)c | 118 (11,67) | 1 (0,11) | 117 (68,02) |
| Enterococcus faecalis | 37 (3,66) | 37 (4,41) | 0 (0,0) |
| Enterococcus faecium | 22 (2,18) | 22 (2,62) | 0 (0,0) |
| Propioniobacterium spp. | 22 (2,18) | 0 (0,0) | 22 (12,79) |
| Micrococcus spp. | 16 (1,58) | 0 (0,0) | 16 (9,30) |
| Corynebacterium spp. | 15 (1,48) | 0 (0,0) | 15 (8,72) |
| Staphylococcus aureus | 48 (4,74) | 48 (5,72) | 0 (0,0) |
| Streptococcus pyogenes | 14 (1,38) | 14 (1,67) | 0 (0,0) |
| Streptococcus viridans | 4 (0,40) | 2 (0,24) | 2 (1,16) |
| Listeria monocytogenes | 5 (0,49) | 5 (0,59) | 0 (0,0) |
| SAMR | 9 (0,89) | 9 (1,07) | 0 (0,0) |
| Otras grampositivas (Streptococcus spp.) | 9 (0,89) | 9 (1,07) | 0 (0,0) |
| Bacterias anaerobias; 6 (0,59%) | |||
| Bacteroides spp. | 2 (0,20) | 2 (0,24) | 0 (0,0) |
| Clostridium spp. | 2 (0,20) | 2 (0,24) | 0 (0,0) |
| Otras bacterias anaerobiasd | 2 (0,20) | 2 (0,24) | 0 (0,0) |
| Mixtas; 13 (1,29%)e | 13 (1,29) | 13 (1,55) | 0 (0,0) |
SAMR: Staphylococcus aureus resistente a meticilina.
Otras gramnegativas: Morganella morganii, Hafnia alvei,Acinetobacter baumannii y Stenotrophomonas maltophilia.
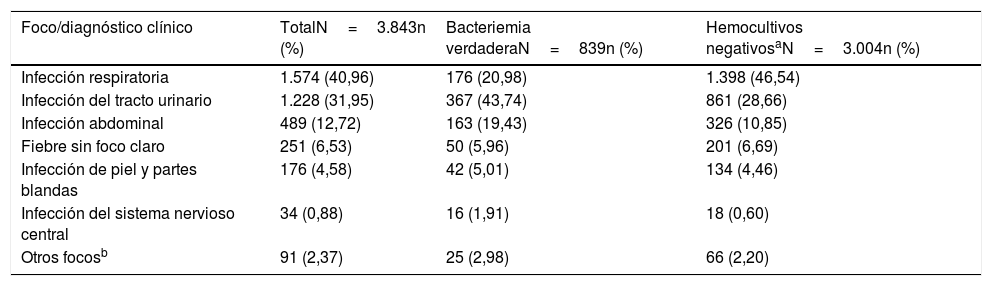
El foco u origen clínico de presunción en el SUH de las BV y de los HC negativos se muestra en la tabla 2.
Foco/diagnóstico clínico de presunción en el servicio de urgencias de la muestra global en función de la existencia o no de bacteriemia verdadera
| Foco/diagnóstico clínico | TotalN=3.843n (%) | Bacteriemia verdaderaN=839n (%) | Hemocultivos negativosaN=3.004n (%) |
|---|---|---|---|
| Infección respiratoria | 1.574 (40,96) | 176 (20,98) | 1.398 (46,54) |
| Infección del tracto urinario | 1.228 (31,95) | 367 (43,74) | 861 (28,66) |
| Infección abdominal | 489 (12,72) | 163 (19,43) | 326 (10,85) |
| Fiebre sin foco claro | 251 (6,53) | 50 (5,96) | 201 (6,69) |
| Infección de piel y partes blandas | 176 (4,58) | 42 (5,01) | 134 (4,46) |
| Infección del sistema nervioso central | 34 (0,88) | 16 (1,91) | 18 (0,60) |
| Otros focosb | 91 (2,37) | 25 (2,98) | 66 (2,20) |
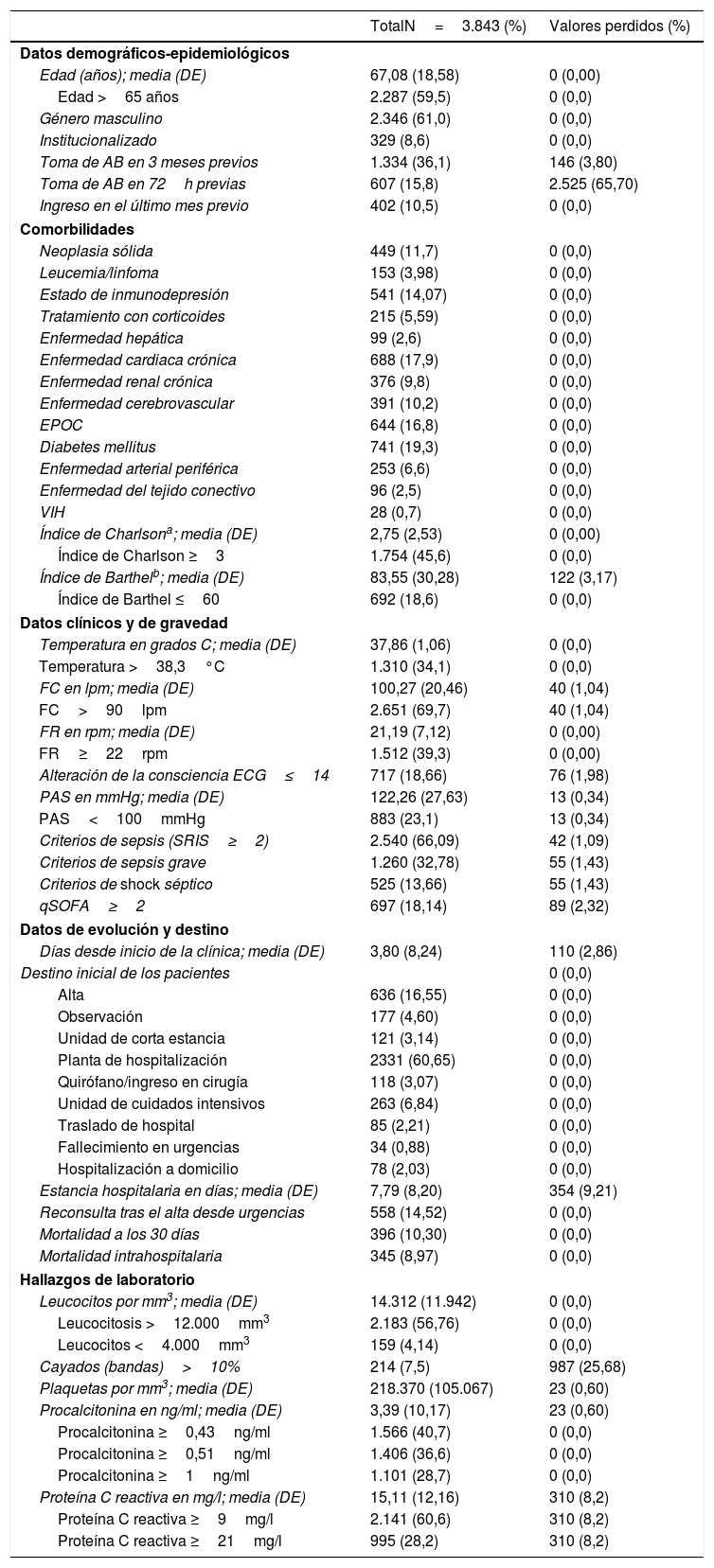
En la tabla 3 se muestran las características sociodemográficas, epidemiológicas, comorbilidades, funcionales, clínicas, de gravedad, de evolución y destino de los pacientes de la muestra global del estudio. En la tabla 1S (material suplementario) se muestran esas mismas características con los datos del estudio comparativo de los casos de BV frente a los HC negativos.
Características clínico-epidemiológicas, de evolución, destino y analíticas de la muestra global
| TotalN=3.843 (%) | Valores perdidos (%) | |
|---|---|---|
| Datos demográficos-epidemiológicos | ||
| Edad (años); media (DE) | 67,08 (18,58) | 0 (0,00) |
| Edad >65 años | 2.287 (59,5) | 0 (0,0) |
| Género masculino | 2.346 (61,0) | 0 (0,0) |
| Institucionalizado | 329 (8,6) | 0 (0,0) |
| Toma de AB en 3 meses previos | 1.334 (36,1) | 146 (3,80) |
| Toma de AB en 72h previas | 607 (15,8) | 2.525 (65,70) |
| Ingreso en el último mes previo | 402 (10,5) | 0 (0,0) |
| Comorbilidades | ||
| Neoplasia sólida | 449 (11,7) | 0 (0,0) |
| Leucemia/linfoma | 153 (3,98) | 0 (0,0) |
| Estado de inmunodepresión | 541 (14,07) | 0 (0,0) |
| Tratamiento con corticoides | 215 (5,59) | 0 (0,0) |
| Enfermedad hepática | 99 (2,6) | 0 (0,0) |
| Enfermedad cardiaca crónica | 688 (17,9) | 0 (0,0) |
| Enfermedad renal crónica | 376 (9,8) | 0 (0,0) |
| Enfermedad cerebrovascular | 391 (10,2) | 0 (0,0) |
| EPOC | 644 (16,8) | 0 (0,0) |
| Diabetes mellitus | 741 (19,3) | 0 (0,0) |
| Enfermedad arterial periférica | 253 (6,6) | 0 (0,0) |
| Enfermedad del tejido conectivo | 96 (2,5) | 0 (0,0) |
| VIH | 28 (0,7) | 0 (0,0) |
| Índice de Charlsona; media (DE) | 2,75 (2,53) | 0 (0,00) |
| Índice de Charlson ≥3 | 1.754 (45,6) | 0 (0,0) |
| Índice de Barthelb; media (DE) | 83,55 (30,28) | 122 (3,17) |
| Índice de Barthel ≤60 | 692 (18,6) | 0 (0,0) |
| Datos clínicos y de gravedad | ||
| Temperatura en grados C; media (DE) | 37,86 (1,06) | 0 (0,0) |
| Temperatura >38,3°C | 1.310 (34,1) | 0 (0,0) |
| FC en lpm; media (DE) | 100,27 (20,46) | 40 (1,04) |
| FC>90lpm | 2.651 (69,7) | 40 (1,04) |
| FR en rpm; media (DE) | 21,19 (7,12) | 0 (0,00) |
| FR≥22rpm | 1.512 (39,3) | 0 (0,00) |
| Alteración de la consciencia ECG≤14 | 717 (18,66) | 76 (1,98) |
| PAS en mmHg; media (DE) | 122,26 (27,63) | 13 (0,34) |
| PAS<100mmHg | 883 (23,1) | 13 (0,34) |
| Criterios de sepsis (SRIS≥2) | 2.540 (66,09) | 42 (1,09) |
| Criterios de sepsis grave | 1.260 (32,78) | 55 (1,43) |
| Criterios de shock séptico | 525 (13,66) | 55 (1,43) |
| qSOFA≥2 | 697 (18,14) | 89 (2,32) |
| Datos de evolución y destino | ||
| Días desde inicio de la clínica; media (DE) | 3,80 (8,24) | 110 (2,86) |
| Destino inicial de los pacientes | 0 (0,0) | |
| Alta | 636 (16,55) | 0 (0,0) |
| Observación | 177 (4,60) | 0 (0,0) |
| Unidad de corta estancia | 121 (3,14) | 0 (0,0) |
| Planta de hospitalización | 2331 (60,65) | 0 (0,0) |
| Quirófano/ingreso en cirugía | 118 (3,07) | 0 (0,0) |
| Unidad de cuidados intensivos | 263 (6,84) | 0 (0,0) |
| Traslado de hospital | 85 (2,21) | 0 (0,0) |
| Fallecimiento en urgencias | 34 (0,88) | 0 (0,0) |
| Hospitalización a domicilio | 78 (2,03) | 0 (0,0) |
| Estancia hospitalaria en días; media (DE) | 7,79 (8,20) | 354 (9,21) |
| Reconsulta tras el alta desde urgencias | 558 (14,52) | 0 (0,0) |
| Mortalidad a los 30 días | 396 (10,30) | 0 (0,0) |
| Mortalidad intrahospitalaria | 345 (8,97) | 0 (0,0) |
| Hallazgos de laboratorio | ||
| Leucocitos por mm3; media (DE) | 14.312 (11.942) | 0 (0,0) |
| Leucocitosis >12.000mm3 | 2.183 (56,76) | 0 (0,0) |
| Leucocitos <4.000mm3 | 159 (4,14) | 0 (0,0) |
| Cayados (bandas)>10% | 214 (7,5) | 987 (25,68) |
| Plaquetas por mm3; media (DE) | 218.370 (105.067) | 23 (0,60) |
| Procalcitonina en ng/ml; media (DE) | 3,39 (10,17) | 23 (0,60) |
| Procalcitonina ≥0,43ng/ml | 1.566 (40,7) | 0 (0,0) |
| Procalcitonina ≥0,51ng/ml | 1.406 (36,6) | 0 (0,0) |
| Procalcitonina ≥1ng/ml | 1.101 (28,7) | 0 (0,0) |
| Proteína C reactiva en mg/l; media (DE) | 15,11 (12,16) | 310 (8,2) |
| Proteína C reactiva ≥9mg/l | 2.141 (60,6) | 310 (8,2) |
| Proteína C reactiva ≥21mg/l | 995 (28,2) | 310 (8,2) |
AB: antibióticos; C: centígrados; m: meses; DE: desviación estándar; n: número; EPOC: enfermedad pulmonar obstructiva crónica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; h: horas; lpm: latidos por minuto; rpm: respiraciones por minuto; qSOFA: quick Sepsis Related Organ Failure Assessment; VIH: virus de la inmunodeficiencia humana.
a Índice de Charlson: ponderado por la edad21.
b Índice de Barthel22.
Criterios de sepsis (SRIS≥2) según conferencia de Consenso de 200123.
Criterios de sepsis (qSOFA≥2) según la tercera conferencia de consenso (Sepsis-3)24.
*Hemocultivos negativos: incluye los 2.832 sin aislamiento y los 172 definidos como contaminados.
Asimismo, en la tabla 3 se muestran los resultados en la muestra global del estudio de las determinaciones analíticas relevantes como el recuento absoluto de leucocitos, existencia de leucocitosis >12.000/mm3, una proporción >10% de cayados y leucopenia <4.000/mm3, recuento de plaquetas y trombocitopenia <150.000/mm3 y las concentraciones de PCT y PCR absolutas y según los PC predeterminados. Por su parte, en la tabla 2S (material suplementario) se muestran esas mismas variables con los datos del estudio comparativo de los casos de BV frente a los HC negativos.
La mortalidad a los 30 días de todos los pacientes con el diagnóstico de infección fue del 10,30%, mientras que en los pacientes con BV frente a los que tuvieron HC negativos fue del 15,97 frente al 8,72% (p<0,001).
Comportamiento de la escala y análisis de los grupos de riesgo del modelo predictivo 5MPB-Toledo en la muestra del estudio de validaciónLa figura 2 muestra la escala de puntuación 5MPB-Toledo (Tª>38,3°C, índice de Charlson ≥3, FR≥22, leucocitosis >12.000/mm3 y PCT≥0,51ng/ml), así como el valor y el peso de cada una de las variables del modelo, y la probabilidad del modelo original y de la cohorte de validación en función de la categoría de bajo (0-2 puntos), moderado (3-5 puntos) o alto (6-8 puntos) riesgo de bacteriemia que fue del 1,1 frente al 1,5%, 10,5 frente al 16,8% y 77 frente al 81,6%, respectivamente.
Por su parte, el porcentaje de pacientes incluidos en los grupos bajo, moderado y alto riesgo del modelo original 5MPB-Toledo y la cohorte de validación fue del 65,24% frente al 52,5%, 23,44% frente al 20,4% y 11,32% frente al 27,1%, respectivamente. Los casos incluidos con 0 puntos fueron 336 (8,7%), con un punto 860 (22,4%), con 2 puntos 823 (21,4%), con 3 puntos 348 (9,1%), con 4 puntos 127 (3,3%), con 5 puntos 309 (8,0%), con 6 puntos 486 (12,6%), con 7 puntos 409 (10,6%) y con 8 puntos 145 (3,8%).
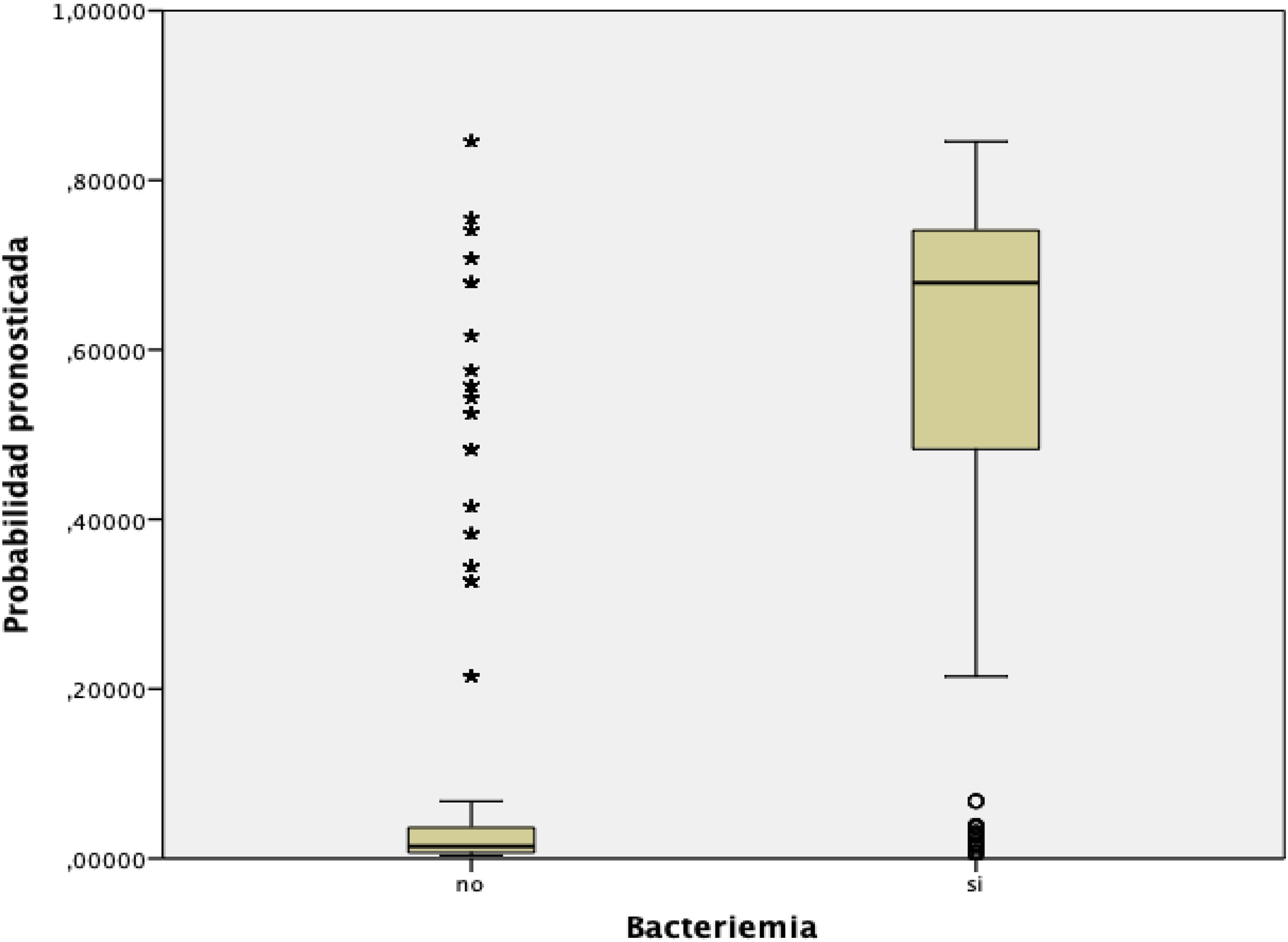
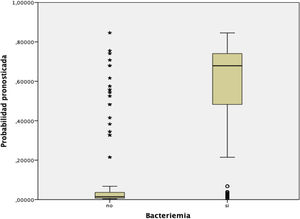
En la figura 3 se muestra la distribución y relación de los resultados de las distintas puntuaciones de la escala con la probabilidad de presentar BV.
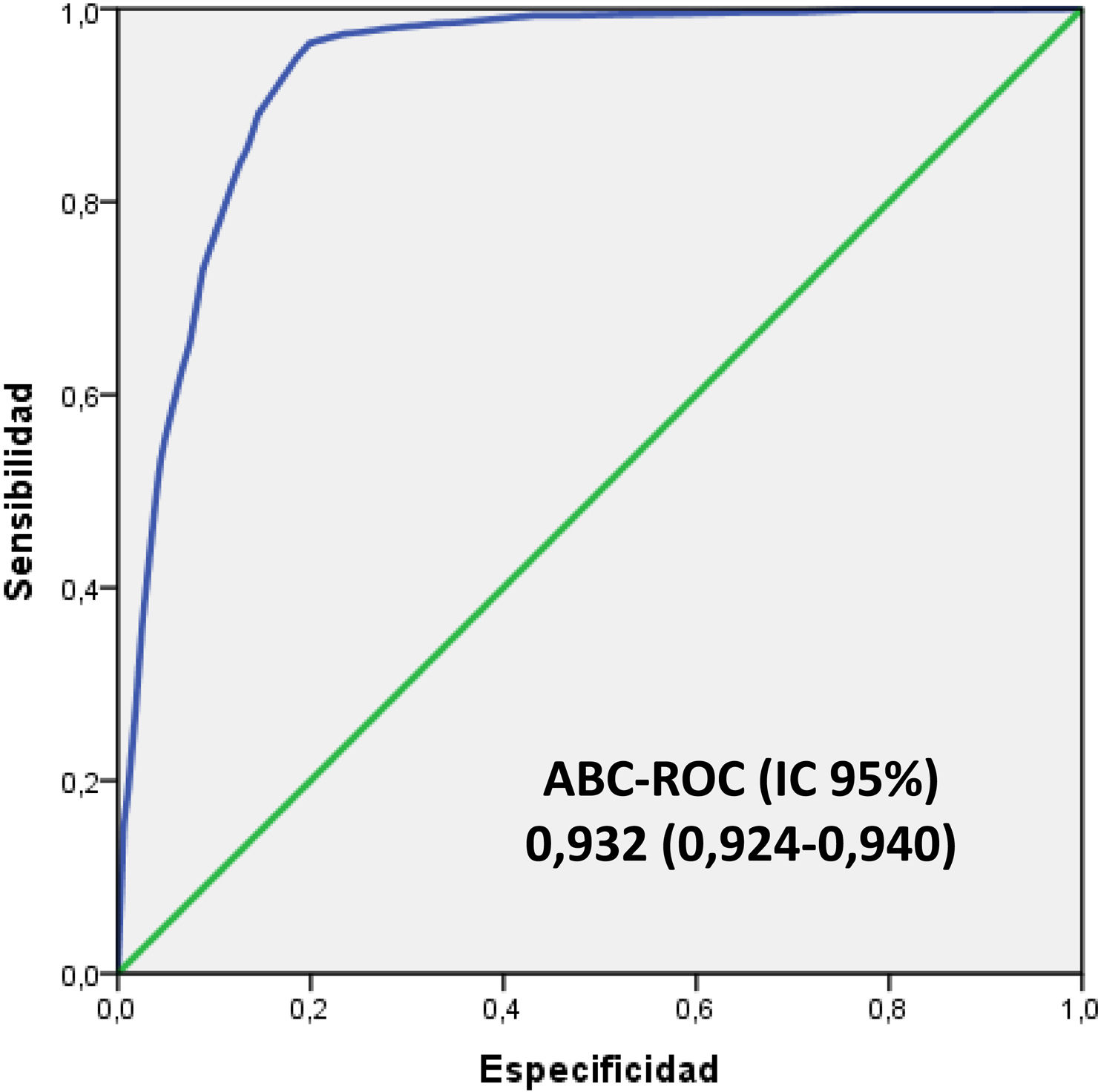
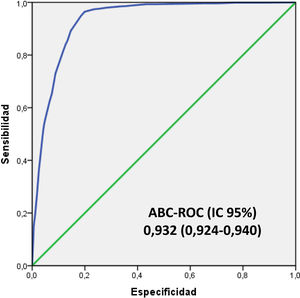
En la figura 4 se muestra el ABC-COR del modelo 5MPB-Toledo en la corte de validación que fue de 0,932 (IC 95%: 0,924-0,940; p<0,001). El test de bondad de ajuste de Hosmer-Lemeshow presentó un valor de p de 0,631. La validación interna, mediante la técnica de remuestreo (bootstrapping) fue de 0,930 (IC 95%: 0,916-0,948; p<0,001).
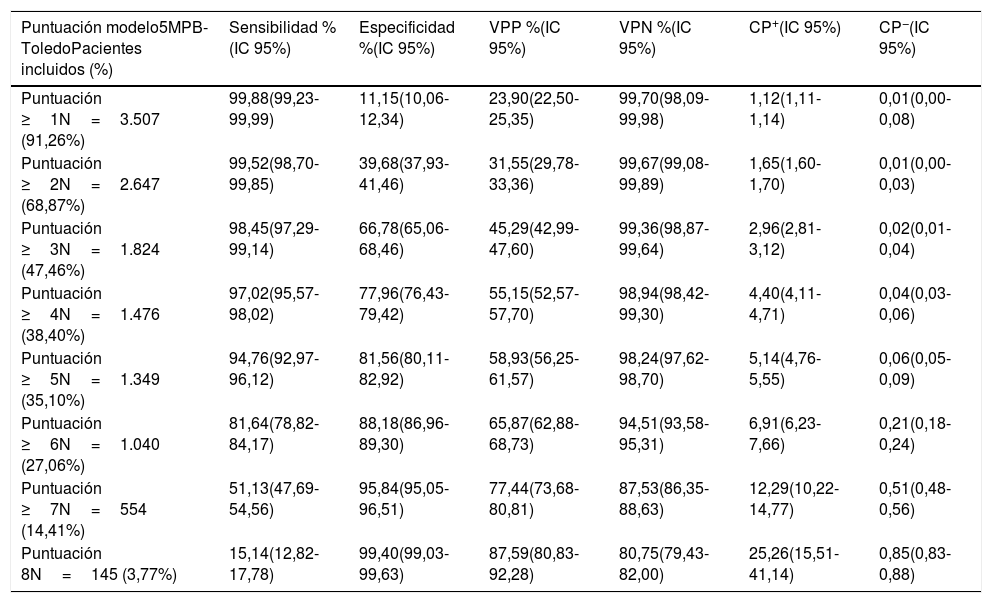
Análisis de los resultados según los distintos puntos de corte del modelo predictivo 5MPB-Toledo con la muestra del estudio de validaciónEn la tabla 4 se muestran los resultados de rendimiento diagnóstico de los distintos PC analizados y el número y porcentaje de episodios correspondientes a los grupos según los PC establecidos.
Rendimiento para la predicción de bacteriemia verdadera en los hemocultivos extraídos en urgencias según los puntos de corte del modelo 5MPB-Toledo
| Puntuación modelo5MPB-ToledoPacientes incluidos (%) | Sensibilidad %(IC 95%) | Especificidad %(IC 95%) | VPP %(IC 95%) | VPN %(IC 95%) | CP+(IC 95%) | CP−(IC 95%) |
|---|---|---|---|---|---|---|
| Puntuación ≥1N=3.507 (91,26%) | 99,88(99,23-99,99) | 11,15(10,06-12,34) | 23,90(22,50-25,35) | 99,70(98,09-99,98) | 1,12(1,11-1,14) | 0,01(0,00-0,08) |
| Puntuación ≥2N=2.647 (68,87%) | 99,52(98,70-99,85) | 39,68(37,93-41,46) | 31,55(29,78-33,36) | 99,67(99,08-99,89) | 1,65(1,60-1,70) | 0,01(0,00-0,03) |
| Puntuación ≥3N=1.824 (47,46%) | 98,45(97,29-99,14) | 66,78(65,06-68,46) | 45,29(42,99-47,60) | 99,36(98,87-99,64) | 2,96(2,81-3,12) | 0,02(0,01-0,04) |
| Puntuación ≥4N=1.476 (38,40%) | 97,02(95,57-98,02) | 77,96(76,43-79,42) | 55,15(52,57-57,70) | 98,94(98,42-99,30) | 4,40(4,11-4,71) | 0,04(0,03-0,06) |
| Puntuación ≥5N=1.349 (35,10%) | 94,76(92,97-96,12) | 81,56(80,11-82,92) | 58,93(56,25-61,57) | 98,24(97,62-98,70) | 5,14(4,76-5,55) | 0,06(0,05-0,09) |
| Puntuación ≥6N=1.040 (27,06%) | 81,64(78,82-84,17) | 88,18(86,96-89,30) | 65,87(62,88-68,73) | 94,51(93,58-95,31) | 6,91(6,23-7,66) | 0,21(0,18-0,24) |
| Puntuación ≥7N=554 (14,41%) | 51,13(47,69-54,56) | 95,84(95,05-96,51) | 77,44(73,68-80,81) | 87,53(86,35-88,63) | 12,29(10,22-14,77) | 0,51(0,48-0,56) |
| Puntuación 8N=145 (3,77%) | 15,14(12,82-17,78) | 99,40(99,03-99,63) | 87,59(80,83-92,28) | 80,75(79,43-82,00) | 25,26(15,51-41,14) | 0,85(0,83-0,88) |
CP+: cociente de probabilidad positivo; CP−: cociente de probabilidad negativo; IC: intervalo de confianza; N: número; VPN: valor predictivo negativo; VPP: valor predictivo positivo; 5MPB-Toledo: modelo de 5 variables predictivas de bacteriemia de Toledo.
Finalmente, se eligió el PC≥5 puntos del modelo tras aplicar el índice de Youden y por el interés clínico. Este PC consigue una S del 94,76% (IC 95%: 92,97-96,12), E del 81,56% (IC 95%: 80,11-82,92), VPP del 58,93% (IC 95%: 56,25-61,57), VPN del 98,24% (IC 95%: 97,62-98,70), CP+ de 5,14 (IC 95%: 4,76-5,55) y CP− de 0,06 (IC 95%: 0,05-0,09).
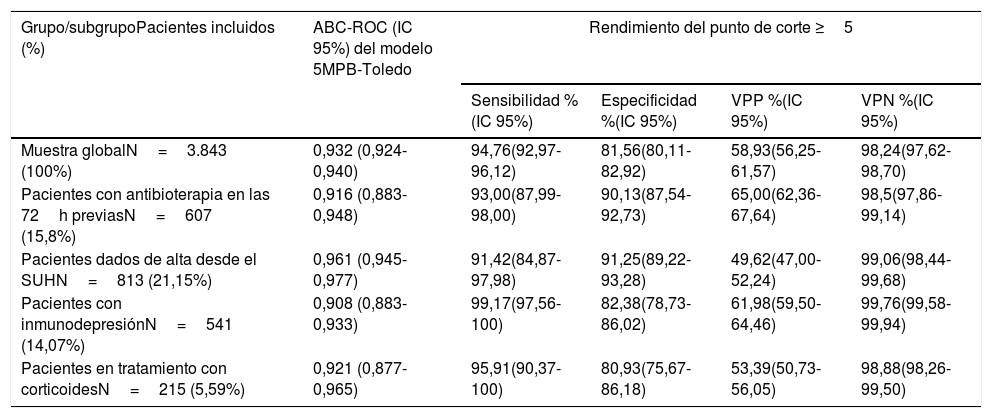
Rendimiento predictivo de bacteriemia verdadera del modelo 5MPB-Toledo en determinados subgruposEn la tabla 5 se muestran los resultados tanto del ABC-ROC del modelo 5MPB-Toledo, como del análisis de rendimiento del PC≥5 puntos, aplicado a los distintos subgrupos de pacientes: 1) Los que habían tomado antibioterapia en las 72h previas; 2) Pacientes dados de alta desde el SUH; 3) Pacientes con inmunodepresión (primaria o secundaria, incluyendo agentes inmunosupresores y neutropénicos), y 4) Pacientes en tratamiento con corticoides de forma continuada (≥10mg prednisona o equivalentes durante más de 7 días).
Capacidad predictiva de bacteriemia verdadera del modelo 5MPB-Toledo en determinados subgrupos y rendimiento del punto de corte ≥5 puntos
| Grupo/subgrupoPacientes incluidos (%) | ABC-ROC (IC 95%) del modelo 5MPB-Toledo | Rendimiento del punto de corte ≥5 | |||
|---|---|---|---|---|---|
| Sensibilidad %(IC 95%) | Especificidad %(IC 95%) | VPP %(IC 95%) | VPN %(IC 95%) | ||
| Muestra globalN=3.843 (100%) | 0,932 (0,924-0,940) | 94,76(92,97-96,12) | 81,56(80,11-82,92) | 58,93(56,25-61,57) | 98,24(97,62-98,70) |
| Pacientes con antibioterapia en las 72h previasN=607 (15,8%) | 0,916 (0,883-0,948) | 93,00(87,99-98,00) | 90,13(87,54-92,73) | 65,00(62,36-67,64) | 98,5(97,86-99,14) |
| Pacientes dados de alta desde el SUHN=813 (21,15%) | 0,961 (0,945-0,977) | 91,42(84,87-97,98) | 91,25(89,22-93,28) | 49,62(47,00-52,24) | 99,06(98,44-99,68) |
| Pacientes con inmunodepresiónN=541 (14,07%) | 0,908 (0,883-0,933) | 99,17(97,56-100) | 82,38(78,73-86,02) | 61,98(59,50-64,46) | 99,76(99,58-99,94) |
| Pacientes en tratamiento con corticoidesN=215 (5,59%) | 0,921 (0,877-0,965) | 95,91(90,37-100) | 80,93(75,67-86,18) | 53,39(50,73-56,05) | 98,88(98,26-99,50) |
CP+: cociente de probabilidad positivo; CP−: cociente de probabilidad negativo; IC: intervalo de confianza; N: número; SUH: servicios de urgencias hospitalarios; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los resultados de este estudio permiten validar externamente un modelo de riesgo sencillo para predecir bacteriemia en los pacientes adultos atendidos por un episodio de infección en los SUH. La escala de puntuación 5MPB-Toledo20 incluye variables, fácilmente obtenibles en el primer momento de la atención de los pacientes con sospecha de infección grave, exploratorias (Tª y FR), de comorbilidad (índice de Charlson) y analíticas (recuento de leucocitos y concentración sérica de PCT). Por lo tanto, puede representar una herramienta de ayuda útil a la hora de predecir la existencia de bacteriemia, para así optimizar las decisiones más importantes e inmediatas que se deben tomar en los SUH: indicación de extracción de los HC, administrar una terapia antimicrobiana adecuada y precoz y el ingreso hospitalario o el alta domiciliaria, entre otras5,12.
El excelente ABC-COR obtenida tras el remuestreo (0,930 [IC 95%: 0,916-0,948; p<0,001]), mínimamente inferior a la publicada del modelo original (0,946 [IC 95%: 0,922-0,969; p<0,001])20 y la distribución del porcentaje de BV en cada grupo de riesgo (1,5% en el de bajo riesgo, 16,8% en el de moderado riesgo y el 81,6% en el de alto riesgo) clasifican a los pacientes en 3 categorías bien diferenciadas. Por su parte, el PC≥5 puntos ofrece con una S de más del 94% y un VPN superior al 98%, una garantía evidente para descartar la existencia de bacteriemia en un paciente con diagnóstico clínico de infección. Además, con pequeñas diferencias en el comportamiento del modelo (ABC-ROC de 0,908 a 0,961) en los subgrupos de pacientes estudiados individualmente (dados de alta directamente desde el SUH, enfermos que habían tomado antibióticos previamente o corticoides y los inmunodeprimidos) donde el PC≥5 consigue igualmente S de más del 91% y un VPN superior al 98%. Todo ello supone, si el juicio clínico, el tipo de proceso y las características del paciente lo permiten, que el paciente pueda ser dado de alta con el tratamiento antimicrobiano adecuado y optimizar la decisión de extracción de los HC en el SUH con eficacia y seguridad20.
En la actualidad, la técnica de extracción de los HC está bien protocolizada1,6, pero todavía hay importantes controversias en relación a las indicaciones de cuándo debemos obtenerlos en el SUH1,10,15. A pesar de ello, la obtención de los HC es una práctica creciente en la valoración inicial de los pacientes con sospecha de infección en el SUH5,6,15. En ellos, la sospecha y confirmación de bacteriemia tiene un importante significado diagnóstico, pronóstico y terapéutico. Pero, además, los HC también se obtienen en el SUH como garantía de continuidad asistencial, ya que del conocimiento de sus resultados dependerá el manejo y evolución posterior del paciente en su destino final5,15,26.
En este contexto, en la última década, se ha acentuado el estudio de los factores predictores de bacteriemia y se han propuesto distintos modelos predictivos para los SUH de distinta complejidad13–20,27. En ellos, ha adquirido una gran relevancia el papel que pueden jugar los biomarcadores, y en especial la PCT15, como factores predictores independientes de bacteriemia. Se ha demostrado que su capacidad diagnóstica puede igualar, e incluso superar, la de distintos modelos8,12,16,20,27–31.
Shapiro et al.13 publicaron una propuesta de modelo que clasifica el riesgo de bacteriemia en bajo (<1%), moderado (7-9%) y alto (15-26%), en función de unos criterios mayores (Tª>39,4°C, presencia de catéter vascular o sospecha de endocarditis) y de unos criterios menores (Tª>38,3°C, edad >65 años, escalofríos, vómitos, PAS<90mmHg, leucocitosis >18.000/mm3, >5% cayados, trombocitopenia <150.000/mm3 o creatinina >2mg/dl). Esta escala, durante muchos años, y tras ser validada14, ha sido la referencia más importante para los SUH15,26. Según este modelo de decisión, estaría indicada la extracción de los HC cuando se cumpliera un criterio mayor o, al menos, 2 menores. La escala de Shapiro consigue un ABC-COR de 0,83. Sin duda, se trata de un modelo con un rendimiento relevante y útil (aunque menor al conseguido por el modelo 5MPB-Toledo original que fue de 0,946 y en nuestra cohorte de validación de 0,932)20, pero resulta demasiado complejo para aplicarlo en los SUH y no tiene en cuenta la indudable aportación que podrían hacer los biomarcadores27–31. Por ello, otras propuestas pretendieron ser más rápidas y sencillas, como la de Tudela et al.16, que relacionó variables clínicas, analíticas y el índice de comorbilidad de Charlson, tras el análisis multivariante definió 2 variables significativas: el índice de Charlson ≥2 y una PCT>0,4ng/ml (uno y 2 puntos, respectivamente)16. Con estas 2 variables, se establecieron 4 grupos de probabilidad creciente de bacteriemia y conseguía un ABC de 0,80 y un VPN del 95,3% para «descartar» la existencia de bacteriemia. Al comparar el modelo de Tudela et al. con la escala 5MPB-Toledo, esta última incluye (con otros PC) las 2 variables del modelo anterior más la Tª, FR y leucocitos (que están presentes en las escalas pronósticas de gravedad y criterios definitorios de sepsis: qSOFA y SRIS). Por lo que la 5MPB-Toledo, junto a la valoración de PAS, FC y alteración del nivel de consciencia, podría ayudar a realizar fácilmente de forma integral una valoración diagnóstica (de infección y bacteriemia) y pronóstica (gravedad y mortalidad) de los pacientes con infección en los SUH5.
Recientemente, Contenti et al.28 consiguen la misma ABC-COR del modelo de Shapiro (0,83), solo con una variable de las definidas en nuestro estudio, la PCT, pero elevando el PC de esta a concentraciones mayores de 2,25ng/ml. Por ello, pensamos que la inclusión de la PCT en cualquier modelo o como factor individual, hoy en día, debería ser considerada en los SUH como sugieren distintos autores15,27–31. En nuestro estudio y en el modelo 5MPB-Toledo20, la PCT es el factor que mayor peso tiene en la escala (4 puntos) y el PC de PCT≥0,51ng/ml coincide con el recomendado de forma reciente12.
En la actualidad, la inclusión de la PCT en el modelo no debe suponer ninguna demora ni retraso en la toma de decisiones en el SUH. Primero, porque ante los pacientes con una situación clínica grave (sepsis grave-shock séptico) se debe actuar de forma inmediata, obteniendo las muestras de analítica y HC, y administrándose la primera dosis de antimicrobiano sin esperar los resultados (como se hace habitualmente). Y, por otro lado, en el resto de pacientes los valores de PCT hoy en día se disponen junto con el resto de la analítica urgente permitiendo atender, valorar y tomar las decisiones urgentes en la primera hora de estancia del paciente en el SUH5.
Otros modelos, que incluyen algunos de los factores identificados en nuestro estudio, aunque útiles, no consiguen alcanzar el rendimiento del modelo de Shapiro13. Pero algunos de ellos son más fáciles de evaluar e implementar en el SUH18,19. Como el de Su et al.17, que incluye como variables la Tª ≥38,3°C, taquicardia ≥120lpm, linfopenia <500/mm3 y una PCT>0,5ng/ml con otros datos analíticos. Este modelo de Su et al.17 consigue un ABC-ROC de 0,85, inferior al rendimiento de 5MPB-Toledo20.
Como es de suponer, que un modelo sea sencillo y rápido de realizar en el SUH, ha sido señalado como un factor fundamental para tener éxito en recientes metaanálisis y revisiones18,19. Aunque, asombrosamente, se ha comprobado que ninguno de los 15 modelos de dichas revisiones se han implementado en la práctica clínica diaria, ni siquiera, por sus respectivos autores19.
Pero, a diferencia de lo comentado anteriormente, otro artículo de revisión que analiza 35 estudios no ha sido capaz de identificar los factores independientes predictores de bacteriemia18. Por ello, en él no se recomienda la extracción de los HC sistemática solo con la existencia de fiebre y leucocitosis, lo que por ejemplo podría estar ausente en pacientes inmunodeprimidos o en tratamiento con corticoides27, y que para nuestro modelo serían 2 puntos (riesgo bajo del 1,5%). Los autores sugerían que se debería continuar buscando un modelo ideal que incorporara otras variables como los biomarcadores y la valoración clínica de la gravedad del paciente (con los signos vitales: Tª, FC, FR, PAS y nivel de consciencia)18,26.
Nuestro estudio presenta algunas limitaciones que hay que señalar. Así, la indicación de solicitar los HC se realiza según las decisiones del médico responsable en cada centro. Por ello, junto a esta variabilidad clínica, hay que recordar que un 5,48% de los HC no se registraron por no cumplir los criterios de inclusión (seguimiento y confirmación a los 30 días, sensibilidad de la PCT), y que los casos fueron incluidos por oportunidad (cuando los investigadores estuvieron de guardia en los SUH), así todo ello podría suponer un sesgo de selección al no haber sido considerados todos los episodios. Además, la selección de variables clínicas del modelo podría haber sido más completa (no se incluyeron algunas variables como escalofríos, tiritona o náuseas-vómitos, entre otras)18,19,26.
También hay que señalar la importante tasa de los HC contaminados (4,47%), hecho que se repite en estudios recientes, pero esto no supone un obstáculo para analizar los resultados, como ya ha sido publicado7,8,20. No obstante, a pesar de estas limitaciones, creemos que los resultados representan un fiel reflejo de la realidad de nuestros SUH. Por otra parte, respecto al modelo original, aporta las fortalezas de ser multicéntrico y prospectivo, con una muestra adecuada y sin datos perdidos en las variables que integran el modelo.
En conclusión, el modelo 5MPB-Toledo es de utilidad para la estratificación de riesgo de bacteriemia en los pacientes adultos con un proceso infeccioso en los SUH, ya que es capaz de predecirla adecuadamente con variables fácilmente disponibles y, junto al juicio clínico y otras variables independientes del proceso y del paciente, facilita la toma de decisión de indicación de obtención de los HC en los SUH y la estrategia diagnóstico-terapéutica.
Responsabilidades éticasTodos los autores han confirmado el mantenimiento de la confidencialidad y respeto de los derechos de los pacientes y la cesión de derechos a Enfermedades Infecciosas y Microbiología Clínica. El estudio fue aprobado por el Comité de Ética de Investigación Clínica (CEIC) del Complejo Hospitalario de Toledo (n.°: 398/2109) y posteriormente por los CEIC/CEIm de todos los centros participantes. Los pacientes dieron por escrito su consentimiento para participar en el estudio.
FinanciaciónEste manuscrito no ha recibido ninguna financiación por parte de ningún organismo ni público ni privado.
AutoríasLos autores declaran ser los responsables del diseño, desarrollo y elaboración del artículo.
Conflicto de interesesAJJ ha participado en reuniones científicas organizadas por Roche, Thermo Scientific Biomarkers, B·R·A·H·M·S AG y Biomerieux.
El resto de autores declaran la ausencia de conflictos de intereses en relación con el presente artículo.
Ningún autor ha recibido compensación económica por participar en este trabajo.
A Pedro Beneyto Martín y Francisco Javier Martín Sánchez, por su ayuda en el análisis estadístico de los datos.
Esperanza Ansa Arlegui, Igor Gallastegi Ruiz de Egino, Ricardo Palenzuela Arozena, Nerea Sarriegi Gorrotxategi, Xabier Errazkin Telletxea, Laura Munguía Nieva, Diego Vicente Anza, Maitane Arrastia Erviti (Hospital Universitario de Donosti); Isabel Nieto Rojas, William Esnaider López Forero, Elena Sánchez Maganto, Raúl Canabal Berlanga, Pedro Beneyto Martín (Complejo Hospitalario Universitario de Toledo); Isabel María Morales Barroso, María Carmen Manzano Alba, Fernando Oltra Hostalet, José Gallardo Bautista, María Angustias Sevilla Espejo (Hospital Virgen Macarena de Sevilla); María Jesús Domínguez García, M. Eugenia Barrero Ramos, Cristina Latorre Marco, Gema Delgado Cárdenas, Alberto Sánchez Bernal, Ángela Flores Palacio, Laura Martínez Vega, Laura Pérez Calero, Teresa Rincón Sánchez (Hospital Universitario de Fuenlabrada); M. Lourdes Nieto de Haro, Jerónimo Amores Fernández (Hospital Virgen de la Victoria de Málaga); Pablo Jerez-Fernández, Miguel Suarez-Robles, Clara Ramos-Rey, Ines Armenteros Yeguas, María Fernández-Revaldería, Eva Orviz García, Francisco Javier Martín Sánchez (Hospital Universitario Clínico San Carlos de Madrid); Silvia Álvarez Kailis, Beatriz Paderne Díaz, Gema María Gómez García, Alicia Rodríguez Urgel (Hospital Universitario de Móstoles); Sebastià Quetglas Roselló, Manel Tuells Morales, Marta Maristany Bosch, Ana Badía Tejero (Hospital Universitario de Bellvitge); Omar Saavedra, Nuria Seguí, Leticia Fresco, Gina Osorio, Julia Calvo, Joan Ribot, Irene Carbonell (Hospital Clínic de Barcelona); Leopoldo Higa Sansone, Marta Blazquez Andion, Miriam Mateo Roca, Sergio A. Herrera Mateo (Hospital de Sant Pau de Barcelona); Esperanza Puga Montalvo, Ziad Issa-Masad Khozouz (Hospital Campus de la Salud de Granada); Ramón Perales Pardo, Katia Chávez Tafur, Yolanda Prieto Corredor, Consuelo Parra Carretero, Mercedes Elena Pina (Complejo Hospitalario Universitario de Albacete); María José Marchena González, Esther Maldonado Pérez, Rocío Garrido Rasco, Miguel Albarrán Núñez (Hospital Juan Ramón Jiménez de Huelva); María del Mar Sousa Reviriego, Alicia Beteta López, Laura Janeth Duran Ducón, Sandra Verónica Tarabó Mieles, Ricardo Juárez González (Hospital Nuestra Señora del Prado de Talavera); José María Ferreras Amez (Hospital Clínico Universitario Lozano Blesa de Zaragoza); Henrique Villena García del Real (Complejo Hospitalario Universitario de Santiago de Compostela); Belén Arribas Entrala (Hospital Universitario Miguel Servet de Zaragoza); Marta Honrado Fernández de Valderrama (Hospital Santiago Apóstol de Miranda de Ebro); Eva Quero Motto, Eva Mónico Castillo, Antonia Cantero Sandoval, Roxana Rojas Luán, María Jesús Huertas Sánchez (Hospital Virgen de la Arrixaca de Murcia); Idoia Madariaga Ordeñana, Ainhoa Burzako Sánchez (Hospital Universitario de Basurto); Agustín Arévalo Velasco, M. Jesús Bringas García, Ángel García García, Carmen Rivas Herrero, Sonia del Amo Diego (Complejo Asistencial Universitario de Salamanca); Manel R. Chanovas-Borràs, Manuel Martínez Maimó, Noelia Cases Ariño, Carmen Melinda Prica, Montserrat Pech Solà (Hospital Verge de la Cinta de Tortosa); María Bóveda García, Jessica Mansilla Collado, Leticia Serrano Lázaro, Javier Millán Soria (Hospital La Fe de Valencia); Sergio Pastor Marín, Elena del Carmen Sánchez Cánovas, Gaelia Bornas Cayuela, Alba Hernández Sánchez, José Andrés Sánchez Nicolás (Hospital Universitario Reína Sofía de Murcia); Ángel Estella García, Mariola Aguilera Vidal, Mónica Carlota Aguilera Casasola, María del Mar Luque de Igunza, María Cristina Martín Rodríguez (Hospital Universitario de Jerez); Octavio José Salmerón Béliz, Ana Mecina Gutiérrez, Marta Beneyto Arana, Olivia Devora Ruano, M. Mar Bermejo Olano (Hospital Universitario Fundación de Alcorcón); Guillermo Burillo Putze, Aarati Vaswani-Bouchald, Carmen Mercedes García-Pérez, Carmen de la Fuente-García, Jazael Santana Rodríguez (Hospital Universitario de Canarias); Ester Monclús Cols, María Jové Lázaro, David Pellejà Monné, María Mercedes Brea Álvarez (Hospital Sant Jaume de Calella de Barcelona); Marta Balaguer Catalán, Teresa López Fernández, Noelia Orts Saurí, Alberto Cercós Perez, María Luisa López Grima (Hospital Universitario Doctor Peset de Valencia); Manuel Gil Mosquera, Luis Pérez Ordoño, Natalia Sánchez Prida, Laura Santos Franco, María Eugenia García Gil (Hospital Universitario 12 de octubre de Madrid); Ainhoa Urraca Gamaury, Marta Abeijón Vila, Carlos Aldasoro Frías (Complejo Asistencial de Zamora); Raúl López Izquierdo, Nieves Sobradillo Castrodeza (Hospital Universitario Río Hortega de Valladolid); Luis Quero Reboul (Hospital Virgen de la Merced de Osuna); Agurtzane Auzmendi Aguirre (Hospital de Mendaro de Gipuzkoa); Federico Melgosa Latorre, Fernando Abadia Cebrian, Ainhoa Albizuri Bernaola (Hospital de Alto Deba de Arrasate); Francisco José Ezponda Inchauspe, Ana María Iturzaeta Gorrotxategi (Hospital de Zumárraga); Pilar Jiménez (Hospital de Antequera); Josefina Monedero La Orden, Fernando Constantino Briones Monteagudo, Luis Miguel Cruz Ramírez (Hospital de Almansa); Ariel Ruben Lindo Noriega, Miguel Ángel Callejas Montoya, Gonzalo Fuentes Rodríguez (Hospital de Villarrobledo); Marta Iglesias Vela, Susana García Escudero, Nuria Álvarez Díez (Complejo Asistencial Universitario de León); Inmaculada Adán Valero, Pilar Yagüe Gómez, Jorge Eduardo Toledo (Hospital de Valdepeñas); Félix González Martínez, Diana Moya Olmeda, María José Rodríguez Escudero (Hospital Virgen de la Luz de Cuenca); Belén Rodríguez (Hospital Universitario Rey Juan Carlos); Francisco J. Aramburu, Oscar Pérez Carral, Natalia Catherine Franco Zárate (Complejo Hospitalario Universitario de Ourense); Bárbara Díaz García, María José del Río Paz, Sonia Beatriz Rodríguez Martínez (Hospital de Barbanza); Virginia Álvarez Rodríguez, Eduardo Manzone, Rodolfo Romero Pareja (Hospital Universitario de Getafe); Ángel José Macías López, Antón Trigo González, Ángel Francisco Viola Candela (Complejo Asistencial de Ávila); María Debán Fernández, Pablo Herrero Puente (Hospital Central de Asturias); Fernando Rodríguez Pérez-Reverte, Ascensión Martínez Más, Sofía Martínez Saldumbide (Hospital Universitario Santa Lucía de Cartagena en Murcia); Neus Robert, Adrià Mendoza, Arantzazu Blanco (Hospital de Can Ruti); Silvia Flores Quesada, Osvaldo Troiano Ungerer (Hospital San Pau i Santa Tecla de Tarragona); Rosa García García, Fátima González Jiménez, Sara Moreno Suarez (Hospital Virgen de las Nieves de Granada); Raquel Rodríguez Calveiro, Inés López Fernández (Hospital Alvaro Cunqueiro de Vigo); Manuel García Novio, Teresa Pajares Vázquez (Hospital Universitario Lucus Augusti de Lugo); Laura González González (Hospital del Salnes de Vilagarcía de Arousa); Elena Carrasco Fernández (Hospital Virgen de Altagracia de Manzanares); María Pilar Lozano García, Daniela Mihaela Comaneci (Hospital Universitario de Guadalajara); Rigoberto del Río Navarro, Guillermo Moreno Montes (Hospital de Torrevieja); Elizabeth Ortiz García (Hospital Santa Bárbara de Soria); Leopoldo Sánchez Santos (Hospital Universitario de Burgos); Rosario Peinado (Hospital Infanta Cristina de Badajoz); Beatriz Valle Borrego (Hospital Severo Ochoa de Leganés); Pablo Javier Marchena Yglesias (Parc Sanitari Sant Joan de Déu de Sant Boi de Llobregat); Cristina Herranz Martínez (Hospital de Viladecans de Barcelona); Núria Pomares, Xavier López Altimirias (Fundació Hospital de Mollet); Sara Gayoso Martín (Hospital Comarcal Universitario El Escorial); Patricia Gutiérrez García (Hospital Comarcal de Medina del Campo); Marco Bustamante (Hospital General de Granollers); Coral Suero Méndez (Hospital de la Axarquía de Vélez-Málaga); María García-Uría Santos (Clínica Universitaria de Navarra de Madrid); José Gregorio Zorrilla Riveiro (Hospital Sant Joan de Déu de Manresa); María Ángeles Leciñena (Hospital Can Mises de Ibiza); Antonio Duarte (Hospital de Torrecardenas de Almería); Carmen del Arco Galán (Hospital de la Princesa de Madrid).