Identificar y analizar los recursos y costes asociados a la administración del tratamiento antirretroviral (TAR) cabotegravir+rilpivirina (CAB+RPV) intramuscular frente al TAR oral en el manejo de la infección por el virus de la inmunodeficiencia humana tipo I (VIH-1), en España.
MétodosSe desarrolló un modelo para la identificación de recursos y análisis de costes desde la perspectiva del Sistema Nacional de Salud (SNS) y de la sociedad asociado a la administración del TAR intramuscular (CAB+RPV) frente al TAR oral en un horizonte temporal de 2 años. Los costes englobaron la monitorización por cambio de tratamiento, la dispensación farmacéutica, la administración, el manejo de los eventos adversos por reacciones en el lugar de inyección (EAs-RLI), el desplazamiento al centro hospitalario, el servicio de telefarmacia y la pérdida de productividad laboral. Los costes unitarios (€, 2023) se obtuvieron de la literatura. Se realizaron análisis de sensibilidad para evaluar la robustez del modelo.
ResultadosEl TAR intramuscular frente al TAR oral se asoció con un incremento de los costes de 673,16€/paciente en 2 años desde la perspectiva del SNS y de 719,59€/paciente desde la perspectiva social. El TAR intramuscular generaría un incremento de costes de dispensación (+97,75€), administración (+394,55€), monitorización (+288,74€), manejo de los EAs-RLI (+6,46€), desplazamiento (+8,36€) y pérdida de productividad laboral (+38,07€), respecto a la administración del TAR oral.
ConclusionesEl tratamiento del VIH-1 con CAB+RPV intramuscular implica un aumento del consumo de recursos y costes, frente al TAR oral.
To identify and analyze the resources and costs associated with the administration of intramuscular antiretroviral therapy (ART) cabotegravir+rilpivirine (CAB+RPV) compared to oral ART in the management of Human Immunodeficiency Virus Type 1 (HIV-1) infection in Spain.
MethodsAn economic model was developed to identify resources and analyze costs from the perspective of the National Health System (NHS) and societal, associated with the administration of intramuscular ART (CAB+RPV) compared to oral ART over a two-year time horizon. Costs included treatment change monitoring, pharmaceutical dispensation, administration, management of adverse events to injection-site reactions (AEs-ISR), travel to the hospital, telepharmacy service, and lost work productivity. Unit costs (€, 2023) were obtained from the literature. Sensitivity analyses were conducted to evaluate the robustness of the model.
ResultsIntramuscular ART compared to oral ART was associated with an increase in costs of €673.16/patient over two years from the perspective of the NHS, and €719.59/patient from the social perspective. Intramuscular ART would generate increased costs for dispensation (+€97.75), administration (+€394.55), monitoring (+€288.74), management of AEs-ISR (+€6.46), travel (+€8.36), and lost work productivity (+€38.07), compared to oral ART administration.
ConclusionTreating HIV-1 with intramuscular CAB+RPV leads to increased resource consumption and costs, compared to oral ART.
Se estima que, actualmente, entre 136.436 y 162.307 personas viven con el virus de la inmunodeficiencia humana (VIH) en España, lo que supone una prevalencia del 0,31%, de las cuales el 92,5% son conocedoras de su infección1.
El abordaje terapéutico para el manejo crónico del VIH tipo 1 (VIH-1) se centra en los tratamientos antirretrovirales (TAR), cuyo objetivo es conseguir la máxima y más duradera supresión de la carga viral plasmática, reducir la morbilidad asociada a la replicación del VIH y su efecto sobre otras comorbilidades, además de prevenir la transmisión del virus2–4. El acceso generalizado a este tipo de tratamientos ha conseguido disminuir drásticamente la morbimortalidad relacionada con el VIH3,5.
En aquellos pacientes que no han recibido TAR previo, la estrategia terapéutica se basa en combinaciones de 2 o 3 fármacos antirretrovirales orales administrados diariamente3,6. Sin embargo, la proporción de personas que viven con VIH, conocedoras de su diagnóstico y que están en tratamiento es del 96,6% y, de estas, un 9,6% no logran alcanzar la supresión viral1.
Los continuos avances terapéuticos y la evolución de las necesidades terapéuticas de los pacientes con VIH han conllevado al desarrollo de nuevas alternativas que permiten una mayor independencia, como los TAR de acción prolongada «long-acting agents» que permiten mantener los niveles terapéuticos del TAR durante un mayor tiempo2,3,7.
El TAR de acción prolongada disponible en la actualidad, cabotegravir (CAB) y rilpivirina (RPV), que se administra bimensualmente de forma intramuscular, fue aprobado en noviembre del 2022 para el tratamiento en pacientes adultos con infección por el VIH-1, que están virológicamente suprimidos con un TAR estable, sin evidencia actual o previa de resistencia, y sin fracaso virológico previo con inhibidores de la transcriptasa inversa no nucleósidos (ITINN) e inhibidores de la integrasa (INI)2.
El desarrollo de este tipo de fármacos de administración intramuscular supone un cambio de paradigma al reducir la percepción del estigma por el paciente o la preocupación por la menor confidencialidad sobre el estatus de la infección por VIH, ligados a los tratamientos orales8,9. Sin embargo, dadas las características de este tipo de terapias «long-acting» que requieren de un profesional sanitario para su administración, sería necesario llevar a cabo estudios que identifiquen el posible impacto económico y la posible pérdida de tiempo libre asociada a la administración intramuscular del TAR.
El presente análisis tiene como objetivo determinar el uso de recursos y costes asociados a la administración del TAR intramuscular con CAB+RPV comparado con la administración del TAR oral en los pacientes adultos con VIH-1, desde la perspectiva del Sistema Nacional de Salud (SNS) y desde la perspectiva de la sociedad.
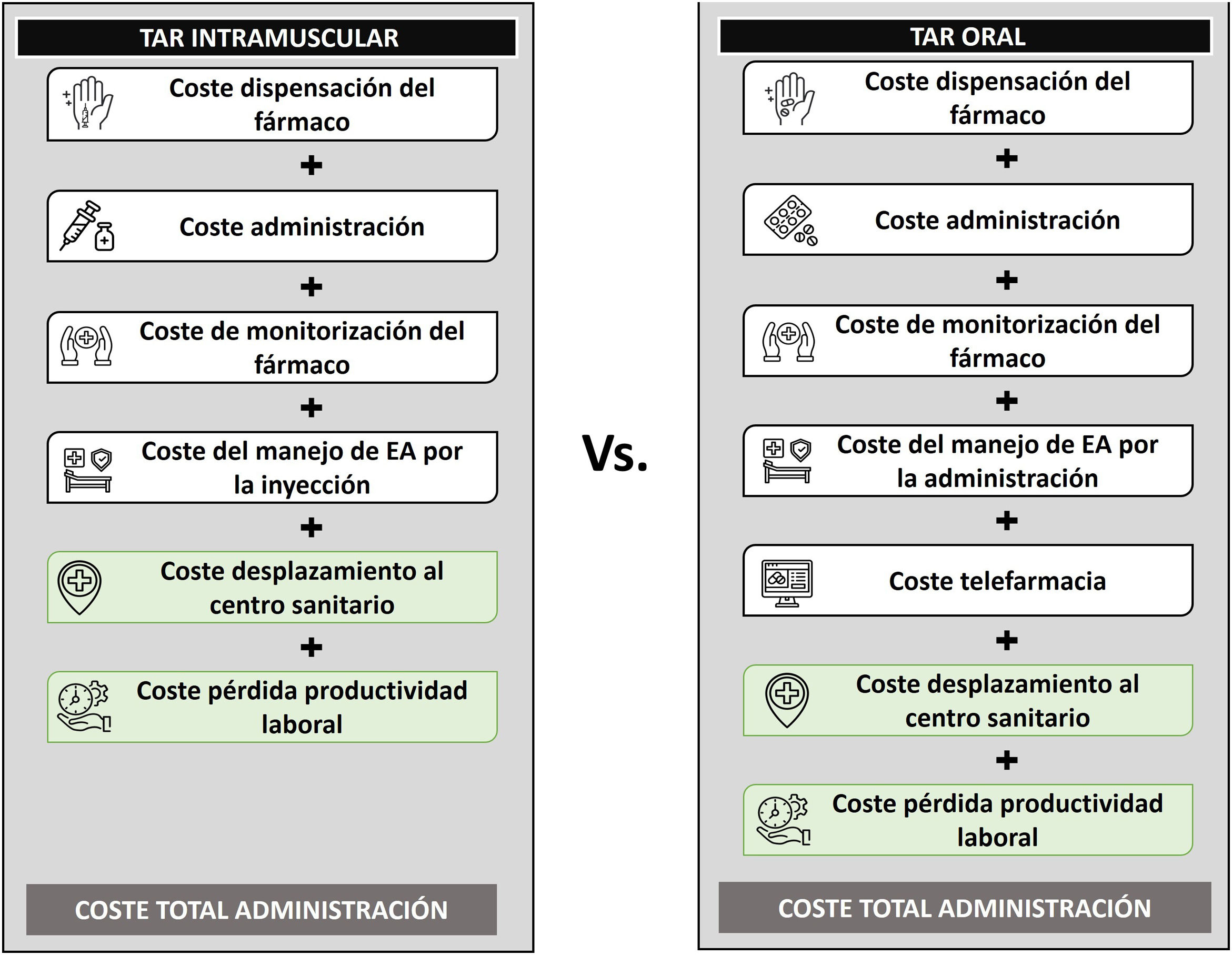
MétodosSe desarrolló un modelo de análisis de costes en Microsoft Excel® con la finalidad de estimar el consumo de recursos y los costes asociados a la administración del TAR intramuscular con CAB+RPV frente a la administración del TAR oral, en pacientes adultos con VIH-1 en tratamiento estable y virológicamente suprimidos (fig. 1). Debido a que CAB+RPV requiere de una fase de inducción seguida de inyecciones de continuación bimensuales, se consideró un horizonte temporal de 2 años con el objetivo de reflejar la totalidad de administraciones necesarias en el inicio del tratamiento intramuscular.
En base a la perspectiva empleada se tuvieron en cuenta diferentes recursos y costes. En el caso de la perspectiva del SNS, se consideraron únicamente los costes directos sanitarios asociados con la dispensación, administración, monitorización y manejo de los eventos adversos por reacciones en el lugar de la inyección (EAs-RLI) de los fármacos. Desde la perspectiva social, además de los costes directos sanitarios, se consideraron los costes directos no sanitarios, como el desplazamiento al centro sanitario para la administración y/o dispensación de la medicación, y los costes indirectos calculados mediante la pérdida de productividad laboral.
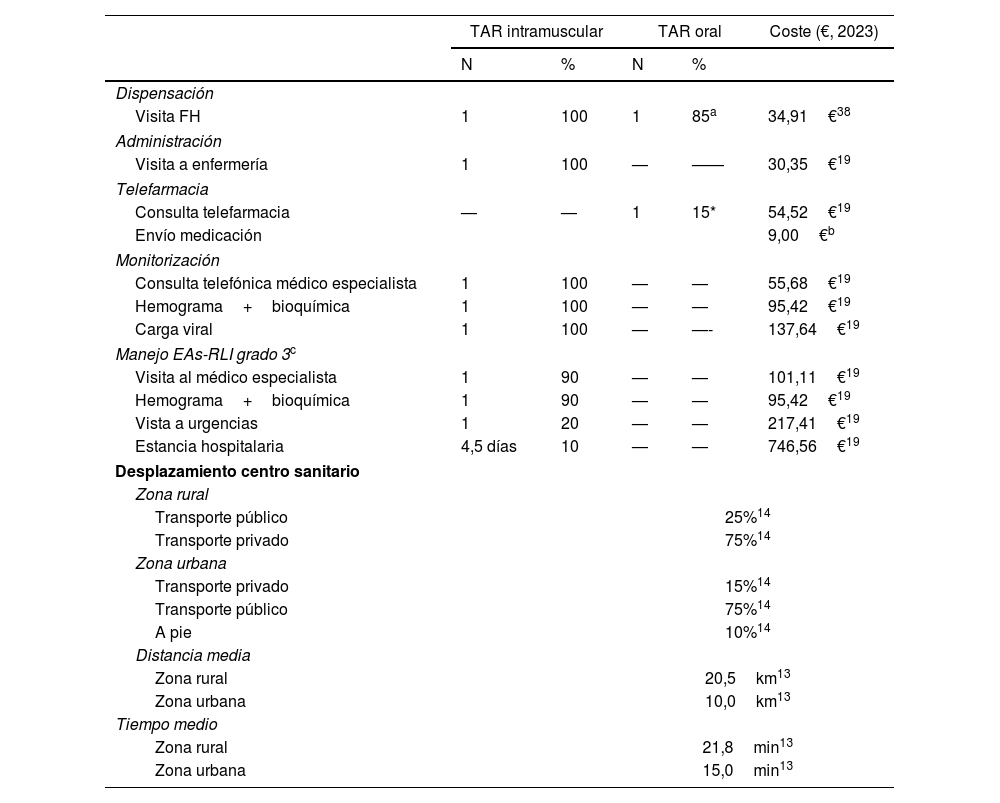
En el caso de CAB+RPV se consideró una administración bimensual10,11, lo que supuso un total de 13 administraciones (7 administraciones el primer año y 6 administraciones el segundo año) a lo largo del horizonte temporal. Su administración se asoció con el coste de dispensación por farmacia hospitalaria y de administración por enfermería (tabla 1).
Consumo y costes de los recursos por administración, según el tratamiento TAR
| TAR intramuscular | TAR oral | Coste (€, 2023) | |||
|---|---|---|---|---|---|
| N | % | N | % | ||
| Dispensación | |||||
| Visita FH | 1 | 100 | 1 | 85a | 34,91€38 |
| Administración | |||||
| Visita a enfermería | 1 | 100 | — | —— | 30,35€19 |
| Telefarmacia | |||||
| Consulta telefarmacia | — | — | 1 | 15* | 54,52€19 |
| Envío medicación | 9,00€b | ||||
| Monitorización | |||||
| Consulta telefónica médico especialista | 1 | 100 | — | — | 55,68€19 |
| Hemograma+bioquímica | 1 | 100 | — | — | 95,42€19 |
| Carga viral | 1 | 100 | — | —- | 137,64€19 |
| Manejo EAs-RLI grado 3c | |||||
| Visita al médico especialista | 1 | 90 | — | — | 101,11€19 |
| Hemograma+bioquímica | 1 | 90 | — | — | 95,42€19 |
| Vista a urgencias | 1 | 20 | — | — | 217,41€19 |
| Estancia hospitalaria | 4,5 días | 10 | — | — | 746,56€19 |
| Desplazamiento centro sanitario | |||||
| Zona rural | |||||
| Transporte público | 25%14 | ||||
| Transporte privado | 75%14 | ||||
| Zona urbana | |||||
| Transporte privado | 15%14 | ||||
| Transporte público | 75%14 | ||||
| A pie | 10%14 | ||||
| Distancia media | |||||
| Zona rural | 20,5km13 | ||||
| Zona urbana | 10,0km13 | ||||
| Tiempo medio | |||||
| Zona rural | 21,8min13 | ||||
| Zona urbana | 15,0min13 | ||||
| Pérdida productividad laboral, tiempo | TAR intramuscular | TAR oral |
|---|---|---|
| Dispensación en farmacia hospitalariab | 15min | — |
| Administración del fármacod | 10min | — |
| Desplazamiento idae | 16min | — |
| Desplazamiento vueltae | 16min | — |
| Coste salario/hora | 23,55€39 |
Los costes unitarios obtenidos de la base de datos eSalud19 representan un promedio de las tarifas publicadas en los Boletines oficiales de las Comunidades Autónomas.
EAs-RLI: eventos adversos relacionados con el lugar de la inyección; FH: farmacia hospitalaria; TAR: tratamiento antirretroviral.
Del total de pacientes con TAR oral se consideró que el 85% acuden al servicio de farmacia hospitalaria para la recogida del TAR oral cada 2 meses, mientras que el 15% disponen de servicio de telefarmarcia por lo que la medicación es enviada a su domicilio cada 2 meses.
Coste de manejo aplicado a la proporción de pacientes con Eas-RLI de grado 3 (1,16% del total de pacientes tratados con CAB+RPV).
Tiempo estimado a partir de las fichas técnicas de cabotegravir y rilpivirina para observación del paciente tras la administración10,11.
En el TAR oral, la dispensación farmacéutica se estableció, según el panel de expertos, cada 2 meses. Con la finalidad de reflejar los programas asistenciales existentes a nivel nacional y el uso cada vez más extendido de la telefarmacia (entrega informada a distancia) como estrategia de dispensación, en un 85% de los pacientes se asumió el coste de desplazamiento hasta el centro hospitalario y la dispensación del tratamiento por farmacia hospitalaria, mientras que en el 15% restante se imputó el coste de telefarmacia (tabla 1). En el caso del TAR intramuscular, se asumió que un 50% de los pacientes acuden a recoger el tratamiento a farmacia hospitalaria para su administración en el centro y en el 50% restante el fármaco es enviado por este servicio al lugar de administración a través de personal sanitario del propio centro.
En cuanto a los costes de monitorización, únicamente se consideró de forma diferencial las pruebas de laboratorio y la consulta telefónica del especialista realizadas tras la primera administración de CAB+RPV debido al inicio del nuevo tratamiento (tabla 1). Se asumió que la monitorización de los pacientes con VIH no difiere en función de la vía de administración del TAR, por lo que su coste no fue considerado.
Debido a su relevancia clínica y económica únicamente se consideró el coste de manejo de los EAs-RLI de grado 3 asociados a CAB+RPV (tabla 1). De acuerdo con la práctica clínica observada por los expertos en el manejo del VIH, un 90% de los pacientes tratados con CAB+RPV reportan EAs-RLI, de los cuales un 1,29% son de grado 37.
Para poder estimar los costes de desplazamiento se consideró la proporción de población que reside en áreas urbanas (84%) y rurales (16%)12, y sus distancias hasta el centro sanitario13, así como el tipo de transporte empleado (transporte privado, público o a pie)14 (tabla 1). La estimación del coste asociado al transporte privado se realizó a partir del consumo medio de combustible y del coste medio del carburante en España publicados en la literatura (1,29€/l)15. En el caso del trasporte público se aplicó el coste medio del billete en España (1,51€)16.
En lo relativo a la pérdida de productividad laboral se asumió que el 100% de las administraciones intramusculares se realizan en horario de mañana y se estimó considerando los pacientes con VIH activos laboralmente (52,2%)17, la proporción de pacientes en tratamiento con CAB+RPV que acuden al centro hospitalario durante la jornada laboral (12,5%) y el tiempo medio invertido en el desplazamiento al centro sanitario (estimado a partir de datos localizados en la literatura13 y de la práctica clínica observada por los expertos) (tabla 1). En el caso de los pacientes con TAR oral no se contempló pérdida de productividad laboral debido a la posibilidad de acudir a farmacia hospitalaria en horario de tarde y fuera de la jornada de trabajo.
El consumo de recursos fue validado y consensuado por un panel de expertos multidisciplinar formado por 3 clínicos y 2 farmacéuticos hospitalarios. Los costes unitarios se obtuvieron de diferentes fuentes bibliográficas15,16,18 y de una base de datos nacional de costes sanitarios19. Todos los costes fueron actualizados acorde al índice de precios de consumo? (IPC)20, y se expresan en valores de euro del año 2023 (€,2023) (tabla 1).
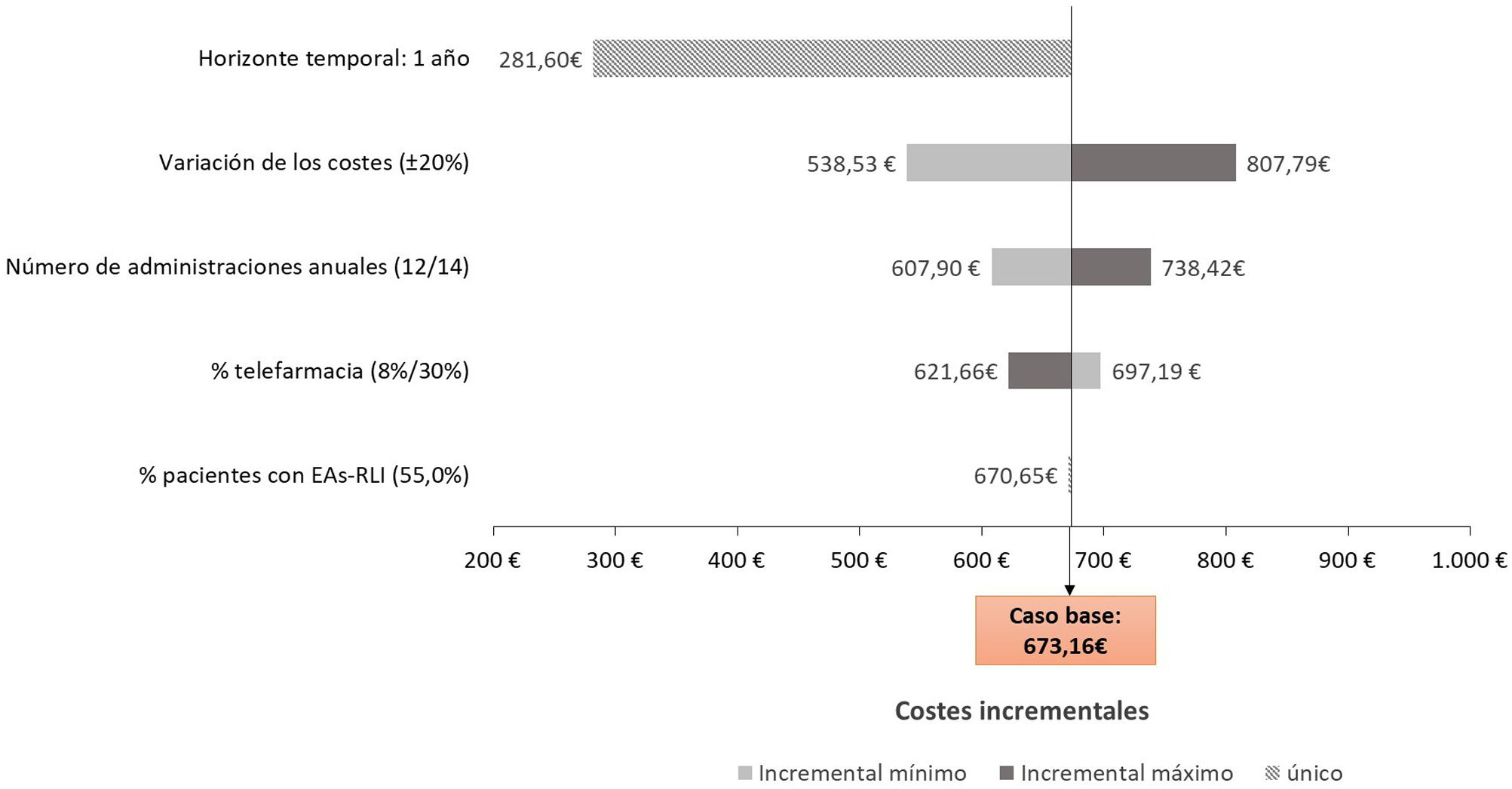
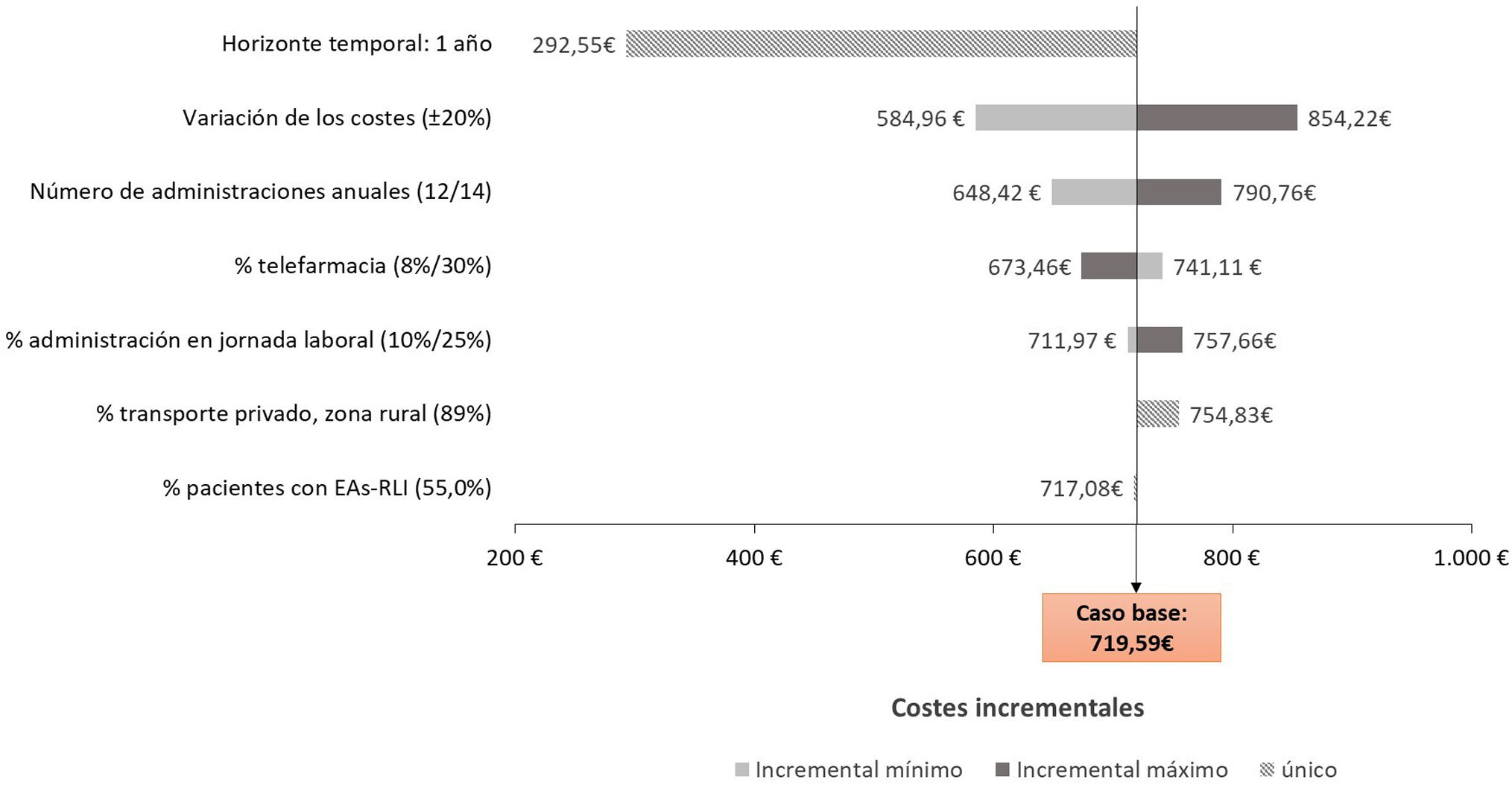
Análisis de sensibilidadCon el fin de evaluar la robustez del análisis, se realizó un análisis de sensibilidad determinístico (ASD) univariante con diferentes escenarios, modificando el número de administraciones anuales de CAB+RPV (±1 administraciones), el horizonte temporal a un año, los costes unitarios (±20%), la proporción de pacientes con TAR oral con opción de telefarmacia (8 y 30%), la proporción pacientes con EAs-RLI de cualquier grado (55%)7, la proporción de pacientes que emplean el trasporte privado en la zona rural (89%)13 y la proporción de pacientes con TAR intramuscular que acuden al centro hospitalario para su administración durante la jornada laboral (10 y 25%).
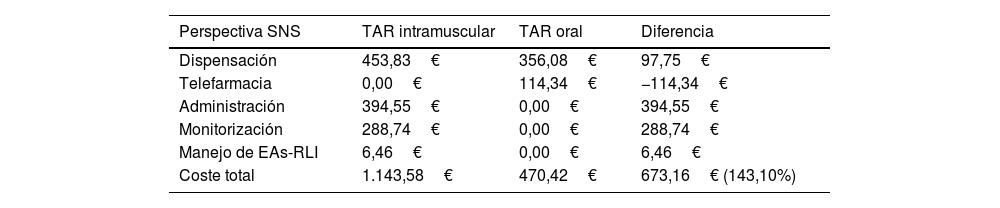
ResultadosPerspectiva del Sistema Nacional de SaludDesde la perspectiva del SNS y considerando un horizonte temporal de 2 años, el coste total asociado a la administración intramuscular del TAR intramuscular fue de 1.143,58€ por paciente, frente a los 470,42€ generados con la administración del TAR oral, lo que supuso un incremento de los costes sanitarios del 143,10% por paciente (tabla 2). Considerando una paridad de precio en los costes de adquisición de ambos fármacos, el coste total del TAR intramuscular supondría un coste adicional de 673,16€ por paciente respecto al TAR oral.
Resultados caso base desde la perspectiva del SNS
| Perspectiva SNS | TAR intramuscular | TAR oral | Diferencia |
|---|---|---|---|
| Dispensación | 453,83€ | 356,08€ | 97,75€ |
| Telefarmacia | 0,00€ | 114,34€ | −114,34€ |
| Administración | 394,55€ | 0,00€ | 394,55€ |
| Monitorización | 288,74€ | 0,00€ | 288,74€ |
| Manejo de EAs-RLI | 6,46€ | 0,00€ | 6,46€ |
| Coste total | 1.143,58€ | 470,42€ | 673,16€ (143,10%) |
EAs-RLI: eventos adversos relacionados con el lugar de la inyección; SNS: sistema nacional de salud; TAR: tratamiento antirretroviral.
El manejo del VIH con TAR intramuscular en comparación con el TAR oral generó unos costes por paciente de administración (+394,55€), monitorización (+288,74€) y manejo de los EAs-RLI de grado 3 (+6,46€) (tabla 2). Además, el tratamiento con CAB+RPV se asoció con un incremento de los costes de dispensación por farmacia hospitalaria de 97,75€ por paciente, respecto a los asociados con el TAR oral.
Como contrapartida, el TAR oral se asoció con un coste por paciente de telefarmacia de 114,34€ (tabla 2).
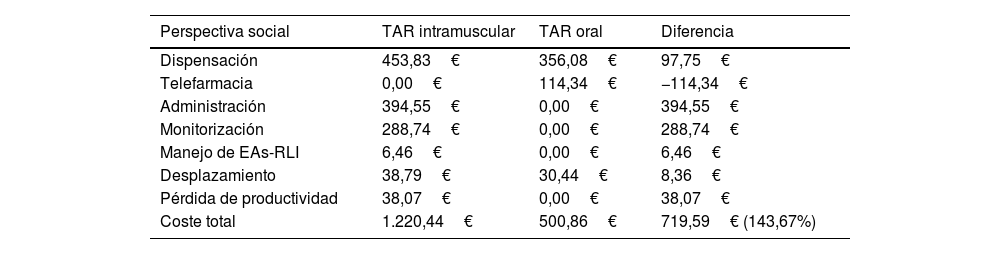
Perspectiva socialDesde la perspectiva social, el coste total asociado a la administración del TAR intramuscular durante un horizonte temporal de 2 años fue de 1.220,44€ por paciente, frente a los 500,86€ generados con el TAR oral, lo que supuso un incremento, por paciente, del 143,67% (tabla 3). Considerando una paridad de precio en los costes de adquisición de ambos fármacos, el coste total del TAR intramuscular supondría un coste adicional de 719,59€ por paciente respecto al TAR oral.
Resultados caso base desde la perspectiva social
| Perspectiva social | TAR intramuscular | TAR oral | Diferencia |
|---|---|---|---|
| Dispensación | 453,83€ | 356,08€ | 97,75€ |
| Telefarmacia | 0,00€ | 114,34€ | −114,34€ |
| Administración | 394,55€ | 0,00€ | 394,55€ |
| Monitorización | 288,74€ | 0,00€ | 288,74€ |
| Manejo de EAs-RLI | 6,46€ | 0,00€ | 6,46€ |
| Desplazamiento | 38,79€ | 30,44€ | 8,36€ |
| Pérdida de productividad | 38,07€ | 0,00€ | 38,07€ |
| Coste total | 1.220,44€ | 500,86€ | 719,59€ (143,67%) |
EAs-RLI: eventos adversos relacionados con el lugar de la inyección; SNS: sistema nacional de salud; TAR: tratamiento antirretroviral.
Además de los costes sanitarios anteriormente mencionados, el TAR intramuscular generó costes de pérdida de productividad laboral (+38,07€/paciente) y se asoció con un incremento de los costes de desplazamiento por paciente con respecto al TAR oral de 8,36€ (tabla 3).
Análisis de sensibilidadDesde la perspectiva del SNS (fig. 2), el escenario que ocasionó una mayor variación de los costes fue considerar el horizonte temporal a un año, debido al mayor número de administraciones intramusculares realizadas en el año 1 respecto al año 2, y por el seguimiento más exhaustivo del paciente como consecuencia del cambio de tratamiento. El escenario que menos afectó a los resultados alcanzados fue la variación de la proporción de pacientes con EAs-RLI de cualquier grado, ya que aquellos de carácter leve no se asociaron con ningún coste de manejo.
Desde la perspectiva social (fig. 3), los escenarios alternativos analizados siguieron una tendencia similar a los observados desde la perspectiva del SNS, en referencia al horizonte temporal, número de administraciones intramusculares y variación de los costes. El aumento de la proporción de pacientes que emplean el transporte privado en la zona rural, y la variación de la proporción de pacientes que acuden al centro hospitalario durante su jornada laboral para la administración del TAR intramuscular, también generó, aunque en menor medida, un aumento de los costes incrementales entre el TAR intramuscular y el oral.
DiscusiónEl presente análisis ha estimado el impacto económico de la administración del TAR intramuscular (CAB+RPV) frente a la administración del TAR oral en pacientes con VIH-1 en España, centrándose exclusivamente en la cuantificación, desde la perspectiva del SNS y de la sociedad, de los recursos consumidos y asociados con la vía de administración del TAR.
El análisis de costes ha permitido cuantificar, en unidades monetarias, y estimar el impacto financiero asociado a la administración del TAR intramuscular y compararlo frente a la administración oral, proporcionando información de manera descriptiva del coste del tratamiento. Este tipo de estudios centrados en la estimación de costes son un recurso clave en la evaluación de la asignación de recursos sanitarios, humanos y materiales en el sistema sanitario y la sociedad en conjunto21,22.
Tal y como se demuestra a través de este análisis, los costes relacionados con la administración del TAR intramuscular podría suponer un incremento de hasta el 143,67% (perspectiva social), con respecto a la administración del TAR oral. Teniendo en cuenta los resultados alcanzados, en caso de que los costes de adquisición del TAR intramuscular y oral no fuesen paritarios, el coste farmacológico del TAR oral podría incrementarse alrededor de un 14% hasta alcanzar la paridad con el coste total que supondría la adquisición y administración del TAR intramuscular. Así mismo, si tuviésemos en cuenta una cohorte hipotética de 12.000 pacientes con VIH-1 tratados con TAR intramuscular, estimados a partir los datos publicados en España sobre el número de pacientes con VIH suprimidos1,23 y la posible proporción de uso del TAR intramuscular (10%), se generaría un incremento del coste bienal total de 8.635.060€ respecto al TAR oral, desde la perspectiva de la sociedad. Estos resultados deberían tenerse en cuenta para la optimización de la elección terapéutica.
Este es el primer estudio publicado en comparar los costes asociados a la administración del TAR intramuscular frente a las alternativas de TAR orales. En general, son pocos los estudios de evaluación económica publicados acerca de TAR intramuscular6,24, los cuales se desarrollaron con el objetivo de evaluar la eficiencia de este tipo de tratamientos. Uno de estos estudios se desarrolló desde la perspectiva del SNS y se centró en analizar los costes farmacológicos y la adherencia6, obviando los costes no sanitarios (tanto directos como indirectos) los cuales suponen una elevada carga para los pacientes, tal y como sugiere nuestro análisis. Los resultados de dicho análisis coste-efectividad mostraron que tras un horizonte temporal lifetime el tratamiento con CAB+RPV intramuscular respecto al TAR oral se asoció con 0,27 años de vida ajustados por calidad adicionales y con un incremento de los costes totales de 4.003€, resultando un ratio coste-utilidad incremental de 15.003€ por año de vida ajustado por calidad6. Es posible que los costes totales se viesen incrementados al analizar los costes desde una perspectiva social.
En nuestro análisis, centrado en analizar las diferencias existentes en el consumo de recursos asociados a la vía de administración intramuscular versus la oral, no se tuvieron en cuenta los costes farmacológicos por no disponer de precios públicos, ni los costes asociados al manejo del VIH, al asumir que el seguimiento del paciente es igual independientemente de la vía de administración del tratamiento, a excepción del inicio del tratamiento con CAB+RPV en el que se consideró, de forma diferencial, la monitorización realizada.
Uno de los aspectos claves de los costes asociados al TAR oral es la telefarmacia (seguimiento telemático por parte del farmacéutico y envío de la medicación al domicilio del paciente), la cual ha supuesto un gran beneficio para el paciente debido al ahorro del desplazamiento hasta el centro sanitario para la dispensación de la medicación, sin necesidad de ver reducido su tiempo libre o de la jornada laboral25,26. En aquellos centros sanitarios en los que no se ha implementado el servicio de telefarmacia, se han generado modelos de atención farmacéutica (AF) que permiten minimizar la pérdida de productividad laboral del paciente con VIH al ofrecerle la posibilidad de acudir a farmacia hospitalaria fuera de la jornada laboral27–29.
Este tipo de modelos de AF no son posibles con el TAR intramuscular que, en cualquier caso, requiere de la administración por parte de un profesional en el centro sanitario, generando pérdidas de productividad laboral y un incremento de los costes a asumir por los pacientes, como es el caso del desplazamiento que en ocasiones debe realizarse desde zonas más remotas.
En relación con la pérdida de productividad laboral, en el presente estudio se estimó partiendo de la asunción de que la totalidad de las administraciones intramusculares se realizan en horario de consulta de 8 a 15h, sin embargo, cabe la posibilidad de que determinados centros hospitalarios dispongan de horarios de atención más amplio, lo que permitiría a los pacientes acudir a la administración del TAR intramuscular fuera de su jornada laboral y, por lo tanto, se asociaría con una disminución del coste social por pérdida de productividad laboral.
Otro hecho destacable en el tratamiento con los «long-acting agents» y que no se ha tenido en cuenta en el presente análisis es el desarrollo de resistencia al tratamiento30–32. En el ensayo clínico ATLAS-2M se reportó que un 2,3% de los pacientes con CAB+RPV administrado cada 2 meses presentaron fracaso virológico confirmado a las 152 semanas7.
Nuestro análisis no está exento de limitaciones, siendo una de ellas la gran variabilidad existente en el manejo de los pacientes entre los diferentes centros hospitalarios3,33–36. Con la finalidad de minimizar dicha heterogeneidad, los parámetros incluidos en el análisis recogieron la práctica clínica de un panel de expertos conformado por farmacéuticos hospitalarios y especialistas en enfermedades infecciosas de diferentes hospitales de España.
Otra de las limitaciones a tener en cuenta es no haber considerado, ante la falta de datos, el tiempo de espera por parte del paciente en el centro sanitario. A pesar de desarrollar nuevos modelos de atención orientados a una mejor gestión del tiempo3,33–36, hay pacientes que requieren de un tiempo de espera considerable en el momento previo a la administración del TAR intramuscular o en farmacia hospitalaria para la recogida del TAR oral. Es posible que de haber considerado este tiempo invertido por el paciente, los costes de pérdida de productividad laboral se viesen incrementados.
En cuanto al manejo de los EAs-RLI, de acuerdo con los datos reportados en el ensayo clínico de CAB+RPV7, un 55% de los pacientes con TAR intramuscular presentó algún tipo de EAs. Sin embargo, se ha observado que las tasas de pacientes que refieren algún tipo de molestia en el lugar de inyección (fundamentalmente dolor e hinchazón) en vida real son mucho mayores de las reportadas en los ensayos clínicos. Tras considerarse en el caso base una tasa de EAs-RLI de cualquier grado del 90%, según lo observado en práctica clínica, se realizó un análisis de sensibilidad con las tasa reportadas en el ensayo ATLAS-2M (55,0%)7, observándose que los costes generados por el manejo de los EAs-RLI afectan en menor medida a los resultados, ya que el manejo de los pacientes con EAs-RLI leves no requiere del consumo de recursos sanitarios, y en el caso de los EAs-RLI de grado 3 solamente se han observado en una ínfima proporción de pacientes.
Uno de los aspectos clave en este tipo de tratamientos y que no se ha tenido en cuenta en el presente análisis es la adherencia del paciente, la cual puede verse afectada por aspectos relacionados con la pauta posológica y la frecuencia de dosificación, las restricciones dietéticas y el estigma generado8,9. Los ensayos clínicos realizados con CAB+RPV parecen reportar tasas de adherencia más elevadas que la de los tratamientos orales7, sin embargo, es necesario realizar estudios basados en la práctica clínica real que reflejen las tasas de adherencia a largo plazo para poder analizar con mayor prospectiva el cumplimiento terapéutico37.
Debido a la naturaleza de los análisis de costes, el presente estudio se ha centrado en la cuantificación de los recursos generados por la administración intramuscular y oral del TAR, sin valorarse otros aspectos fundamentales como son la eficacia y la calidad de vida, tal y como se realiza en los estudios de coste-efectividad32.
A pesar de las limitaciones descritas anteriormente, este tipo de estudios son fundamentales para determinar la sostenibilidad de un sistema sanitario que cuenta con recursos limitados. El presente análisis de costes representa un primer paso en la evaluación del impacto económico asociado al tipo de administración del TAR. Sin embargo, y a la luz de los resultados obtenidos, sería necesaria la realización de estudios observacionales en los que se recogiese con mayor detalle los recursos sanitarios y no sanitarios consumidos, así como los costes generados por la administración de los TAR tanto por vía intramuscular como oral. Además, es necesario el desarrollo de más análisis coste-efectividad que evalúen la eficiencia de las alternativas intramusculares versus las orales. Esto ayudaría al sistema en la generación de modelos de gestión sanitaria más eficientes.
ConclusionesEl TAR intramuscular respecto al TAR oral, en adultos con infección por el VIH-1 virológicamente suprimidos, supone un aumento de los costes sanitarios y de los costes indirectos, fundamentalmente a expensas de la necesidad de personal sanitario para su administración.
AutoríasVE, JEL, RMV, MPE y JS han validado la estructura del modelo, han contribuido en la interpretación de los datos y en la elaboración del manuscrito.
AC ha participado en la interpretación de los resultados y la revisión del manuscrito.
MP y LSO contribuyeron a la búsqueda bibliográfica, el diseño del estudio, la recopilación de datos, la interpretación de los datos y la elaboración del manuscrito.
Todos los autores han aprobado el manuscrito final.
FinanciaciónEste trabajo ha sido financiado por Gilead Sciences.
Conflicto de interesesVC, JEL, RMV, MPE y JS han recibido pagos por la participación en reuniones de asesoramiento para este proyecto.
VC ha recibido pagos por la participación en presentaciones y redacción de manuscritos por parte de Gilead Sciences y Janssen Cilag, por charlas y ayudas de asistencia a congresos de Gilead Sciences, Janssen Cilag, y por labores de consultoría para Janssen Cilag y ViiV Healthcare.
JEL ha efectuado labores de consultoría y ha recibido honorarios por charlas y ayudas de asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme, y ViiV Healthcare.
RMV ha recibido honorarios por la redacción de manuscritos de Gilead Sciences.
MPE ha recibido honorarios por la redacción de manuscritos de Gilead Sciences.
JS ha recibido pagos por la participación en reuniones de asesoramiento de Gilead Sciences y ViiV Healthcare y por presentaciones, y redacción de manuscritos por Gilead Sciences, ViiV Healthcare, MSD y Janssen.
AC es empleado de Gilead Science.
MP y LSO son empleadas de Pharmacoeconomics & Outcomes Research Iberia (PORIB), consultora especializada en evaluación de tecnologías sanitarias, que ha recibido apoyo financiero del Instituto de Gielad Science para llevar a cabo el desarrollo del presente trabajo.
El resto de autores declaran que no tienen ningún tipo de conflicto de interés.