La aplicación de los puntos de corte establecidos por el European Committee on Antimicrobial Susceptibility Testing (EUCAST) en comparación con los del Clinical and Laboratory Standards Institute (CLSI) modifica los criterios de interpretación de la sensibilidad de algunos antimicrobianos y esto conduce a cambios en los informes de sensibilidad antibiótica acumulada.
MétodosAnálisis de la influencia de la aplicación del EUCAST en 10.359 aislados clínicos de Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus y Enterococcus spp.
ResultadosAl aplicar los puntos de corte del EUCAST, la mayoría de los porcentajes de sensibilidad a antimicrobianos no se alteró o lo hizo de forma muy leve; sin embargo, se observó una disminución de la sensibilidad a los aminoglucósidos en bacilos gramnegativos, especialmente a la amicacina en Pseudomonas aeruginosa (23,2%), aunque solo el 5,7% fueron totalmente resistentes; además, disminuyó notablemente el porcentaje de aislados sensibles a aztreonam. Es de destacar el aumento de cepas de Staphylococcus aureus resistentes a clindamicina (51,5%) y a aminoglucósidos (gentamicina 43,1%).
ConclusionesEl cambio de los criterios del CLSI a los de EUCAST en algunos patógenos supone una alteración en los porcentajes de resistencia a algunos antimicrobianos y, por tanto, en la epidemiología local de la resistencia. Estos cambios deben realizarse por un grupo multidisciplinar, que analice la influencia de los nuevos datos en los protocolos de tratamiento empírico de cada centro.
Implementation of the breakpoints established in the European Committee on Antimicrobial Susceptibility Testing (EUCAST) guidelines in comparison with those of the Clinical and Laboratory Standards Institute (CLSI) means that the criteria for interpreting the susceptibility of some antimicrobials have been modified, resulting in changes in the reports of accumulated antibiotic susceptibility.
MethodsThe effect of applying EUCAST breakpoints in 10,359 clinical isolates of Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus and Enterococcus spp. was analysed.
ResultsBy applying EUCAST breakpoints, most antimicrobial susceptibility percentages did not change or changed very slightly. However, a decrease in aminoglycoside susceptibility was observed in Gram-negative bacilli, mainly for amikacin and Pseudomonas aeruginosa (23.2%), although only 5.7% were completely resistant; a notably decrease in the percentage of isolates susceptible to aztreonam was also observed. There was also a marked increase in the number of Staphylococcus aureus strains resistant to clindamycin (51.5%) and aminoglycosides (gentamicin 43.1%).
ConclusionsSwitching from CLSI to EUCAST criteria in some pathogens alters the percentages of resistance to several antimicrobials, and therefore the local epidemiology of the resistance. These changes should be implemented by a multidisciplinary group in order to analyse the influence of the new data on the empirical treatment protocols of each centre.
La resistencia antibiótica es un grave problema de salud pública, cuyo abordaje exige un trabajo multidisciplinar. Uno de los pilares básicos es el tratamiento empírico adecuado de los pacientes con base en los datos de la epidemiología local1. Gracias al trabajo del Comité Español del Antibiograma (COESANT), entre los hospitales españoles hay una clara tendencia a sustituir la normativa del comité norteamericano Clinical and Laboratory Standards Institute (CLSI) por la establecida por el European Committee on Antimicrobial Susceptibility Testing (EUCAST) a la hora de interpretar los datos aportados por los estudios de sensibilidad antibacteriana. Nuestro estudio pretende comparar los cambios de las tasas de resistencia que origina esta modificación en nuestro medio.
Material y métodosSe analizan los patrones de sensibilidad de 10.359 aislados clínicos (primer aislado de cada paciente) de Escherichia coli (n=4.987), Klebsiella pneumoniae (n=1.324), Pseudomonas aeruginosa (n=1.159), Staphylococcus aureus (n=1.066), Enterococcus faecalis (n=1.522) y Enterococcus faecium (n=301), aislados durante un período de 17 meses en el Hospital General Universitario de Alicante (pacientes hospitalizados y atención primaria) mediante ambos criterios. Los valores de concentración mínima inhibitoria se estudiaron por el método de microdilución comercial (MicroScan WalkAway 96 Plus, Siemens, Alemania) y se compararon los porcentajes de sensibilidad obtenidos según los puntos de corte del CLSI y el EUCAST (2017) mediante el sistema informático Microb Dynamic (Soria Melguizo, España).
Para comparar los resultados se utilizó el índice kappa.
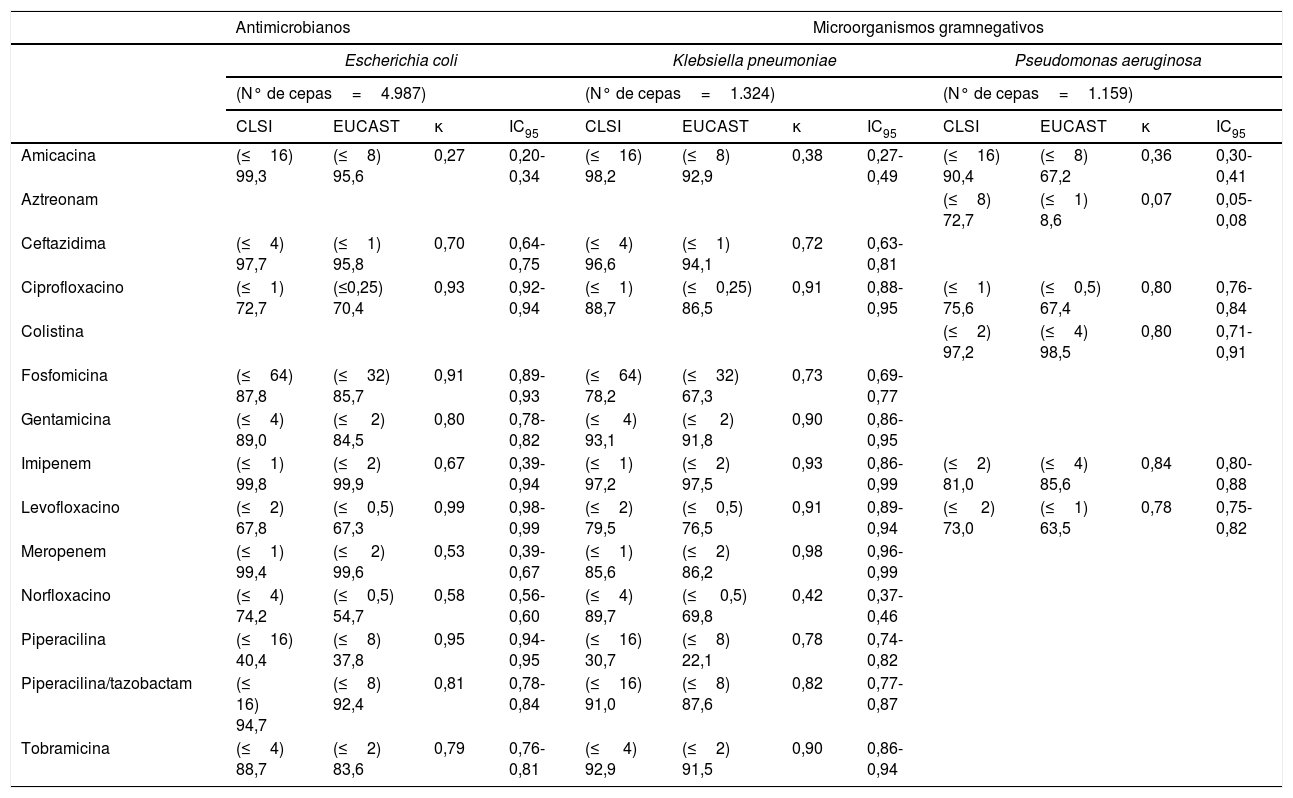
ResultadosLos criterios de interpretación para la mayoría de las combinaciones microorganismo-antibiótico fueron iguales por ambos criterios. En las enterobacterias, el cambio de criterio no supuso un cambio en los datos de sensibilidad para varios antimicrobianos. Así, para Escherichia coli/Klebsiella pneumoniae los porcentajes de sensibilidad por ambos criterios fueron: ampicilina (43,3-0%), cefotaxima (87,8-77,9%) y trimetoprim-sulfametoxazol (68,3-86,5%); en Pseudomonas aeruginosa fueron: cefepima (82,3%), ceftazidima (86,8%), meropenem (78,9%), piperacilina (70,9%), piperacilina/tazobactam (84,5%), ticarcilina (43,9%) y tobramicina (88,7%); en Staphylococcus aureus los porcentajes de sensibilidad fueron: ciprofloxacino (90,8%), daptomicina (100%), levofloxacino (91,9%), linezolid (100%), oxacilina (84,9%), trimetoprim-sulfametoxazol (99,1%) y vancomicina (100%), y en Enterococcus spp., el cambio no produjo variaciones en el porcentaje de sensibilidad a la vancomicina (100%). No fue posible evaluar la actividad de amoxicilina/ácido clavulánico ya que la concentración de ácido clavulánico recomendada por los 2 comités es diferente. En otras combinaciones antibiótico-microorganismo se observaron algunas diferencias que pueden tener trascendencia clínica. La comparación de estos datos se detalla en la tabla 1.
Comparación de los porcentajes de sensibilidad a antimicrobianos de microorganismos gramnegativos y de los porcentajes de sensibilidad antibiótica en bacterias grampositivas según criterios del CLSI y del EUCAST
| Antimicrobianos | Microorganismos gramnegativos | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Escherichia coli | Klebsiella pneumoniae | Pseudomonas aeruginosa | ||||||||||
| (N° de cepas=4.987) | (N° de cepas=1.324) | (N° de cepas=1.159) | ||||||||||
| CLSI | EUCAST | κ | IC95 | CLSI | EUCAST | κ | IC95 | CLSI | EUCAST | κ | IC95 | |
| Amicacina | (≤16) 99,3 | (≤8) 95,6 | 0,27 | 0,20-0,34 | (≤16) 98,2 | (≤8) 92,9 | 0,38 | 0,27-0,49 | (≤16) 90,4 | (≤8) 67,2 | 0,36 | 0,30-0,41 |
| Aztreonam | (≤8) 72,7 | (≤1) 8,6 | 0,07 | 0,05-0,08 | ||||||||
| Ceftazidima | (≤4) 97,7 | (≤1) 95,8 | 0,70 | 0,64-0,75 | (≤4) 96,6 | (≤1) 94,1 | 0,72 | 0,63-0,81 | ||||
| Ciprofloxacino | (≤1) 72,7 | (≤0,25) 70,4 | 0,93 | 0,92-0,94 | (≤1) 88,7 | (≤0,25) 86,5 | 0,91 | 0,88-0,95 | (≤1) 75,6 | (≤0,5) 67,4 | 0,80 | 0,76-0,84 |
| Colistina | (≤2) 97,2 | (≤4) 98,5 | 0,80 | 0,71-0,91 | ||||||||
| Fosfomicina | (≤64) 87,8 | (≤32) 85,7 | 0,91 | 0,89-0,93 | (≤64) 78,2 | (≤32) 67,3 | 0,73 | 0,69-0,77 | ||||
| Gentamicina | (≤4) 89,0 | (≤ 2) 84,5 | 0,80 | 0,78-0,82 | (≤ 4) 93,1 | (≤ 2) 91,8 | 0,90 | 0,86-0,95 | ||||
| Imipenem | (≤1) 99,8 | (≤2) 99,9 | 0,67 | 0,39-0,94 | (≤1) 97,2 | (≤2) 97,5 | 0,93 | 0,86-0,99 | (≤2) 81,0 | (≤4) 85,6 | 0,84 | 0,80-0,88 |
| Levofloxacino | (≤2) 67,8 | (≤0,5) 67,3 | 0,99 | 0,98-0,99 | (≤2) 79,5 | (≤0,5) 76,5 | 0,91 | 0,89-0,94 | (≤ 2) 73,0 | (≤1) 63,5 | 0,78 | 0,75-0,82 |
| Meropenem | (≤1) 99,4 | (≤ 2) 99,6 | 0,53 | 0,39-0,67 | (≤1) 85,6 | (≤2) 86,2 | 0,98 | 0,96-0,99 | ||||
| Norfloxacino | (≤4) 74,2 | (≤0,5) 54,7 | 0,58 | 0,56-0,60 | (≤4) 89,7 | (≤ 0,5) 69,8 | 0,42 | 0,37-0,46 | ||||
| Piperacilina | (≤16) 40,4 | (≤8) 37,8 | 0,95 | 0,94-0,95 | (≤16) 30,7 | (≤8) 22,1 | 0,78 | 0,74-0,82 | ||||
| Piperacilina/tazobactam | (≤ 16) 94,7 | (≤8) 92,4 | 0,81 | 0,78-0,84 | (≤16) 91,0 | (≤8) 87,6 | 0,82 | 0,77-0,87 | ||||
| Tobramicina | (≤4) 88,7 | (≤2) 83,6 | 0,79 | 0,76-0,81 | (≤ 4) 92,9 | (≤2) 91,5 | 0,90 | 0,86-0,94 | ||||
| Antibiótico | Microorganismos grampositivos | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Staphylococcus aureus | Enterococcus faecium | Enterococcus faecalis | ||||||||||
| (N° de cepas=1.066) | (N° de cepas=301) | (N° de cepas=1.522) | ||||||||||
| CLSI | EUCAST | κ | IC95 | CLSI | EUCAST | κ | IC95 | CLSI | EUCAST | κ | IC95 | |
| Ampicilina | (≤8) 14,4 | (≤4) 11,2 | 0,866 | 0,78-0,95 | (≤ 8) 100 | (≤4) 99,7 | 0 | 0,00-0,00 | ||||
| Ciprofloxacino | 0,00 | 0,00-0,00 | (≤ 1) 58,3 | (≤4) 100 | 0 | 0,00-0,00 | ||||||
| Clindamicina | (≤0,5) 95,9 | (≤0,25) 44,4 | 0,07 | 0,05-0,09 | ||||||||
| Eritromicina | (≤0,5) 76,9 | (≤1) 77,7 | 0,98 | 0,96-0,99 | ||||||||
| Gentamicina | (≤4) 94,6 | (≤1) 51,5 | 0,12 | 0,09-0,14 | ||||||||
| Levofloxacino | (≤2) 15,3 | (≤4) 23,4 | 0,75 | 0,65-0,84 | (≤2) 65,4 | (≤4) 66,6 | 0,97 | 0,96-0,98 | ||||
| Linezolid | (≤2) 100 | (≤4) 100 | (≤ 2) 100 | (≤4) 100 | ||||||||
| Teicoplanina | (≤ 8) 100 | (≤2) 99,0 | 0 | 0,00-0,00 | (≤8) 100 | (≤2) 100 | (≤8) 100 | (≤ 2) 100 | ||||
| Tetraciclinas | (≤ 4) 94,0 | (≤1) 86,2 | 0,57 | 0,49-0,65 | ||||||||
| Tobramicina | (≤4) 90,9 | (≤1) 53,0 | 0,20 | 0,17-0,24 | ||||||||
IC95: intervalo de confianza del 95%; κ: índice kappa.
Se señala entre paréntesis el valor de la concentración mínima inhibitoria considerado como sensible por los diferentes criterios.
Para los microorganismos gramnegativos, CLSI solo admite el punto de corte de fosfomicina para aislados urinarios y en infecciones urinarias no complicadas para enterobacterias. No hay punto de corte para Pseudomonas spp. en ninguno de los comités.
Para los microorganismos grampositivos, los puntos de corte para las 2 quinolonas en Enterococcus spp. son solo para aislados urinarios.
Entre paréntesis se indican los puntos de corte de sensibilidad establecidos por el CLSI y por el EUCAST.
El fenómeno más destacado es que la aplicación del EUCAST originó una disminución importante de la sensibilidad a los aminoglucósidos (gentamicina y amicacina), tanto en enterobacterias (3,7 puntos en Escherichia coli y 5,3 puntos en Klebsiella pneumoniae para amicacina) como en Pseudomonas aeruginosa (23,2 puntos para el mismo antibiótico). No obstante, la gran mayoría de estos aislados no llegaron a ser completamente resistentes, ya que los porcentajes de resistencia a amicacina se elevaron mucho menos: Escherichia coli (0,4%), Klebsiella pneumoniae (1,6%) y Pseudomonas aeruginosa (5,7%).
En relación con la actividad de la fosfomicina, la aplicación del EUCAST originó un incremento de la resistencia en Escherichia coli (2,1%) y en Klebsiella pneumoniae (10,9%).
El porcentaje de cepas sensibles a las fluoroquinolonas en enterobacterias presentó una escasa variación, pero en el caso de Pseudomonas aeruginosa, la aplicación del EUCAST supuso una disminución de la sensibilidad a estos antimicrobianos de forma importante (8,2%). El porcentaje de cepas de Pseudomonas aeruginosa sensibles a aztreonam también disminuyó notablemente (64,1%).
En Staphylococcus aureus es muy destacable la disminución de la sensibilidad a la gentamicina (43,1%) y a la tobramicina (37,9%), fenómeno que también se observó para la clindamicina (51,5%). En cuanto a la sensibilidad de Enterococcus spp., se observaron cambios mucho menos marcados excepto para ciprofloxacino, que supuso un 100% de sensibilidad al aplicar los criterios del EUCAST.
DiscusiónUna de las principales aportaciones de la Microbiología Clínica a la mejora del tratamiento de los procesos infecciosos, además del diagnóstico rápido y correcto de los mismos, es el estudio de la epidemiología local de la resistencia antibiótica, pieza angular de los protocolos locales de terapia empírica2. Estos datos han cobrado mucha más importancia con el incremento de la multirresistencia, lo que exige un análisis riguroso y exhaustivo de los mismos3,4.
La incorporación paulatina de los criterios del EUCAST en los hospitales europeos está obligando a evaluar la repercusión clínica de este cambio en cada entorno geográfico5,6. En general, los cambios en las tasas de resistencia aplicando los 2 criterios son pequeños en nuestro medio, por lo que el cambio de normas no tiene por qué alterar de forma significativa la política de antibióticos del hospital. Estos cambios reflejan la complejidad de la resistencia antibiótica, en especial de los mecanismos que originan bajos niveles de resistencia a los antimicrobianos7.
Sin embargo, el cambio que puede tener un mayor impacto clínico al aplicar los criterios del EUCAST es la reducción de las tasas de sensibilidad de Pseudomonas aeruginosa a la amicacina, que podría obligar a replantear la asociación de este antibiótico a los carbapenémicos como tratamiento empírico de infecciones graves con sospecha de este patógeno. Sin embargo, hay que tener en cuenta que la mayor parte de los aislados no llegan a encuadrarse en la categoría de resistentes, por lo que habrá que evaluar la terapia más adecuada cuando estén implicadas cepas con estas características8. En relación con los carbapenémicos, las diferencias de puntos de corte al aplicar ambos criterios no varían y no suponen una trascendencia clínica en nuestro medio ni en el caso de enterobacterias ni en Pseudomonas aeruginosa9,10.
Otro hecho destacable es la disminución de los porcentajes de sensibilidad a fosfomicina en enterobacterias y en Pseudomonas aeruginosa. Este hecho puede ser más importante en el futuro porque cada vez aumenta más la necesidad de utilizar este antimicrobiano en tratamientos empíricos de infecciones producidas por cepas multirresistentes11,12.
En relación con la disminución de los porcentajes de sensibilidad a clindamicina en Staphylococcus aureus también puede obligar a revisar algunas terapias empíricas, especialmente en el tratamiento de infecciones de piel y partes blandas, en las que este fármaco es uno de los considerados como de elección.
Es recomendable el cambio a los criterios del EUCAST, pero las modificaciones en los porcentajes de sensibilidad que origina deben ser analizadas de forma conjunta por todos los especialistas implicados en el manejo de la enfermedad infecciosa, ya que las variaciones que pueden aparecer en la epidemiología local de la resistencia pueden tener repercusiones clínicas en la práctica asistencial13–15.
FinanciaciónEste trabajo ha sido realizado gracias a la ayuda de la Fundación Soria Melguizo y a la Fundación FISABIO (UGP-14-270).
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.