Se trata de un paciente de 28 años, natural de Portugal, que llevaba 15 días en España y mantenía relaciones sexuales con hombres (HSH). Acudió a urgencias con diarrea y fiebre de 38,1°C, así como leve disuria y 20x103μl leucocitosis en sangre. Se recogió muestra de heces y orina, y el paciente fue ingresado con ceftriaxona intravenosa (1g/24h) como tratamiento empírico. En el coprocultivo se aisló Shigella spp., y el paciente fue dado de alta con ciprofloxacino oral (500mg/12h durante 3 días) antes de conocer la sensibilidad a antimicrobianos. El aislado resultó ser Shigella sonnei (S. sonnei) productora de una betalactamasa de espectro extendido (BLEE), CTX-M del grupo 9 resistente a cefalosporinas, cotrimoxazol y quinolonas. Varios días después, el paciente vuelve a ingresar por persistencia de cuadro con fiebre alta y diarrea líquida, siendo tratado esta vez con ertapenem (1g cada 24h por vía intravenosa durante 5 días). Es dado de alta al finalizar el ciclo de antibiótico por resolución del cuadro.
Caso n.°2Paciente de 47 años, HSH, en tratamiento mantenido con profilaxis preexposición (PrEP), que acudió a la consulta de infecciones de transmisión sexual (ITS) para control y recibir profilaxis con ceftriaxona (1g intramuscular) por contacto sexual de riesgo. Refería cuadro de dolor abdominal difuso con aumento de deposiciones (hasta 10 al día) con productos patológicos (moco/sangre) con inicio 48h antes, pero en ese momento se decidió actitud expectante. Volvió a ser atendido 7 días después dada la persistencia del cuadro clínico, recogiéndose muestra de coprocultivo y de su pareja actual (con clínica gastrointestinal similar), con actitud expectante a la espera de los resultados de coprocultivo. En la muestra de heces se detecta S. sonnei productora de la BLEE de tipo cefalosporinasa del grupo CTX-M-9, mientras que en su pareja se detecta Shigella flexneri (S. flexneri) no portadora de BLEE y cuya sensibilidad a antimicrobianos fue distinta (únicamente resistente a quinolonas).
MicrobiologíaEn el primer caso se realizó panel de PCR «STI Essential Assay, AllplexTM» (Seegene Inc, Seúl, Corea del Sur) de la muestra de orina (primera parte de la micción) con detección de Chlamydia trachomatis. En ambos casos se extrajo muestra de heces para realizar el panel de PCR «Enteric bacterial» del sistema BD MaxTM (Becton Dickinson, Franklin Lakes, NJ, EE. UU.) con detección de ADN de Shigella/Escherichia coli (E. coli) enteroinvasivo. Posteriormente, la muestra de heces se sembró en los medios de agar MacConkey y Hektoen (BDTM), pudiéndose aislar colonias lactosa negativas en el agar MacConkey que se identificaron como Shigella spp./E. coli mediante espectrometría de masas MALDI-TOF (Bruker, Massachusetts, EE. UU.), ya que este sistema no permite discriminar entre estos dos géneros. Las colonias lactosa negativas se sembraron en los medios de agar hierro-triple azúcar (TSI) y agar lisina-hierro (LIA) (BDTM) para su identificación, confirmándose el género Shigella spp. (fig. 1A). Posteriormente se realizó aglutinación con «DifcoTM Shigella Antisera Poly» (BDTM) para determinar la especie, y se confirmó la identificación de S. sonnei.
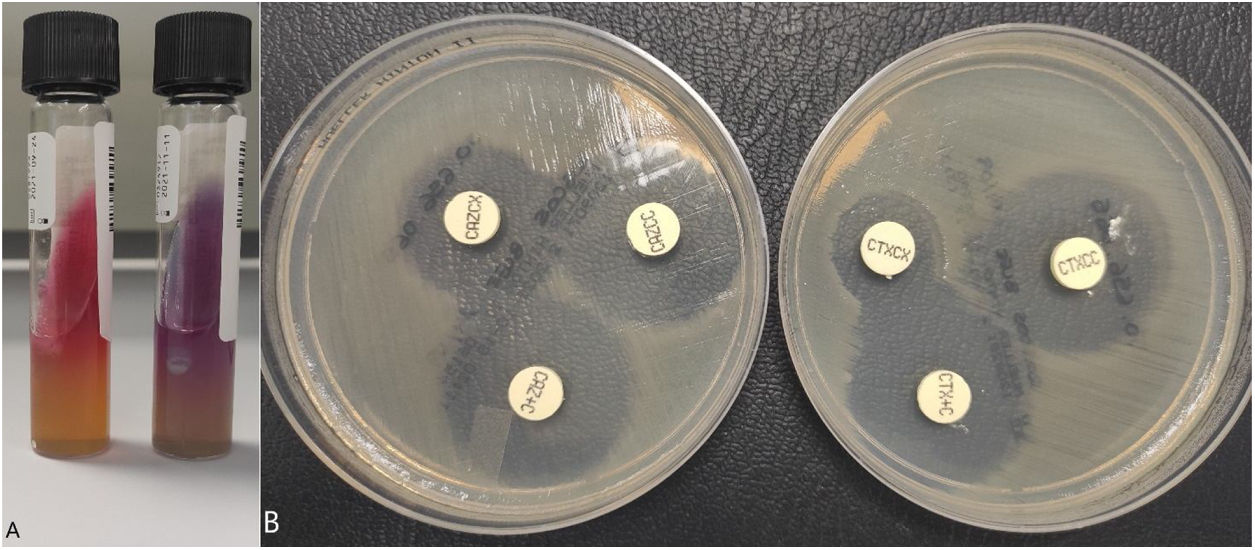
Identificación de Shigella spp. y detección de la presencia de una betalactamasa de espectro extendido (BLEE).
A) Izquierda: medio TSI (triple azúcar-hierro), se observa fermentación de glucosa sin producir gas; derecha: medio LIA (lisina-hierro), se observa que no descarboxila ni desamina la lisina. B) Técnica de disco-difusión con los kits de confirmación «Total ESBL, AmpC and ESBL+AmpC Confirm kit» (ROSCO Diagnostica A/S, Taastrup, Dinamarca). Se observa el aumento del halo (> 5mm) de cefotaxima y ceftazidima en presencia del ácido clavulánico pero no en presencia de cloxacilina, confirmándose la presencia de una BLEE.
El antibiograma se realizó utilizando la técnica disco-difusión, así como el panel «ID/NMIC 503» del sistema Phoenix BDR (Becton Dickinson, Franklin Lakes, NJ, EE. UU.), mediante los cuales se detectó resistencia a cefalosporinas, aztreonam, trimetoprima/sulfametoxazol y quinolonas. También se estudió la sensibilidad a azitromicina en ambos aislados mediante E-testR resultando resistentes con CMIs>256mg/l (punto de corte epidemiológico de las cepas salvajes en ≤16mg/l). Se realizó prueba rápida de inmunocromatografía «NG-Test CTX-M Múltiple» (NG Biotech, Guipry-Messac, Francia), que permite detectar los tipos más comunes de cefalosporinasas (grupos CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9 y CTX-M-25) resultando positiva. Posteriormente, se confirma el fenotipo de resistencia BLEE mediante la técnica de disco-difusión con los kits de confirmación (fig. 1B) «Total ESBL, AmpC and ESBL+AmpC Confirm kit» (ROSCO Diagnostica A/S, Taastrup, Dinamarca y mediante el panel «Check-Direct ESBL Screen» del sistema BD MaxTM con detección de betalactamasa de tipo cefalosporinasa del grupo CTX-M-9 (que puede englobar distintos genes: blaCTX-M-14, blaCTX-M-24 y blaCTX-M-27).
Ambas cepas fueron enviadas al Centro Nacional de Microbiología (Instituto de Salud Carlos III, Majadahonda, Madrid) que realizó detección fenotípica y genotípica de resistencias antibióticas. Se detectó que ambas cepas eran portadoras de la BLEE CTX-M-27 mediante técnicas fenotípicas y por secuenciación, perteneciendo al secuenciotipo 152 (MLST). El análisis de los genomas indicó que ambos aislados pertenecían al clúster de la alerta de S. sonnei multirresistente emitida por Reino Unido durante los meses previos a los casos expuestos1. Los dos aislados eran idénticos entre sí con 0 alelos de diferencia usando el esquema cgMLST del software SeqSphere (Ridom Bioinformatics, Alemania).
DiscusiónEl género Shigella (incluye las especies S. sonnei, S. flexneri, Shigella boydii y Shigella dysenteriae) causa un síndrome gastrointestinal denominado shigelosis. La mayoría de los pacientes sufren diarrea (en ocasiones con productos patológicos), fiebre y dolor abdominal. Su transmisión se produce principalmente por contacto de persona a persona, con alimentos o agua contaminados. Normalmente, la infección es autolimitada, sin necesidad de requerir tratamiento antibiótico. Con respecto a la transmisión por vía sexual, en los últimos años se ha visto asociada a brotes entre HSH por todo el mundo, en EE. UU., España y Londres2–4. En cuanto a los factores de riesgo de infección, el uso de la PrEP posiblemente podría estar influyendo en los comportamientos sexuales al reducir el uso de las medidas de barrera (preservativos), aumentando así la prevalencia de las ITS, entre las que se incluye la shigelosis como causa emergente5.
Por otro lado, las resistencias a antimicrobianos debidas a BLEE cada vez suponen un problema mayor. Las comunicaciones de cepas de S. sonnei portadoras de BLEE en pacientes que no han viajado a zonas endémicas (Asia) son escasas hasta el momento, de modo que un adecuado programa de vigilancia nos podría dar información acerca de la situación epidemiológica en nuestro país6–8. Precisamente en Gran Bretaña, se han comunicado varios brotes (o brote prolongado) de S. sonnei portadoras de BLEE (gen blaCTX-M-27-Grupo 9) y un plásmido QnrB19 (sensibilidad disminuida a quinolonas) entre HSH desde 20159. Así mismo, en Australia desde 2019 se comprobó un aumento de casos de shigelosis en HSH cuyas cepas comparten un perfil similar a las estudiadas en Gran Bretaña (probablemente introducido por viajeros que regresaron de una zona en la que circulaba este grupo clonal)10. En España, hay 8 casos confirmados y 22 posibles casos relacionados con estas cepas multirresistentes de S. sonnei. De hecho, al menos otros cuatro aislamientos secuenciados están estrechamente relacionados dentro del clúster y con las secuencias representativas del Reino Unido, al igual que nuestras dos cepas1.
En pacientes HSH que presenten clínica gastrointestinal con fiebre, dolor abdominal, vómitos o diarrea con productos patológicos como sangre o moco, se debería sospechar Shigella spp. como infección transmitida por vía sexual. Se debería restringir el uso de antibióticos a los casos moderados/graves para evitar la consolidación y transmisión de resistencias antibióticas. A nivel epidemiológico debería vigilarse su transmisión y actuar como otra ITS más, evitando mantener relaciones sexuales y con coprocultivo de control para asegurarse de que la carga bacteriana es baja o indetectable.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.