Existen escasos datos sobre el cribado serológico extenso, familiar, de Trypanosoma cruzi a partir de un infectado-índice. Por tratarse de una parasitosis con posibilidad de transmisión materno-fetal, el estudio de la descendencia de mujeres crónicamente infectadas posee una especial relevancia.
MétodosEstudio observacional por método de captura-recaptura que valora el estado serológico en la descendencia de las mujeres diagnosticadas de infección por T. cruzi en el área metropolitana norte de Barcelona durante el periodo 2005-2016.
ResultadosSe identificaron 238 mujeres son serología positiva para T. cruzi. De ellas, se pudieron localizar 117 (49,2%) y sus 300 descendientes. Entre los descendientes, 192 (64%) tenían registro de serología, con 23 positivas para T. cruzi (11,98%; IC 95%: 8,1-17,3). Hubo 53 niños nacidos en el área de estudio, con 5 casos de transmisión vertical (9,8%; IC 95%: 4,2-20,9). Todos los nacidos a partir de la implementación del programa de cribado materno (en 2010) tenían registro serológico.
ConclusionesLa población de descendientes de mujeres con serología positiva para T. cruzi muestra una tasa elevada de seropositividad. La prevalencia de transmisión vertical es notablemente alta, pero comparable a la obtenida en otros estudios europeos. La principal fuente de pérdidas lo constituyen las mujeres ilocalizables. Es razonable incluir la determinación serológica familiar extensa en los protocolos de cribado de enfermedad de Chagas. A fin de evitar pérdidas, se debería implementar un eventual cribado en el momento del diagnóstico materno.
To date, very little data is available on the extensive, familiar, serological screening of Trypanosoma cruzi from infected-index cases. As it is a parasite with possibility of mother-to-child fetal transmission, the study of the offspring of chronically infected women has a special relevance.
MethodsAn observational study using a capture-recapture method that evaluates the offspring serological status of women diagnosed with T. cruzi infection (positive serology) in the northern metropolitan area of Barcelona during 2005-2016.
ResultsA total of 238 women with positive serology for T. cruzi were identified. Of these, 117 (49.2%) could be localized. Their offspring summarized 300 individuals, of which 192 (64%) had serology records, with 23 positive for T. cruzi (11.98%; CI95%: 8.1-17.3). Among the 53 children born within the study area, 5 (9.8%, CI95%: 4.2-20.9) cases of vertical transmission were recorded. All children born as of 2010 (the starting year of mother screening) had serological outputs.
ConclusionsOffspring of T. cruzi-seropositive women showed a high rate of seropositivity. The prevalence of vertical transmission is also remarkably high but comparable to that obtained in other European studies. The main source of loss was non-accessible women. It is reasonable to formaly include extensive, familiar, serological assessment in Chagas screening guidelines. In order to avoid losses, any eventual screening should be implemented at the time of the maternal diagnosis.
La parasitación crónica por el protozoo Trypanosoma cruzi da lugar a la llamada enfermedad de Chagas o tripanosomiasis americana, una parasitosis del Nuevo Mundo ampliamente difundida en un marco geográfico que abarca desde Texas hasta el norte de Argentina. Aproximadamente un 30% de los infectados desarrollan disfunciones graves de los órganos parasitados, sobre todo del corazón1. Más allá de la problemática personal, ello supone un impacto y una carga económica de primer orden en los sistemas sanitarios de América Latina. Aunque la principal vía de contagio es la vectorial (chinches triatómidos), la vía de contagio materno-fetal representa entre un 5 y un 8% de los nuevos contagios, según diversos estudios2,3. España recibió un gran número de inmigrantes procedentes del denominado «foco del Chaco» (Bolivia, Paraguay y norte de Argentina) durante la primera década del siglo XXI, lo que conllevó la aparición de casos de enfermedad de Chagas. Con mayor o menor rapidez se fueron diseñando los programas de cribado serológico de hemoderivados y trasplantes (2005 y 2006)4,5. Posteriormente, diversas comunidades autónomas fueron definiendo e implementando protocolos para la detección serológica de la infección materna por T. cruzi durante el primer trimestre del embarazo (2010)6-8. Dichos documentos especifican el manejo de las mujeres embarazadas y los neonatos con serología positiva para T. cruzi. No obstante, estos documentos aconsejan, pero no protocolizan, el cribado de la totalidad de la descendencia anterior. Esta débil recomendación se basa más en la opinión de expertos y en la lógica común que en la disponibilidad de datos que aporten evidencia al respecto9.
La posibilidad de implementación protocolizada del cribado extenso a todos los hijos de mujeres infectadas por T. cruzi, detectadas durante el cribado del primer trimestre del embarazo o no, dependerá de las posibilidades del sistema sanitario y de la proporción de casos identificados: en definitiva, de su coste-beneficio. El presente estudio pretende aportar datos epidemiológicos y clínicos al respecto.
Pacientes y métodoSe trata de un estudio observacional y retrospectivo que pretende conocer y caracterizar la situación serológica frente a T. cruzi en la descendencia de mujeres diagnosticadas de infección crónica por T. cruzi en el área metropolitana norte de Barcelona. Esta área sanitaria comprende los municipios de Santa Coloma de Gramenet, Badalona, El Masnou, Sant Adrià del Besòs y Montgat (en total, 404.023 habitantes según datos del padrón de 2015), con un 13,8% de población inmigrante. Según los datos extraídos de los padrones municipales (2016), aproximadamente 18.000 personas (4,5%) serían originarias de países endémicos de enfermedad de Chagas. La población más afectada, inmigrantes bolivianos, asciende a 3.606 personas (0,9%)10.
La población de estudio se definió como todo descendiente de mujer con diagnóstico conocido de infección chagásica (T. cruzi+) y residente en el área de estudio con independencia de si dicho diagnóstico derivaba de un programa de cribado específico (neonatal o del banco de sangre y tejidos) o no. Para su identificación se consultaron las bases de datos de un hospital de tercer nivel (Hospital Universitari Germans Trias i Pujol, Badalona), una unidad territorial de salud internacional (PROSICS Metropolitana Nord, Santa Coloma de Gramenet) y la base de datos común a los 22 centros de Atención Primaria del área sanitaria. Asimismo, se aplicó una estrategia de captura-recaptura en tanto que, en un segundo escalón, se consultó la base de datos del laboratorio compartido. Una vez confeccionada la base de datos, se contactaba telefónicamente con las mujeres y se recababa su permiso para proceder a una encuesta, a cuyo término se les ofrecía la posibilidad de estudiar serológicamente a sus hijos sin resultado conocido, previo consentimiento expreso paterno o materno en menores de edad. Las variables del estudio fueron: número de hijos, sexo, edad, nacimiento en Cataluña u otro lugar con un programa vigente de cribado antenatal (sí/no), lugar de residencia actual, realización de serología de T. cruzi (sí/no), resultado serológico (positivo/negativo) y tratamiento de los seropositivos (sí/no). Además, los hijos se categorizaron como: accesibles (lugar de nacimiento o lugar de residencia actual en Cataluña) y no accesibles (lugar de nacimiento o residencia actual fuera de Cataluña). A todo descendiente de madre con infección chagásica del que se desconocía su estado serológico para T. cruzi se le ofrecía la posibilidad de realizar una serología, previo consentimiento de padres o tutores en los menores de edad.
Para calcular el tamaño muestral mínimo se estimó que el número de mujeres infectadas (procedentes de zonas endémicas) y con descendencia en el área de estudio era aproximadamente de 700 personas, considerando que pudiera haber unos 1.300 descendientes (1,86 hijos por mujer), para un nivel de confianza del 95%, una precisión del 3% y una proporción estimada de casos positivos para T. cruzi del 8% (297 individuos descendientes de madre con serología para T. cruzi+).
Los datos se analizaron por medio del programa Stata 10©, versión 10.0 (Stata Corporation, Texas, EE. UU.). Se aplicó la prueba de Chi-cuadrado para comparar variables cualitativas. Se consideraron estadísticamente significativos aquellos valores de p < 0,05.
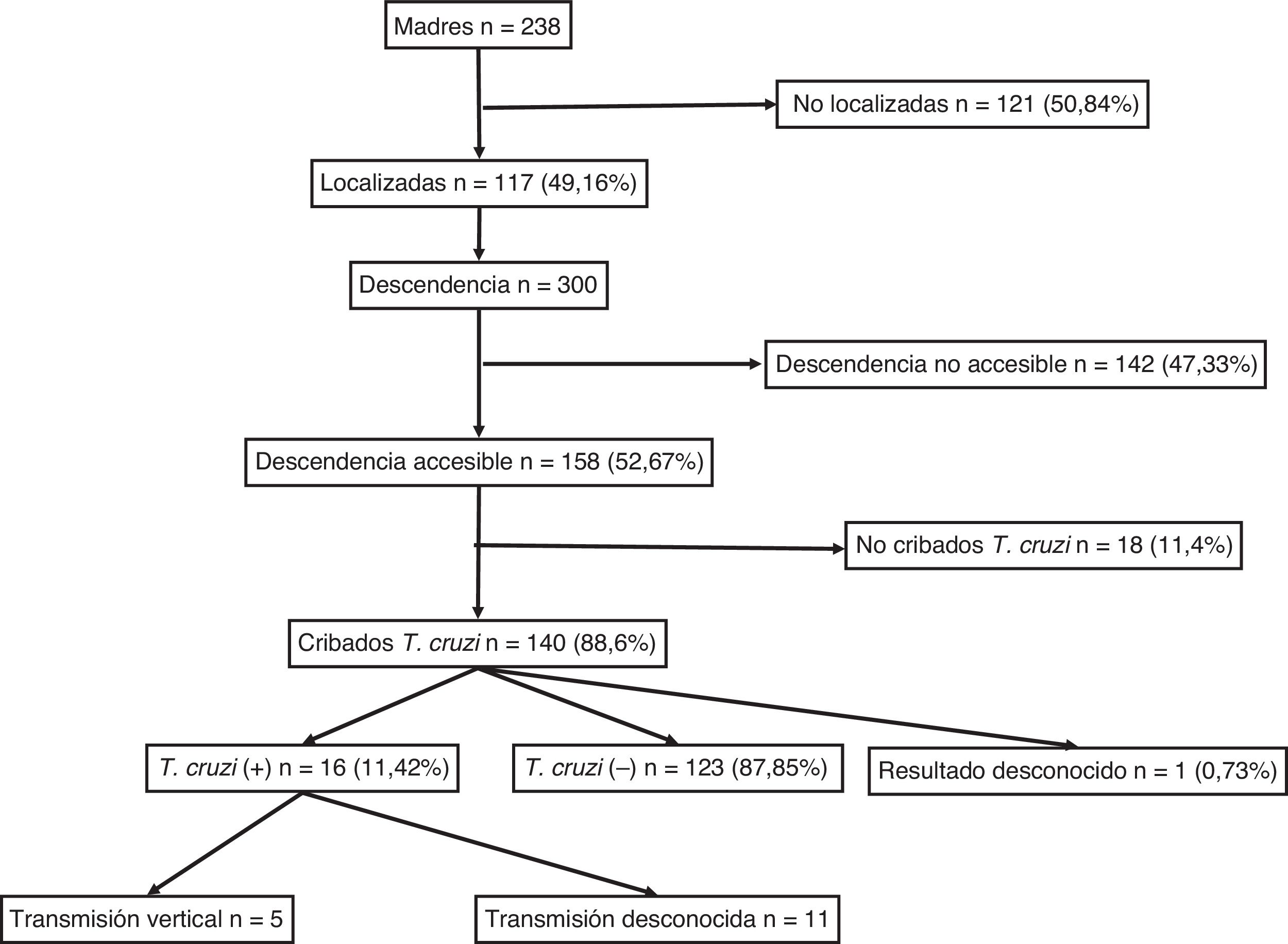
ResultadosSe identificaron 238 mujeres con descendencia y con serología positiva para T. cruzi. De ellas, se pudo localizar a 117 (49,16%). El diagnóstico de infección chagásica derivaba principalmente de la sospecha clínica o epidemiológica y solo 18 (15,4%) de ellas se identificaron a partir del cribado durante el embarazo. No se determinó la presencia de ninguna diferencia significativa entre el grupo de 117 madres localizadas y el de 121 madres no localizadas por lo que respecta a su edad, número de hijos, proporción de originarias de Bolivia y proporción de infecciones asintomáticas.
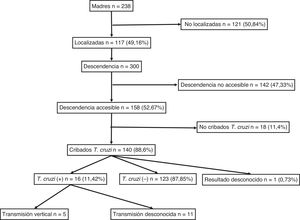
El número de sus descendientes ascendió a un total de 300 individuos (media: 2,5 hijos/mujer). De ellos, 156 eran varones (52%) y 144 mujeres (48%), con una edad media de 21,31 (±7,4) años. Entre ellos, 53 habían nacido en la Unión Europea (17,67%) y 247 en Sudamérica (82,33%) y de estos últimos, 238 en Bolivia (96,36%). Se consideraron individuos accesibles al cribado serológico 158 (52,67%), mientras que 142 (47,33%) se consideraron no accesibles por haber residido permanentemente en Sudamérica.
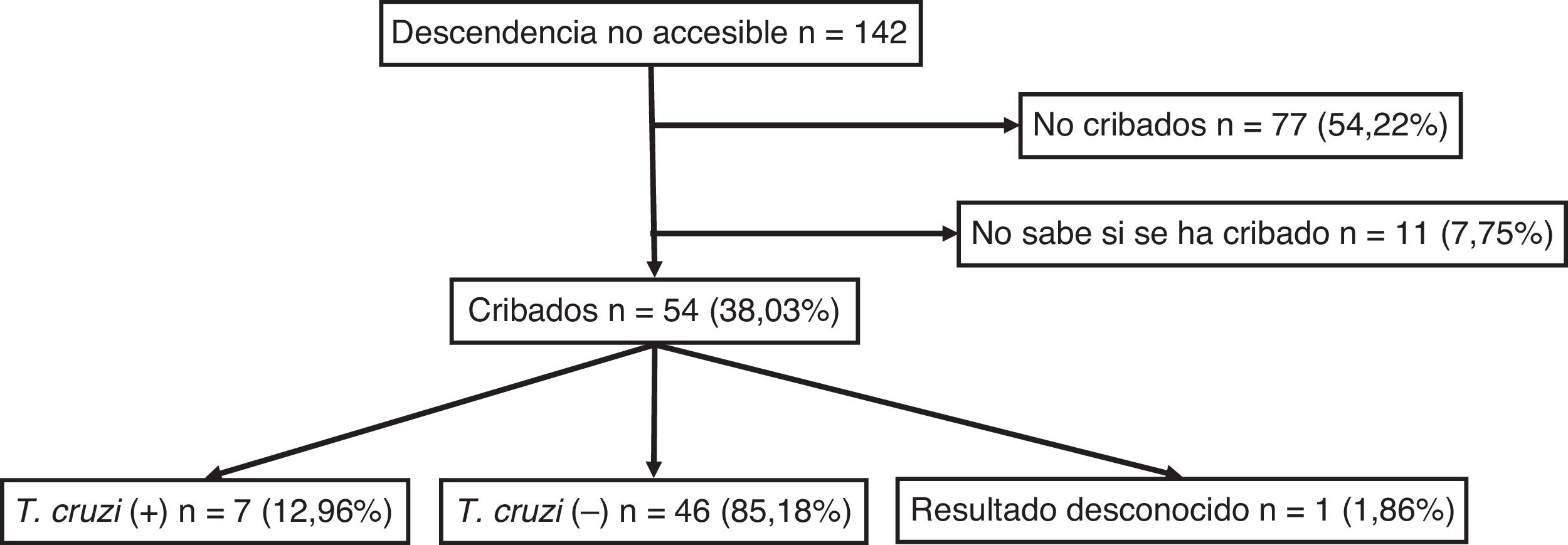
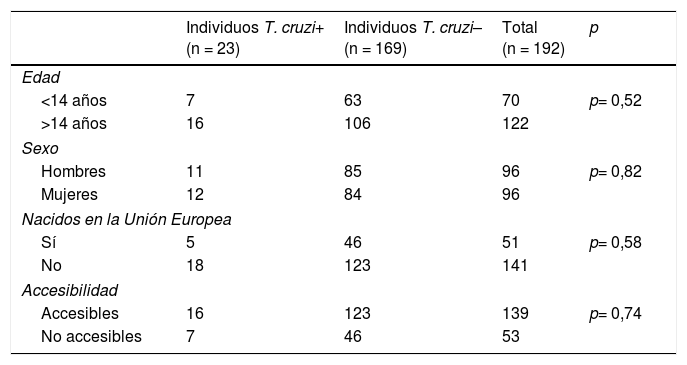
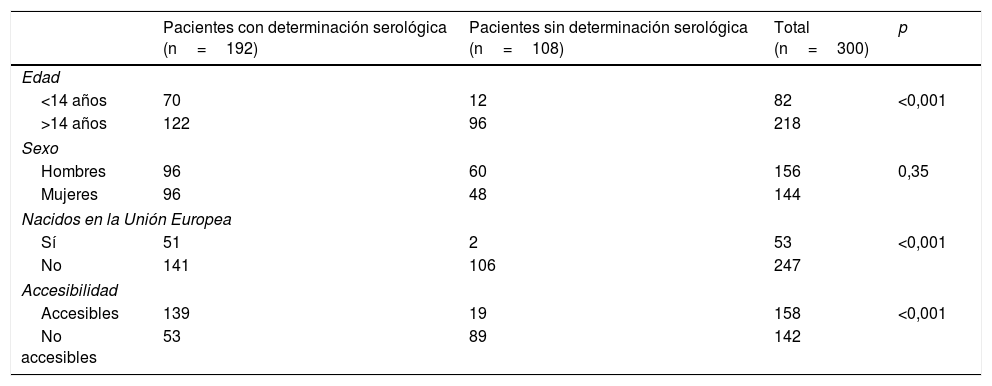
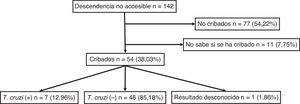
Para el total de los 300 descendientes estudiados, constaban resultados serológicos en 192 (64%) y, de ellos, 23 presentaron seropositividad para T. cruzi (11,98%; IC 95% 8,1-17,3%). En relación con su accesibilidad: a) de los 158 individuos considerados descendencia accesible, constaban resultados en 140 (88,6%), distribuidos en 16 positivos (11,42%), 123 negativos (87,85) y uno desconocido (0,7%) y b) de los individuos definidos como no accesibles, se habían realizado serologías en Sudamérica a 54 (38,03%) individuos, de los que 7 (12,96%) fueron positivos. Los datos para ambos grupos se presentan en las figuras 1 y 2. No se encontró ninguna relación significativa entre presentar serología positiva para T. cruzi y alguna variable sociosanitaria. No obstante, tener estudio serológico se relacionó significativamente con una edad inferior a 14 años, haber nacido en la Unión Europea y ser accesible al diagnóstico (en todos los casos p < 0,001); dichas asociaciones se muestran en las tablas 1 y 2.
Estado serológico con relación a diversas variables socio-demográficas
| Individuos T. cruzi+ (n = 23) | Individuos T. cruzi– (n = 169) | Total (n = 192) | p | |
|---|---|---|---|---|
| Edad | ||||
| <14 años | 7 | 63 | 70 | p= 0,52 |
| >14 años | 16 | 106 | 122 | |
| Sexo | ||||
| Hombres | 11 | 85 | 96 | p= 0,82 |
| Mujeres | 12 | 84 | 96 | |
| Nacidos en la Unión Europea | ||||
| Sí | 5 | 46 | 51 | p= 0,58 |
| No | 18 | 123 | 141 | |
| Accesibilidad | ||||
| Accesibles | 16 | 123 | 139 | p= 0,74 |
| No accesibles | 7 | 46 | 53 | |
T. cruzi+: serología positiva; T. cruzi−: serología negativa.
Determinación serológica con relación a diversas variables sociodemográficas
| Pacientes con determinación serológica (n=192) | Pacientes sin determinación serológica (n=108) | Total (n=300) | p | |
|---|---|---|---|---|
| Edad | ||||
| <14 años | 70 | 12 | 82 | <0,001 |
| >14 años | 122 | 96 | 218 | |
| Sexo | ||||
| Hombres | 96 | 60 | 156 | 0,35 |
| Mujeres | 96 | 48 | 144 | |
| Nacidos en la Unión Europea | ||||
| Sí | 51 | 2 | 53 | <0,001 |
| No | 141 | 106 | 247 | |
| Accesibilidad | ||||
| Accesibles | 139 | 19 | 158 | <0,001 |
| No accesibles | 53 | 89 | 142 | |
De los 53 niños nacidos en Cataluña constaban resultados en 51 (96,23%), de los que 5 fueron seropositivos para T .cruzi (con una tasa de transmisión vertical del 9,8%; IC 95%: 4,2-20,9). A partir de 2010, cuando se implementó el cribado serológico de todos los niños nacidos de madre infectada conocida, se registraron 34 nacimientos; en todos ellos constaban resultados serológicos al nacimiento, aunque se perdieron 4 casos (11,8%) para la segunda determinación a los 9 meses y se registraron 2 casos positivos. Siete mujeres dieron a luz 8 niños después de haber completado el tratamiento antichagásico con benznidazol. Todos estos niños fueron cribados correctamente y presentaron una serología negativa para T. cruzi.
Mediante la búsqueda telefónica activa de los 18 descendientes accesibles sin determinación serológica, se recuperaron 3 individuos, de los que uno fue positivo. De los 23 descendientes T. cruzi+, 16 casos eran accesibles y, de ellos, constaba prescripción de tratamiento en 12 individuos (75%): 6 con benznidazol, 2 con nifurtimox y en los 4 restantes no se conocía el tratamiento recibido. En 4 casos (25%) se perdió todo contacto antes del inicio del tratamiento.
DiscusiónEl año 2006 presenció el acmé de una de las mayores olas migratorias de América a Europa; algunas fuentes estiman que durante el periodo entre los años 2000 y 2010 hasta 2.400.000 ciudadanos de Bolivia, el país con mayor prevalencia de infección chagásica del mundo (aproximadamente un 18%)11, migraron al extranjero. España fue el principal receptor europeo de dicha población, con alrededor de 190.000 inmigrantes registrados solicitantes de regularización, a los que habría que añadir los irregulares12. Inevitablemente, afloró la enfermedad de Chagas. Antes poco conocida y bastante ignorada, pasó a ser considerada un reto médico en tanto que afectaba a países desarrollados13. El primer caso de tripanosomiasis americana transmitida por vía materno-fetal se describió en 2006 y situó a esta enfermedad sobre la mesa de los planificadores sanitarios14. En Cataluña, en enero de 2010, se redactó el «Protocolo para el cribado de la enfermedad de Chagas en mujeres embarazadas y sus neonatos»15 y se implementó de manera notablemente eficaz a la luz de la evidencia aportada por artículos que apoyaban su favorable coste-efectividad16. Este protocolo aconseja el cribado de los otros hijos habidos anteriormente de la mujer seropositiva para T. cruzi, pero no es explícito acerca del nivel sanitario de su implementación ni se prevé su declaración, seguimiento o evaluación.
Existen muchas referencias en la literatura procedentes de zonas endémicas y no endémicas que valoran, discuten y concluyen a favor del cribado serológico antenatal de T. cruzi a fin de evitar la transmisión materno-fetal del parásito17,18. Ello contrasta con la escasez de trabajos que evalúan el estado serológico del conjunto de los hijos de madres infectadas, ninguno de los cuales se realizó en la Unión Europea. Las recomendaciones de grupos de expertos con posiciones más claras a favor del cribado familiar extenso proceden de la Organización Mundial de la Salud-América Latina (del denominado Grupo Técnico IVa)19.
En nuestro caso, aunque se estimó en 700 el número aproximado de mujeres en edad fértil seropositivas para T. cruzi en el área de estudio, solo se localizaron 238, por lo que muy probablemente existe un número elevado de personas infectadas sin diagnosticar. Este «efecto iceberg» propio de las enfermedades infecciosas con periodos asintomáticos largos es algo que otros autores ya habían advertido20, por lo que cabe concluir que un programa de cribado dirigido a mujeres infectadas o a su descendencia debería contemplar medidas de carácter comunitario21.
En nuestro estudio, la tasa de prevalencia total de infección chagásica (11,98%) en la población estudiada se compone de la suma de las infecciones materno-infantiles más las vectoriales, transmitidas originalmente en Sudamérica, y es superior a las tasas indicadas en uno de los escasos estudios similares publicados (7,2%), realizado en Brasil22. La tasa bruta de transmisión vertical (9,8%) deriva, por lo tanto, únicamente del estudio de los niños nacidos en Cataluña. Comparado con las cifras consideradas habituales en Sudamérica (4-7%)22, nuestra cifra es también elevada, aunque su intervalo de confianza (4,2-20,9) las incluye y podría, por lo tanto, derivar de lo limitado de la casuística. No obstante, no se trata del primer estudio europeo que muestra tasas alrededor del 10%, ya que en otros estudios se indican tasas del 7,3%3 y del 13,8%23, ya sea debido a una mejor calidad en las determinaciones o a la presencia en Europa de inmigrantes con linajes parasitarios más afines por la placenta24. Presumiendo que el programa de cribado antenatal tiene una cobertura amplia en el área estudiada (del 85% en 2011 y >97% en 2015)25, la tasa referida podría aproximarse mucho a la real. Un total de 82 de los descendientes (27,3%) eran niños menores de 14 años, lo que supone una proporción sustancial que es relevante, ya que esa es la población en la que el tratamiento es más eficaz y, por lo tanto, determina en gran parte el ratio de coste-efectividad de un eventual programa de cribado ampliado20.
La principal fuente de pérdidas se debe a la imposibilidad de localización de la madre índice. La población estudiada es móvil, con frecuencia cambian de domicilio, trabajo, número telefónico o proveedor sanitario, por lo tanto, el momento del diagnóstico de infección chagásica en una mujer con hijos, si se quiere aún bajo los efectos del impacto emocional que conlleva, es el más adecuado para aconsejar y realizar el cribado a todos sus descendientes anteriores. La investigación epidemiológica retrospectiva basada en un método de captura-recaptura se mostró eficaz (se localizaron 139 de 158 serologías) y eficiente (no precisó recursos económicos específicos), pero solo recuperó a 3 de los 18 individuos accesibles sin serología conocida, por lo que no puede sustituir a una determinación «familiar» inmediata al diagnóstico materno realizada en el mismo centro asistencial19. Cabe destacar que en un 25% de los descendientes con serología positiva se perdió todo contacto entre diagnóstico e inicio del tratamiento. El tratamiento con benznidazol es clave en la población infantil en tanto que es altamente eficaz en menores de 12 años. Inevitablemente, el proceso de determinación serológica y, sobre todo, de consecución de la medicación (a través de Farmacia Extranjera) toma su tiempo, por lo que hay que asegurar las vías de comunicación con la madre.
Diversos artículos apoyan un ratio de coste-efectividad favorable por lo que respecta al cribado de embarazadas y de recién nacidos. El «Documento de consenso de sobre el abordaje de la enfermedad de Chagas» (2015)26 publicado por profesionales de la Atención Primaria propone el cribado de todos los inmigrantes procedentes de Sudamérica continental, y prioriza el cribado en ciertos colectivos (inmunodeprimidos, pacientes con antecedentes familiares, etc.). Situado aún más allá en la defensa del cribado universal en razón de origen, hay al menos un modelo realizado con población similar que considera económicamente viable y asimismo coste-eficaz el cribado serológico de infección chagásica a todos los pacientes sudamericanos sin distinción, que estima una prevalencia de seropositividad del 4,2% y una cobertura de programa del 80%27. Si ello se admite, entonces los argumentos contrarios al cribado de una población de descendientes de madres chagásicas, con una prevalencia de casi el 12%, se desvanecen28. Aunque el presente estudio no es un estudio de base ni con objetivos económicos, los escasos costes directos de las serologías (44,25 € precio final de la serología con antígenos crudos y recombinantes), más el coste atribuible a visitas médicas (140 € la primera visita y 18 € adicionales las sucesivas), más lo imputable a la compra y transporte de benznidazol (aproximadamente 170 €/paciente) con una previsión de los costes debidos a los efectos secundarios de la medicación, acumulan un montante muy inferior al asociado con los costes de la atención a los casos asintomáticos (677,2 €; IC: 294,6-1.060) y ello sin incluir el 30% de los pacientes que presentan progresión a enfermedad digestiva (16.475 €; IC 95%: 7.711-39.111) o cardíaca (25.475 €; IC 95%: 13.105-67.999)29. La cifra de 170 € es coherente, o incluso algo inferior, con la estimación de costes directos para «familiares conniventes» en caso-base (399 €) realizado por la Agencia de Evaluación de Tecnologías Sanitarias29. Más allá de las estimaciones y cálculos, no hay que olvidar que en el plano ético se trata de una enfermedad que puede transmitirse a la descendencia, que tiene tratamiento eficaz en los recién nacidos, que presenta graves complicaciones a largo plazo y que puede detectarse en las madres con una prueba sencilla, no invasiva y de bajo coste, sea cual sea la incidencia de transmisión madre-hijo en la vida real30.
Entre sus limitaciones, el estudio adolece de un alto número de mujeres que se perdieron para el análisis, no localizables, por lo que podría existir un sesgo de selección en el sentido de que las mujeres con infección chagásica sintomática tendieran a permanecer más en contacto con el sistema sanitario y, por consiguiente, estuvieran sobrerrepresentadas. No obstante, la mayoría de las mujeres no localizables constaban de baja en la base de datos del Servei Català de la Salut, algo que indica traslado o vuelta a su país y esta circunstancia suele deberse a factores no sanitarios. Con respecto a la metodología empleada, cabe concluir que, aunque un estudio retrospectivo como el presente es sencillo y factible, solo ha sido capaz de rescatar algunos casos, algo ya indicado en estudios previos31.
En definitiva, la población de descendientes de mujeres diagnosticadas de infección chagásica tiene una alta prevalencia de seropositividad para T. cruzi y justifica la existencia de un programa de cribado extenso, sistemático y protocolizado, que refuerce y complete los programas de vigilancia epidemiológica de la enfermedad de Chagas. La determinación serológica inmediatamente posterior al diagnóstico materno sería el momento más adecuado para realizar el cribado familiar extenso, con monitorización posterior a la entrega de los resultados y al inicio del tratamiento antichagásico.
Conflicto de interesesLos autores no perciben ni declaran la existencia de conflictos de interés reales o potenciales.