En esta revisión se pretende actualizar los nuevos procedimientos aplicables en el diagnóstico microbiológico de las bacteriemias y fungemias.
MétodoRevisión de la literatura científica.
Resultados y conclusionesTras definir el proceso e indicar sus principios fundamentales, se revisan los principales biomarcadores utilizados en la práctica clínica. Posteriormente, se resaltan las particularidades de la fase preanalítica (recogida y transporte de las muestras) y se detallan los pasos a seguir para la identificación microbiológica por métodos clásicos, basados en el cultivo de las muestras de sangre. En el siguiente apartado, se revisan los métodos diagnósticos no basados en el cultivo, incluyendo los que detectan la presencia del genoma del microorganismo y los basados en el estudio del proteoma mediante espectrometría de masas. En el último apartado se describen los procedimientos a seguir para el estudio de la sensibilidad antibiótica, tanto por métodos fenotípicos como genotípicos.
In this review we try to update the new procedures applicable in the microbiological diagnosis of bacteriemia and fungemias.
MethodReview of scientific literature.
Results and conclusionsAfter defining the process and indicating its fundamental principles, the main biomarkers used in clinical practice are reviewed. Subsequently, the particularities of the pre-analytical phase (collection and transport of samples) are highlighted and the steps to follow for the microbiological identification by classical methods are detailed, based on the culture of the blood samples. In the following section, we review the diagnostic methods not culture based, including those that detect the presence of the genome of the microorganism and those based on the study of proteome by mass spectrometry. The last section describes the procedures more frecuently used for the study of antibiotic susceptibility, both by phenotypic and genotypic methods.
La detección de la bacteriemia y la fungemia constituye una de las prioridades del Servicio de Microbiología Clínica, dada su importancia diagnóstica y pronóstica. Estos procesos se asocian a una mortalidad elevada, que puede oscilar entre el 10 y el 30% según las series y según el tipo de paciente, el origen y el manejo inicial. La gravedad de esta entidad clínica requiere de la administración rápida de tratamiento antimicrobiano empírico en función de los datos clínicos y de la epidemiología local de la resistencia. A pesar de esto, el porcentaje de tratamientos inadecuados puede alcanzar hasta un 25-30%, siendo este dato especialmente determinante en pacientes con enfermedades de base, con procesos graves o en centros con elevadas tasas de microorganismos multirresistentes1.
Se define como bacteriemia la presencia de bacterias en la sangre que se pone de manifiesto por el aislamiento de estas en los hemocultivos. El origen de la bacteriemia puede ser diverso en función de las características clínicas del paciente. El término fungemia se utiliza para designar la presencia de hongos en la sangre, generalmente levaduras del género Candida spp. que, aunque pueden originarse a partir de focos semejantes a los que ocasionan las bacteriemias, frecuentemente tienen su origen en la infección de catéteres2.
Actualmente, la sepsis se define como una disfunción orgánica que amenaza la vida de un paciente causada por una respuesta no regulada del individuo frente a la infección; se ha diseñado una nueva escala, denominada quick Sepsis Related Organ Failure Assesment (qSOFA), que incluye exclusivamente criterios clínicos, por lo que es fácilmente aplicable en cualquier nivel asistencial (no solo en el hospital). Se define shock séptico como el cuadro de sepsis que cursa con alteraciones circulatorias, celulares y del metabolismo lo suficientemente profundas como para aumentar sustancialmente la mortalidad a cifras superiores al 40%.
La creación de un código específico para el manejo de la sepsis, el código sepsis, obedece al hecho de que esta entidad es la principal causa infecciosa de muerte, afectando a 100-150 de cada 100.000 habitantes/año, lo que supone en nuestro país más de 50.000 pacientes/año de los cuales pueden fallecer más de una tercera parte; la mortalidad asociada a un cuadro de sepsis puede combatirse con un diagnóstico correcto y un manejo adecuado en las primeras horas de comienzo. La aplicación del paquete de medidas recomendadas por la Surviving Sepsis Campaign logra disminuir la morbilidad y la mortalidad a cifras en torno al 25%3.
Diagnóstico microbiológicoSe debe tener en cuenta la escasa cantidad de microorganismos presentes en la sangre durante un episodio de bacteriemia, que suele oscilar entre 10 unidades formadoras de colonias (UFC)/ml y 104UFC/ml, pudiendo ser incluso inferior a 0,1UFC/ml en un 20% de los casos; esta característica hace que solo las técnicas muy sensibles puedan ser utilizadas en el diagnóstico rápido de este proceso. El hemocultivo sigue siendo actualmente el principal método diagnóstico de la bacteriemia, aunque su valor práctico se ve perjudicado por el retraso en la obtención de resultados y porque no es positivo en todos los pacientes, siendo su rendimiento más bajo en pacientes en tratamiento antibiótico o si la infección se produce por hongos, por bacterias de crecimiento lento o por aquellas con requerimientos especiales. Otro factor clave es la elevada proporción de hemocultivos contaminados por microorganismos pertenecientes a la microbiota de la piel; esto puede dar lugar a errores diagnósticos, tratamientos inadecuados y ocasionar un elevado gasto económico para el sistema sanitario. La sensibilidad de los hemocultivos está en gran medida relacionada, además de con el tipo de microorganismo, con el volumen de la muestra, el momento de la extracción y la ausencia de tratamientos antibióticos previos4.
BiomarcadoresEn estos momentos ya no se puede hablar del diagnóstico de la sepsis sin tener presente la detección de biomarcadores5. Existen algunos más conocidos como la procalcitonina, la proteína C reactiva, la interleucina-6 y la región medial de la proadrenomedulina, y se está investigando en otro gran número de moléculas de diversos orígenes, incluidos aquellos que reflejan cambios en el metaboloma y algunos marcadores genéticos del huésped (RNA biosignatures) presentes en el suero como respuesta a infecciones bacterianas. Idealmente, estas moléculas deberían permitir desescalar o incluso interrumpir en algunas situaciones el tratamiento antimicrobiano, contribuir a establecer la gravedad del paciente y permitir monitorizar su evolución6.
Procesamiento de los hemocultivosNo existe una recomendación universal sobre cuáles son las indicaciones de la toma de hemocultivos, aunque generalmente se recomienda su extracción ante la presencia de escalofríos, fiebre (temperatura corporal ≥ 38°C) o hipotermia en neonatos y pacientes ancianos. También en caso de leucocitopenia, leucocitosis o trombocitopenia no relacionada con procesos hematológicos, en otros signos de infección focal o sepsis, así como en el caso de sospecha de endocarditis. La extracción de hemocultivos está indicada, asimismo, en niños pequeños o ancianos con un decaimiento súbito de la vitalidad, ya que estas poblaciones pueden no presentar los signos y síntomas típicos de la bacteriemia. Además, siempre se deben extraer cuando se remite para su siembra una punta de catéter por sospecha de bacteriemia originada en el mismo, ya que si no, no es posible diferenciar de la colonización del catéter7.
En relación con la sospecha de infección, se deben extraer hemocultivos en pacientes susceptibles de presentar meningitis, osteomielitis, pielonefritis, infección intraabdominal, artritis, infecciones graves de la piel y tejidos blandos, neumonía, endocarditis y fiebre de origen desconocido (absceso oculto, fiebre tifoidea, brucelosis, tularemia, etc.). El cultivo de la sangre debe complementarse con el de muestras de otras localizaciones para tratar de determinar el foco del proceso.
Las muestras de sangre para hemocultivo deben extraerse mediante venopunción (extracción periférica), evitándose la extracción a partir de dispositivos intravasculares tal y como lo recomienda el American College of Physicians, cambiando de equipo y localización anatómica en la extracción de cada hemocultivo. Solo se deberían realizar extracciones a través del catéter si se pretende diagnosticar una infección del mismo y esta debe ir acompañada de otra extracción por venopunción periférica; excepcionalmente, se puede extraer sangre a través de catéter en pacientes pediátricos con enfermedad oncohematológica. Por otra parte, la extracción de sangre debe hacerse antes de iniciar la administración del tratamiento antibiótico y en el caso de que esto no fuera posible, cuando el antibiótico esté en su concentración valle (justo antes de la siguiente dosis)8.
El volumen de sangre es el factor más importante para aumentar el rendimiento diagnóstico del hemocultivo; en general se siguen las recomendaciones de la Infectious Diseases Society of America/American Society for Microbiology (ASM), según las cuales el volumen de sangre a cultivar está relacionado con el peso del paciente. Así, en niños pequeños se requerirán entre 1 y 5ml (dilución 1:5), inoculados en un solo frasco aerobio mientras que el volumen de sangre a cultivar admitido para niños mayores y adultos será de 10-20ml (dilución 1:10), repartidos en los 2frascos (anaerobio y aerobio)9.
La probabilidad de recuperar el agente causal se incrementa en relación con el número de hemocultivos extraídos al paciente. Es cercana al 60-80% en el primer hemocultivo, del 80-90% cuando se cursan 2hemocultivos y del 95-99% con el tercer hemocultivo. No existe una recomendación universal sobre el intervalo a respetar entre cada extracción y, aunque por lo general se aconseja que estén separadas 10-30 min, este intervalo se puede acortar en situaciones de extrema urgencia e incluso en estos casos, para no retrasar el tratamiento antibiótico, pueden extraerse los hemocultivos simultáneamente de extremidades diferentes.
La extracción de sangre para hemocultivo debe realizarse con las máximas condiciones de asepsia, desinfectando escrupulosamente la piel en el lugar donde se va a efectuar la venopunción y también los tapones de caucho de los frascos de hemocultivo, preferiblemente con clorhexidina alcohólica al 2% en pacientes mayores de 2 meses de edad. En todos los hospitales debe vigilarse regularmente el porcentaje de hemocultivos contaminados y realizar actividades formativas periódicas entre el personal encargado de la extracción de los mismos para difundir la necesidad de que esta se haga utilizando el protocolo establecido en cada centro. En la tabla 1 se resume la metodología a seguir para la extracción de hemocultivos.
Metodología a seguir para la extracción de un hemocultivo
| 1. Utilización de guantes y mascarilla |
| 2. Limpieza con clorhexidina de los tapones de los viales |
| 3. Selección del lugar de la extracción (no obtener la sangre a través de catéter) |
| 4. Desinfectar la piel con clorhexidina y dejar actuar |
| 5. Realizar la punción sin tocar la piel del paciente con la mano |
| 6. No poner en contacto la aguja con el algodón |
| 7. Extraer la sangre necesaria para que se puedan añadir 10ml de sangre en cada frasco en el caso de los adultos y entre 1 y 5ml en el frasco pediátrico |
| 8. Inocular primero el frasco anaerobio evitando la entrada de aire |
| 9. Inocular después del frasco aerobio; no es necesario añadir aire |
| 10. Inocular el resto de los tubos si los hubiere (bioquímica, etc.) |
| 11. Agitar suavemente los 2frascos |
| 12. Llevar de forma urgente al Servicio de Microbiología |
| 13. Si no fuera posible, mantener a temperatura ambiente preferiblemente no más de 2 h |
En aquellos casos en los que se sospeche que el origen de la bacteriemia es el catéter y no sea fácil recambiar o prescindir de este, se recomienda utilizar la técnica del tiempo diferencial de positividad para confirmar el diagnóstico10.
Una vez obtenida la muestra e inoculados los frascos de hemocultivos, deben identificarse adecuadamente en cuanto a los datos del paciente y las parejas de frascos correspondientes a cada una de las extracciones. Deben enviarse rápidamente al laboratorio conservándolos en todo momento a temperatura ambiente. No se deben conservar en estufa, ya que podría ocurrir que cuando estos frascos se introdujesen en el incubador inteligente ya hubieran llegado a la fase de crecimiento estacionario y, por tanto, no se detectasen como positivos. Se ha comunicado que hay una importante disminución de la recuperación de patógenos si en lugar de introducir los frascos inmediatamente en el incubador se mantienen mucho tiempo a temperatura ambiente, por lo que las guías del CLSI recomiendan que se introduzcan los frascos de hemocultivos en el incubador en menos de 2 h desde su extracción. Se debe valorar también la necesidad de disponer de incubadores satélites en los lugares que no pudieran cumplir este requerimiento.
El desarrollo de los nuevos métodos automatizados (sistemas BacT/Alert® VIRTUO™ (BioMerieux) y BD BACTEC™ FX) (Becton Dickinson) para el procesamiento de los hemocultivos ha supuesto un avance sustancial, ya que los frascos se introducen en sistemas de incubación automatizados que mantienen la temperatura de los mismos a unos 36 ±1°C. Estos sistemas constan de una serie de celdas individuales con agitación continua para facilitar la multiplicación bacteriana y realizan una monitorización periódica para la detección de frascos positivos.
Además cada una de estas compañías desarrolla diferentes frascos con especificaciones concretas; en general, existen frascos diseñados para aislamiento de bacterias aerobias y anaerobias facultativas, y frascos para aislamiento de anaerobios facultativos y estrictos. También existen frascos optimizados para pequeños volúmenes de sangre, útiles en pediatría y los selectivos para micobacterias (medio Middlebrook 7H9) u hongos que se pueden utilizar en casos específicos.
Aunque se ha cuestionado la utilidad de los frascos para anaerobios debido al bajo porcentaje de bacterias anaerobias estrictas responsables de bacteriemia, actualmente se siguen recomendando en adultos ya que su utilización ayuda a localizar el foco de la infección y además en este tipo de frascos se recupera más rápidamente un 10% de bacterias anaerobias facultativas. Esto no es aplicable a población pediátrica donde el riesgo de desarrollar bacteriemia por estos microorganismos es mucho menor.
El 85-90% de los hemocultivos son positivos en menos de 48 h salvo en el caso de que se trate de una fungemia o de una bacteriemia causada por una bacteria de crecimiento lento. En general, los frascos se incuban 5 días antes de informarse como negativos. Este tiempo suele ser suficiente para la recuperación de la mayoría de los microorganismos, incluidas las bacterias exigentes del grupo HACEK (Haemophilus spp., Aggregatibacter spp., Cardiobacterium spp., Eikenella spp. y Kingella spp.) y se debe prolongar en aquellas enfermedades como la endocarditis que pueden estar causadas por bacterias de crecimiento lento o cuando se sospeche la presencia de hongos, micobacterias, Legionella spp., Brucella spp., Bartonella spp. o Nocardia spp. Hay que tener en cuenta que la prolongación del tiempo de incubación favorece la recuperación de contaminantes, por lo que los hallazgos tardíos deben valorarse con mucha precaución y siempre considerando el microorganismo aislado11.
Si la colaboración entre el profesional clínico y el microbiólogo es siempre necesaria, mucho más lo debe ser ante la sospecha de una infección cuyo agente etiológico es de difícil aislamiento y crecimiento. La mayoría de estas bacterias necesitan medios de cultivo especiales por sus requerimientos nutricionales y, en algunos casos, su incubación debe ser prolongada debido a su lento crecimiento. En alguno de estos procesos infecciosos el estudio serológico y las técnicas de microbiología molecular son procedimientos indispensables para el diagnóstico.
Las levaduras crecen bien en los frascos de hemocultivo habituales a pesar de lo cual esta prueba solo es positiva en aproximadamente la mitad de los pacientes en los que se sospecha fungemia debido a que los monocitos y otras células del sistema inmunológico lisan las células fúngicas, puede haber un inóculo muy bajo o las fungemias pueden ser transitorias o intermitentes. Para mejorar la sensibilidad de la técnica, el volumen de sangre cultivado es un factor crucial. Un aspecto controvertido es la utilidad de realizar una extracción adicional de un frasco específico para hongos, aunque algunos autores han comunicado que mejoran los porcentajes de recuperación especialmente para infecciones asociadas a Candida glabrata.
En relación con el tiempo de incubación de los frascos de hemocultivos con sospecha de infección fúngica por levaduras, la gran mayoría de estos microorganismos se aíslan en los primeros 3días de incubación siendo C. glabrata y Cryptococcus neoformans los patógenos que tienen crecimiento más lento; a pesar de ello, debido a la baja rentabilidad de este método diagnóstico en este proceso, se aconseja ampliar el tiempo de incubación de estos frascos si tras 5 días permanecen negativos y la sospecha clínica de fungemia es elevada12.
Un tema capital a la hora de establecer la importancia clínica de los hallazgos microbiológicos es lograr diferenciar entre contaminación e infección. El National Healthcare Safety Network de Estados Unidos define hemocultivo contaminado (falso positivo) como aquel en el que se aíslan especies propias de la microbiota comensal de la piel o propias del medio ambiente: estafilococos coagulasa negativa, otros microorganismos de baja o nula virulencia como Aerococcus spp., Micrococcus spp., Pronionibacterium acnes, la mayoría de las especies de los géneros Bacillus y Corynebacterium y algunos estreptococos del grupo viridans. Sin embargo, antes de considerar un aislamiento de estos microorganismos como contaminante, hay que analizar detenidamente las características clínicas del paciente y el número de hemocultivos en los que se aíslan ya que, en algunos casos, estos microorganismos pueden estar implicados en bacteriemias. En el caso de los niños, esta diferenciación es particularmente difícil porque habitualmente solo se realiza una extracción y, por tanto, deben extremarse las medidas para evitar la contaminación de los frascos; en caso de duda, se debe extraer una segunda muestra13. La detección de Staphylococcus aureus, Streptococcus pneumoniae, enterobacterias, Pseudomonas aeruginosa y Candida albicans traduce generalmente bacteriemia verdadera.
La interpretación óptima de los resultados de los hemocultivos positivos requiere del conocimiento de la situación clínica del paciente, su enfermedad de base, los factores predisponentes a la infección y, a poder ser, de los tratamientos antimicrobianos que le han sido administrados. Ello obliga a revisar la historia clínica de los pacientes, sobre todo hoy en día, en la que suele estar informatizada y ser de fácil acceso, siendo muy recomendable que exista una estrecha comunicación con el facultativo responsable del paciente con objeto de informar de los hallazgos de forma precoz y valorar conjuntamente el proceso. Para ello, deben establecerse cauces fluidos de comunicación utilizando los nuevos avances tecnológicos. Se ha demostrado repetidamente que la comunicación rápida de los resultados a grupos multidisciplinares que apliquen esa información al manejo del paciente de forma correcta hace que los resultados aportados desde el Servicio de Microbiología adquieran valor en el manejo clínico de estos procesos y mejoren su coste-eficacia; por tanto, es importante potenciar estos grupos en cada hospital y establecer cauces rápidos y eficaces de intercambio de información, utilizando todos los medios disponibles14.
Diagnóstico etiológico por procedimientos no basados en el cultivoLa mayoría de las técnicas disponibles se basan en la detección de ADN del microorganismo causante de la bacteriemia/fungemia. La ventaja de estas técnicas, además de la rapidez, es que son de gran ayuda cuando se trata de microorganismos no cultivables o de difícil crecimiento y cuando la toma de muestras se realiza después de instaurado el tratamiento antimicrobiano. Además, algunas permiten ofrecer información sobre la etiología del proceso y sobre la sensibilidad antibiótica del microorganismo implicado mediante la detección de algunos determinantes de resistencia. En contrapartida, son caras y necesitan una interpretación experta ya que miden la ADNemia en lugar de la bacteriemia y pueden poner de manifiesto ADN de bacterias no viables. Se ha de tener en cuenta que la sangre posee una gran cantidad de ADN humano respecto al bacteriano y puede presentar sustancias inhibidoras habituales (hemoglobina, heparina, etc.) que afecten a la eficacia de la reacción produciendo tanto resultados inválidos (por inhibición de la técnica de detección) como resultados falsamente negativos. Además, en lo que respecta al análisis de la sensibilidad de las técnicas moleculares, se ha de considerar el número de copias genómicas de un microorganismo presentes en una muestra, más que la determinación de la carga bacteriana en UFC/ml; este concepto también tendría en consideración el ADN de bacterias muertas o las capturadas por células fagocíticas circulantes. De acuerdo con esta opción, se estima que en un episodio de bacteriemia el número de copias genéticas circulantes sería entre 103 y 104 copias de ADN/ml de sangre, valor que estaría por encima del límite de detección de la mayoría de las técnicas de amplificación15.
La aplicación de la espectrometría de masas (matrix-assisted laser desorption ionization time-of-fligh [MALDI-TOF]) a la Microbiología Clínica ha supuesto una revolución en los protocolos de trabajo de los centros que disponen de esta tecnología. Este nuevo método puede ofrecer información sobre la etiología de forma precoz, pocos minutos después de realizarse la tinción de Gram y, por tanto, permite un ajuste precoz de la terapia antimicrobiana, especialmente si se dispone de la epidemiología local de la resistencia antibiótica del centro16.
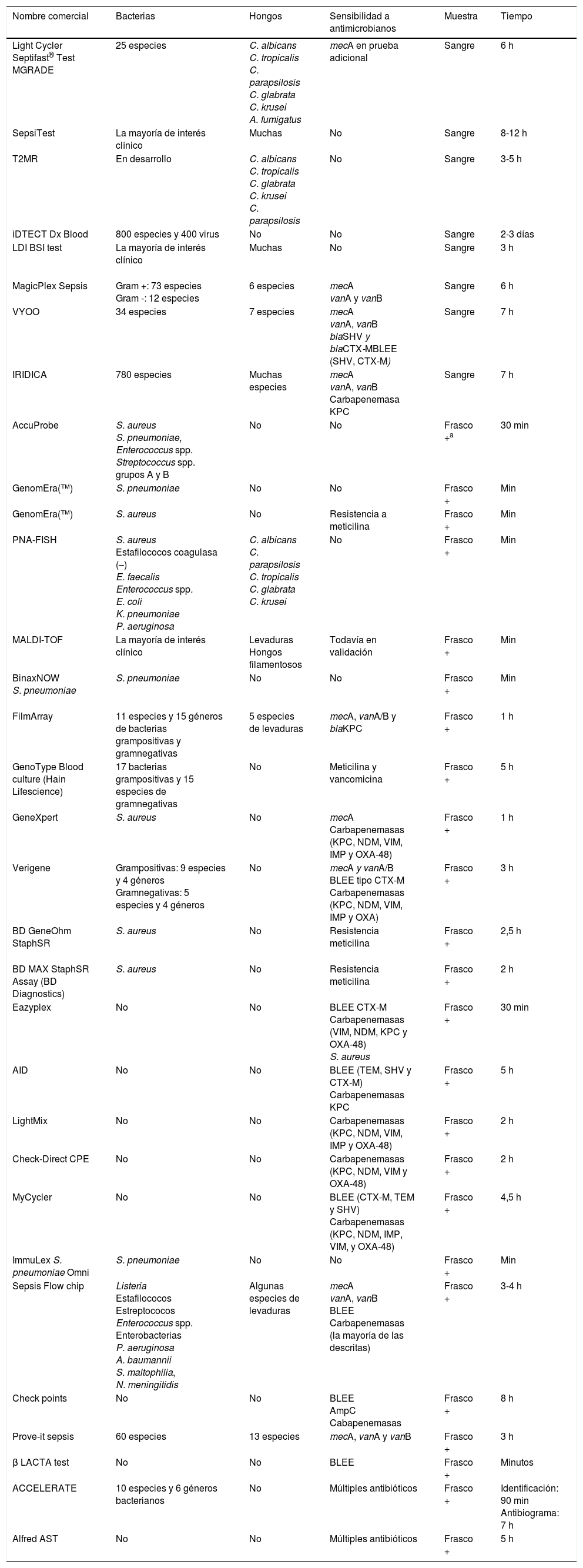
Existen 2grupos de técnicas: el primero está formado por aquellas que se aplican sobre frascos de hemocultivos positivos, con objeto de obtener información de forma más rápida que los métodos tradicionales basados en el cultivo. Estas técnicas están cada vez más extendidas por su gran utilidad en la práctica clínica habitual y su estrecha correlación con los métodos clásicos. Un segundo grupo de técnicas está formado por aquellas que se aplican directamente a partir de la sangre del paciente, con objeto de ofrecer información aún más precoz. Se dispone de menos experiencia con estas técnicas por lo que se utilizan menos en la práctica clínica habitual17 (tabla 2).
Sistemas comerciales disponibles para la detección de bacteriemia y fungemia
| Nombre comercial | Bacterias | Hongos | Sensibilidad a antimicrobianos | Muestra | Tiempo |
|---|---|---|---|---|---|
| Light Cycler Septifast® Test MGRADE | 25 especies | C. albicans C. tropicalis C. parapsilosis C. glabrata C. krusei A. fumigatus | mecA en prueba adicional | Sangre | 6 h |
| SepsiTest | La mayoría de interés clínico | Muchas | No | Sangre | 8-12 h |
| T2MR | En desarrollo | C. albicans C. tropicalis C. glabrata C. krusei C. parapsilosis | No | Sangre | 3-5 h |
| iDTECT Dx Blood | 800 especies y 400 virus | No | No | Sangre | 2-3 días |
| LDI BSI test | La mayoría de interés clínico | Muchas | No | Sangre | 3 h |
| MagicPlex Sepsis | Gram +: 73 especies Gram -: 12 especies | 6 especies | mecA vanA y vanB | Sangre | 6 h |
| VYOO | 34 especies | 7 especies | mecA vanA, vanB blaSHV y blaCTX-MBLEE (SHV, CTX-M) | Sangre | 7 h |
| IRIDICA | 780 especies | Muchas especies | mecA vanA, vanB Carbapenemasa KPC | Sangre | 7 h |
| AccuProbe | S. aureus S. pneumoniae, Enterococcus spp. Streptococcus spp. grupos A y B | No | No | Frasco +a | 30 min |
| GenomEra(™) | S. pneumoniae | No | No | Frasco + | Min |
| GenomEra(™) | S. aureus | No | Resistencia a meticilina | Frasco + | Min |
| PNA-FISH | S. aureus Estafilococos coagulasa (–) E. faecalis Enterococcus spp. E. coli K. pneumoniae P. aeruginosa | C. albicans C. parapsilosis C. tropicalis C. glabrata C. krusei | No | Frasco + | Min |
| MALDI-TOF | La mayoría de interés clínico | Levaduras Hongos filamentosos | Todavía en validación | Frasco + | Min |
| BinaxNOW S. pneumoniae | S. pneumoniae | No | No | Frasco + | Min |
| FilmArray | 11 especies y 15 géneros de bacterias grampositivas y gramnegativas | 5 especies de levaduras | mecA, vanA/B y blaKPC | Frasco + | 1 h |
| GenoType Blood culture (Hain Lifescience) | 17 bacterias grampositivas y 15 especies de gramnegativas | No | Meticilina y vancomicina | Frasco + | 5 h |
| GeneXpert | S. aureus | No | mecA Carbapenemasas (KPC, NDM, VIM, IMP y OXA-48) | Frasco + | 1 h |
| Verigene | Grampositivas: 9 especies y 4 géneros Gramnegativas: 5 especies y 4 géneros | No | mecA y vanA/B BLEE tipo CTX-M Carbapenemasas (KPC, NDM, VIM, IMP y OXA) | Frasco + | 3 h |
| BD GeneOhm StaphSR | S. aureus | No | Resistencia meticilina | Frasco + | 2,5 h |
| BD MAX StaphSR Assay (BD Diagnostics) | S. aureus | No | Resistencia meticilina | Frasco + | 2 h |
| Eazyplex | No | No | BLEE CTX-M Carbapenemasas (VIM, NDM, KPC y OXA-48) S. aureus | Frasco + | 30 min |
| AID | No | No | BLEE (TEM, SHV y CTX-M) Carbapenemasas KPC | Frasco + | 5 h |
| LightMix | No | No | Carbapenemasas (KPC, NDM, VIM, IMP y OXA-48) | Frasco + | 2 h |
| Check-Direct CPE | No | No | Carbapenemasas (KPC, NDM, VIM y OXA-48) | Frasco + | 2 h |
| MyCycler | No | No | BLEE (CTX-M, TEM y SHV) Carbapenemasas (KPC, NDM, IMP, VIM, y OXA-48) | Frasco + | 4,5 h |
| ImmuLex S. pneumoniae Omni | S. pneumoniae | No | No | Frasco + | Min |
| Sepsis Flow chip | Listeria Estafilococos Estreptococos Enterococcus spp. Enterobacterias P. aeruginosa A. baumannii S. maltophilia, N. meningitidis | Algunas especies de levaduras | mecA vanA, vanB BLEE Carbapenemasas (la mayoría de las descritas) | Frasco + | 3-4 h |
| Check points | No | No | BLEE AmpC Cabapenemasas | Frasco + | 8 h |
| Prove-it sepsis | 60 especies | 13 especies | mecA, vanA y vanB | Frasco + | 3 h |
| β LACTA test | No | No | BLEE | Frasco + | Minutos |
| ACCELERATE | 10 especies y 6 géneros bacterianos | No | Múltiples antibióticos | Frasco + | Identificación: 90 min Antibiograma: 7 h |
| Alfred AST | No | No | Múltiples antibióticos | Frasco + | 5 h |
Frasco +: frasco de hemocultivo con crecimiento bacteriano.
Los estudios fenotípicos para la determinación de la sensibilidad antibiótica realizados directamente a partir del frasco del hemocultivo positivo no están avalados por las recomendaciones de EUCAST, CLSI ni ASM pero muchos estudios han comunicado que hay una excelente correlación entre los resultados obtenidos a partir del hemocultivo positivo y los que ofrece el método de referencia, que realiza el antibiograma a partir de la colonia bacteriana aislada en medio sólido. La utilización de los nuevos sistemas automatizados de lectura continua en la mayoría de los Servicios de Microbiología podría facilitar la estandarización del inóculo. Con el sistema directo se disminuye el tiempo de respuesta en 24h pudiendo informarse la sensibilidad de la bacteria el mismo día de la positividad del hemocultivo. De todas maneras, se recomienda considerar los resultados preliminares y confirmar posteriormente estos con los métodos estandarizados18.
Otro abordaje interesante para ofrecer información preliminar es la utilización de placas de subcultivo con medios cromogénicos para la detección de S. aureus resistente a meticilina, enterococos resistentes a la vancomicina y enterobacterias productoras de betalactamasas de espectro extendido o de carbapenemasas. Estos medios tienen buena sensibilidad y especificidad, pero los resultados también tienen que ser siempre confirmados por los métodos estandarizados de estudio de la sensibilidad, por lo que en principio solo deberían utilizarse si la situación epidemiológica así lo justifica.
En relación con los métodos no basados en el cultivo que aportan información sobre la sensibilidad a antimicrobianos del microorganismo implicado en la bacteriemia a partir de hemocultivo positivo, están apareciendo nuevas tecnologías que deben ser validadas correctamente antes de que puedan ser aplicadas a la práctica clínica. En general, aportan resultados poco tiempo después de la visualización de la tinción de Gram y, por tanto, sus datos son muy útiles clínicamente. Con objeto de modular las peticiones y disminuir el gasto sanitario es importante que se hagan dentro de un contexto de comunicación constante con el grupo hospitalario multidisciplinar responsable del manejo de la bacteriemia/fungemia en cada centro19 (tabla 2).
ConclusionesEl diagnóstico rápido y correcto de la bacteriemia/fungemia debe ser una de las prioridades estratégicas de todos los Servicios de Microbiología Clínica y debe formar parte de un sistema multidisciplinar de manejo de estas enfermedades, instaurado en cada hospital de manera que todos los pacientes puedan beneficiarse de forma precoz de los resultados. Por otra parte, el diagnóstico rápido y correcto de estos procesos contribuirá a mejorar el uso de los antibióticos con lo que, además de una disminución del gasto sanitario, ayudará a controlar la resistencia a los antimicrobianos.
Deben ponerse en marcha las medidas necesarias para que se disponga de la mayor cantidad de información posible a poder ser en menos de 6 h tras la positividad del hemocultivo. Esta información debe ser transmitida de forma urgente al resto del equipo multidisciplinar para que realmente tenga repercusión clínica; de hecho, cuando se han aplicado sistemas rápidos y eficientes de comunicación, se ha demostrado que tienen incidencia sobre la evolución de los pacientes. En este sentido, es muy importante que se avance al modelo de atención continuada (24 h todos los días de la semana) de los Servicios de Microbiología, ya que actualmente está ampliamente demostrado el impacto del diagnóstico etiológico precoz en el pronóstico del paciente20.