La infección por el virus del papiloma humano (VPH) es la infección de transmisión sexual más frecuente en el mundo. Este virus ocasiona generalmente lesiones benignas, como verrugas genitales, pero también su persistencia ocasiona procesos malignos, como cáncer de cuello de útero (CCU) y, menos frecuentemente, anal, vaginal y de la cavidad orofaríngea. El CCU es una enfermedad muy severa, con alta mortalidad en muchos países. El cribado de CCU con citología ha tenido mucho éxito en estos últimos años, pero hay innumerable evidencia científica para que sea sustituida por la detección del VPH como prueba inicial. Para esto, hay en el mercado gran cantidad de técnicas, siendo aconsejable utilizar sistemas automáticos y pruebas aprobadas por la FDA. Un nuevo algoritmo basado en la detección individualizada de los genotipos 16 y 18 presentes en el 70% de los CCU ha sido propuesto por expertos y su implantación será inmediata en algunos países.
Infection with human papillomavirus (HPV) is the leading cause of sexually transmitted infection worldwide. This virus generally causes benign lesions, such as genital warts, but persistent infection may lead to cervical cancer, anal cancer, vaginal cancer, and oropharyngeal cancer, although less frequently. Cervical cancer is a severe disease with a high mortality in some countries. Screening with cytology has been very successful in the last few years, but nowadays there are numerous studies that confirm that cytology should be replaced with the detection of HPV as a first line test in population based screening. There are several commercially available FDA approved tests for screening of cervical cancer. A new strategy, based on individual detection of the high risk genotypes HPV16 and HPV18, present in 70% of cervical cancer biopsies, has been proposed by some experts, and is going to be implemented in most countries in the future.
El virus del papiloma humano (VPH) es un virus ADN perteneciente a la familia Papillomaviridae que origina la enfermedad de transmisión sexual más frecuente en todo el mundo. Generalmente se adquiere por vía sexual, pero también puede contraerse verticalmente de madre a hijo, por contacto con la mucosa cervical durante el parto, por vía transplacentaria y, menos frecuentemente, por transmisión horizontal durante la infancia1.
En España, la prevalencia en mujeres sexualmente activas en la población general alcanza el 14%, aunque puede variar según el grupo de edad estudiado y los factores de riesgo asociados. A partir de los 40 años la cifra es más baja, aproximadamente entre el 5 y el 6%2.
El VPH infecta específicamente las células basales del epitelio escamoso del cuello del útero, aprovechando la división celular activa de esta zona para su replicación. En la capa superior del epitelio se forman los típicos coilocitos, células multinucleadas y células con el núcleo aumentado de tamaño1. Estos cambios citopáticos son claramente visibles con la tinción de Giemsa o Papanicolaou (citología) en los cepillados cervicales, que es la muestra idónea para la detección del virus en relación con la patología cervical que ocasiona.
En la mayoría de los casos la infección por VPH es asintomática, transitoria y puede pasar desapercibida; en otros, las manifestaciones clínicas son muy diversas y comprenden desde simples verrugas y otros procesos benignos, hasta el desarrollo de neoplasias anogenitales tan severas como el cáncer de cuello de útero (CCU), el cáncer anal (CA), el cáncer de pene (PIN), el cáncer de vagina e incluso en otros sitios anatómicos distantes, como orofaringe y cavidad oral (CCO). En este momento hay suficiente evidencia científica para asegurar sin ninguna duda que la persistencia del ADN del VPH en la célula infectada es una condición indispensable para el desarrollo del cáncer.
Se han identificado más de 100 genotipos de VPH, y se estima que aproximadamente 40 de estos se pueden encontrar en el área genital y anal. Las manifestaciones benignas, condilomas y verrugas genitales están ocasionados por los genotipos no oncogénicos 6 y 11 (VPH6, VPH11). Estos mismos genotipos son los causantes también de la papilomatosis respiratoria recurrente (PRR), en la que, aunque de modo infrecuente, la recurrencia de papilomas en vías respiratorias puede conducir a la muerte en los niños y adolescentes que la padecen.
En el año 1983, después de muchas dudas y bastante controversia en la comunidad científica, zur Hausen et al.3 (1983) demostraron la implicación del VPH en la etiopatogenia del CCU implicando concretamente al genotipo 16 (VPH16). Un año más tarde aislaron el genotipo 18 (VPH18), que, junto con el VPH16, causan el 70% de los CCU en el mundo4. Precisamente por su grado de asociación con el CCU, los genotipos de VPH se clasifican en genotipos de «alto riesgo oncogénico» (VPH-AR), que comprenden los genotipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59; «probable/posible alto riesgo oncogénico» (VPH-PAR) (68, 26, 53, 64,65, 66, 67, 69, 70, 73, 82), y «bajo riesgo, no oncogénicos» (VPH-BR), siendo los más frecuentes entre estos últimos el VPH6 y el VPH115.
Existen en el mercado innumerables pruebas directas para la detección de la presencia del virus en muestras cervicales. La mayoría se basan en reacción en cadena de la polimerasa (PCR) a tiempo real, amplificación de señal o detección de la presencia del ARN mensajero de los oncogenes E6 y E7. Sin embargo, la Food and Drug Administration (FDA) ha aprobado únicamente 4 pruebas para su utilización en el cribado de CCU1. Casi todas están automatizadas, son muy reproducibles y tienen una elevada sensibilidad para detectar la presencia del virus en mujeres con lesiones premalignas. Por todo esto, en estos momentos hay acuerdo en que la prueba de VPH debe usarse como prueba inicial o «de primera línea» en el cribado de CCU en sustitución de la citología o tinción de Papanicolaou, tradicionalmente utilizada con este fin pero que se ha mostrado muy poco sensible y muy subjetiva en estudios comparativos. Asimismo, considerando que los genotipos VPH16 y VPH18 causan el 70% de los CCU4, todos los esfuerzos han sido dirigidos tanto a la prevención primaria de estos genotipos concretos (vacunas bi o cuadrivalentes añadiendo los VPH6 y VPH11) como a su detección con el genotipado selectivo o parcial (identificación individualizada de VPH16 y VPH18, además de otros VPH-AR), aconsejado en el cribado poblacional.
El CCU es la tercera neoplasia más frecuente en mujeres en el mundo, con algunas diferencias en la tasa de mortalidad según los países. En el África subsahariana la mortalidad alcanza hasta el 22,3% en la población femenina. En España se estima que cada año se diagnostican 2.511 casos nuevos y se producen unas 848 muertes, es decir, aproximadamente 2 mujeres cada día6. Estas cifras son extremadamente altas para una enfermedad totalmente prevenible hoy en día en cualquier país desarrollado.
Además, el VPH no solo origina una morbimortalidad alta en mujeres, sino que los procesos malignos asociados a este virus están aumentando en estos últimos años también en hombres, principalmente el CA, el PIN y el CCO. Así, los cánceres localizados en zonas genitales han aumentado su tasa anual en aproximadamente un 3% y los CCO en un 1%, alcanzando estos últimos una incidencia de 6,2 y 1,4 por 100.000 en hombres y en mujeres, respectivamente. Estas cifras pueden ser más altas en individuos infectados por el virus de la inmunodeficiencia humana (VIH), hombres que tienen sexo con hombres (MSM) e inmunodeprimidos, en general. Igualmente, el VPH16 es el genotipo prevalente tanto en CA como en CCO7. Los mismos criterios de cribado y vacunación aprobados para el CCU sirven también para el CA, aunque este terreno está menos estudiado y todavía no hay algoritmos validados para comprobar su eficacia.
En la infección por VPH también hay otros factores que conviene considerar, principalmente el impacto social en algunas etapas de la vida. El CCU produce una reducción en los años de esperanza de vida en la mujer estimada en 29 años, considerablemente mayor que en el cáncer de mama. Por otra parte, los adolescentes con lesiones benignas son altamente contagiosos. Por lo tanto, la realidad biológica es que la exposición a la infección y reinfección frecuente al VPH en jóvenes pueden tener consecuencias graves en la salud a largo plazo.
Aspectos virológicos. Virus del papiloma humano y oncogenesEl VPH pertenece a la familia Papillomaviridae, y es un virus que generalmente infecta la piel y las mucosas. Se han clasificado en VPH-AR y VPH-BR según su capacidad oncogénica5. Los VPH-BR únicamente ocasionan las verrugas y condilomas genitales y otras patologías benignas de piel y mucosas y la asociación con el CCU es bastante infrecuente, por lo que, desde el punto de vista clínico y de cribado, únicamente se deben detectar los VPH-AR.
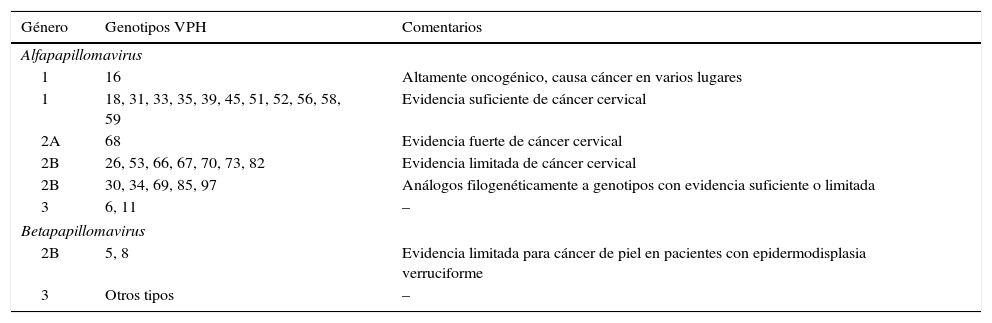
El grupo VPH-AR comprende los genotipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59 (tabla 1)5. El genotipo 68 se considera de «probable» riesgo oncogénico y el genotipo 66 previamente era considerado de alto riesgo, y por esta razón están incluidos en muchas de las pruebas de detección del ADN del VPH (prueba VPH) disponibles en el mercado.
Clasificación de los genotipos del VPH según su capacidad oncogénica4
| Género | Genotipos VPH | Comentarios |
|---|---|---|
| Alfapapillomavirus | ||
| 1 | 16 | Altamente oncogénico, causa cáncer en varios lugares |
| 1 | 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 | Evidencia suficiente de cáncer cervical |
| 2A | 68 | Evidencia fuerte de cáncer cervical |
| 2B | 26, 53, 66, 67, 70, 73, 82 | Evidencia limitada de cáncer cervical |
| 2B | 30, 34, 69, 85, 97 | Análogos filogenéticamente a genotipos con evidencia suficiente o limitada |
| 3 | 6, 11 | – |
| Betapapillomavirus | ||
| 2B | 5, 8 | Evidencia limitada para cáncer de piel en pacientes con epidermodisplasia verruciforme |
| 3 | Otros tipos | – |
Los VPH son virus pequeños, de aproximadamente 50-55nm de diámetro, sin envoltura y con una cápside icosaédrica formada por 72 capsómeros. Su genoma está constituido por ADN circular, de doble cadena, covalentemente cerrado, de un tamaño de 7.500-8.000pb. Este ADN se divide en: 1)una regiónE, de expresión temprana, que codifica diversas proteínas estructurales (E1-E7); 2)una región L, de expresión tardía, que codifica las proteínas de la cápside (L1 y L2), y 3)una región reguladora, no codificadora (RNC/LCR), situada en dirección 5′. La región temprana (E) representa un 50% del genoma; la tardía (L), un 40%, y la región reguladora (RNC/LCR), un 10%.
Relación entre virus del papiloma humano y cáncerEstá demostrado que en la mayoría de los casos la infección por VPH es una condición necesaria, si bien no única, para el desarrollo de la neoplasia intraepitelial cervical (CIN) y del cáncer. Esta asociación se basa en varios puntos8: 1)el virus es detectado en más del 97% de las CIN y carcinomas invasivos, principalmente los genotipos 16, 18, 31 y 45; 2)la infección por VPH tiene el mayor riesgo relativo para desarrollar lesiones premalignas, comparado con otros posibles factores de riesgo asociados, y la progresión de la lesión está relacionada con el tipo de VPH presente en la lesión; 3)el desarrollo de una neoplasia intraepitelial grado 3 (CIN3) está muy relacionado con la existencia anterior a 2años de una infección cervical crónica por VPH16 o VPH18, y 4)existe asociación entre VPH y carcinomas de vulva, vagina, PIN, CA y, en menor frecuencia, CCO, laringe, esófago y tracto respiratorio.
La integración del ADN del VPH en el cromosoma de la célula huésped está asociada con la progresión de CIN de alto grado a cáncer9. La integración aparece en la mayoría de los carcinomas invasivos pero es rara en lesiones premalignas y benignas. Formas integradas y episómicas pueden coexistir en la misma célula. Los puntos de inserción para la integración vírica en el genoma del huésped son múltiples y pueden afectar a distintos cromosomas, en proximidad a oncogenes celulares. El lugar de integración del genoma vírico está característicamente situado entre el final 3’ de E1 y el 5’ de E2, dando como resultado la rotura, pérdida o inactivación del ORF de E2 y la función de regulación de la replicación vírica que ejerce la proteína E2 sobre otras proteínas del virus. La integración puede también afectar a los genes E1, E4, E5, L1 y L2 pero nunca afecta a E6 y E7. La integración vírica no siempre es necesaria para la transformación maligna; así, algunas infecciones producidas por VPH-BR han sido asociadas a carcinoma de células escamosas, y en ellas el virus, manteniéndose episómico, había experimentado deleciones, mutaciones y amplificaciones en su genoma.
Otros factores endógenos asociados a la transformación maligna han sido identificados10. Los oncogenes celulares c-myc y c-ras pueden ser activados por la integración del ADN vírico en su proximidad. Esto es significativo, puesto que E7 puede cooperar en la activación de c-ras e inducir transformación celular in vitro. La metilación puede también alterar la función de los genes celulares y víricos. También se han detectado anormalidades genéticas en carcinomas cervicales afectando al cromosoma1, y pérdidas alélicas en el brazo corto de los cromosomas3 y 17 y en el largo del cromosoma11. Los genes supresores, como p53, pueden estar delecionados en el cromosoma17, y las proteínas E6 y E7 pueden inducir anormalidades cromosómicas in vitro. Algunos trabajos han asociado haplotipos HLA-DQ con cáncer cervical, sugiriendo un posible papel de factores inmunogenéticos.
Numerosos factores exógenos juegan un papel cooperador en la transformación maligna relacionada con el VPH. Entre ellas se incluyen las radiacionesX y UV, el tabaco, las hormonas esteroideas, las vitaminasA y D, los retinoides, los factores de crecimiento como el beta-TGF, los factores de crecimiento epidérmico y derivado de las plaquetas, citoquinas como el TNF y los interferones alfa y gamma, y virus tales como VIH y herpesvirus.
Proteínas oncogénicas del virus del papiloma humanoLas proteínas E1 y E2 están implicadas en la replicación vírica, formando un complejo esencial como activador transcripcional del genoma vírico11. E1 también contribuye al mantenimiento del virus en forma episómica y puede estar ausente cuando el ADN vírico permanece integrado.
La proteína E5 está unida a la membrana y participa en la transformación maligna de la célula. Sin embargo, su participación no es imprescindible, ya que a menudo el gen E5 se encuentra delecionado en células de cáncer de cérvix. Participa en el proceso de tumorigénesis interactuando con receptores de factores de crecimiento celular, incluyendo el receptor del factor de crecimiento epidérmico (EGF) y, en el caso de VPH-6, también con erbB2 y el receptor del factor de crecimiento de las plaquetas, interfiriendo en el proceso de endocitosis e inactivación de estos receptores. E5 también se une a una porina que participa en la bomba de protones endosómica, y su inactivación conduce a la inhibición en la acidificación del endosoma, incrementando la vida media del receptor EGF y favoreciendo la acción funcional del EGF de activación de los oncogenes c-fos y c-jun.
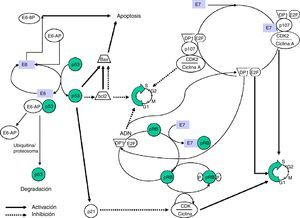
Las proteínas E6 y E7 juegan un papel central en la transformación maligna. Ambas se unen a factores celulares con diferente afinidad según el genotipo vírico, lo que permite distinguir entre proteínas con alta capacidad oncogénica (VPH-AR) de otras con escaso o nulo poder transformante (VPH-BR).
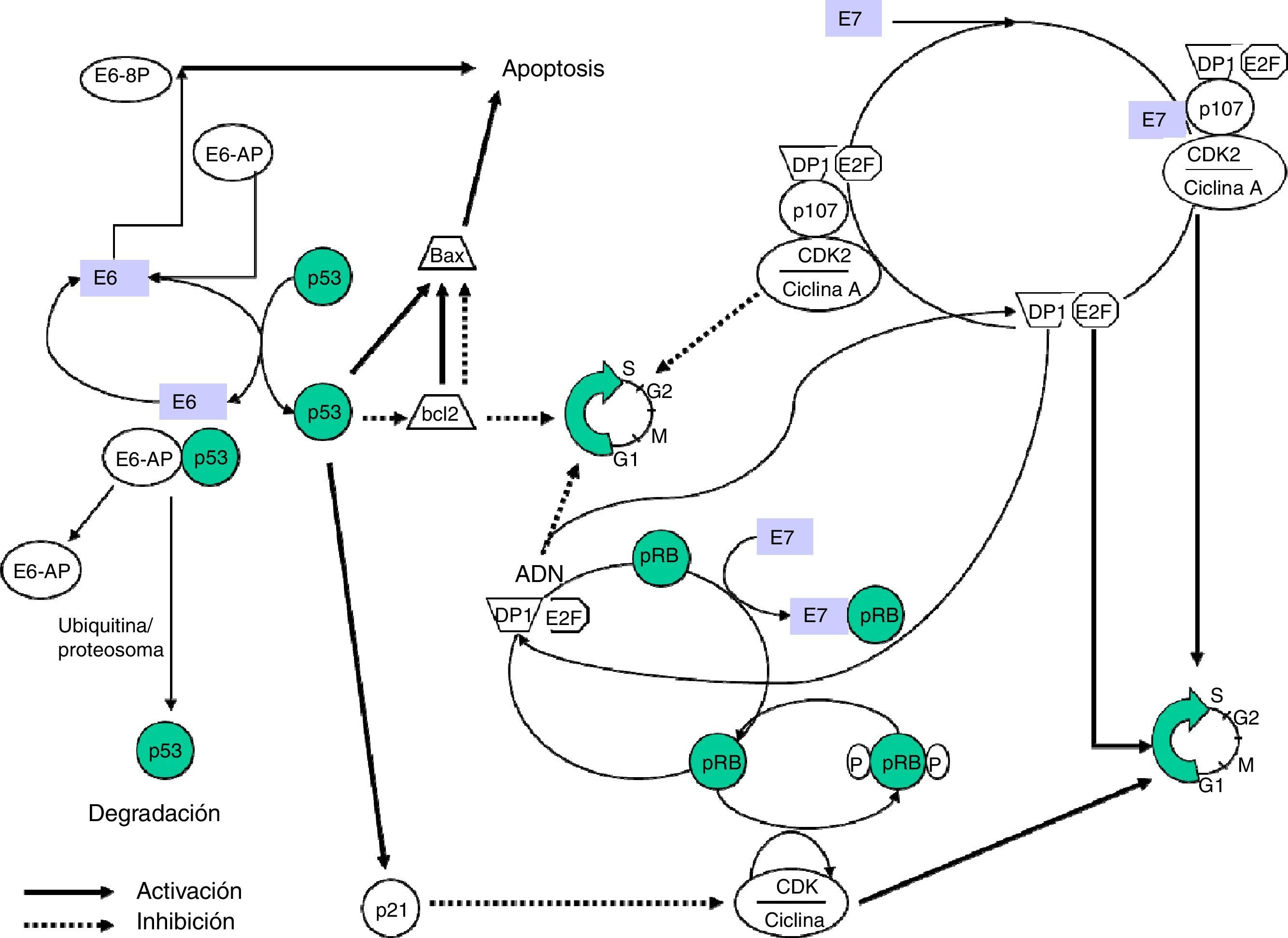
E6 es una proteína que se fija al ADN bicatenario. En combinación con una proteína asociada, la ubiquitinaligasa (E6-AP) se une a p5312, una proteína muy importante en la regulación del ciclo celular y que es acumulada en el núcleo durante la fase G1 del ciclo celular. Esta proteína detecta el ADN dañado y activa una serie de genes que inhibirán el progreso del ciclo celular o estimularán la apoptosis. La proteína p53 es degradada por el complejo E6-AP mediante mecanismos ligados a la ubiquitina. De forma resumida, consiste en una reacción en cadena en la que, tras la activación de la ubiquitina por la acción de la enzima E1, se une mediante una enzima conjugante (E2 o UBC) con la proteína diana, que a su vez está unida a la ligasaubiquitina-proteína (E3) y este complejo es reconocido por el proteosoma y conduce a la proteólisis. La E6-AP ligada a la oncoproteína E6 de VPH y a p53 funciona como una enzima E3 y facilita la degradación de la proteína diana, p53 en este caso, por el proteosoma. La p53 contribuye a detener el ciclo celular en fase G1, transactivando el gen WAF1/CIP1, cuya proteína p21 interactúa directamente con el complejo ciclina/kinasa dependiente de ciclinas/antígeno nuclear de células proliferativas, responsable de la fosforilación e inactivación de la proteína del retinoblastoma (pRB).
La inactivación de p53 no es el único mecanismo de carcinogénesis inducido por E613. Se ha observado que la presencia de E6 disminuye la capacidad de unión de p53 al ADN mediante mecanismos similares al utilizado por otras proteínas víricas oncogénicas, como la E1A de adenovirus y el antígeno T del virus SV40.
En cultivos celulares se ha comprobado la capacidad de E6 para inducir inestabilidad genómica, incluyendo aneuploidía y amplificación. También se ha comprobado que E6 puede unirse a la proteína c-Myc produciéndose una activación de la telomerasa transcriptasa inversa (hTERT). Esta enzima restaura los telómeros contribuyendo a la inmortalización de la célula14.
La proteína E6 puede también unirse a una proteína ligada al calcio, la reticulocalbina2 (E6-BP), asociada a fenómenos de apoptosis y diferenciación celular. E6 puede comportarse también como un regulador de la transcripción, y coopera, junto al oncogén ras activado, en la transformación de células de roedores primarias. La transformación de cultivos celulares infectados por mutantes víricos incapaces de degradar p53 ha demostrado que existen mecanismos alternativos capaces de malignizar la célula, por la activación de diversos factores de transcripción celulares (paxicilina, AP-1, hDLG, IRF-3, Myc, hMCM7, Bak y E6TP-1) y la activación de la telomerasa.
La proteína E7 altera la funcionalidad de la pRB (proteína del retinoblastoma), un producto del gen supresor de tumores Rb-1 que, al unirse al factor de transcripción EF-2 y su proteína asociada DP-1, frena el ciclo celular en la fase G1. La unión E7-pRB modifica e inactiva su función de control del ciclo celular colaborando en la transformación. También E7 puede unirse a las proteínas p107 y p130, con funciones similares a la pRB, provocando la misma acción. Del mismo modo que E6, E7 tiene actividad reguladora de la transcripción del oncogén ras en cultivos celular y en animales transgénicos (fig. 1).
La obtención de ratones transgénicos que expresan por separado las proteínas E6 y E7 ha permitido estudiar los efectos aislados de estas sobre la carcinogénesis, observándose que E7 induce tumores benignos, al contrario que E6, que produce la transformación maligna de la célula.
La detección de formas episómicas de VPH causantes de carcinoma de cérvix ha estimulado el estudio de otros factores que no impliquen la integración del virus en el cromosoma de la célula. Así, se ha demostrado que mutaciones en el lugar de fijación del factor de transcripción YY del segmento URR conducen a la progresión del cáncer cervical.
Historia natural. Formas clínicas de la infección por virus del papiloma humanoEl VPH es un patógeno que forma parte de la condición humana, está bien adaptado a infectar el epitelio y es tan frecuente su infección como para ser casi inevitable su relación con el hospedador. A diferencia de los virus que establecen enfermedades graves agudas, la infección por VPH es principalmente latente, subclínica y oportunista, con una reproducción y transmisión esporádica, encontrándose generalmente en un estado ecológico de equilibrio con el hospedador. En las mujeres, la infección por VPH se ha asociado principalmente a CCU, cáncer de vagina y de vulva. En muchos países industrializados la prevalencia de las infecciones por VPH en mujeres adultas jóvenes es tan alta como del 40 al 80% y la probabilidad de infectarse a lo largo de la vida de un 80-90%. La mayoría de estas infecciones desaparecen espontáneamente sin signos o síntomas clínicos. La historia natural de la infección por VPH y los primeros pasos de la carcinogénesis cervical son bien conocidos por estudios prospectivos.
El CCU es la etapa final —afortunadamente poco frecuente— de una infección en el cérvix no resuelta de VPH, en la que se mantiene la presencia persistente del ADN de VPH en muestras cervicales15. Esta persistencia (más de 2años) en el cérvix es el evento necesario para el desarrollo de CCU. La fracción de portadores persistentes de VPH en la edad media se estima en un rango del 4 al 10%, y estas mujeres son el verdadero grupo de alto riesgo para el CCU, y probablemente para cualquier otro tipo de cáncer relacionado con el VPH. Los factores endógenos y exógenos subyacentes que impulsan el proceso de persistencia de la infección aún no están claros. El tiempo que transcurre entre la infección por el VPH y la incidencia de cáncer es de 2 a 4 décadas16, por lo que el inicio de la infección y las lesiones precursoras del CCU son un objetivo apropiado para el cribado y la detección temprana.
En cuanto a los cánceres de la vagina y sus lesiones precursoras, el ADN del VPH se detecta en la mayoría de los casos. Entre el 60 y el 90% de los casos de cáncer vaginal y entre el 82 y el 100% de las lesiones vaginales catalogadas como neoplasia intraepitelial de grado 3 fueron VPH-ADN positivo. Igualmente se ha encontrado también ADN del VPH en los cánceres de la vulva, aunque la asociación de la infección por VPH con estos es menor, alrededor de un 40-50%.
En los hombres, a pesar de que la PIN es poco conocida, los datos revelan la participación del VPH, puesto que el ADN del VPH se encuentra en un tercio de los casos de PIN y en el 87,1% de las lesiones de alto grado17.
El CA es una patología que podemos considerar emergente desde que se asoció a la infección por VPH. Incide preferentemente en MSM, pero también en mujeres infectadas en el cérvix. En ambos sexos, el ADN del VPH se detecta en el CA (88-94%)18.
Por último, entre las patologías malignas asociadas al VPH se encuentran los CCO. En ellos, la prevalencia de ADN del VPH varía mucho según los diferentes estudios, la localización anatómica del tumor y la geografía, debido a factores exógenos y culturales propios. El hallazgo más consistente se refiere al cáncer de orofaringe, donde el ADN del VPH se ha encontrado entre el 35 y el 50% en los países desarrollados, en contraste con el resto de la cavidad oral, donde el ADN del VPH se encuentra en el 5 al 15% de los casos. También se ha confirmado la expresión del ARNm de E6/E7 y la integración del genoma vírico, y los modelos experimentales han mostrado la expresión de las proteínas oncogénicas E6/E7 como necesarias para la iniciación y el mantenimiento del fenotipo maligno de estos cánceres.
También la infección por VPH está asociada causalmente con enfermedades benignas como las verrugas, condilomas genitales y patología de las vías aéreas superiores como la PRR. Los genotipos VPH6 y 11 son la causa de ambos cuadros clínicos. La PRR se caracteriza por el crecimiento de múltiples papilomas, habitualmente en la región laríngea. La PRR puede manifestarse en la infancia temprana, con un inicio juvenil, o en la edad adulta, y es una enfermedad poco frecuente. El factor de riesgo más importante para la PRR juvenil es una historia materna de verrugas genitales en el embarazo, mientras que para la PRR del adulto lo son el número de parejas sexuales a lo largo de su vida y el sexo genital-oral. Muchas terapias han sido ensayadas para la PRR, con un éxito limitado y, a menudo, con efectos secundarios graves. Puede ser que la terapia más eficaz a largo plazo sea la que estimula una respuesta inmune eficaz y persistente mediante vacunación.
TransmisiónEl VPH es el agente responsable de una enfermedad altamente contagiosa que afecta a la especie humana debido a su comportamiento sociable. Los datos que tenemos en este momento indican que la transmisión del VPH entre parejas heterosexuales es extremadamente común, principalmente por contacto con la piel de la zona genital, pero también puede transmitirse por contacto con mucosas y fluidos biológicos. Se ha descrito algún caso también por compartir objetos sexuales.
También es común en la mujer la autoinoculación entre las regiones genitales y anales. Los estudios demuestran que las infecciones por VPH en la región anal en mujeres y en MSM son muy comunes, sobre todo en personas infectadas por el VIH. Del mismo modo, el aclaramiento del VPH anal es también común y pocos individuos muestran persistencia, a menos que estén infectados por el VIH. Este es un factor que influye fuertemente en el desarrollo del estadio precursor del cáncer invasivo anal.
Tener un alto número de parejas sexuales aumenta el riesgo de adquisición de infecciones por VPH. Otros factores de riesgo son no utilizar protección en el acto sexual —aunque se ha comprobado que utilizar preservativo no protege al 100%—, relaciones entre MSM y tener una disminución de la inmunidad.
EpidemiologíaLa prevalencia global de la infección por VPH en mujeres con citología normal es de alrededor del 11-12%, con las cifras mayores en África subsahariana (24%), Europa del Este (21%) y América Latina (16%). Las tasas máximas de prevalencia del VPH se observan en mujeres menores de 25años y con una disminución en las edades más avanzadas en muchas poblaciones, aunque algunas tienen un repunte secundario en la perimenopausia temprana o en las mujeres menopáusicas. En otras poblaciones, como en China, la prevalencia de VPH es relativamente independiente de la edad. La explicación de la diferencia en estos patrones de prevalencia y la importancia clínica no se comprende con certeza. Los 5 tipos de virus más frecuentes en todo el mundo son VPH16 (3,2%), VPH18 (1,4%), VPH52 (0,9%), VPH31 (0,8%) y VPH58 (0,7%), aunque estas estimaciones representan la prevalencia puntual y no acumulativa a la exposición y pueden estar subestimadas19.
En un estudio reciente se demuestra que aproximadamente el 85% de las lesiones CIN3, más del 70% de las neoplasia intraepiteliales de grado2 (CIN2) y la mitad de las lesiones intraepiteliales de grado1 (CIN1) están asociadas a infecciones por los tipos VPH6/11/16/18/31/33/45/52/58, de lo que se deduce que una vacuna nonavalente protegería de la mayoría de las infecciones oncogénicas.
La prevalencia aumenta en mujeres con patología cervical en proporción directa con el nivel de evolución de la lesión determinada por citología, alcanzando alrededor del 90% en mujeres con CIN3 y CCU. Las investigaciones retrospectivas han demostrado que en casi el 100% de todos los CCU se encuentra el VPH.
El CCU es el cuarto cáncer más común en las mujeres y el séptimo en general, con una estimación de 528.000 nuevos casos en 2012 y de 609.000 para 2020. Al igual que con el cáncer de hígado, una gran mayoría (alrededor del 85%) de los casos se producen en las regiones menos desarrolladas, donde representa casi el 12% de todos los cánceres que afectan a la mujer. Las regiones de alto riesgo, con una tasa estandarizada por edad superior a 30 por 100.000, incluyen el este de África (42,7), Melanesia (33,3), sur de África (31,5) y África central (30,6). Los índices más bajos están en Australia/Nueva Zelanda (5,5) y Asia occidental (4,4). En España, en 2012 hubo 2.511 nuevos casos, y las estimaciones para 2020 son de 2.710; en cuanto a la mortalidad, en 2010 se produjeron 848 muertes, estimándose que en 2020 se producirán 94920.
Recogida, transporte, conservación y manejo de las muestrasRecogida de la muestraLa muestra adecuada para la detección de VPH es el cepillado o la biopsia —dependiendo de la localización—, recogida habitualmente en medio líquido, en recipientes estériles de cierre hermético.
Los cepillos utilizados serán estériles y de material inerte. Se evitarán materiales naturales como el algodón o el vástago de madera, pues podrían inhibir la PCR. También hay que recordar que deben rechazarse las muestras con más de un 2% v/v de sangre, dado que la hemoglobina podría inhibir la PCR.
El cepillado cervical se tomará con un cepillo específicamente diseñado para la recolección de células del canal cervical (cepillo endocervical o citobrush). Se introduce en las dos terceras partes del canal endocervical y se rota suavemente entre 90 y 180 grados o 5 veces en el sentido de las agujas del reloj. Si se visualizan lesiones en exocérvix, se tomará muestra de dicha región. Se evitarán tomas de muestra con sangre, dado que la hemoglobina puede inhibir la PCR. A continuación debe introducirse el cepillo en un medio de transporte líquido. Si el cepillo se puede cortar fácilmente o si desprende el cabezal, se dejará en su interior. En otro caso, se frotará unas 10 veces contra el fondo del vial con el medio de transporte y se desechará.
La muestra de orina en la mujer, aunque es muy fácil de tomar, ha mostrado una sensibilidad inferior, y por esto no se recomienda para el cribado de CCU.
El cepillado anal, tanto en mujeres como en hombres, se hará de varias zonas tomadas al azar.
En el varón, la muestra genitourinaria recomendada por la mayoría de los autores es la triple toma en glande, surco coronario y uretra distal (introduciendo los tres cepillos en un mismo vial). Se pueden utilizar cepillados, orina y semen, pero los resultados son peores.
También pueden recogerse cepillados de otras localizaciones para detectar la presencia de VPH, pero no se ha establecido el valor predictivo positivo o negativo de tales determinaciones: cepillado de amígdalas, interior de la boca y bordes de la lengua, o enjuagues bucales con soluciones antisépticas comerciales en el caso del diagnóstico de infección oral. Debe aclararse que la detección de VPH en la cavidad oral no debe utilizarse como cribado de cáncer orofaríngeo. En este caso, la biopsia extraída en el momento del tratamiento quirúrgico de la lesión es la muestra adecuada para la detección de VPH y hay que señalar que es especialmente útil. Dado que el pronóstico es diferente según se detecte o no el VPH, el resultado de la prueba ayudará a decidir la duración y la dosis del tratamiento quimio y radioterápico más adecuado.
En ciertos contextos clínicos la biopsia de verrugas podría ser útil (por ejemplo, verrugas resistentes al tratamiento tópico o de lesiones verrugosas de dudosa etiología y que precisan extracción quirúrgica). Se enviarán en un bote estéril sobre una gasa con un fondo de solución salina o en medio líquido. Debe evitarse el formol, puesto que podría inhibir la PCR. En caso de que sean biopsias parafinadas, podrán extraerse tras desparafinado con una solución indicada para tal uso.
Habitualmente se recomienda la utilización de los medios líquidos (medios de citología líquida) en los que se ha evaluado cada técnica comercial y que en ciertas ocasiones son los únicos viales reconocidos por los aparatos automáticos de extracción/PCR. El de uso más extendido es Thin Prep® PreservCyt® Solution (Hologic Inc., Marlborough, MA, EE.UU.). BD SurePath™ (BD Diagnostics) es otro medio de citología líquida que, a diferencia del anterior, contiene formalina. Esto promueve la unión del ADN del VPH a las proteínas, lo que puede provocar una fragmentación de dicho ADN interfiriendo con su amplificación y, por lo tanto, reduciendo la sensibilidad analítica. Como consecuencia, debe realizarse un pretratamiento de las muestras de SurePath™ antes de la detección de VPH.
Se podrían utilizar otros medios líquidos adecuados para PCR, como buffer TE pH 8.0 grado biología molecular. Aunque no existen muchos estudios que hayan comparado el efecto de la utilización de diversos medios de transporte líquidos, ciertos autores han concluido que el resultado no está influido por los medios de trasporte sino por la sensibilidad analítica de las pruebas utilizadas.
Transporte y conservación de la muestraPreviamente a la toma de muestra, los viales de citología líquida se mantendrán a temperatura ambiente. Las muestras se cerrarán herméticamente, se etiquetarán con el nombre de paciente y se acompañarán de una petición con datos clínicos. El transporte de las muestras debe realizarse lo antes posible al laboratorio de microbiología a temperatura ambiente.
Manejo de la muestra en el laboratorioDado que no es una determinación urgente, las muestras se procesarán en grupos de mayor o menor tamaño según el sistema a utilizar. Sin embargo, el ADN —y sobre todo el ARNm— pueden degradarse tras repetidos ciclos de congelación y descongelación, por lo que siempre se recomienda no congelar, mantener la muestra en nevera y demorar lo menos posible su procesamiento. De forma general los medios de transporte se deben mantener un máximo de 4-6 semanas a temperatura ambiente (15-30°C) antes de su procesamiento. Los extraídos de ácidos nucleicos se deben mantener a −20°C.
Las biopsias se machacarán para la posterior extracción de ácidos nucleicos y se congelarán a −20°C.
Las muestras muy mucosas se pueden homogeneizar previamente con ayuda de bolitas de vidrio estériles y vorteado previo a la extracción tomando las precauciones necesarias para evitar contaminaciones.
Una adecuada carga de trabajo, entrenamiento del personal y frecuencia en la determinación de PCR darán mayor fiabilidad a los resultados.
Técnicas comerciales de detección del virus del papiloma humanoExisten en el mercado más de 125 técnicas comercializadas para la detección de VPH, con más de 84 variantes de las mismas, y se incrementa anualmente la oferta en aproximadamente un 20%. Se trata de uno de los grupos de técnicas diagnósticas más numerosos, pero también es el menos regulado. En general, se puede utilizar cualquier técnica que esté validada para el uso indicado, que se elegirá dependiendo de la capacidad de procesamiento, del entrenamiento del personal y de la organización general del laboratorio, pero es muy recomendable que se utilicen técnicas automatizadas, aprobadas por la FDA, por las ventajas que suponen en cuanto a la estandarización y el control de calidad que ofrecen.
Validación clínica y marcado FDA para su uso en cribadoCualquier nueva tecnología que se vaya a aplicar en el diagnóstico de cáncer en general debe demostrar en ensayos clínicos controlados y aleatorizados que su uso disminuye la incidencia de cáncer invasivo a lo largo del tiempo. La detección de ADN del VPH lo ha demostrado con datos de 8años de seguimiento de pacientes incluidas en 4 ensayos europeos.
Debido a que no es viable realizar ensayos controlados aleatorizados longitudinales con todas las pruebas de VPH que se comercializan, un comité internacional de expertos21 propuso en el año 2009 que cualquier prueba debe ser al menos tan precisa como las técnicas utilizadas en dichos ensayos (gold standard: PCR GP5+/GP6+ y captura de híbridos) y muy reproducible para poder utilizarla en el cribado primario de CCU en mujeres de 30años o más En concreto son unos criterios de validación basados en la sensibilidad y la especificidad clínicas, es decir, sensibilidad y especificidad para la detección de lesiones cervicales. Debe demostrar sensibilidad y especificidad relativas al gold standard ≥0,90 y ≥0,98, respectivamente. Una sensibilidad muy elevada se traducirá en un valor predictivo negativo (VPN) muy alto del test, permitiendo la ampliación de los intervalos de cribado en mujeres con resultado negativo, que son la mayoría de las participantes en un programa de cribado. Como contrapartida, dada la baja prevalencia de lesiones premalignas esperables en dicho programa, mínimos descensos de especificidad supondrán resultados falsos positivos que tendrían repercusiones importantes en el aumento de seguimientos ginecológicos innecesarios y los costes asociados. Estos estudios de no inferioridad suelen realizarse con la ayuda de laboratorios de referencia donde también se evalúa la reproducibilidad intralaboratorio y la concordancia interlaboratorio.
Por otra parte, el proyecto VALGENT (Validación de Test de Genotipado de VPH22) es una red internacional y un foro de validación de ensayos de genotipado de VPH. Lleva a cabo la recolección de 1.300 muestras de citología cervical que proporciona un gran laboratorio europeo con capacidad suficiente en su biobanco. Entre estas muestras se incluye un número suficiente de citologías con lesiones premalignas y también citologías normales para poder calcular la especificidad y la sensibilidad de la prueba de VPH en cribado primario. Los informes generales de las evaluaciones se publican en una lista donde aparece claramente si cumple o no los umbrales para su uso en la práctica clínica. El estudio VALGENT permitirá a los organizadores de programas de cribado realizar las mejores decisiones respecto a qué test será más conveniente utilizar.
Asimismo, para conseguir la aprobación FDA, una prueba debe establecer su sensibilidad y especificidad clínica mediante estudios prospectivos llevados a cabo en 3 o más lugares diferentes que son evaluados por varias comisiones en un proceso largo y costoso. También debe probar su reproducibilidad, la ausencia de reactividad cruzada, contaminación y arrastre, y que dichas características se mantienen a lo largo del período de almacenamiento máximo considerado por el fabricante.
A continuación se describen brevemente las técnicas aprobadas por la FDA (tabla 2). Las 4 están validadas clínicamente para cribado primario y además poseen aprobación FDA para triaje de ASCUS. Hay que señalar que solo una técnica en la actualidad está aprobada para el cribado primario basado en detección de VPH (Cobas® HPV Test). Ninguna la posee actualmente para control postratamiento de cáncer cervical, diagnóstico de CA, detección en varón o en orofaringe.
Indicaciones clínicas de las técnicas VPH-AR aprobadas por la FDA
| Sistemas comercializados | FDA: indicación aceptada | Automatización Nombre (n.° muestras/tiempo) |
|---|---|---|
| Captura híbridos (Qiagen) | • Cribado VPH+citología > 30 años • Triaje ASC-US | No |
| Cervista (Hologic) | • Cribado VPH+citología > 30 años • Triaje ASC-US | MTA (96/8h) HTA (500/8h) |
| Cobas 4800 HPV (Roche Diagnostics) | • Cribado VPH ≥ 25 años • Cribado VPH+citología > 30 años • Triaje ASC-US ≥ 21 años • VPH16/18 en ASC-US ≥ 21 y ≥ 30 años | COBAS 4800 (282/8h) |
| Onclarity™ HPV (BD) | • En curso | Viper™ LT (120/8h) |
| Aptima (Hologic) | • Cribado VPH+citología ≥ 30 años • Triaje ASC-US ≥ 21 años | Panther (240/8h) |
En todas las pruebas aprobadas por la FDA se ha utilizado el medio de transporte Thin Prep® PreservCyt.
Es la primera prueba aprobada por la FDA (marzo del 2003) para la detección de los genotipos carcinogénicos del VPH, siendo el método más evaluado en la literatura. Es una técnica de amplificación de la señal que utiliza un cóctel de sondas de alto riesgo que, en la última versión, incluye 13 tipos de VPH (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68), y otro para el grupo de bajo riesgo que incluye los genotipos 6, 11, 42, 43 y 44, por lo que detecta cualquiera de estos genotipos en 2 únicas reacciones, si bien en el cribado de CCU solo se deben detectar los VPH-AR. No discrimina el genotipo presente. Tiene algunas limitaciones, como la reactividad cruzada con algunos genotipos de VPH-BR que ocasiona resultados falsos positivos.
Cervista HPV HR® (Hologic)En el año 2009, la FDA aprobó las pruebas Cervista® HPV HR y Cervista® HPV16/18 para su uso en el cribado de CCU. Es una técnica de amplificación de señal con tecnología Invader. Consta de 2 reacciones isotérmicas: la primera se produce en la secuencia del ADN del VPH y la segunda produce una señal fluorescente. Incluye un control interno, el gen de la histona human2. El resultado informa de la presencia de alguno de los 14 genotipos VPH-AR pero no los detecta de manera individualizada. Cervista HPV 16/18 identifica los VPH16 y VPH18 individualmente.
Cobas® HPV Test (Roche Diagnostics)El sistema Cobas 4800 (Roche Diagnostics, Mannheim, Alemania) es un sistema totalmente automatizado compuesto por el CobasX, el termociclador Cobas Z y el software necesario para la realización de una PCR a tiempo real con primers de la región L1 del VPH. Se pueden procesar tandas de 22 hasta 94 muestras y es capaz de realizar 1.344 pruebas en 24h utilizando viales primarios. Los resultados aparecen diferenciados en 4 canales: VPH16, VPH18, otros VPH-AR no16,18 (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 66) y beta-globina, que se utiliza como control interno en cada muestra. Tiene una alta sensibilidad clínica y se ha evaluado en estudios multicéntricos en Europa23 y en Estados Unidos (estudio ATHENA)24 con gran concordancia con los resultados obtenidos por otras técnicas de referencia. Es de destacar que en los resultados positivos no se han observado reacciones cruzadas con VPH-BR. La reproducibilidad y el grado de automatización son muy elevados. Por todas estas características es uno de los sistemas totalmente automáticos más extendidos y preferidos para cribado de CCU.
Aptima HPV Assay® (Hologic)Aptima® detecta la presencia de ARNm de los oncogenes E6 y E7 de 14 genotipos. Utiliza la tecnología TMA y detección de los productos amplificados por hibridación. Se puede realizar en la plataforma automatizada Panther. En caso de utilizar ThinPrep®, la muestra debe transferirse a unos tubos específicos. No realiza genotipado parcial, pero ya existe un prototipo que identifica VPH16 y VPH18/45. No posee control de celularidad humana. En los estudios publicados, este método ha demostrado ser tan sensible como las pruebas que detectan ADN del VPH con una especificidad mayor, lo que resulta prometedor. Los datos del ensayo clínico aleatorizado realizado con este test de detección de ARNm se han analizado a 3años. Sin embargo, debe esperarse a la demostración del bajo riesgo de >CIN3 tras un resultado negativo de ARNm a lo largo de un período de tiempo mayor para que no quepa ninguna duda de su utilidad en el cribado de cáncer cervical a intervalos de 5años o más.
CalidadEl laboratorio de microbiología donde se realice la prueba VPH debe tener unos requerimientos imprescindibles22 así como una infraestructura adecuada y el seguimiento de las directrices de buenas prácticas de laboratorio y de procedimientos considerados estándar. También es recomendable la acreditación del laboratorio para pruebas moleculares clínicas, así como la participación en evaluaciones intra e interlaboratorio regulares.
En los laboratorios que desde hace años procesan un elevado número de pruebas de biología molecular para el diagnóstico de diversos patógenos, estos requerimientos de calidad suelen cumplirse fácilmente pues se dan unas condiciones adecuadas de manejo e instalaciones para evitar contaminaciones. Asimismo se aplicarán las precauciones generales para el manejo de sustancias infecciosas comunes a todos los servicios de microbiología.
En el aseguramiento de la calidad es importante el control de calidad interno, la evaluación externa de calidad y la mejora continua de calidad. La red de laboratorios de VPH de la OMS (WHO HPV LabNet) ha establecido, entre otros, el primer estándar internacional de ADN de VPH16 y VPH18. También lidera periódicamente estudios de evaluación de genotipado donde considera un test adecuado si detecta 50UI de VPH16 y VPH18, así como 500 equivalentes de genoma de los otros 12 tipos incluidos en el panel tanto en coinfección como en monoinfección. Para considerar una prueba como adecuada también deberá tener una tasa cero de falsos positivos. Aunque es un control para validación analítica de pruebas de genotipado, no se descarta que en un futuro elaboren un panel para la evaluación de pruebas de cribado. Otros controles de calidad externos destacables son UKNEQAS (Plan de Evaluación Nacional de Calidad Externo del Reino Unido) y QCMD (Control de Calidad Europeo para el Diagnóstico Molecular).
RetosEl primer reto debe ser utilizar solo pruebas validadas clínicamente o con la marca FDA para el cribado de CCU. También debemos tener en cuenta las discordancias de especificidad y sensibilidad entre las diferentes pruebas cuando se utilizan en programas de cribado, incluso cuando se comparan pruebas comerciales totalmente automatizadas y con marca FDA25.
Se deben utilizar pruebas con alta sensibilidad y especificidad clínica y totalmente evaluadas, siendo también aconsejable que estén totalmente automatizadas a un precio razonable.
Otro reto importante es conseguir evidencia científica en poblaciones vacunadas, pues todos los estudios de sensibilidad y especificidad del cribado se han hecho con población no vacunada. El rendimiento de las pruebas diagnósticas podría variar en el cribado de población vacunada.
Mejorar la especificidad de la prueba VPH es uno de los objetivos a cumplir en los próximos años, puesto que debido a la elevada prevalencia de infección por VPH en menores de 30años, la detección de VPH no puede utilizarse para cribado de mujeres menores de esta edad.
Por último, sería muy útil desde el punto de vista clínico disponer de criterios de validación para poder predecir el riesgo de recaída de lesiones premalignas en los primeros 2años postratamiento. Este riesgo es alto, aproximadamente del 8%, y la sensibilidad de las diferentes pruebas de VPH en la predicción de este fracaso puede variar ampliamente26.
Cribado de cáncer de cuello de úteroHay un acuerdo unánime entre los expertos en que el cribado de CCU debe ser poblacional, puesto que el cribado oportunista cuyo único fin es solucionar un problema individual a la mujer que lo demanda se ha mostrado totalmente «ineficaz, ineficiente y no equitativo»27. El objetivo principal del cribado de CCU es descartar la presencia de lesiones premalignas en la población de mujeres sanas, pero además otro segundo objetivo, también muy importante, es detectar a las mujeres con lesiones de neoplasia cervical intraepitelial grado2 o lesión más severa (>CIN2) según la clasificación de Bethesda28, para iniciar su tratamiento. Conviene recordar que las lesiones cervicales se pueden definir como lesiones leves (CIN1), moderadas (CIN2) o severas (CIN3).
Utilización de la prueba del virus del papiloma humano en el cribado de cáncer de cuello de úteroLas ventajas más importantes de la prueba VPH son las siguientes: a)tiene un VPN muy alto, cercano al 100%. Esto quiere decir que si el resultado de la prueba es negativo, esta mujer tiene casi nula probabilidad de desarrollar lesiones premalignas en un periodo mínimo de 5años. Con esto se limitarían el número de rondas de cribado a 5-7 según la edad de inicio o los protocolos adoptados por los distintos países; b)tiene una altísima sensibilidad, mucho mayor que la de la citología; c)es muy reproducible y menos subjetiva, puesto que a veces el resultado de la citología está influido por la experiencia del citólogo que la examina; d)está totalmente automatizada, por lo que se pueden procesar elevado número de muestras con fiabilidad de los resultados, y e)la influencia en el coste también es importante, según los estudios realizados.
Por todas estas razones, no hay duda en este momento de que la prueba de VPH debe sustituir a la citología como prueba inicial en el cribado de CCU. Pero también hay que considerar que el punto débil de la prueba VPH es su especificidad, ligeramente menor que la de la citología. Como consecuencia, en el caso de obtener un resultado positivo en la prueba inicial de detección de VPH se necesita una segunda prueba, llamada de triaje, con el objetivo de estratificar a las mujeres según el riesgo de sufrir lesiones premalignas en los próximos años. El objetivo de esta prueba de triaje es ahorrar colposcopias y tratamientos innecesarios a aquellas mujeres con citología negativa y VPH positivo, ya que tienen un riesgo mínimo de padecer CCU en los próximos años. La prueba de triaje que se aconseja en la Guía de la Sociedad Española de Obstetricia y Ginecología es la citología, y es la que se ha estado utilizando en Holanda y en todos los países con más experiencia y mayor efectividad en los cribados de CCU. Sin embargo, recientemente se han publicado varios estudios evaluando otras opciones con muy buenos resultados, como el genotipado parcial (detección separada de los genotipos 16 y 18) o la tinción dual, si bien esta última necesita aún más estudios que avalen los buenos resultados obtenidos.
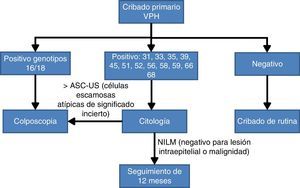
Algoritmo de cribado basado en el genotipado parcial de virus del papiloma humanoLa elección del genotipado parcial del VPH como prueba de triaje a partir de un resultado positivo en la prueba de detección del VPH es una consecuencia de la importancia que tiene la persistencia de los genotipos VPH16 y VPH18 en el desarrollo de las lesiones premalignas. Uno de los primeros estudios fue el de Khan et al.29, en el que se comprobó que la incidencia acumulada de lesiones >CIN3 a los 12años de seguimiento es del 20% cuando se detecta el VPH16, del 15% cuando está presente el VPH18 y únicamente del 2% si el resultado es positivo para otros genotipos VPH-AR no16,18. Un segundo estudio muy reciente con similares conclusiones es el ATHENA24, cuyo objetivo principal fue la aprobación del sistema Cobas 4800 por la FDA para su uso en el cribado poblacional de CCU. En este estudio realizado en Estados Unidos se incluyeron 42.209 mujeres sanas y en sus conclusiones claramente se confirma la importancia de detectar en los cepillados cervicales la presencia de los genotipos 16 y 18 y distinguirlos de otros VPH-AR no16,18. Los resultados más concluyentes fueron que las mujeres con citología negativa pero con un resultado positivo a VPH16 o VPH18 tienen un riesgo absoluto estimado en los próximos 3años de presentar lesiones premalignas, neoplasia intraepitelial grado3 o más severas (>CIN3) del 9,8%; en cambio, si los genotipos presentes son VPH-AR no16,18 el riesgo estimado disminuye al 2,4%.
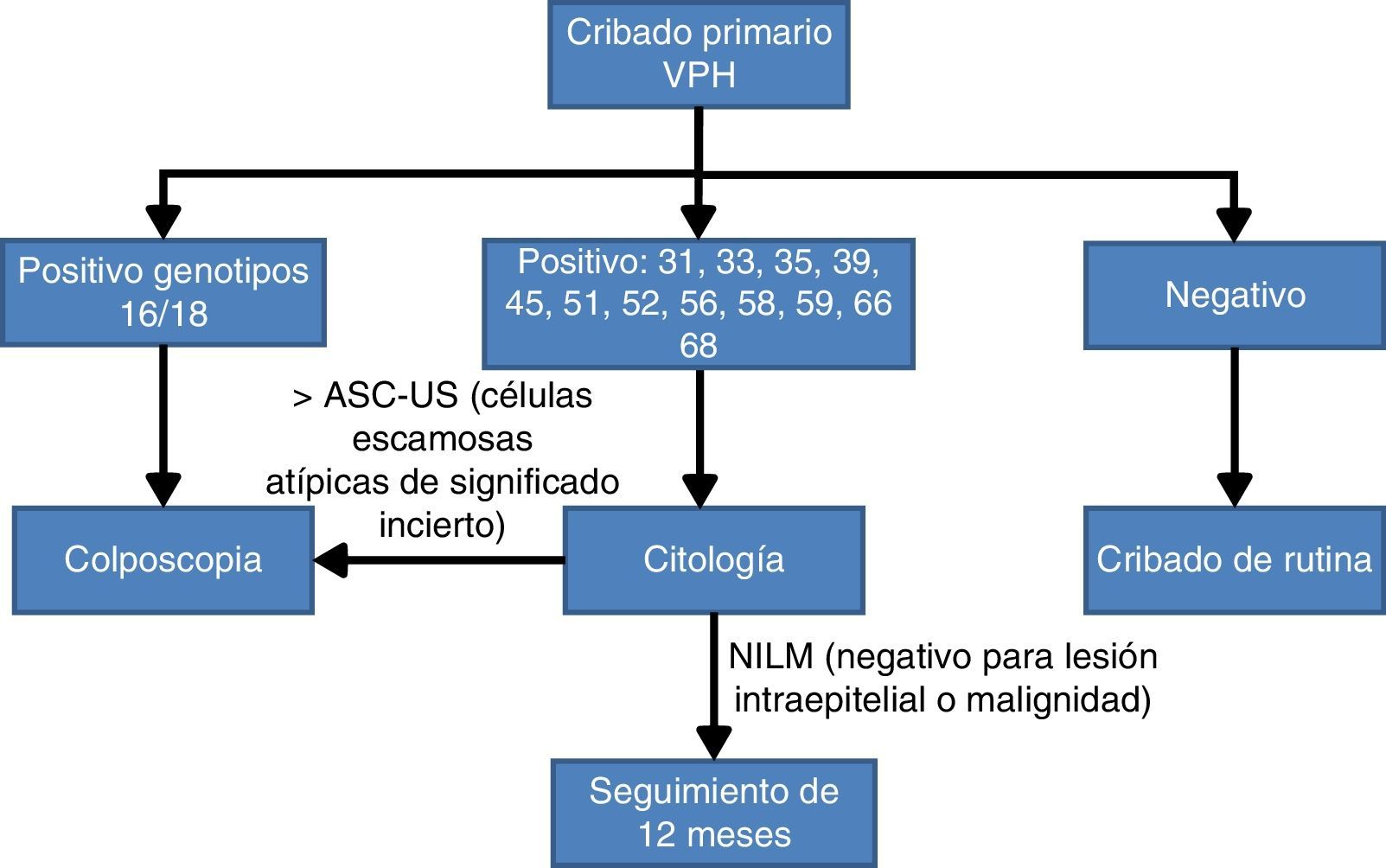
Teniendo en cuenta la evidencia científica comentada anteriormente sobre la importancia de conocer si los VPH16 y VPH18 están presentes en el cuello del útero, recientemente un panel de expertos30 ha llegado a un acuerdo de algoritmo de cribado de CCU basado en la prueba VPH con genotipado parcial como prueba inicial. Las mujeres con resultado positivo para los genotipos más oncogénicos, VPH16 o VPH18, se estudiarán directamente con colposcopia; en cambio, si están infectadas por otros VPH-AR, la citología se utilizará como test de triaje para el seguimiento a los 12meses si el resultado es negativo para lesión intraepitelial o malignidad (NILM) o monitorización con colposcopia (fig. 2).
Algoritmo de cribado poblacional basado en el genotipado parcial30.
Este algoritmo parece cumplir con los requisitos de ser «aceptable, efectivo, eficiente y basado en la evidencia científica actual», tal como las autoridades sanitarias proponen que debe ser un cribado de CCU.
Situación del cribado de cáncer de cuello de útero en EspañaEn nuestro país no existe un plan de cribado de CCU a nivel nacional, dando por resultado una situación que podríamos calificar de caótica. En un informe del Sistema Nacional de Salud sobre la situación del cribado de CCU en España en el año 2014 (Informe de situación del cribado de cáncer de cérvix en España 2014, Ministerio de Sanidad, Servicios Sociales e Igualdad; www.cribadodecancer.es/images/archivos/PAISVASCO2015/28) se pone de manifiesto que:
- -
El cribado es oportunista en 16 comunidades autónomas y en 2 ciudades autónomas.
- -
La prueba primaria de cribado utilizada mayoritariamente es la citología, aunque se va implantando progresivamente la prueba VPH, que ya se usa como cribado primario en 6 comunidades autónomas (cotest) y en una como prueba inicial.
- -
Los programas autonómicos de cribado se encuentran en proceso de revisión en 13 comunidades autónomas, y en 7 de ellas ya está planificado el cribado primario con la prueba VPH como prueba inicial.
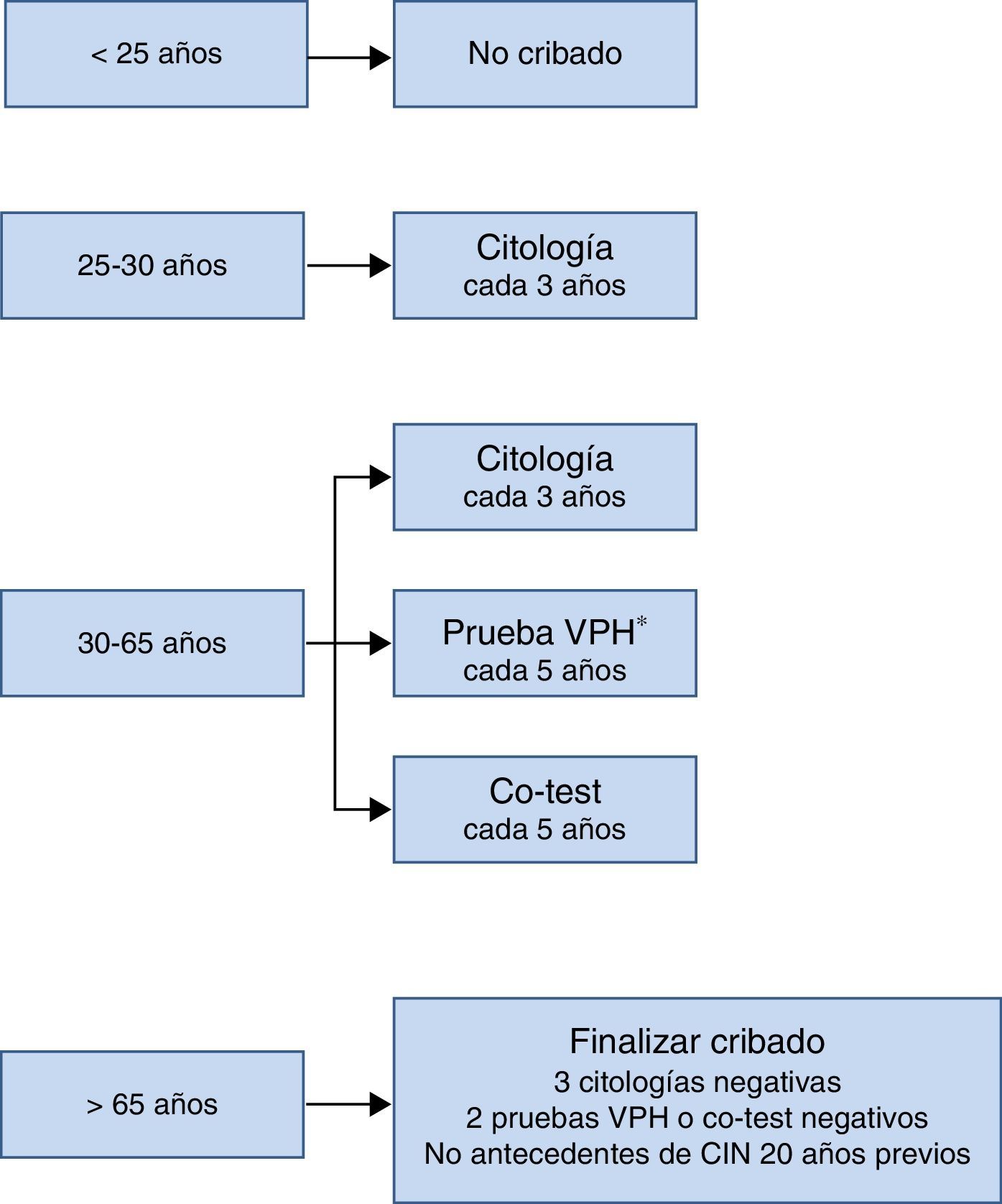
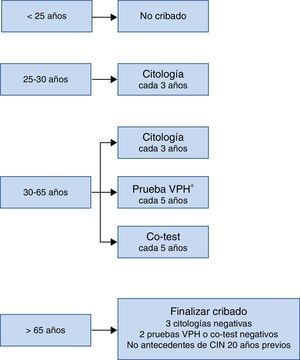
El esquema de cribado recomendado en el Documento de Consenso realizado por varias sociedades científicas en 2014 se resume en la figura 3. Lo más remarcable es que no se debe comenzar el cribado antes de los 25años, que entre los 25 y los 30años se recomienda citología como prueba inicial por la elevada prevalencia de infección por VPH en esta edad, y que a partir de los 30años, como se ha comentado previamente, la prueba de detección de VPH es la opción preferente porque es la que aporta mayores beneficios.
Ahora bien, cualquiera que sea la estrategia de cribado elegida, hay que recordar que el 50% de las mujeres que padecen CCU no han participado nunca en un cribado y el 10% lo han realizado en un periodo de tiempo superior a 5años. Por lo tanto, sea con citología si no se dispone de medios mejores, con prueba de detección de VPH-AR, con o sin genotipado parcial, el primer objetivo que debemos conseguir es que el cribado sea poblacional, es decir, que se extienda a toda la población diana, mujeres con edades comprendidas entre los 30 y 60, que sea de fácil acceso, que tenga una cobertura amplia y que se realice en las mismas condiciones en todas las comunidades autónomas de España. La principal función de los microbiólogos como colectivo debería ser ayudar a conseguir los objetivos anteriores a nivel de salud pública, aportando nuestros conocimientos y realizando el método de detección de VPH más sensible y específico según la evidencia científica en cada momento, siempre dentro de un marco de coordinación y coste asumibles. Solamente así habrá alguna esperanza de que esta grave enfermedad totalmente prevenible desaparezca en la mayor parte de los países.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.