La válvula aórtica bicúspide (VAB) es la malformación cardíaca congénita más frecuente. Se asocia a un mayor riesgo de complicaciones cardiovasculares, entre las que se incluye la endocarditis infecciosa (EI).
MétodosEstudio observacional, unicéntrico de cohorte, que incluye de forma prospectiva a todos los pacientes ingresados por EI entre 1996 y 2014. Se analizan datos epidemiológicos, clínicos, microbiológicos, ecocardiográficos, complicaciones durante la hospitalización, necesidad quirúrgica, mortalidad intrahospitalaria y seguimiento a un año. Se excluyen los casos con endocarditis sobre válvulas protésicas o en otras localizaciones, y aquellos de cuya válvula aórtica no se tienen datos certeros acerca de su morfología. Se ha realizado un análisis estadístico comparativo entre VAB y tricúspide (VAT).
ResultadosDe un total de 328 casos con EI, 118 (35,67%) fueron sobre válvula aórtica. Tenían VAB 18 (16,22%). Los casos con VAB eran más jóvenes que los portadores de VAT (51±19,06 vs. 60,83±15,73 años, p=0,021) y tenían menos comorbilidad (índice de Charlson 0,67±0,77 vs. 1,44±1,64, p=0,03). En el grupo con VAB observamos tendencia a EI causada por Staphylococcus spp. (38,9 vs. 21,5%, p=0,137). Con diferencia estadística, hubo más complicaciones perivalvulares entre los casos con VAB (55,6% vs. 16,1%, p=0,001) predominando los abscesos (38,9 vs. 16,1%, p=0,047). Ser portador de VAB fue el único factor predictor de las mismas (OR 7,87, IC del 95%, 2,38-26,64, p=0,001). Los pacientes con VAB se operaron más (83,3 vs. 44,1%, p=0,004) y la mortalidad durante el ingreso hospitalario fue menor, aunque no alcanzó significación estadística (5,6 vs. 25,8%, p=0,069). La supervivencia a un año fue significativamente superior en el grupo de VAB (93,8 vs 69,3%, p=0,048).
ConclusionesLos pacientes con EI sobre VAB son jóvenes, con poca comorbilidad asociada. Tienen frecuentemente complicaciones perivalvulares por lo que requieren cirugía precoz. La mortalidad intrahospitalaria comparada con EI sobre VAT es menor y la supervivencia a un año es significativamente mayor.
Bicuspid aortic valve (BAV) is the most frequent congenital cardiac disease. It is associated to a higher risk of cardiovascular complications, including infective endocarditis (IE).
MethodsRetrospective, observational and single centre study that included all patients with IE diagnosed between 1996 and 2014. An analysis was made of the epidemiological, clinical, microbiological and echocardiographic data, complications during hospital admission, need for surgery, in-hospital mortality, and 1-year follow-up. Cases with endocarditis on prosthetic valves or other locations were excluded, as well as those for which the aortic valve morphology had not been accurately defined. A comparative statistical analysis was performed between BAV and tricuspid (TAV).
ResultsOf a total of 328 cases with IE, 118 (35.67%) were on aortic valve, with 18 (16.22%) of them being BAV. The BAV cases were younger than TAV (51±19.06 vs. 60.83±15.73 years, P=.021) and they had less comorbidity (Charlson 0.67±0.77 vs. 1.44±1.64, P=.03).). There was a higher tendency of Staphylococcal origin (38.9 vs. 21.5%, P=.137), and 55.6% showed peri-valvular complications (TAV 16.1%, P=.001), in particular, abscesses (38.9 vs.16.1%, P=.047). BAV was the only predictive factor of peri-valvular complications (OR 7.87, 95% CI; 2.38–26.64, P=.001). Patients with BAV had more surgery during their admission (83.3 vs. 44.1%, P=.004), had less in-hospital mortality, with no statistical significance (5.6 vs. 25.8%, P=.069), and 1-year survival was significantly superior (93.8 vs 69.3%, P=.048).
ConclusionsPatients with IE on BAV are young, with low comorbidity. They frequently present with peri-valvular complications and they often require early surgery. Compared to TAV cases, in-hospital mortality is lower and 1-year survival is significantly higher.
La válvula aórtica (VAo) bicúspide (VAB) es la malformación cardíaca congénita más frecuente con una prevalencia del 1-2% según la bibliografía1,2, si bien hay datos que indican que su presencia en población mediterránea es probablemente ligeramente menor3–5. Es conocido que estos pacientes presentan una mayor frecuencia de complicaciones cardiovasculares, tales como disfunción de la VAo6–8, aneurisma de la aorta ascendente9–11, disección aórtica12,13 o endocarditis infecciosa (EI)14.
Hay pocos estudios previos que evalúen las características clínicas y ecocardiográficas así como el pronóstico de los pacientes con VAB que presentan una EI.
El objetivo de nuestro estudio fue, por tanto, determinar estas características, estableciendo diferencias respecto a la población con EI sobre VAo tricúspide (VAT).
MétodosPoblación y ámbito del estudioEstudio observacional, unicéntrico de cohorte, en la que se ha incluido de forma prospectiva a todos los pacientes ingresados por EI entre enero de 1996 y diciembre del 2014 en un hospital de tercer nivel. Es de destacar que desde 2008 estos pacientes fueron atendidos mediante una estrategia de alerta multidisciplinaria15, tal y como ya se recomienda en las últimas guías publicadas16. Se excluye para el análisis a los pacientes con endocarditis sobre válvulas protésicas o en otras localizaciones, y aquellos de cuya VAo no se obtuvieron datos certeros acerca de su morfología. Se analizan los datos epidemiológicos, clínicos, microbiológicos, ecocardiográficos, las complicaciones durante la hospitalización, necesidad quirúrgica, mortalidad intrahospitalaria y seguimiento a un año.
Definición de variables del estudioEstudio clínicoSe ha considerado el diagnóstico de EI cuando se cumplen los criterios de Duke modificados17. La comorbilidad se ha valorado usando el índice de comorbilidad de Charlson18. Se ha considerado insuficiencia renal (IR) aguda cuando la creatinina es mayor de 1,5mg/dL en pacientes con función renal previa normal o si existe un deterioro > 25% del aclaramiento de creatinina base en pacientes con IR crónica. Se ha diagnosticado insuficiencia cardíaca de acuerdo con los criterios de Framingham y se ha considerado grave cuando fue preciso tratamiento con inotrópicos por vía intravenosa o ventilación mecánica. Se ha definido shock séptico según los estándares habituales19. Las afecciones del sistema nervioso central analizadas incluyen el accidente cerebrovascular (isquémico o hemorrágico) diagnosticado tras examen clínico y estudios de imagen, así como la encefalopatía, la meningitis y el absceso cerebral.
Se ha definido tratamiento quirúrgico precoz el llevado a cabo durante el periodo de hospitalización. La selección de pacientes considerados para tratamiento quirúrgico precoz vs. manejo médico se ha realizado en su momento mediante acuerdo entre los especialistas de enfermedades infecciosas, cardiólogos y cirujanos cardíacos, según las recomendaciones internacionalmente reconocidas20. Se ha definido como tiempo hasta la cirugía el transcurrido desde la fecha de ingreso hospitalario hasta la fecha de cirugía. Se ha utilizado la escala logística EuroScore21 para calcular el potencial riesgo quirúrgico. Se ha valorado la mortalidad intrahospitalaria como la ocurrida durante el ingreso o entre los 30 días posteriores al alta, y se ha analizado la mortalidad a los 12 meses del alta hospitalaria.
Estudio microbiológicoSe realizó mediante hemocultivos (sistema automatizado BACTEC®), por cultivo valvular u otro material obtenido durante la cirugía. A partir de 2008 también se realizó la reacción en cadena de la polimerasa (PCR universal 16S rARN) de muestras quirúrgicas en aquellos casos con hemocultivos negativos o dudosos en cuanto a la etiología de la EI. Se aseguró la curación de la infección con hemocultivos al final del tratamiento y a los 2 meses del mismo.
Estudio ecocardiográficoSe realizó ecocardiograma transtorácico a la totalidad de los pacientes, estudio que incluyó modo-M, bidimensional (2D), Doppler espectral y color. Se realizó estudio transesofágico a todos los pacientes con alta sospecha de endocarditis que tenían un estudio transtorácico negativo o dudoso, y en aquellos con sospecha de complicaciones perivalvulares22. Las sondas transesofágicas usadas fueron monoplanares o biplanares hasta 2008, y multiplanares a partir de entonces. El estudio se realizó en el laboratorio de ecocardiografía o en el área de críticos cuando el paciente presentaba inestabilidad hemodinámica o precisaba ventilación mecánica, o intraquirófano.
El grado de regurgitación valvular fue valorado y clasificado como leve, moderado o severo, siguiendo las normas de la American Society of Echocardiography23.
El diagnóstico de vegetación se realizó por el hallazgo de imágenes de masa móvil situada sobre estructuras valvulares o zona de impacto de chorros patológicos con vibración o movimiento errático diferente del de la estructura valvular donde asientan. Se definió absceso como la presencia de zonas hipoecogénicas o de ecogenicidad irregular sin evidencia de flujo en su interior, situada en las inmediaciones de la válvula afectada. Los seudoaneurismas se diagnosticaron por la presencia de zonas anecoicas con flujo en su interior y expansión sistólica. Se denominó fístulas a las comunicaciones anormales entre 2 cavidades cardíacas.
El diagnóstico de VAB se llevó a cabo bien mediante ecocardiografía (transtorácica o transesofágica), o bien, en el caso de los pacientes con mala ventana acústica o con válvulas más calcificadas y desestructuradas, mediante visualización directa por parte del cirujano cardíaco.
Análisis estadísticoTodas las variables se han comparado entre los grupos con EI sobre VAB y EI sobre VAT. Las variables cualitativas se expresan en porcentajes y se analizan los contrastes de asociación mediante el test de la chi al cuadrado (χ2) o test de Fischer. Las variables cuantitativas se expresan como media±desviación estándar; su distribución se analiza con el test de Kolmogorov-Smirnov y las diferencias mediante la t de Student para las variables que siguen una distribución normal o con la prueba U de Mann-Whitney para las que no. El análisis multivariado se ha realizado mediante regresión logística binaria. Hemos utilizado el método de Kaplan-Meier y la regresión de Cox para el análisis de la supervivencia. Todos los análisis estadísticos se han llevado a cabo mediante Stata 13.1 (Statacorp, Texas, EE. UU.).
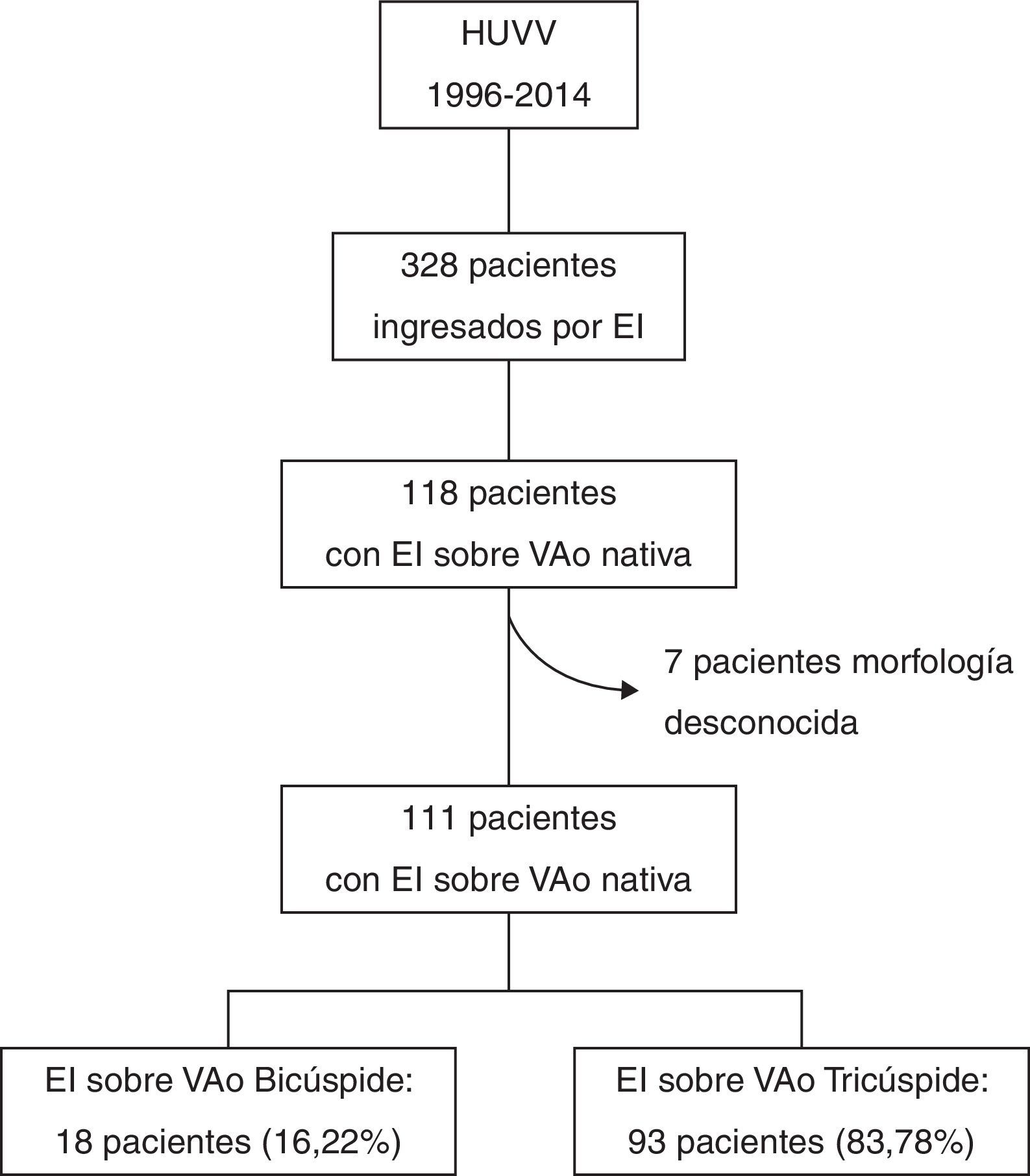
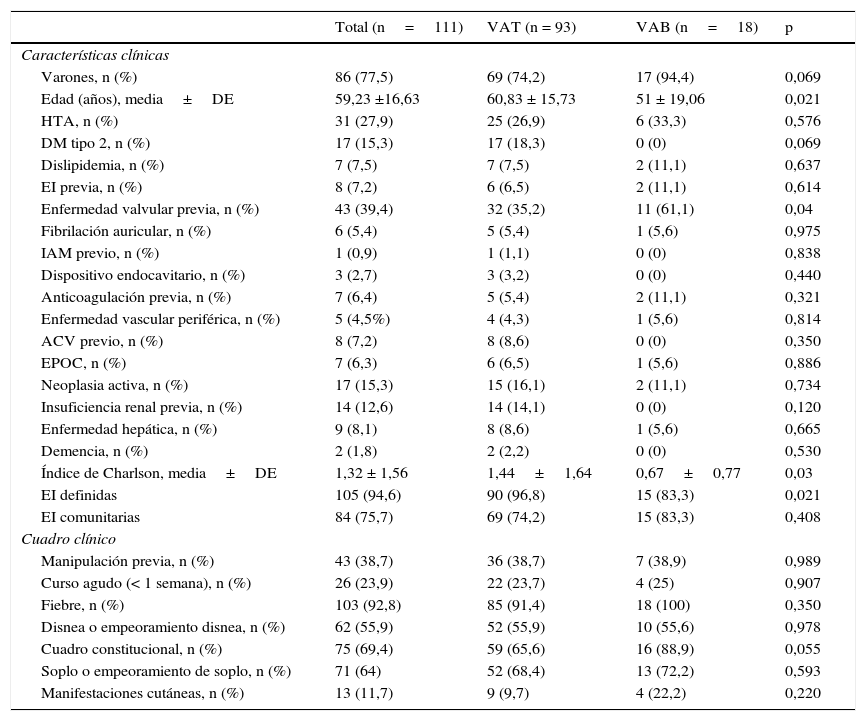
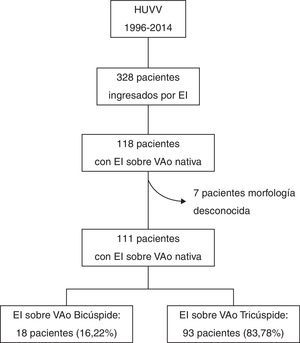
ResultadosCaracterísticas basalesDe los 328 ingresos por EI durante el periodo del estudio, 118 fueron sobre VAo nativa (35,67%). No se registraron datos acerca de la morfología de la VAo en 7 de ellos. De los restantes 111, 18 (16,22%) tenían VAB (15 descritas por ecocardiograma y 3 por un cirujano cardíaco durante recambio valvular) (fig. 1). En comparación con la población con EI sobre VAT (n=93), estos pacientes fueron significativamente más jóvenes (51±19,06 vs. 60,83±15,73 años, p=0,021) y tenían menos comorbilidad (índice de Charlson 0,67±0,77 vs. 1,44±1,64, p=0,03). El porcentaje de pacientes con «EI definida» según criterios de Duke modificados fue del 94,6% del total, siendo mayor en el grupo de VAT (83,3% vs. 96,8, p=0,021). Las proporciones de EI adquiridas en la comunidad fueron similares (83,3 vs 74,2%, p=0,408), así como la prevalencia de EI con curso agudo y otros hallazgos clínicos (tabla 1).
Características basales y del cuadro clínico
| Total (n=111) | VAT (n = 93) | VAB (n=18) | p | |
|---|---|---|---|---|
| Características clínicas | ||||
| Varones, n (%) | 86 (77,5) | 69 (74,2) | 17 (94,4) | 0,069 |
| Edad (años), media±DE | 59,23 ±16,63 | 60,83 ± 15,73 | 51 ± 19,06 | 0,021 |
| HTA, n (%) | 31 (27,9) | 25 (26,9) | 6 (33,3) | 0,576 |
| DM tipo 2, n (%) | 17 (15,3) | 17 (18,3) | 0 (0) | 0,069 |
| Dislipidemia, n (%) | 7 (7,5) | 7 (7,5) | 2 (11,1) | 0,637 |
| EI previa, n (%) | 8 (7,2) | 6 (6,5) | 2 (11,1) | 0,614 |
| Enfermedad valvular previa, n (%) | 43 (39,4) | 32 (35,2) | 11 (61,1) | 0,04 |
| Fibrilación auricular, n (%) | 6 (5,4) | 5 (5,4) | 1 (5,6) | 0,975 |
| IAM previo, n (%) | 1 (0,9) | 1 (1,1) | 0 (0) | 0,838 |
| Dispositivo endocavitario, n (%) | 3 (2,7) | 3 (3,2) | 0 (0) | 0,440 |
| Anticoagulación previa, n (%) | 7 (6,4) | 5 (5,4) | 2 (11,1) | 0,321 |
| Enfermedad vascular periférica, n (%) | 5 (4,5%) | 4 (4,3) | 1 (5,6) | 0,814 |
| ACV previo, n (%) | 8 (7,2) | 8 (8,6) | 0 (0) | 0,350 |
| EPOC, n (%) | 7 (6,3) | 6 (6,5) | 1 (5,6) | 0,886 |
| Neoplasia activa, n (%) | 17 (15,3) | 15 (16,1) | 2 (11,1) | 0,734 |
| Insuficiencia renal previa, n (%) | 14 (12,6) | 14 (14,1) | 0 (0) | 0,120 |
| Enfermedad hepática, n (%) | 9 (8,1) | 8 (8,6) | 1 (5,6) | 0,665 |
| Demencia, n (%) | 2 (1,8) | 2 (2,2) | 0 (0) | 0,530 |
| Índice de Charlson, media±DE | 1,32 ± 1,56 | 1,44±1,64 | 0,67±0,77 | 0,03 |
| EI definidas | 105 (94,6) | 90 (96,8) | 15 (83,3) | 0,021 |
| EI comunitarias | 84 (75,7) | 69 (74,2) | 15 (83,3) | 0,408 |
| Cuadro clínico | ||||
| Manipulación previa, n (%) | 43 (38,7) | 36 (38,7) | 7 (38,9) | 0,989 |
| Curso agudo (< 1 semana), n (%) | 26 (23,9) | 22 (23,7) | 4 (25) | 0,907 |
| Fiebre, n (%) | 103 (92,8) | 85 (91,4) | 18 (100) | 0,350 |
| Disnea o empeoramiento disnea, n (%) | 62 (55,9) | 52 (55,9) | 10 (55,6) | 0,978 |
| Cuadro constitucional, n (%) | 75 (69,4) | 59 (65,6) | 16 (88,9) | 0,055 |
| Soplo o empeoramiento de soplo, n (%) | 71 (64) | 52 (68,4) | 13 (72,2) | 0,593 |
| Manifestaciones cutáneas, n (%) | 13 (11,7) | 9 (9,7) | 4 (22,2) | 0,220 |
VAB, válvula aórtica bicúspide; VAT, válvula aórtica tricúspide; HTA: hipertensión arterial; DM, diabetes mellitus; IAM, infarto agudo de miocardio; ACV, accidente cerebrovascular; EPOC, enfermedad pulmonar obstructiva crónica.
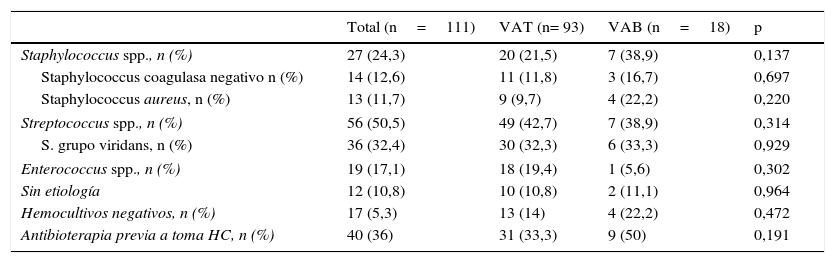
Se halló agente causante de la EI en la amplia mayoría de los pacientes de ambos grupos, permaneciendo sin etiología definida el 10,8% (11,1 vs. 10,8%), sin diferencias asimismo en cuanto a EI con hemocultivos negativos (22,2 vs 14%, p=0,472). En el grupo de VAB existió una mayor tendencia hacia la etiología estafilocócica (38,9 vs. 21,5%, p=0,137), a expensas sobre todo de Staphylococus aureus (S. aureus), aunque sin alcanzar la significación estadística. En los pacientes con VAB hubo mayor tendencia a la toma de antibióticos previamente a la extracción de hemocultivos (50 vs. 33,3%, p=0,191) (tabla 2).
Características microbiológicas
| Total (n=111) | VAT (n= 93) | VAB (n=18) | p | |
|---|---|---|---|---|
| Staphylococcus spp., n (%) | 27 (24,3) | 20 (21,5) | 7 (38,9) | 0,137 |
| Staphylococcus coagulasa negativo n (%) | 14 (12,6) | 11 (11,8) | 3 (16,7) | 0,697 |
| Staphylococcus aureus, n (%) | 13 (11,7) | 9 (9,7) | 4 (22,2) | 0,220 |
| Streptococcus spp., n (%) | 56 (50,5) | 49 (42,7) | 7 (38,9) | 0,314 |
| S. grupo viridans, n (%) | 36 (32,4) | 30 (32,3) | 6 (33,3) | 0,929 |
| Enterococcus spp., n (%) | 19 (17,1) | 18 (19,4) | 1 (5,6) | 0,302 |
| Sin etiología | 12 (10,8) | 10 (10,8) | 2 (11,1) | 0,964 |
| Hemocultivos negativos, n (%) | 17 (5,3) | 13 (14) | 4 (22,2) | 0,472 |
| Antibioterapia previa a toma HC, n (%) | 40 (36) | 31 (33,3) | 9 (50) | 0,191 |
VAB, válvula aórtica bicúspide; VAT, válvula aórtica tricúspide; HC, hemocultivos.
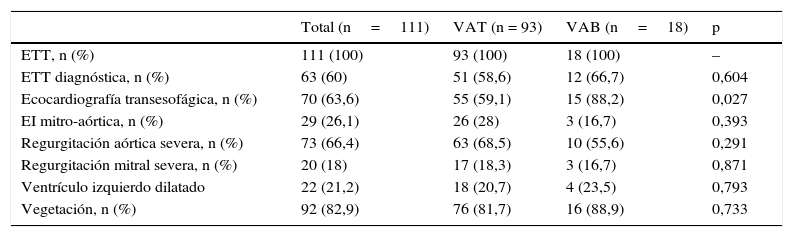
Se realizó ecocardiograma transtorácico a la totalidad de los pacientes, sin existir diferencias estadísticamente significativas en el porcentaje de pacientes con evidencia ecocardiográfica de endocarditis (66,7 vs. 58,6%, p=0,604). El ecocardiograma transesofágico fue realizado a más pacientes con VAB (88,2 vs. 59,1%, p=0,027), con hallazgos indicativos de EI en el 90,1% de los casos del total, sin tampoco diferencias en este aspecto entre ambos grupos (90,3 vs. 89,3%, p=0,640). El porcentaje de pacientes con insuficiencia aórtica (IAo) severa fue similar entre ambos grupos. Asimismo, tampoco existieron diferencias estadísticamente significativas respecto a la prevalencia de ventrículo izquierdo dilatado (como indicador de IAo crónica) entre los pacientes con IAo severa. La visualización ecocardiográfica de vegetación fue similar (88,9 vs 81,7%, p=0,733), como también lo fue la afectación concomitante de la válvula mitral (16,7 vs 28%, p=0,393) (tabla 3).
Características ecocardiográficas
| Total (n=111) | VAT (n = 93) | VAB (n=18) | p | |
|---|---|---|---|---|
| ETT, n (%) | 111 (100) | 93 (100) | 18 (100) | – |
| ETT diagnóstica, n (%) | 63 (60) | 51 (58,6) | 12 (66,7) | 0,604 |
| Ecocardiografía transesofágica, n (%) | 70 (63,6) | 55 (59,1) | 15 (88,2) | 0,027 |
| EI mitro-aórtica, n (%) | 29 (26,1) | 26 (28) | 3 (16,7) | 0,393 |
| Regurgitación aórtica severa, n (%) | 73 (66,4) | 63 (68,5) | 10 (55,6) | 0,291 |
| Regurgitación mitral severa, n (%) | 20 (18) | 17 (18,3) | 3 (16,7) | 0,871 |
| Ventrículo izquierdo dilatado | 22 (21,2) | 18 (20,7) | 4 (23,5) | 0,793 |
| Vegetación, n (%) | 92 (82,9) | 76 (81,7) | 16 (88,9) | 0,733 |
VAB, válvula aórtica bicúspide; VAT, válvula aórtica tricúspide; ETT, ecocardiograma transtorácico.
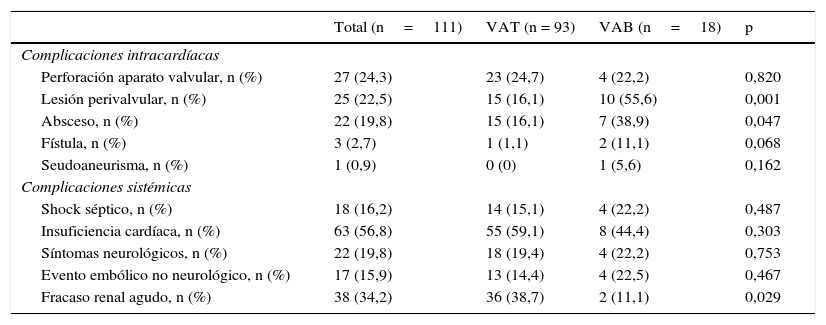
Presentaron complicaciones perivalvulares 25 pacientes (absceso, fístula o seudoaneurisma visualizadas en ecocardiograma o durante la cirugía), representando un 55,6% de los pacientes con EI sobre VAB y un 16,1% del grupo de VAT (p=0,001), y siendo el absceso la complicación más frecuentemente hallada (38,9 vs. 16,1%, p=0,047) (tabla 4). Mediante análisis de regresión logística, que incluyó otros factores posiblemente asociados a la aparición de complicaciones perivalvulares como la edad, el índice de Charlson, la infección por S. aureus, la manipulación previa y la duración de los síntomas; la presencia de VAB fue el único factor predictor de las mismas (OR 7,87, IC del 95%, 2,38-26,64, p=0,001).
Curso clínico
| Total (n=111) | VAT (n = 93) | VAB (n=18) | p | |
|---|---|---|---|---|
| Complicaciones intracardíacas | ||||
| Perforación aparato valvular, n (%) | 27 (24,3) | 23 (24,7) | 4 (22,2) | 0,820 |
| Lesión perivalvular, n (%) | 25 (22,5) | 15 (16,1) | 10 (55,6) | 0,001 |
| Absceso, n (%) | 22 (19,8) | 15 (16,1) | 7 (38,9) | 0,047 |
| Fístula, n (%) | 3 (2,7) | 1 (1,1) | 2 (11,1) | 0,068 |
| Seudoaneurisma, n (%) | 1 (0,9) | 0 (0) | 1 (5,6) | 0,162 |
| Complicaciones sistémicas | ||||
| Shock séptico, n (%) | 18 (16,2) | 14 (15,1) | 4 (22,2) | 0,487 |
| Insuficiencia cardíaca, n (%) | 63 (56,8) | 55 (59,1) | 8 (44,4) | 0,303 |
| Síntomas neurológicos, n (%) | 22 (19,8) | 18 (19,4) | 4 (22,2) | 0,753 |
| Evento embólico no neurológico, n (%) | 17 (15,9) | 13 (14,4) | 4 (22,5) | 0,467 |
| Fracaso renal agudo, n (%) | 38 (34,2) | 36 (38,7) | 2 (11,1) | 0,029 |
VAB, válvula aórtica bicúspide; VAT, válvula aórtica tricúspide.
No hubo diferencias significativas en el desarrollo de shock séptico, insuficiencia cardíaca, manifestaciones neurológicas o eventos embólicos a otros territorios. Sin embargo, los pacientes con VAB presentaron porcentualmente menos desarrollo de fracaso renal agudo (11,1 vs. 38,7%) (tablas 1–4).
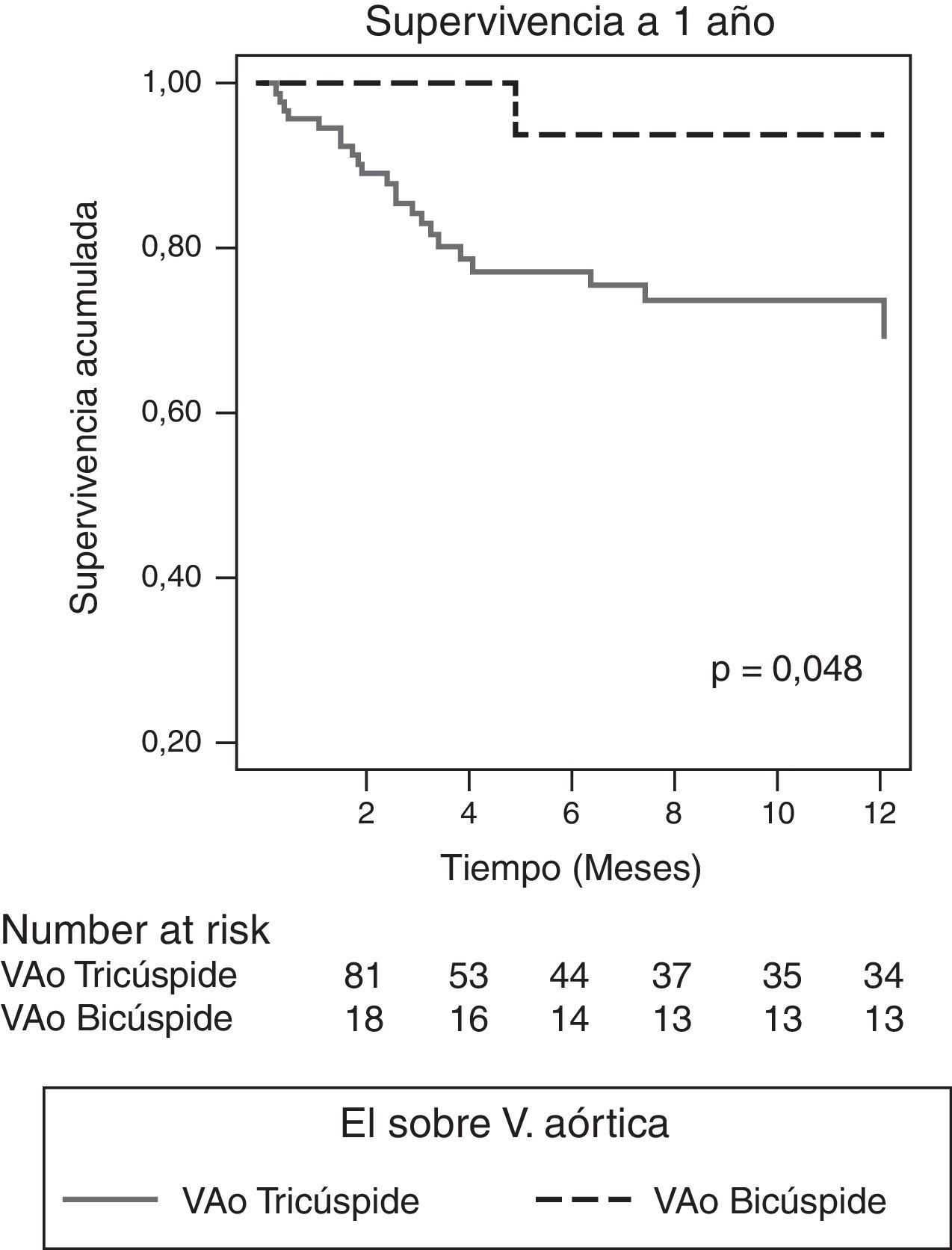
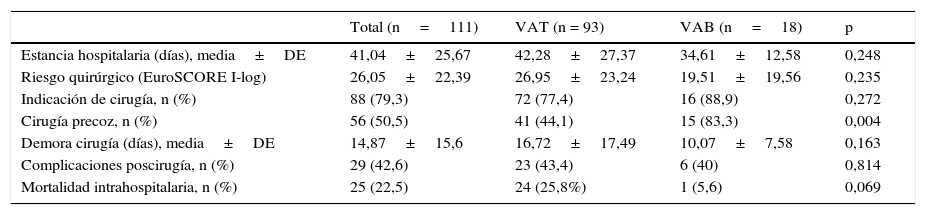
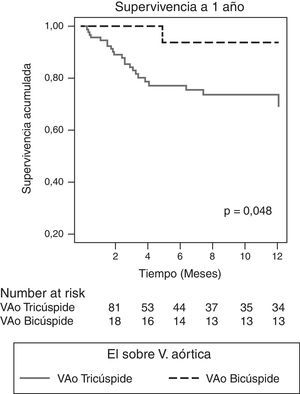
Características evolutivasLa indicación de cirugía fue similar en ambos grupos (88,9 vs. 77,4%, p=0,272), pero los pacientes con EI sobre VAB se operaron significativamente más durante el ingreso (83,3 vs. 44,1%, p=0,004). La mortalidad intrahospitalaria fue menor en este grupo, aunque sin alcanzar la significación estadística (5,6 vs. 25,8%, p=0,069) (tabla 5), y la supervivencia a un año fue significativamente superior (93,8 vs. 69,3%, p=0,048) (fig. 2). Tras ajustar por aquellos parámetros posiblemente asociados a la supervivencia (edad, comorbilidad, fracción de eyección, presencia de VAB, infección por S. aureus, hallazgo de IAo severa, presencia de complicaciones perivalvulares y realización de cirugía precoz), el análisis mediante regresión de Cox reveló como único factor predictor de mortalidad la IAo severa (RR 3,73, IC del 95%, 1,22-11,36, p=0,021) y la realización de cirugía precoz se mostró protectora (OR 0,303, IC del 95%, 0,097-0,951). No influyó en la mortalidad el tener VAB o complicaciones perivalvulares.
Características evolutivas
| Total (n=111) | VAT (n = 93) | VAB (n=18) | p | |
|---|---|---|---|---|
| Estancia hospitalaria (días), media±DE | 41,04±25,67 | 42,28±27,37 | 34,61±12,58 | 0,248 |
| Riesgo quirúrgico (EuroSCORE I-log) | 26,05±22,39 | 26,95±23,24 | 19,51±19,56 | 0,235 |
| Indicación de cirugía, n (%) | 88 (79,3) | 72 (77,4) | 16 (88,9) | 0,272 |
| Cirugía precoz, n (%) | 56 (50,5) | 41 (44,1) | 15 (83,3) | 0,004 |
| Demora cirugía (días), media±DE | 14,87±15,6 | 16,72±17,49 | 10,07±7,58 | 0,163 |
| Complicaciones poscirugía, n (%) | 29 (42,6) | 23 (43,4) | 6 (40) | 0,814 |
| Mortalidad intrahospitalaria, n (%) | 25 (22,5) | 24 (25,8%) | 1 (5,6) | 0,069 |
VAB, válvula aórtica bicúspide; VAT, válvula aórtica tricúspide.
En este estudio, el 35,6% de las EI asienta sobre válvula nativa aórtica y 18 (16,2%) de ellas son válvulas bicúspides (tabla 1). Esta proporción es similar a previas publicadas en la literatura (Lamas y Eykyn, 2000; Tribouilloy et al., 2010)14,24. El diagnóstico inicial en nuestros pacientes con EI sobre VAB se realizó por ecocardiografía transtorácica y se confirmó por ETE en cerca del 90% de los casos (tabla 3). Es preciso tener en cuenta que en los pacientes con claro criterio quirúrgico y sometidos a cirugía precoz (83,3%) el ETE pudo ser realizado intraquirófano. Porcentajes similares se han descrito en estudios previos con similar número de ETE realizadas ya sea en VAB o VAT, o incluso con menor número de las mismas14,25. Aunque infrecuente, la EI sobre VAB es importante y nuestros resultados corroboran los hallazgos de otros autores25. Se manifiesta más frecuentemente en varones jóvenes 51±19,1 años, sin comorbilidad (índice de Charlson medio=0,67 puntos) (tabla 1). No hemos encontrado ningún germen causal predominante, en probable relación con el escaso número de casos, aunque sí apreciamos que existe mayor tendencia de la etiología estafilocócica (tabla 2). No encontramos en este estudio diferencias valorables entre VAB y VAT en cuanto a complicaciones sistémicas, presentando ambas porcentajes similares de insuficiencia cardíaca, shock séptico, eventos neurológicos, cardioembolias a otros territorios o deterioro renal (tabla 4). La importancia en este estudio acerca de la EI sobre VAB estriba en la presencia de complicaciones perivalvulares (55,6%) con diferencia estadística a pesar de la cortedad de la muestra, con relación a VAT (tabla 4), predominando el absceso perivalvular aórtico (40%) seguido a distancia de las fístulas (11%) y seudoaneurismas en el 5%. Todas ellas fueron el motivo de cirugía precoz en estos pacientes (83,3% del total) y esta se realizó más frecuentemente que en VAT (tabla 5). A pesar del mal pronóstico asociado a la presencia de lesión perivalvular en la EI26,27, el hecho de sumarse la cirugía precoz28,29 a la escasa edad y comorbilidad de estos pacientes ha condicionado que la mortalidad intrahospitalaria sea menor que en a VAT: 1 (5,6%) vs. 24 (25,8%), p = 0,029, siendo la supervivencia al año del alta, cercana al 94%.
Estos hallazgos también encontrados por otros autores14,24,25 nos hacen concluir que la presencia de complicaciones perivalvulares es constante en la EI sobre VAB. Se ha postulado que la aparición precoz de alteraciones hemodinámicas (consecuencia de una VAo disfuncionante desde edades tempranas de la vida) puede inducir daño tisular, que ejerce de asiento para los gérmenes causantes de la EI. Varios son los motivos propuestos para explicar la mayor incidencia de complicaciones perivalvulares. El hecho de que la VAB afecte a pacientes jóvenes, ignorantes de su cardiopatía y con escasa comorbilidad puede hacer descender el índice de sospecha de esta entidad y retrasar el diagnóstico (especialmente en los casos con hemocultivo negativo, habitualmente relacionado con el uso de antibioterapia previa para otros posibles focos) y el adecuado tratamiento, condicionando mayor extensión local de las lesiones cardíacas. Asimismo, la etiología estafilocócica de la EI, especialmente en el caso de S. aureus, debido a su agresividad, contribuiría también a una mayor y más rápida destrucción tisular.
Como limitaciones de nuestro estudio, la primera y principal es el escaso número de pacientes incluidos con VAB, debido principalmente a una probable infraestimación de la prevalencia de VAB, dado que no se realizaron en todos los casos técnicas que permitieran la máxima definición morfológica de la válvula (como el ETE) ni fueron tampoco intervenidos quirúrgicamente todos los pacientes con EI sobre VAo. El amplio periodo del estudio supone asimismo la segunda. Ambas limitaciones son compartidas según nuestro criterio con los trabajos realizados por otros autores ya comentados en el texto.
ConclusionesEn nuestra población, los pacientes con EI sobre VAB son más jóvenes y tienen menos comorbilidad que los portadores de EI sobre VAo tricúspide. Sin embargo, presentan un mayor porcentaje de complicaciones perivalvulares, requiriendo cirugía precoz la mayoría de los casos. A pesar de ello, la mortalidad intrahospitalaria o al mes siguiente al alta es menor, y la supervivencia a un año es significativamente mejor.
Conflictos de interesesNo existen conflictos de intereses relacionados con la publicación de este artículo.