La endoftalmitis endógena o metastásica por diseminación hematógena desde un foco séptico extraocular representa menos del 10% de todas las formas de endoftalmitis1. La diabetes, la inmunosupresión y el uso de drogas por vía parenteral son factores de riesgo bien establecidos. La afectación bilateral es rara y se observa más habitualmente en las formas de etiología fúngica1. A continuación describimos un caso de endoftalmitis bilateral como primera manifestación de una endocarditis neumocócica y realizamos una revisión de la literatura de este escenario clínico.
Se trata de una mujer de 80 años con antecedentes de hipertensión arterial, obesidad mórbida, síndrome de apneas-hipopneas durante el sueño y de obesidad-hipoventilación con insuficiencia respiratoria crónica, y fibrilación auricular permanente. Un ecocardiograma transtorácico realizado un año antes mostraba una válvula aórtica degenerativa con apertura discretamente disminuida e insuficiencia ligera. Su tratamiento habitual comprendía furosemida, acenocumarol, candesartán y omeprazol. Había recibido la vacuna antineumocócica de polisacáridos a los 66 años. Fue valorada en el Servicio de Urgencias por un cuadro de malestar general, sensación distérmica, somnolencia y disminución brusca de agudeza visual en ambos ojos desde hacía 48h. A la exploración física destacaba una temperatura axilar de 39°C sin datos de inestabilidad hemodinámica (tensión arterial de 142/75mmHg, frecuencia cardíaca de 98lpm), un soplo sistólico en foco aórtico de intensidad iii/vi y edemas maleolares bilaterales. La exploración oftalmológica puso de manifiesto la existencia de conjuntivas hiperémicas con córnea transparente y un nivel de hipopion en ambos ojos (más evidente en el derecho), en tanto que la fundoscopia no permitió la visualización de las estructuras retinianas por opacidad de los medios anteriores. Analíticamente presentaba trombocitopenia (76×1.000 plaquetas/μL), deterioro de la función renal (creatinina sérica: 1,60mg/dL) y elevación de la proteína C reactiva (23,5mg/dL [rango normal: 0,10-0,50]). Ante la sospecha de endoftalmitis endógena se inició tratamiento intravítreo con ceftazidima y vancomicina (0,5mL), así como antibioterapia sistémica con piperacilina/tazobactam (4/0,5g/6h), levofloxacino (500mg/12h) y linezolid (600mg/12h). Un ecocardiograma transtorácico urgente reveló una imagen móvil de 1×1,3cm en el velo anterior de la válvula mitral con protrusión hacia la aurícula izquierda, así como una segunda lesión de menor tamaño (0,5×0,5cm) en el velo posterior que protruía hacia el ventrículo. Estos hallazgos eran compatibles con vegetaciones endocardíticas. En los 2 sets de hemocultivos extraídos a su llegada (tiempo hasta positividad menor de 12h) se identificaron de forma preliminar cocos grampositivos en cadenas, por lo que se modificó el tratamiento sistémico por ceftriaxona (2g/24h) y ampicilina (2g/h), manteniendo el linezolid. Finalmente se confirmó el aislamiento de Streptococcus pneumoniae con susceptibilidad intermedia a penicilina G (concentración mínima inhibitoria: 1mg/L), por lo que se suspendió la ampicilina. El abordaje quirúrgico de la endocarditis fue desestimado debido a la pobre situación funcional basal de la paciente y la elevada carga de comorbilidad. Se apreció discreta mejoría de la endoftalmitis del ojo derecho, con disminución del hipopion (1mm). Sin embargo en las siguientes 48h la situación clínica fue deteriorándose progresivamente, produciéndose el fallecimiento en el contexto de un fracaso multiorgánico.
La endoftalmitis endógena es una complicación infrecuente en el curso de una bacteriemia y suele presentar un carácter devastador en cuanto al pronóstico visual, circunstancia a la que contribuye el eventual retraso diagnóstico. El microorganismo penetra en el globo ocular a través de los vasos del polo posterior y, tras cruzar la barrera hematoocular, se extiende desde la retina y la coroides hasta el cuerpo vítreo y, finalmente, la cámara anterior. Las fuentes de bacteriemia más habitualmente descritas en la literatura incluyen catéteres intravasculares, endocarditis y, de forma más excepcional, abscesos hepáticos, en tanto que Klebsiella pneumoniae (particularmente cepas de los serotipos K1 y K2 portadoras del gen asociado a hipermucoviscosidad magA en las series asiáticas), Staphylococcus aureus y estreptococos son los agentes más comunes1.
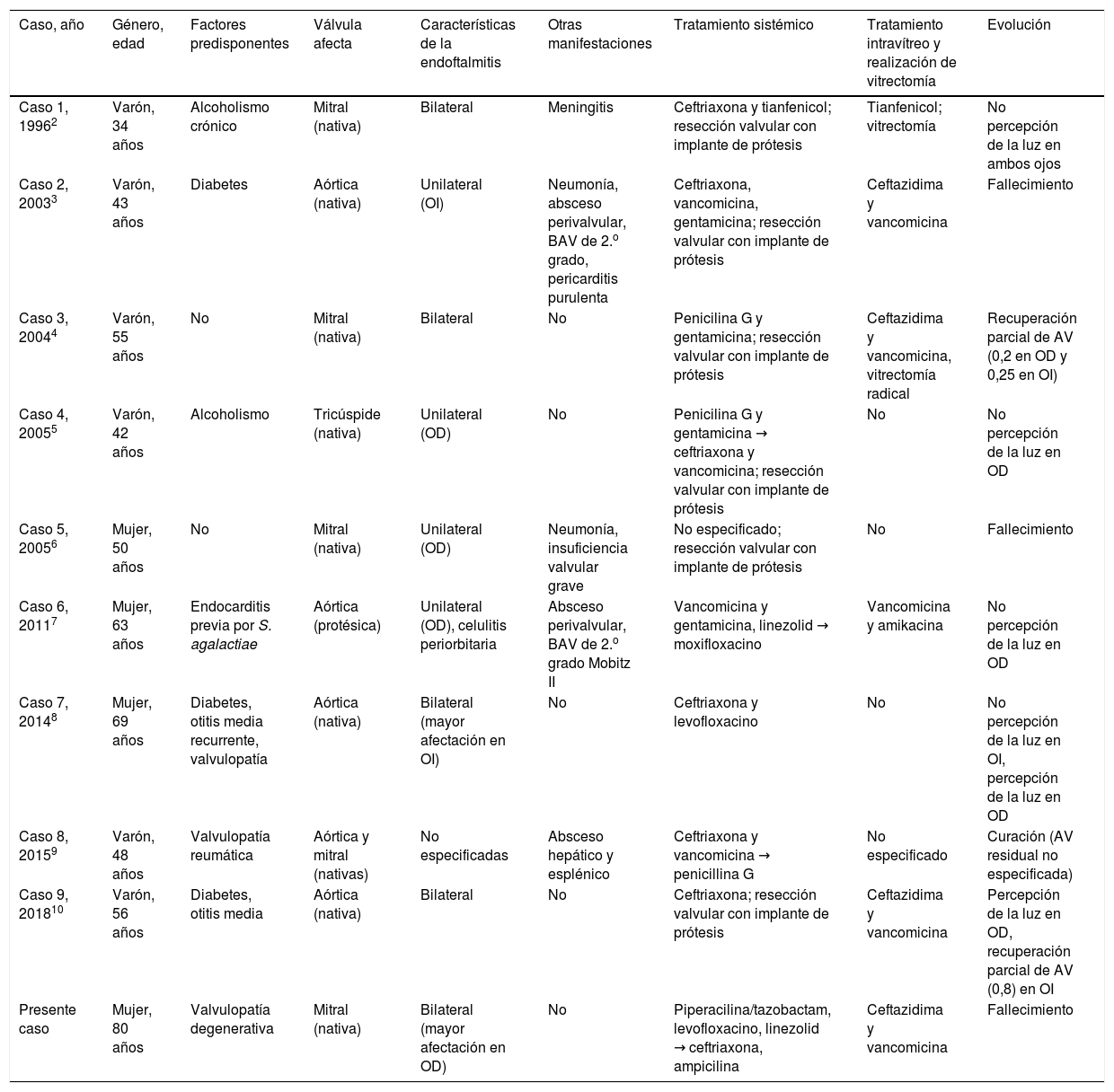
Si bien Streptococcus pneumoniae ha sido descrito en algunas series como la cuarta causa más frecuente de endoftalmitis endógena1, la afectación bilateral como forma de presentación de una endocarditis neumocócica supone una situación poco habitual. Realizamos una búsqueda en la base de datos PubMed (términos MeSH: «Streptococcus pneumoniae» o «pneumococcus» más «endophthalmitis» más «endocarditis»), así como una revisión manual de la lista de referencias de los artículos identificados, revelando 9 casos adicionales2–10 comunicados hasta septiembre de 2018 (tabla 1). Predominaron las formas de endocarditis sobre válvula nativa2–6,8–10 y en 4 pacientes (40%) se asociaron otras manifestaciones concurrentes de enfermedad neumocócica invasora, tales como meningitis2, neumonía3,6 o abscesos viscerales9. La endoftalmitis fue bilateral en la mitad de la serie. En 6 de los casos con información disponible (66,7%) se administró tratamiento antibiótico intravítreo2–4,7,10, aunque la utilidad de dicha estrategia en la endoftalmitis endógena está menos definida que en las formas exógenas, debido probablemente a la baja incidencia de esta complicación. Por ese motivo el tratamiento sistémico debe incluir antibióticos con buena penetración en el globo ocular, como linezolid o fluoroquinolonas7,8. Solo en 2 de los casos revisados se realizó una vitrectomía2,4. Este procedimiento, no obstante, no debería demorarse en las formas debidas a microorganismos agresivos como Staphylococcus aureus o Klebsiella pneumoniae1. La evolución fue desfavorable en términos generales, pues 2 pacientes3,6 (además del presente caso) fallecieron, mientras que la agudeza visual entre los supervivientes experimentó una recuperación parcial en solo 3 de los 10 ojos afectados4,10.
Casos comunicados en la literatura de endoftalmitis endógena en el contexto de una endocarditis neumocócica
| Caso, año | Género, edad | Factores predisponentes | Válvula afecta | Características de la endoftalmitis | Otras manifestaciones | Tratamiento sistémico | Tratamiento intravítreo y realización de vitrectomía | Evolución |
|---|---|---|---|---|---|---|---|---|
| Caso 1, 19962 | Varón, 34 años | Alcoholismo crónico | Mitral (nativa) | Bilateral | Meningitis | Ceftriaxona y tianfenicol; resección valvular con implante de prótesis | Tianfenicol; vitrectomía | No percepción de la luz en ambos ojos |
| Caso 2, 20033 | Varón, 43 años | Diabetes | Aórtica (nativa) | Unilateral (OI) | Neumonía, absceso perivalvular, BAV de 2.o grado, pericarditis purulenta | Ceftriaxona, vancomicina, gentamicina; resección valvular con implante de prótesis | Ceftazidima y vancomicina | Fallecimiento |
| Caso 3, 20044 | Varón, 55 años | No | Mitral (nativa) | Bilateral | No | Penicilina G y gentamicina; resección valvular con implante de prótesis | Ceftazidima y vancomicina, vitrectomía radical | Recuperación parcial de AV (0,2 en OD y 0,25 en OI) |
| Caso 4, 20055 | Varón, 42 años | Alcoholismo | Tricúspide (nativa) | Unilateral (OD) | No | Penicilina G y gentamicina → ceftriaxona y vancomicina; resección valvular con implante de prótesis | No | No percepción de la luz en OD |
| Caso 5, 20056 | Mujer, 50 años | No | Mitral (nativa) | Unilateral (OD) | Neumonía, insuficiencia valvular grave | No especificado; resección valvular con implante de prótesis | No | Fallecimiento |
| Caso 6, 20117 | Mujer, 63 años | Endocarditis previa por S. agalactiae | Aórtica (protésica) | Unilateral (OD), celulitis periorbitaria | Absceso perivalvular, BAV de 2.o grado Mobitz II | Vancomicina y gentamicina, linezolid → moxifloxacino | Vancomicina y amikacina | No percepción de la luz en OD |
| Caso 7, 20148 | Mujer, 69 años | Diabetes, otitis media recurrente, valvulopatía | Aórtica (nativa) | Bilateral (mayor afectación en OI) | No | Ceftriaxona y levofloxacino | No | No percepción de la luz en OI, percepción de la luz en OD |
| Caso 8, 20159 | Varón, 48 años | Valvulopatía reumática | Aórtica y mitral (nativas) | No especificadas | Absceso hepático y esplénico | Ceftriaxona y vancomicina → penicillina G | No especificado | Curación (AV residual no especificada) |
| Caso 9, 201810 | Varón, 56 años | Diabetes, otitis media | Aórtica (nativa) | Bilateral | No | Ceftriaxona; resección valvular con implante de prótesis | Ceftazidima y vancomicina | Percepción de la luz en OD, recuperación parcial de AV (0,8) en OI |
| Presente caso | Mujer, 80 años | Valvulopatía degenerativa | Mitral (nativa) | Bilateral (mayor afectación en OD) | No | Piperacilina/tazobactam, levofloxacino, linezolid → ceftriaxona, ampicilina | Ceftazidima y vancomicina | Fallecimiento |
AV: agudeza visual; BAV: bloqueo auriculoventricular; OD: ojo derecho; OI: ojo izquierdo.
En conclusión, el desarrollo de una endoftalmitis bilateral obliga a considerar un mecanismo endógeno secundario a la diseminación hematógena desde un foco extraocular. La endocarditis neumocócica puede constituir en raras ocasiones la entidad subyacente. El pobre pronóstico vital y visual de esta entidad, demostrado en nuestra experiencia y en la revisión de la literatura, justifica un alto grado de sospecha clínica seguido de un abordaje diagnóstico agresivo, a fin de instaurar precozmente el tratamiento sistémico e intraocular apropiado.
Los autores agradecen al personal de la Biblioteca del Hospital Universitario «12 de Octubre» su colaboración en la obtención de los artículos incluidos en la presente revisión de la literatura.