Paciente varón de 79 años, con antecedente de ptosis palpebral moderada, en seguimiento por Oftalmología desde enero de 2014 por degeneración macular asociada a la edad. Incluido en un ensayo clínico autorizado sobre las diferentes pautas de inyecciones intravítreas (IIV) en el brazo «treat and extend», recibía IIV mensuales de ranibizumab 0,5mg/0,05ml en el ojo izquierdo, pero sin extender el periodo entre ellas por seguir con degeneración macular asociada a la edad activa.
Las IIV se administraron siguiendo medidas de asepsia elementales (gorro, mascarilla y guantes) en una sala limpia (no quirófano). Para la desinfección de la conjuntiva y la piel colindante se utilizó povidona yodada al 5% dejando actuar al menos durante 3min. Tanto el blefarostato como el resto del material utilizado durante el proceso era estéril. La presentación del ranibizumab fue en viales unidosis, uno por paciente, y no se realizó control de esterilidad de dichos viales después de cada IIV.
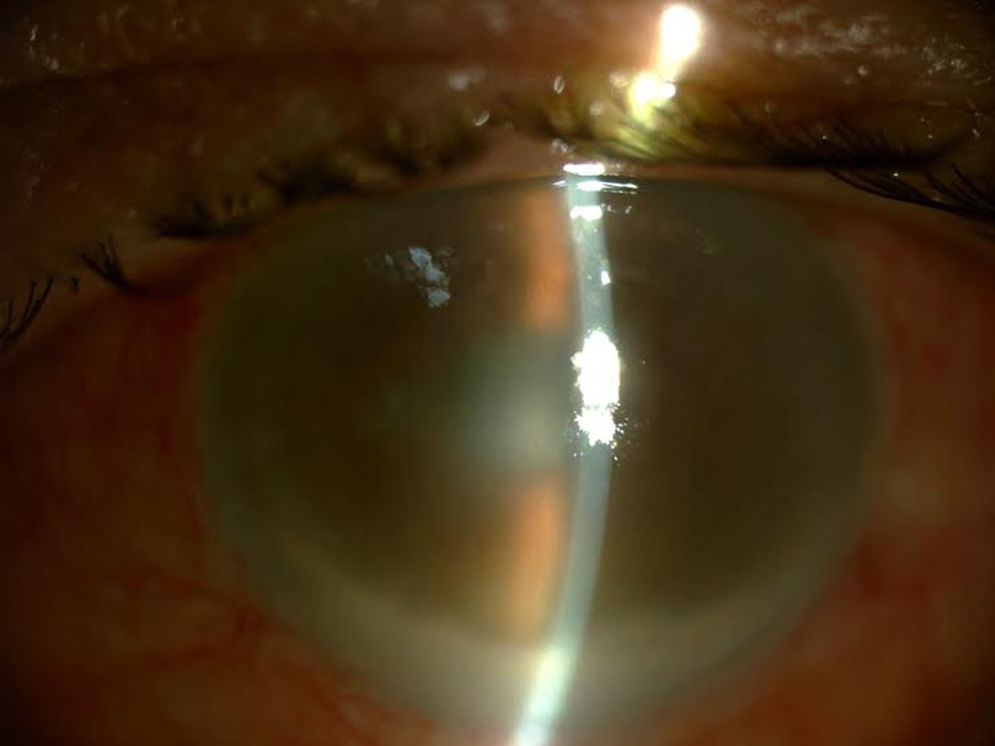
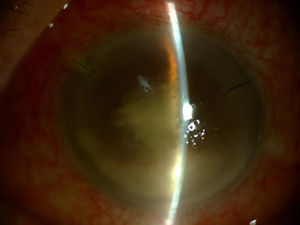
A los 3 días de haberse administrado la última IIV, de 11 previas, acude a Urgencias presentando un cuadro clínico de endoftalmitis hiperaguda, iniciado al día siguiente del procedimiento con disminución severa de la visión, inflamación y dolor ocular (fig. 1).
EvoluciónSe le extrajeron 0,15ml de humor acuoso y 0,4ml de humor vítreo, que se introdujeron en frascos de hemocultivo y se remitieron al Servicio de Microbiología.
Las muestras se incubaron en el sistema automatizado BacT/ALERT® (bioMérieux), según la rutina del laboratorio. A las 24h se detectó crecimiento en humor vítreo, observándose en la tinción de Gram cocos grampositivos en cadenas. Se subcultivó en agar-chocolate, agar-sangre, agar-Sabouraud y medio para anaerobios, recuperándose un Streptococcus α-hemolítico que se identificó como Streptococcus pneumoniae mediante sensibilidad a optoquina y aglutinación rápida de neumococo (Slidex® pneumo-Kit, bioMérieux). Las pruebas de susceptibilidad antimicrobiana se realizaron en disco y E-test, siguiendo las normas del CLSI, resultando sensible a amoxicilina/clavulánico, cefotaxima, penicilina, vancomicina, cotrimoxazol, levofloxacino, eritromicina, clindamicina, tetraciclina, rifampicina y meropenem. El serotipo de esta cepa fue el 35F. El cultivo de humor acuoso fue negativo a los 30 días de incubación.
También se envió una alícuota de muestra al Instituto Universitario de Oftalmología Aplicada de la Universidad de Valladolid para PCR, informándose como Streptococcus spp.
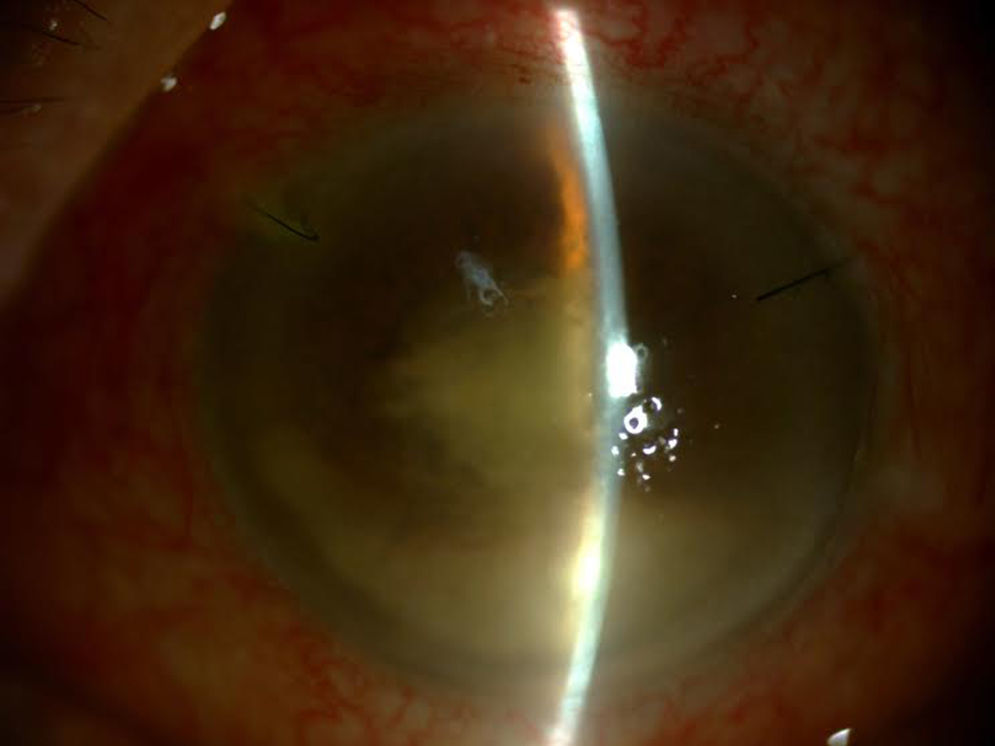
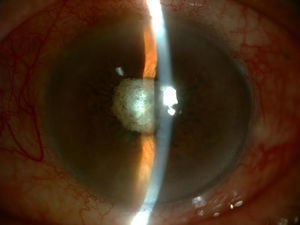
Tras vitrectomía diagnóstica y terapéutica, se inyectó una dosis de vancomicina 1mg/0,1ml, ceftazidima 2mg/0,1ml y dexametasona 4mg/0,1ml intravítreas, y se inició tratamiento oral con moxifloxacino 400mg/día, claritromicina 500mg/12h y prednisona 40mg en pauta descendente, y tópico con moxifloxacino 0,5%, prednisolona acetato 1% y atropina 1% (fig. 2).
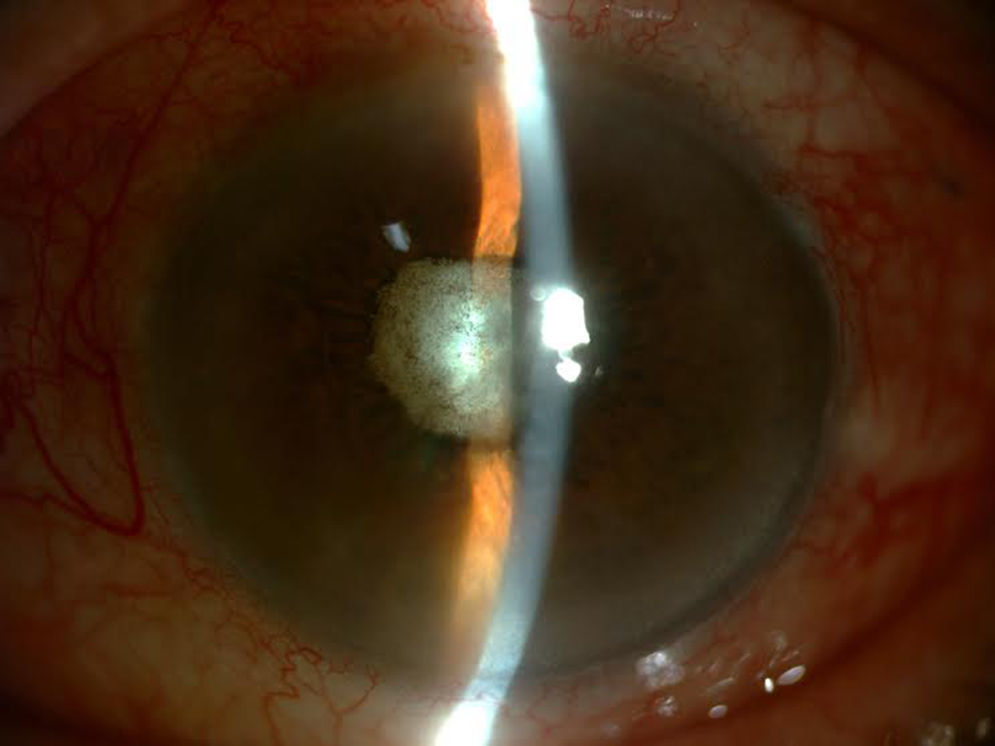
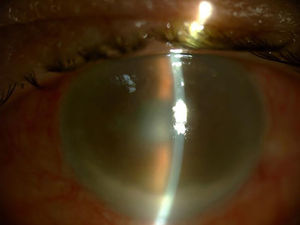
Aunque se observó una leve mejoría inicial, la evolución posterior fue negativa, a pesar de administrarse en 2 ocasiones IIV de vancomicina 1mg/0,1ml y amikacina 0,4mg/0,1ml, y considerarse estéril la cavidad vítrea al presentar cultivos negativos en muestras posteriores. Al tratarse de un ojo amaurótico y doloroso, se optó por la enucleación (fig. 3).
ComentarioLa endoftalmitis es la inflamación de los fluidos y tejidos intraoculares secundaria a un agente infeccioso. Se presenta con visión borrosa, dolor ocular, fotofobia, hiperemia conjuntival e hipopión1. A pesar de un tratamiento adecuado, con frecuencia conduce a la pérdida parcial o total de la visión. La endoftalmitis posquirúrgica es la más frecuente (70%), pudiendo ser aguda (<6 semanas postintervención) o tardía (>6 semanas)2. Aparte de la cirugía, también puede aparecer como consecuencia de la pérdida de la integridad del globo ocular, bien debida a un traumatismo, bien por otros procedimientos, como las IIV3,4.
Ranibizumab es un fragmento de anticuerpo monoclonal humanizado producido en células de Escherichia coli mediante tecnología de ADN recombinante, indicado en diferentes enfermedades oftalmológicas, como la degeneración macular asociada a la edad. Entre sus efectos adversos graves poco frecuentes (≥1/1.000 a<1/100 pacientes) se encuentra la endoftalmitis5.
Se ha publicado que los pacientes sometidos a IIV tienen un mayor riesgo de presentar endoftalmitis estreptocócica, además de tener un peor pronóstico visual6. A pesar del adecuado y precoz tratamiento, la endoftalmitis causada por Streptococcus pneumoniae suele ser de instauración rápida y está asociada a un mal pronóstico visual7.
El serotipo 35F de Streptococcus pneumoniae es poco conocido, y se ha relacionado con casos de enfermedades neumocócicas invasivas. Su emergencia ha cobrado mayor importancia después de la introducción de la vacuna 13-valente, en la cual no está incluido. Su frecuencia en aumento y su virulencia hacen de él un posible candidato a incluirse en futuras vacunas8.
Agradecemos la colaboración del Centro Nacional de Microbiología del Instituto de Salud Carlos III por la realización del serotipado de la cepa, y al Instituto Universitario de Oftalmología Aplicada de la Universidad de Valladolid por el análisis de PCR realizado.