La incidencia de tos ferina ha aumentado últimamente, afectando especialmente a lactantes menores de 2meses. Varias comunidades autónomas han iniciado un programa de vacunación con dTpa a todas las mujeres gestantes en el tercer trimestre de embarazo. Un estudio observacional ha mostrado que esta estrategia reduce la incidencia de tos ferina en lactantes <2meses en un 90%. Modelos matemáticos indican que la estrategia del nido (vacunar a la madre en el posparto inmediato y a los adultos y adolescentes convivientes y cuidadores del recién nacido) reduce en un 70% la incidencia de tos ferina en niños <2meses. Se pretende realizar un ensayo en el que 340 gestantes serán vacunadas con dTpa mientras otras 340 lo serán en el posparto inmediato; a todos los convivientes y cuidadores del recién nacido se ofrecerá vacunarse con dTpa. Tras analizar las razones científicas y éticas del ensayo, se concluye que es ética y legalmente aceptable ofrecer la participación en este ensayo a gestantes que viven en comunidades donde se les ofrece vacunarlas con dTpa.
Pertussis incidence has increased in recent years, especially among infants aged <2months. A number of Spanish regions have started a vaccination program with Tdap vaccine to all pregnant women in the third trimester of pregnancy. An observational study has shown that this strategy reduces the number of cases of pertussis by 90% in infants aged <2months. Mathematical models showed that a cocooning strategy (i.e. vaccination of the mother at immediate postpartum, and other adults and adolescents who have close contact with the newborn and caregivers) will reduce the incidence of pertussis by 70% in infants aged <2months. It is intended to conduct a clinical trial in which 340 pregnant women will receive Tdap vaccine, whereas another 340 pregnant woman will be vaccinated soon after delivery. Vaccination with Tdap will be offered to all partners and caregivers of the newborn. After assessing both the ethical and scientific reasons supporting the trial, it is concluded that it is ethically and legally acceptable to invite pregnant women living in communities where Tdap vaccination has been implemented to participate in the trial.
Recientemente se ha observado una reemergencia de tos ferina, y que la mayor parte de los casos que acontecen en lactantes se producen sobre todo en niños de entre 1 y 2meses de vida —en España la tos ferina alcanzó en 2011 un pico de incidencia de entre 600 y 700 casos/100.000 nacidos1—, antes de haberse iniciado la vacunación frente a difteria, tétanos y tos ferina acelular (DTPa), que se administra a los 2, 4 y 6meses del nacimiento. El número de casos notificados en España en 2011 fue de 3.281, de los que el 49% fueron casos confirmados o probables1. En el periodo 1997-2011, a partir del Conjunto Mínimo Básico de Datos la tasa de incidencia media de hospitalizaciones en niños menores de un año fue de 115 casos/100.000 nacidos, la mayor parte (el 72%) en menores de 2meses, que fue de 83 casos/100.000 nacidos; en estos 15años murieron 37 niños, todos menores de 2años2. Lo habitual es que sea el entorno del recién nacido quien contagie al lactante. Un miembro de la familia es el caso primario (caso fuente de la infección) entre el 27 y el 88% de los casos de tos ferina en lactantes3,4.
Para proteger al lactante se recomiendan distintas estrategias, bien a través de la vacunación sistemática del adolescente y del adulto, o bien mediante la estrategia del nido —vacunar a la madre y a los convivientes del lactante, sean o no familiares—; ambas estrategias presentan dificultades logísticas y de aceptabilidad. La estrategia del nido se ha mostrado eficaz en brotes epidémicos5, aunque un reciente estudio —de muestra muy reducida— no mostró sus beneficios6. Esta estrategia puede ser correctamente aplicada en periodos interbrotes7,8, y se recomienda en Alemania, Australia, Canadá, Estados Unidos, Francia y Suiza3.
El Comité Asesor sobre Prácticas de Inmunización (ACIP) de Estados Unidos recomendó en 2011 la vacunación de las mujeres gestantes en su tercer trimestre del embarazo con el objetivo de proteger al lactante9. Hay transferencia transplacentaria pasiva de anticuerpos antipertúsicos de la madre al feto tras la vacunación de la madre con la vacuna frente al tétanos, la difteria y la tos ferina de baja carga (dTpa)10-13; aquellos presentan una vida media de unas 6semanas14, tiempo clave para proteger al lactante que todavía no está protegido.
Datos muy limitados indican que hay altos títulos de anticuerpos en los recién nacidos a los 2meses de vida, y que a los 4meses los lactantes cuyas madres fueron vacunadas con dTpa tenían títulos de anticuerpos similares a los lactantes cuyas madres no lo fueron15. Un estudio observacional realizado en Inglaterra mostró que la vacunación frente a la tos ferina en embarazadas tuvo una efectividad del 90% en lactantes menores de 2 meses16.
El ACIP recomienda la vacunación de todas las gestantes en el tercer trimestre del embarazo, idealmente entre las semanas 27 y 36 de embarazo. Esto debe complementarse con la estrategia del nido, vacunando a ser posible con, al menos, 2semanas de antelación al probable nacimiento del bebé, a los convivientes del recién nacido que no hayan sido vacunados con dTpa con anterioridad; si una mujer gestante no ha sido vacunada con dTpa, ni antes ni durante el embarazo, deberá serlo inmediatamente después de dar la luz9,17. El Colegio Americano de Obstetras y Ginecólogos18, así como destacados especialistas de 5 sociedades médicas españolas3, suscriben esta recomendación en todos sus términos.
Las vacunas con toxoide tetánico (T y dT) en embarazadas son bien toleradas y no afectan ni a la madre ni al recién nacido17. De la vacuna dTpa se dispone de menos datos, pero de los disponibles no se desprende patrón inusual alguno de reacciones adversas15,17,19.
Vacunación con dTpa a embarazadas en EspañaVarias comunidades autónomas, entre ellas Cataluña, la Comunidad Canaria, la Comunidad Valenciana, Extremadura y el País Vasco, han implementado la vacunación con dTpa en gestantes entre la semana 27.ª y 36.ª de embarazo, sin hacer mención alguna a la estrategia del nido. El objetivo es alcanzar una cobertura de al menos el 50%20 o superior al 50%21. En Michigan (EE.UU.) se ha observado que solo el 35% de las mujeres a las que se ofreció la vacunación de forma gratuita aceptaron ser vacunadas22. En Inglaterra, la aceptabilidad del programa de vacunación a embarazadas se acercó al 60%16.
Ensayo clínico de dTpa en mujeres embarazadasSe plantea realizar un ensayo clínico —dTpa-(Boostrix)-047— en una población en la que no se ha estudiado con anterioridad. El único ensayo clínico realizado hasta la fecha se llevó a cabo con la vacuna Adacel (de Sanofi Pasteur) en 48 mujeres (33 recibieron Adacel y 15 placebo) con resultados positivos, aunque preliminares15. Si bien la composición de Triaxis (de Sanofi Pasteur MSD) —nombre de Adacel en España— difiere ligeramente de la de Boostrix (GSK), ambas vacunas están comercializadas y presentan una eficacia y un perfil de seguridad similares. Al margen del ensayo clínico controlado con placebo mencionado15, se ha determinado la media geométrica de la concentración de un solo tipo de anticuerpos (los anti toxoide pertúsico) en 2 estudios observacionales sin grupo control11,12, y de anticuerpos frente a los 3 componentes antigénicos de B.pertussis que contiene Boostrix en estudios observacionales prospectivos con grupo control en un número muy reducido de mujeres embarazadas10,13. La tabla 1 resume las principales características del ensayo propuesto. En ella se observa que se determinará la media geométrica de la concentración de los anticuerpos frente a los 3 componentes antigénicos de B.pertussis de Boostrix en los 640 casos que participarán en el ensayo.
Principales características del ensayo clínico dTpa-(Boostrix)-047 propuesto por GSK
| Diseño | Ensayo multicéntrico, internacional, cruzado, controlado con placebo, de observador ciego |
| Objetivo primario | Demostrar que la inmunogenicidad de una sola dosis de Boostrix produce en la sangre del cordón unos títulos de anticuerpos (medidos en GMC) superiores a los del grupo control. Se considerará una respuesta positiva si el límite inferior del IC95% de la tasa GMC (Grupo dTpa dividido por Grupo control) para los 3 tipos de anticuerpos (anti-TP, anti-FHA y anti-PRN) es >1,5 |
| Tamaño de la muestra | 680 mujeres embarazadas entre 18 y 45 años de edad, distribuidas en 2 grupos de 340 cada uno |
| Administración de la vacuna y del placebo a las madres | Entre las 27.ª y 36.ª semanas de gestación un grupo recibirá una dosis de Boostrix y el otro, el grupo control, una dosis de placebo (suero salino). Durante las primeras 72h posparto, el grupo control recibirá una dosis de Boostrix, mientras que el grupo de Boostrix recibirá una dosis de placebo. A todos los convivientes (adolescentes y adultos) de todos los recién nacidos se les ofrecerá la vacunación con Boostrix (estrategia del nido) |
anti-FHA: anti hemaglutinina filamentosa; anti-PRN: anti pertactina; anti-TP: anti toxoide pertúsico; GMC: media geométrica de concentración de anticuerpos (Geometric Mean Concentration); IC95%: intervalo de confianza del 95%.
Algunos clínicos y especialistas en salud pública entienden que el ensayo propuesto no debe realizarse en comunidades en las que la autoridad sanitaria ofrece gratuitamente la vacunación con dTpa a mujeres embarazas. Argumentan que si se les ofrece la vacuna dTpa a las gestantes, no se debe invitar a ninguna de ellas a soslayar la vacunación dentro de la campaña para entrar en el ensayo. ¿Es esta una actitud correcta desde el punto de vista ético?
Esta cuestión se plantea asumiendo que el ensayo clínico haya sido aprobado por el comité de ética de la investigación pertinente y autorizado por la Agencia Española de Medicamentos y Productos Sanitarios.
La situación que el ensayo plantea es la siguiente:
- a)
La vacunación con dTpa a embarazadas pretende proteger al lactante durante los primeros 2-3meses de vida. El beneficio, por tanto, es para el hijo. A diferencia de lo que aconseja el ACIP, el programa de vacunación de las comunidades autónomas no incluye la estrategia del nido.
- b)
Autoridades sanitarias como las de Cataluña y la Comunidad Valenciana han planteado unos objetivos de cobertura vacunal de un mínimo del 50% de las embarazadas en el primer año del programa, lo que implica que estiman que serán miles las que no aceptarán ser vacunadas durante la gestación. Es muy probable que entre estas no se vacune mujer alguna en los primeros días del posparto, pues los programas de vacunación de las comunidades no contemplan tal posibilidad. La gratuidad de la vacuna dista de ser un factor determinante en la aceptación generalizada de la vacunación con dTpa entre embarazadas. Los datos disponibles señalan que oscila entre el 35%22 y casi el 60%16.
- c)
El ensayo clínico pretende comprobar que la transferencia de anticuerpos maternos al feto en el grupo que recibió la vacuna dTpa es superior (a un límite predeterminado) a los transferidos en mujeres que no fueron vacunadas durante el embarazo. El 50% de las mujeres que acepten participar en el ensayo recibirán la vacuna dTpa como si aceptasen ser vacunadas en la campaña de vacunación. El otro 50% de gestantes participantes en el ensayo recibirán la vacuna dTpa en las primeras 72h posparto. Es más, a todos los convivientes y cuidadores de los recién nacidos de todas las mujeres participantes en el ensayo se les ofrecerá la vacunación con dTpa (estrategia del nido). Es decir, a todas las mujeres participantes se les vacuna según las recomendaciones del ACIP, tanto a las gestantes como a las puérperas17.
- d)
En España, la incidencia de tos ferina es máxima en niños de entre 1 y 2meses, y alcanzó en 2011 los 600-700 casos/100.000 nacidos1. Datos disponibles más pormenorizados y más recientes (2011-2014) de la Comunidad Valenciana y de lactantes de hasta 2meses de vida indican que la tasa de incidencia de tos ferina se situó entre 260 y 680 casos/100.000 nacidos, que se ingresaron entre el 82 y el 100% de los casos, totalizando entre 28 y 83 casos/año, con una estancia hospitalaria de 10-12días y con una mortalidad de entre 0 y 3 casos/año; la tasa de incidencia de tos ferina en niños de entre 3 y 12 meses edad varió entre 43 y 113 casos/100.000 habitantes20. Los datos de Cataluña —comunidad en donde han aparecido alrededor del 80% de los brotes epidémicos y de sus casos comunicados en España en 20111— indican que en ese año se alcanzó una tasa de incidencia de 469 casos/100.000 niños menores de un año de edad21.
- e)
El riesgo de que los lactantes menores de 2meses padezcan tos ferina puede reducirse en un 90% si se administra la vacuna a sus madres en el tercer trimestre de embarazo16. No se conoce si con la administración de una dosis de dTpa a los convivientes, además de a la madre, se obtendría una reducción adicional (y en qué cuantía) en la tasa de riesgo de los recién nacidos. La administración de dTpa a la mujer en el puerperio inmediato también supone una importante reducción del riesgo de padecer tos ferina en niños <12meses que, según el modelo matemático del ACIP, es el 60% de la producida por la vacunación de las gestantes17. Por otra parte, otros modelos han estimado que la correcta implementación de la estrategia del nido puede reducir hasta en un 70% los casos de tos ferina en lactantes de <3meses de edad23,24.Con estos datos, se puede asumir el siguiente escenario teórico más desfavorable respecto del riesgo al que se enfrentan los participantes en el ensayo propuesto. El tipo (presentar tos ferina) y magnitud (que requiera o no hospitalización) del riesgo es común a todos los lactantes del ensayo. Solo diferirán en la incidencia esperada de aparición en cada grupo. Así, la tasa de incidencia máxima en lactantes menores de hasta 2meses de vida de 700/100.000; la reducción de esta tasa del 90% si se administra la vacuna a las embarazadas, y del 70% si no se administra a gestantes pero se realiza una correcta estrategia del nido, daría unas tasas de incidencia de 70/100.000 y de 210/100.000, respectivamente; es decir, de 0,7/1.000 y 2,1/1.000, respectivamente. Tomando como referencia la tasa de incidencia de tos ferina en lactantes nacidos de madres vacunadas (0,7/1.000), habría que vacunar a 714 mujeres en el posparto (y a los convivientes) para que se presentase un caso adicional de tos ferina en un lactante25. Recuérdese que en el ensayo se pretende incluir 340 mujeres en el grupo que recibirá la vacuna en el puerperio inmediato.
- f)
Rid et al.26 elaboraron un método para la evaluación sistemática de riesgos en la investigación clínica. En él se establece una gradación de la magnitud del daño en 7 situaciones, desde el daño insignificante (p.ej., una magulladura) al daño catastrófico (p.ej., muerte), en relación con el riesgo encontrado en la vida diaria relacionada con la práctica deportiva y a viajar en coche. Así, por ejemplo, jugar al fútbol conlleva un riesgo de 1/10.000 de sufrir una rotura completa de ligamento, y viajar en coche un riesgo de muerte de 1/1.000.00026. Admitiendo que el riesgo del ensayo sea que el lactante padezca tos ferina, se concluye que el riesgo de todos los lactantes cuyas madres participasen en el ensayo (entre 0,7/1.000 y 2,1/1.000) sería del orden del riesgo de padecer un daño de magnitud moderada (p.ej., una fractura ósea) en la vida diaria (deportiva y de automoción), que es de alrededor de un caso/1.00026.
- g)
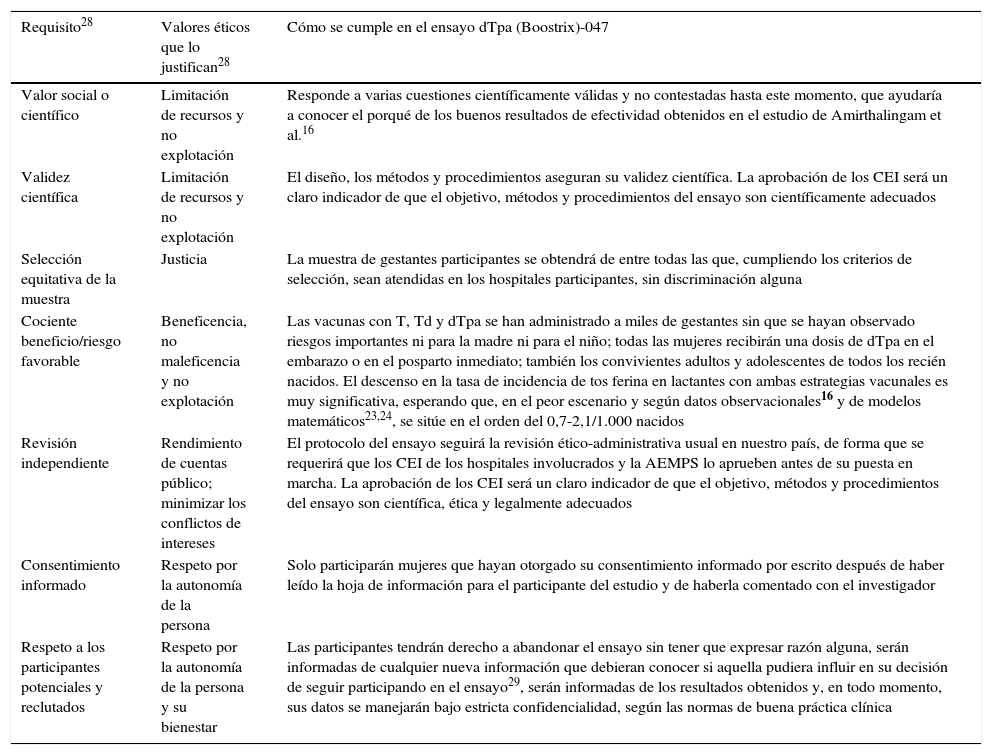
Como es bien sabido, los principios éticos básicos de toda investigación en seres humanos —autonomía, beneficencia y justicia— fueron establecidos por el Informe Belmont27. Veinte años más tarde, Emanuel et al.28 establecieron los 7 requisitos éticos que debe cumplir toda investigación con seres humanos y que se fundamentan en los principios del Informe Belmont, pero ampliados, sobre todo, en los aspectos sociales de la investigación. Como se observa en la tabla 2, el ensayo propuesto cumple los requisitos exigibles.
Tabla 2.Requisitos éticos que debe cumplir toda investigación con seres humanos, según Emanuel et al.28
Requisito28 Valores éticos que lo justifican28 Cómo se cumple en el ensayo dTpa (Boostrix)-047 Valor social o científico Limitación de recursos y no explotación Responde a varias cuestiones científicamente válidas y no contestadas hasta este momento, que ayudaría a conocer el porqué de los buenos resultados de efectividad obtenidos en el estudio de Amirthalingam et al.16 Validez científica Limitación de recursos y no explotación El diseño, los métodos y procedimientos aseguran su validez científica. La aprobación de los CEI será un claro indicador de que el objetivo, métodos y procedimientos del ensayo son científicamente adecuados Selección equitativa de la muestra Justicia La muestra de gestantes participantes se obtendrá de entre todas las que, cumpliendo los criterios de selección, sean atendidas en los hospitales participantes, sin discriminación alguna Cociente beneficio/riesgo favorable Beneficencia, no maleficencia y no explotación Las vacunas con T, Td y dTpa se han administrado a miles de gestantes sin que se hayan observado riesgos importantes ni para la madre ni para el niño; todas las mujeres recibirán una dosis de dTpa en el embarazo o en el posparto inmediato; también los convivientes adultos y adolescentes de todos los recién nacidos. El descenso en la tasa de incidencia de tos ferina en lactantes con ambas estrategias vacunales es muy significativa, esperando que, en el peor escenario y según datos observacionales16 y de modelos matemáticos23,24, se sitúe en el orden del 0,7-2,1/1.000 nacidos Revisión independiente Rendimiento de cuentas público; minimizar los conflictos de intereses El protocolo del ensayo seguirá la revisión ético-administrativa usual en nuestro país, de forma que se requerirá que los CEI de los hospitales involucrados y la AEMPS lo aprueben antes de su puesta en marcha. La aprobación de los CEI será un claro indicador de que el objetivo, métodos y procedimientos del ensayo son científica, ética y legalmente adecuados Consentimiento informado Respeto por la autonomía de la persona Solo participarán mujeres que hayan otorgado su consentimiento informado por escrito después de haber leído la hoja de información para el participante del estudio y de haberla comentado con el investigador Respeto a los participantes potenciales y reclutados Respeto por la autonomía de la persona y su bienestar Las participantes tendrán derecho a abandonar el ensayo sin tener que expresar razón alguna, serán informadas de cualquier nueva información que debieran conocer si aquella pudiera influir en su decisión de seguir participando en el ensayo29, serán informadas de los resultados obtenidos y, en todo momento, sus datos se manejarán bajo estricta confidencialidad, según las normas de buena práctica clínica AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; CEI: comité de ética de la investigación; dTpa: vacuna frente a difteria, tétanos y tos ferina de baja carga; T: vacuna frente a tétanos; Td; vacuna frente a tétanos y difteria tipo adulto.
Así pues, el escenario que plantea el problema ético es si a una mujer embarazada a la que se ha informado de que en su comunidad se ha iniciado un programa de vacunación con dTpa, se la puede invitar a participar en un ensayo que, en sí mismo, cumple los requisitos éticos (y científicos) exigibles a toda investigación en seres humanos. Es decir, el problema ético no se plantearía en una comunidad en la que no se ofreciese la vacunación gratuita con dTpa a las mujeres embarazadas.
Ensayos clínicos que plantean un conflicto ético similar al del ensayo propuestoEl escenario planteado por el ensayo dTpa-(Boostrix)-047 es muy infrecuente en investigación clínica. Sí ocurrió, sin embargo, en el ensayo exploratorio de Munoz et al.15, que se realizó entre octubre de 2008 y mayo de 2012. En efecto, como el ACIP recomendó la vacunación con dTpa en embarazadas desde junio de 20119 hubo, por tanto, mujeres gestantes que aceptaron participar en este ensayo después de que la recomendación estuviese ya vigente. Al margen de este caso, como el beneficiario de la vacunación es el lactante, hay 2 situaciones en las que se puede argüir que tienen ciertas similitudes con la situación del ensayo propuesto, en investigación clínica realizada en niños que no tienen edad suficiente para asentir, es decir, que no hayan cumplido los 7años30.
El primer escenario es el planteado por los ensayos en los que se investigaba la inmunogenicidad y reatogenicidad de vacunas pentavalentes (DTPa-HBV-IPV) o hexavalentes (DTPa-HBV-IPV/Hib) administradas a los 2, 4 y 6meses de edad junto con vacuna frente a meningococoC conjugada con una variante no tóxica de la toxina diftérica (MenC-CRM)31, o frente a meningococoC conjugada con toxoide tetánico (MenC-TT)32, o frente a meningococoC y H.influenzae (Hib-MenC)33. Desde comienzos del sigloxxi, en varias comunidades autónomas se administra la primera dosis de vacuna frente a hepatitisB en el recién nacido antes de darle el alta hospitalaria. Como la pauta de administración de la vacuna en los ensayos consistía en 3 dosis a los 2, 4 y 6meses, los niños a incluir en el estudio no deberían recibir la primera dosis de vacuna anti-hepatitisB que el calendario vacunal establecía. Para realizar el ensayo los investigadores tuvieron que informar acerca del ensayo a las madres inmediatamente después de dar a luz y obtener su consentimiento para que sus hijos participasen en el ensayo y no recibieran la primera dosis de la vacuna anti-hepatitisB según establecía el calendario vacunal. Es evidente que, por los mecanismos de transmisión, el riesgo de un recién nacido de infectarse con el virus de la hepatitisB es muy inferior a hacerlo con B.pertussis, aunque, como se ha visto, el riesgo de que un lactante del ensayo padezca tos ferina es muy bajo. El ejemplo es válido para el análisis, pues es la madre la que decide posponer una vacunación presente en el calendario vacunal para su hijo.
El segundo escenario es claramente diferente, pero plantea una situación que tiene una característica similar al caso que nos ocupa. Son los ensayos clínicos en enfermedades crónicas en los que los pacientes están siendo tratados con la terapia habitual. En estos casos, si se investiga la eficacia de un nuevo medicamento o de un nuevo régimen terapéutico, es habitual que al paciente se le someta durante un tiempo reducido a un período de selección (screening, run-in) o de lavado (wash out), en el que el paciente no recibe medicación activa —si acaso, solo puede recibir medicación de rescate en situación de necesidad manifiesta— y durante el cual suele recibir placebo; tras este período los pacientes son aleatorizados al grupo experimental o al grupo control (en el que recibirán terapia activa o placebo). En estos casos ya no se pospone una vacunación, sino que se retira una medicación que el paciente estaba recibiendo durante un tiempo de semanas o incluso meses. Así, por ejemplo, es habitual que niños hipertensos de entre 1 y 6años de edad que participen en ensayos clínicos tengan una semana de período de selección con placebo de una semana34,35, a la que pueden seguir otros 14 días de placebo antes de recibir medicación activa34. En uno de los ensayos más relevantes para el estudio del control de la hipertensión arterial en niños con insuficiencia renal crónica, se mantuvo a un tercio de los participantes sin tratamiento antihipertensivo durante 2meses como mínimo, antes de la aleatorización a terapia activa36. Del mismo modo, niños con asma leve de entre 2 y 6años de edad participantes en ensayos clínicos suelen tener entre 2 y 4semanas de periodo de selección antes de ser aleatorizados a uno de los grupos de tratamiento37,38, uno de los cuales recibió placebo durante 12 semanas37 o 24 semanas38.
Las razones por las que unos padres autorizan a que sus hijos enfermos estén durante cortos períodos de tiempo sin recibir tratamiento activo son, sin duda, múltiples. Las decisiones de los padres sobre la eventual participación de sus hijos en un ensayo clínico están influenciadas por sus percepciones sobre el bienestar, un bajo nivel de riesgo y la seguridad de sus hijos en el ensayo, beneficios potenciales para sus hijos, la familia y otros niños, si el ensayo interfiere poco en el cuidado habitual o se acompaña de un mayor cuidado, y los aspectos prácticos de su participación39,40. Aunque el riesgo de todos los ensayos clínicos mencionados antes fue minimizado al máximo, el riesgo percibido por los padres —y en general por la población— suele ser menor si los niños siguiesen con su tratamiento habitual a que si se les incluye en un ensayo clínico. De hecho, los ciudadanos cometen el error de pensar que la autoridad sanitaria solo autoriza nuevos medicamentos que son muy eficaces y que carecen de efectos adversos graves41, aunque, de hecho, muchos pacientes son sometidos a intervenciones de poco valor42.
Relación médico-enfermo y el ensayo dTpa-(Boostrix)-047 en comunidades que vacunan con dTpa a las gestantesEl modelo de relación entre médico y paciente válido en Occidente hasta las últimas décadas del sigloxx se fundamentaba en que el médico buscaba el bien de su paciente bajo la premisa del principio moral de beneficencia. En esta relación, el bien lo define el facultativo sin que importe mucho lo que el enfermo pudiese opinar. De ahí que esta relación se conociese como «paternalista».
Los derechos de los pacientes empezaron a fraguarse en Estados Unidos, y posteriormente en diversos países de Europa a lo largo de las últimas 3 décadas del sigloxx43; antes, también en Estados Unidos, se había desarrollado la teoría del consentimiento informado desde una perspectiva jurídica44. Así, desde la década de 1970 empezó a cambiar la relación médico-enfermo: aquel empezó a perder el poder de decisión que tenía sobre el paciente y que había disfrutado durante siglos, para empezar a establecer una relación más equilibrada en la que el paciente y su médico toman decisiones de forma informada y acordada43.
En España, la Ley General de Sanidad de 1986 recoge el cambio en la relación médico-paciente de forma que sanciona la autonomía del enfermo —y, por consiguiente, la necesidad de obtener su consentimiento informado—, frente al modelo paternalista de antaño45. En 1997, el Convenio de Oviedo, impulsado por el Consejo de Europa, establece que toda intervención solo podrá llevarse a cabo tras obtener el consentimiento libre e informado de la persona afectada46. La ley básica reguladora de la autonomía del paciente establece que este, tras recibir la información pertinente, tiene derecho a decidir con plena libertad entre las intervenciones disponibles e, incluso, puede negarse a recibir tratamiento, excepto en los casos que establezca la ley47. Es por ello que todo profesional en su actividad asistencial deberá respetar las decisiones que tome libre y voluntariamente el paciente. Por tanto, todo enfermo tiene el derecho a que se le respete, a que se respeten sus decisiones y a que estas se manifiesten en el consentimiento informado. Este es una autorización libre y expresa a que se le realice una intervención diagnóstica, preventiva o terapéutica determinada, o a ser incluido en una investigación44.
La legislación española, por tanto, decreta que la relación médico-enfermo debe establecerse en un marco en el que los valores y preferencias del paciente deben ser tenidos en cuenta por el profesional sanitario y que, en caso de discrepancia, la decisión del enfermo prevalecerá sobre la de cualquier otra consideración. Así pues, parece que ética y legalmente un facultativo no debe «decidir por» su paciente en caso alguno, excepto en los que contemple la ley. Por tanto, en el caso que nos ocupa, el facultativo que informa a una gestante de la vacunación frente a tos ferina con dTpa no debe en caso alguno omitir informar sobre el ensayo clínico, pues en este caso estaría arrogándose una decisión que no le corresponde. Debe ser la gestante la que decida, una vez informada adecuadamente, si participa en el ensayo o si, por el contrario, decide ser vacunada dentro del programa o no serlo en absoluto.
Por otra parte, los facultativos no deben presumir que el hecho de que el programa de vacunación esté en marcha sea un obstáculo insalvable para el reclutamiento de casos en el ensayo. Ya se ha visto que son muchas y variadas las razones que llevan a unas madres o padres a autorizar a que sus hijos de muy corta edad participen en ensayos clínicos. Es más, es interesante observar que carece de fundamento la creencia común entre algunos médicos de que preguntar a los padres de un niño que potencialmente podría participar en un ensayo clínico les abruma39. No se debe descartar a priori que haya madres que no deseen ser vacunadas dentro del programa de vacunación pero que quieran participar en el ensayo, al percibir que esto conlleva ciertos beneficios.
ConclusiónEl objetivo último de la ética es formar personas capaces de tomar decisiones autónomas y responsables48. A la luz del principio (ético y) legal de autonomía que establece que es la persona quien debe decidir —con la asistencia del profesional sanitario— cuáles son las intervenciones diagnósticas, preventivas y terapéuticas a las que se someterá, no parece que en el momento actual haya espacio para la clásica actitud paternalista del médico en su actividad asistencial. Por todo ello, los facultativos que ejerzan en comunidades en donde se haya implantado la vacunación de embarazadas con dTpa deberán, para poder respetar la voluntad de sus pacientes, informar de la existencia del ensayo de forma que, tras conocer sus riesgos, beneficios, requerimientos e incomodidades, puedan tomar una decisión juiciosa sobre su eventual participación en el ensayo. Otra actitud por parte del profesional sanitario sería paternalista y, por tanto, errónea, pues ignoraría los valores y preferencias de la paciente, que siempre deben ser respetadas49-51.
Una mujer gestante en una comunidad en donde se ofrece gratuitamente la vacuna dTpa y donde se lleva a cabo el ensayo tiene derecho a conocer las 3 oportunidades con las que cuenta: vacunarse en el programa, participar en el ensayo, y no vacunarse ni participar en el estudio. Este derecho no debe ser violado por una actitud paternalista del facultativo que se niega a participar en el ensayo —y, por tanto, no puede ofrecer esta posibilidad a sus pacientes—, entendiendo que es un tercero —la autoridad sanitaria— quien, al haber implementado el programa, impide de facto que la paciente tome una decisión —participar o no en el ensayo— que solo le corresponde a ella. En este supuesto, el facultativo se inhibe de su responsabilidad, que no es otra que informar adecuadamente de por qué es importante que se vacune y sobre la posibilidad de participar en el ensayo.
FinanciaciónEste trabajo, realizado a solicitud de GSK SA, no requirió financiación alguna.
Conflicto de interesesEl autor declara que no tiene conflicto de intereses alguno.