Conocer las características clínicas y epidemiológicas de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y aislamiento de especies de Aspergillus en muestra respiratoria e identificar factores que nos ayuden a diferenciar entre colonización e infección.
MétodosEstudio de cohortes retrospectivo en el que se incluyeron todos los pacientes con EPOC y aislamiento de Aspergillus spp. en muestra respiratoria durante un periodo de 12 años. Se asignaron los pacientes a 2 categorías: colonización y aspergilosis pulmonar (AP), que incluye las diferentes formas de presentación clínica. Se aplicó un modelo de regresión logística binaria para identificar los factores predictores de desarrollo de AP.
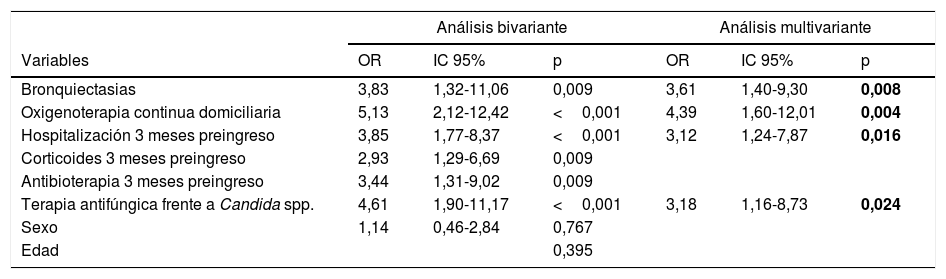
ResultadosUn total de 123 pacientes fueron incluidos en el estudio: 48 (39%) colonizados y 75 (61%) con AP: 68 con AP invasiva probable y 7 con AP crónica. No hubo correlación entre el riesgo de AP y los estadios espirométricos de la clasificación GOLD. Se identificaron como factores predictores independientes de AP en pacientes con EPOC la oxigenoterapia domiciliaria (OR: 4,39; IC 95%: 1,60-12,01; p=0,004), las bronquiectasias (OR: 3,61; IC 95%: 1,40-9,30; p=0,008), la hospitalización en los 3 meses previos al ingreso (OR: 3,12; IC 95%: 1,24-7,87; p=0,016) y la terapia antifúngica frente a Candida spp. en el mes previo (OR: 3,18; IC 95%: 1,16-8,73; p=0,024).
ConclusionesLa oxigenoterapia continua domiciliaria, las bronquiectasias, la hospitalización en los 3 meses previos al ingreso y la utilización de terapia antifúngica frente a Candida spp. en el mes previo se asocian a mayor riesgo de AP en pacientes con EPOC.
To explore the clinical and epidemiological characteristics of chronic obstructive pulmonary disease (COPD) patients with Aspergillus spp. isolation from respiratory samples, and to identify which factors may help us to distinguish between colonisation and infection.
MethodsA retrospective cohort study was performed. All patients with COPD and respiratory isolation of Aspergillus spp. over a 12-year period were included. Patients were assigned to 2 categories: colonisation and pulmonary aspergillosis (PA), which includes the different clinical forms of aspergillosis. A binary logistic regression model was performed to identify the predictive factors of PA.
ResultsA total of 123 patients were included in the study: 48 (39.0%) with colonisation and 75 (61.0%) with PA: 68 with probable invasive pulmonary aspergillosis and 7 with chronic pulmonary aspergillosis. Spirometric stages of the GOLD classification were not correlated with a higher risk of PA. Four independent predictive factors of PA in COPD patients were identified: home oxygen therapy (OR: 4.39; 95% CI: 1.60-12.01; P=.004), bronchiectasis (OR: 3.61; 95% CI: 1.40-9.30; P=.008), hospital admission in the previous three months (OR: 3.12; 95% CI: 1.24-7.87; P=.016) and antifungal therapy against Candida spp. in the previous month (OR: 3.18; 95% CI: 1.16-8.73; P=.024).
ConclusionsContinuous home oxygen therapy, bronchiectasis, hospital admission in the previous three months and administration of antifungal medication against Candida spp. in the previous month were associated with a higher risk of pulmonary aspergillosis in patients with COPD.
La aspergilosis pulmonar (AP) es una infección causada por un hongo filamentoso del género Aspergillus con diferentes formas de presentación clínica dependiendo del estado inmunitario y de la presencia de enfermedad pulmonar subyacente: colonización, aspergilosis broncopulmonar alérgica, formas pulmonares crónicas no invasivas y formas invasivas1,2. La AP invasiva (API) afecta clásicamente a pacientes con inmunodepresión, como neutropenia severa, neoplasias hematológicas o pacientes con trasplante3,4. En los últimos años se está observando un aumento del número de infecciones por dicho hongo en pacientes con menor grado de inmunodepresión, como pacientes con neumopatías que reciben corticoides, cáncer, ancianos con hospitalizaciones prolongadas o estancia en unidades de cuidados intensivos5–7. La enfermedad pulmonar obstructiva crónica (EPOC) que ha recibido corticoides y antibióticos es hoy en día el grupo de riesgo de API más frecuente en pacientes no neutropénicos hospitalizados8. Varios factores involucrados en la progresión de la EPOC se han relacionado con un mayor riesgo de API8,9. En este grupo de pacientes, el significado del aislamiento de Aspergillus spp. en muestra respiratoria es controvertido. Se cuestiona si la colonización podría ser un estado temporal, un portador crónico con un curso benigno o un signo precoz de enfermedad invasiva10,11. Diversos factores como un porcentaje elevado de colonizaciones, una forma de presentación clínica menos agresiva y poco específica o la ausencia de pruebas diagnósticas invasivas, hacen difícil diferenciar entre enfermedad fúngica y colonización lo que supone un retraso en el diagnóstico. Bulpa et al. han propuesto los criterios de API posible, probable y probada en pacientes con EPOC12. Por otro lado, sabemos que un diagnóstico y tratamiento precoces son cruciales para mejorar el pronóstico de la enfermedad12,13.
El objetivo de este estudio es identificar factores que nos ayuden a diferenciar entre colonización y enfermedad pulmonar fúngica en pacientes con EPOC y aislamiento respiratorio de Aspergillus spp.
Material y métodosDiseño del estudioSe realizó un estudio de cohortes retrospectivo en un hospital de 84 camas en Ribeira (A Coruña, España) con una población de referencia de 65.000 habitantes. Este hospital cuenta con una planta de hospitalización de Medicina Interna de 41 camas sin unidad de críticos ni trasplantes. Se incluyeron todos los pacientes con aislamiento de Aspergillus spp. en muestra respiratoria durante un periodo de 12 años (desde el 1 de enero 2007 al 31 de diciembre 2018). Las muestras respiratorias fueron examinadas mediante tinción de Gram y valoradas según los criterios de Murray y Washington. Se consideraron válidas aquellas pertenecientes al grupo 4 (10-25 células epiteliales y>25 leucocitos) y al grupo 5 (<10 células epiteliales y>25 leucocitos).
Las variables recogidas fueron: edad, sexo, índice de Charlson, comorbilidades, estadio de severidad de la EPOC, fenotipo clínico, alteración pulmonar estructural previa, oxigenoterapia continua domiciliaria (OCD), esteroides sistémicos y terapia antibiótica en los 3 meses previos al ingreso y durante el episodio previo al aislamiento, toma de nistatina o fluconazol en el mes previo, hospitalizaciones en el año previo, exacerbaciones que motivaron ingreso o atención en urgencias en el último año, días desde el ingreso hasta el aislamiento, datos microbiológicos, radiológicos y de laboratorio, tratamiento antifúngico, evolución clínica y mortalidad.
Para la valoración del grado de comorbilidad hemos utilizado el índice de comorbilidad de Charlson14. En pacientes con EPOC, la clasificación se realizó según las guías Global Initiative for Chronic Obstructive Lung Disease (GOLD)15 y el fenotipo clínico según la guía española de la EPOC (GesEPOC)16. El uso de esteroides sistémicos se ha definido como la toma de esteroides durante al menos 48h. Adicionalmente se han calculado la dosis acumulada y la dosis media diaria de prednisona o equivalente. Hemos definido terapia antibiótica combinada de amplio espectro como la utilización combinada de antibióticos con cobertura frente a bacilo gramnegativo resistente a cefalosporina de 3.a generación y fluorquinolonas y grampositivo resistente a meticilina. Las muestras respiratorias fueron procesadas por el Servicio de Microbiología del hospital de referencia realizándose procedimientos estándar que incluyen tinción de Gram y cultivo en medio Sabouraud para el aislamiento de hongos. Las muestras se incuban entre 32-37°C y las colonias de hongos se identifican mediante métodos macro- y microscópicos y espectrometría de masa desde el año 2012. La determinación de galactomanano sérico se hizo mediante la prueba de Platelia Aspergillus EIA (Bio-Rad Laboratories, Francia, Ref 62794), según recomendaciones del fabricante: un índice>0,5 se considera positivo. Para la detección de precipitinas séricas frente a Aspergillus se utilizó el método de inmunodifusión de Ouchterlony (Microgen Bioproducts). Las pruebas radiológicas fueron revisadas por un mismo radiólogo para intentar minimizar la disparidad de criterios. Los pacientes se asignaron a 2 categorías: a) colonización (pacientes con aislamiento de Aspergillus spp. asintomáticos o con nuevos síntomas respiratorios con buena evolución clínica con antibiótico apropiado) y b) AP (considerando los criterios de Bulpa et al.12 para API independientemente del estadio GOLD y los de Denning et al.17 para las formas crónicas: aspergiloma, AP crónica cavitaria, AP necrosante crónica. No hubo ningún caso de API posible (ya que se exigía aislamiento de Aspergillus spp. como criterio para incluir en el estudio). A todos los pacientes se les ha hecho un seguimiento hasta la fecha de fin del estudio o fallecimiento.
Análisis estadísticoSe calcularon frecuencias y porcentajes para las variables cualitativas. Las variables cuantitativas se expresaron como media+desviación típica. La comparación de variables cuantitativas se realizó mediante test de T-Student (para variables con distribución normal) y test de U de Mann-Whitney (para variables con distribución no normal). La comparación de variables cualitativas se realizó mediante el test de Chi-cuadrado o el test exacto de Fisher. El grado de asociación se estimó mediante la odds ratio (OR) con un intervalo de confianza del 95% (IC 95%). Se realizó un análisis de regresión logística binaria (procedimiento por pasos sucesivos) para estudiar qué variables eran predictoras independientes de desarrollar enfermedad pulmonar por Aspergillus spp. Se asignó como variable dependiente la presencia de AP y como variables independientes aquellas que presentaron diferencias significativas (p<0,05) en el análisis bivariante. Se ha confirmado la ausencia de colinealidad significativa a través del factor de inflación de la varianza entre las variables incluidas en el modelo. Para valorar la mortalidad se realizaron las curvas de supervivencia por el método de Kaplan-Meier al final del periodo de seguimiento y a los 120 días. El análisis estadístico se llevó a cabo mediante el programa Statistical Package for the Social Sciences (SPSS) para Windows versión 18.0 (SPSS Inc., an IBM Co. Chicago, Illinois, EE. UU.).
Aspectos éticosHemos obtenido la aprobación del comité de Ética del centro para la utilización de los datos médicos. Se garantizó en todo momento el anonimato y la confidencialidad, así como la protección de los datos.
ResultadosSe incluyeron un total de 123 pacientes con aislamiento de Aspergillus spp. en muestra respiratoria: 48 pacientes fueron colonizaciones y 75 AP: 68 API probable, uno aspergiloma, 5 AP necrosante crónica y uno AP crónica cavitaria. La incidencia de aislamiento de Aspergillus spp. fue de un caso por cada 200 ingresos en Medicina Interna/año y su distribución en los últimos 12 años fue similar (media 10 casos/año). La mayoría de los aislamientos fueron en esputo siendo Aspergillus fumigatus la especie aislada con más frecuencia en 111 pacientes (90,3%), seguido de Aspergillus niger en 9 (7,3%), Aspergillus terreus en 2 (1,6%) y Aspergillus spp. en 8 (6,5%). La determinación de galactomanano sérico se realizó en 34 pacientes (27,7%), siendo positivo solo en 5. El tiempo medio de seguimiento tras el aislamiento fue de 1.251 días para colonización (rango 37-4.092 días) y 176 días para AP (rango 1-3.603 días).
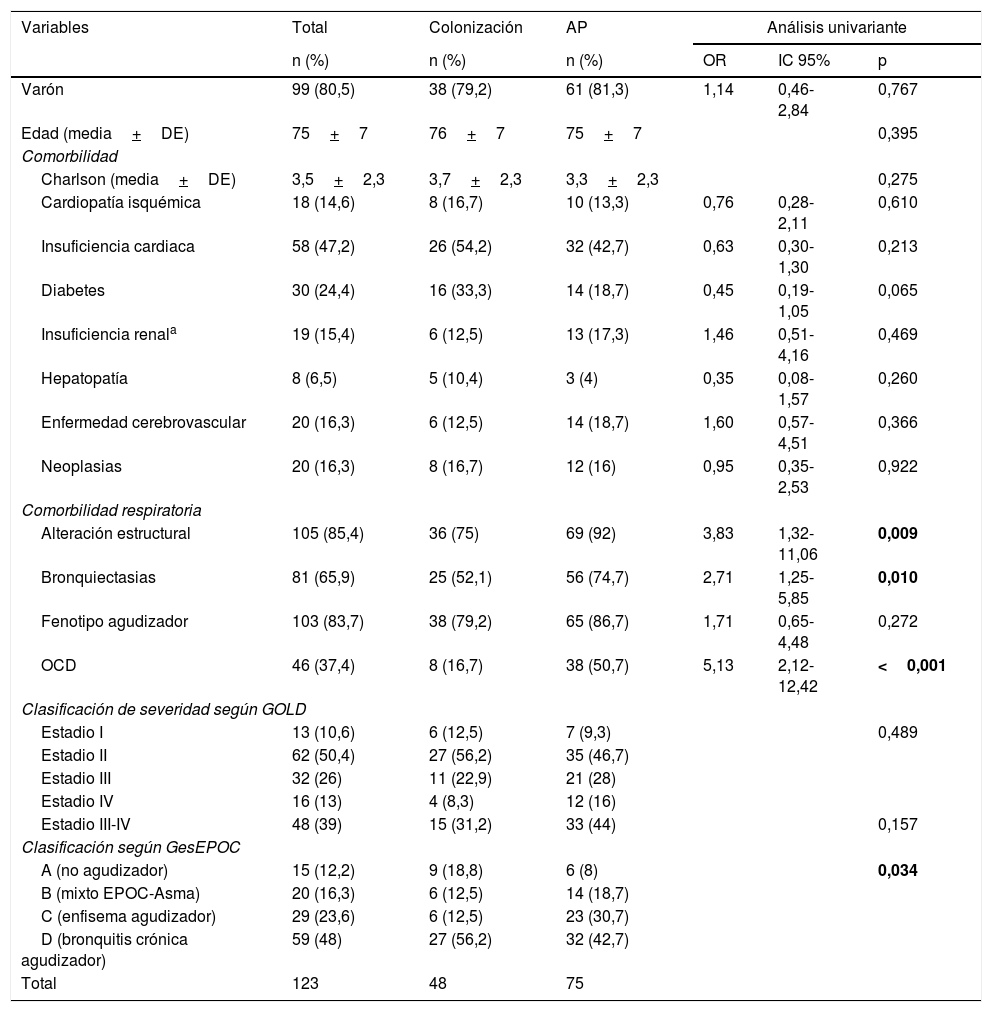
Análisis descriptivoLa tabla 1 muestra los datos epidemiológicos y comorbilidades de los pacientes de nuestro estudio. La edad media fue de 75 años siendo en su mayoría varones. Tenían alteración estructural pulmonar previa el 85,4% de los pacientes (bronquiectasias el 65,9%, bullas-cavidades el 14,6%, enfermedad pulmonar intersticial el 8,1%, cirugía pulmonar el 4,9% y enfermedad pleural el 16,3%), siendo más frecuentes en AP. No se encontraron diferencias significativas entre los grupos con respeto a otras comorbilidades ni en la severidad de la EPOC según la clasificación espirométrica de la GOLD. En cambio se observó un mayor uso de dispositivos de OCD (50,7 vs. 16,7%; p<0,001) en los pacientes con AP.
Datos epidemiológicos y comorbilidades de los pacientes incluidos en el estudio según categoría diagnóstica
| Variables | Total | Colonización | AP | Análisis univariante | ||
|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | OR | IC 95% | p | |
| Varón | 99 (80,5) | 38 (79,2) | 61 (81,3) | 1,14 | 0,46-2,84 | 0,767 |
| Edad (media+DE) | 75+7 | 76+7 | 75+7 | 0,395 | ||
| Comorbilidad | ||||||
| Charlson (media+DE) | 3,5+2,3 | 3,7+2,3 | 3,3+2,3 | 0,275 | ||
| Cardiopatía isquémica | 18 (14,6) | 8 (16,7) | 10 (13,3) | 0,76 | 0,28-2,11 | 0,610 |
| Insuficiencia cardiaca | 58 (47,2) | 26 (54,2) | 32 (42,7) | 0,63 | 0,30-1,30 | 0,213 |
| Diabetes | 30 (24,4) | 16 (33,3) | 14 (18,7) | 0,45 | 0,19-1,05 | 0,065 |
| Insuficiencia renala | 19 (15,4) | 6 (12,5) | 13 (17,3) | 1,46 | 0,51-4,16 | 0,469 |
| Hepatopatía | 8 (6,5) | 5 (10,4) | 3 (4) | 0,35 | 0,08-1,57 | 0,260 |
| Enfermedad cerebrovascular | 20 (16,3) | 6 (12,5) | 14 (18,7) | 1,60 | 0,57-4,51 | 0,366 |
| Neoplasias | 20 (16,3) | 8 (16,7) | 12 (16) | 0,95 | 0,35-2,53 | 0,922 |
| Comorbilidad respiratoria | ||||||
| Alteración estructural | 105 (85,4) | 36 (75) | 69 (92) | 3,83 | 1,32-11,06 | 0,009 |
| Bronquiectasias | 81 (65,9) | 25 (52,1) | 56 (74,7) | 2,71 | 1,25-5,85 | 0,010 |
| Fenotipo agudizador | 103 (83,7) | 38 (79,2) | 65 (86,7) | 1,71 | 0,65-4,48 | 0,272 |
| OCD | 46 (37,4) | 8 (16,7) | 38 (50,7) | 5,13 | 2,12-12,42 | <0,001 |
| Clasificación de severidad según GOLD | ||||||
| Estadio I | 13 (10,6) | 6 (12,5) | 7 (9,3) | 0,489 | ||
| Estadio II | 62 (50,4) | 27 (56,2) | 35 (46,7) | |||
| Estadio III | 32 (26) | 11 (22,9) | 21 (28) | |||
| Estadio IV | 16 (13) | 4 (8,3) | 12 (16) | |||
| Estadio III-IV | 48 (39) | 15 (31,2) | 33 (44) | 0,157 | ||
| Clasificación según GesEPOC | ||||||
| A (no agudizador) | 15 (12,2) | 9 (18,8) | 6 (8) | 0,034 | ||
| B (mixto EPOC-Asma) | 20 (16,3) | 6 (12,5) | 14 (18,7) | |||
| C (enfisema agudizador) | 29 (23,6) | 6 (12,5) | 23 (30,7) | |||
| D (bronquitis crónica agudizador) | 59 (48) | 27 (56,2) | 32 (42,7) | |||
| Total | 123 | 48 | 75 | |||
AP: aspergilosis pulmonar; DE: desviación estándar; IC: intervalo de confianza; OCD: oxigenoterapia continua domiciliaria; OR: odds ratio.
En negrita se resaltan los valores significativos.
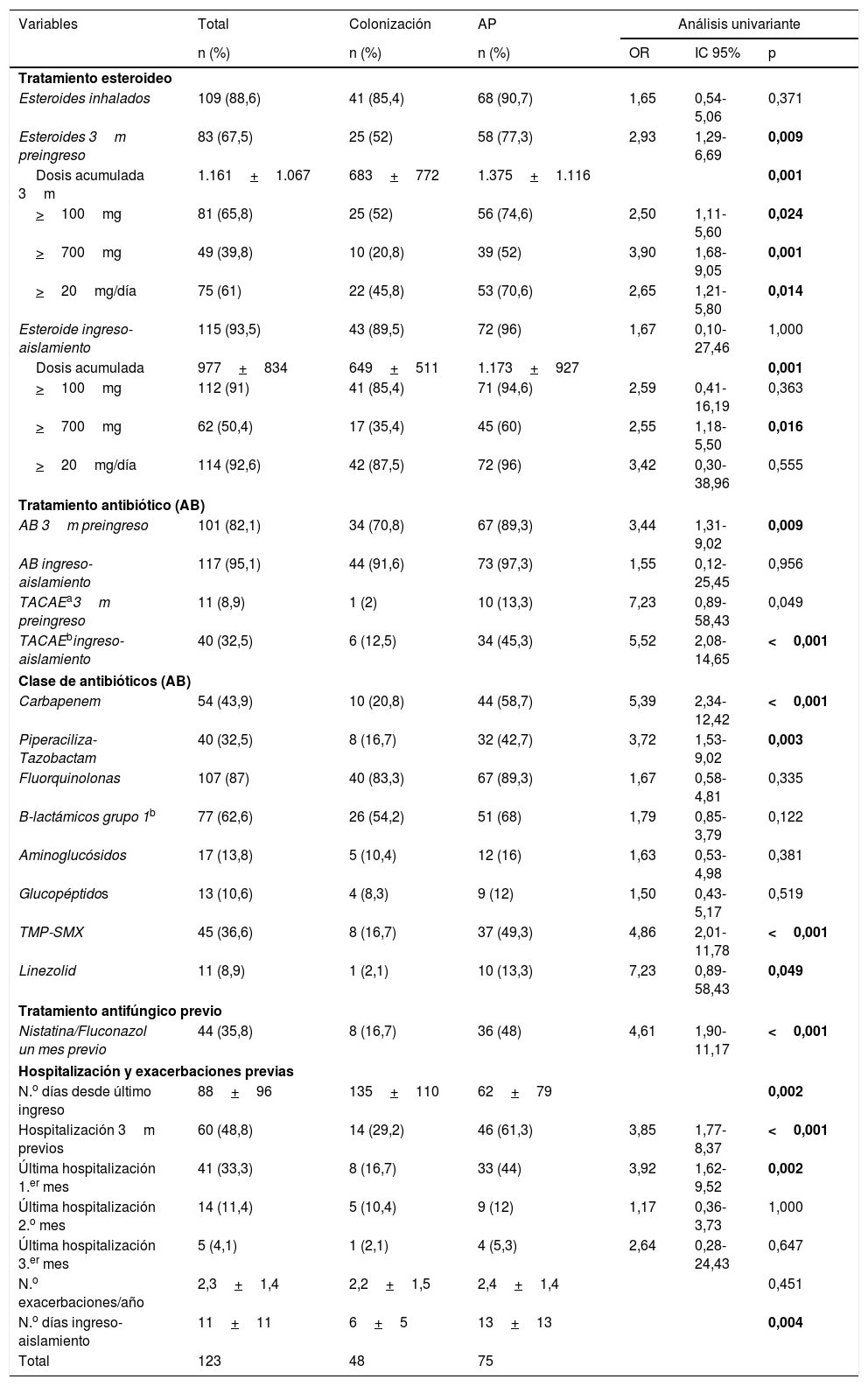
La tabla 2 muestra los datos relacionados con el uso de esteroides, antibioterapia, antifúngicos y hospitalizaciones previas. Los pacientes con AP habían recibido antibióticos y esteroides con mayor frecuencia en los 3 meses previos al ingreso y mayor dosis acumulada. Considerando el periodo desde el ingreso hasta el aislamiento, la frecuencia del uso de esteroides y antibióticos es similar pero el empleo de antibióticos de amplio espectro y la dosis acumulada de prednisona fueron mayores en los pacientes con AP. El uso de antifúngicos frente a Candida albicans (nistatina o fluconazol) en el mes previo fue también mayor en pacientes con AP. El porcentaje de pacientes hospitalizados en los 3 meses previos al ingreso fue mayor en pacientes con AP, aunque no hubo diferencias en el número de exacerbaciones en el año previo.
Factores de riesgo incluidos en el estudio según categoría diagnóstica
| Variables | Total | Colonización | AP | Análisis univariante | ||
|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | OR | IC 95% | p | |
| Tratamiento esteroideo | ||||||
| Esteroides inhalados | 109 (88,6) | 41 (85,4) | 68 (90,7) | 1,65 | 0,54-5,06 | 0,371 |
| Esteroides 3m preingreso | 83 (67,5) | 25 (52) | 58 (77,3) | 2,93 | 1,29-6,69 | 0,009 |
| Dosis acumulada 3m | 1.161+1.067 | 683+772 | 1.375+1.116 | 0,001 | ||
| >100mg | 81 (65,8) | 25 (52) | 56 (74,6) | 2,50 | 1,11-5,60 | 0,024 |
| >700mg | 49 (39,8) | 10 (20,8) | 39 (52) | 3,90 | 1,68-9,05 | 0,001 |
| >20mg/día | 75 (61) | 22 (45,8) | 53 (70,6) | 2,65 | 1,21-5,80 | 0,014 |
| Esteroide ingreso-aislamiento | 115 (93,5) | 43 (89,5) | 72 (96) | 1,67 | 0,10-27,46 | 1,000 |
| Dosis acumulada | 977+834 | 649+511 | 1.173+927 | 0,001 | ||
| >100mg | 112 (91) | 41 (85,4) | 71 (94,6) | 2,59 | 0,41-16,19 | 0,363 |
| >700mg | 62 (50,4) | 17 (35,4) | 45 (60) | 2,55 | 1,18-5,50 | 0,016 |
| >20mg/día | 114 (92,6) | 42 (87,5) | 72 (96) | 3,42 | 0,30-38,96 | 0,555 |
| Tratamiento antibiótico (AB) | ||||||
| AB 3m preingreso | 101 (82,1) | 34 (70,8) | 67 (89,3) | 3,44 | 1,31-9,02 | 0,009 |
| AB ingreso-aislamiento | 117 (95,1) | 44 (91,6) | 73 (97,3) | 1,55 | 0,12-25,45 | 0,956 |
| TACAEa3m preingreso | 11 (8,9) | 1 (2) | 10 (13,3) | 7,23 | 0,89-58,43 | 0,049 |
| TACAEbingreso-aislamiento | 40 (32,5) | 6 (12,5) | 34 (45,3) | 5,52 | 2,08-14,65 | <0,001 |
| Clase de antibióticos (AB) | ||||||
| Carbapenem | 54 (43,9) | 10 (20,8) | 44 (58,7) | 5,39 | 2,34-12,42 | <0,001 |
| Piperaciliza-Tazobactam | 40 (32,5) | 8 (16,7) | 32 (42,7) | 3,72 | 1,53-9,02 | 0,003 |
| Fluorquinolonas | 107 (87) | 40 (83,3) | 67 (89,3) | 1,67 | 0,58-4,81 | 0,335 |
| B-lactámicos grupo 1b | 77 (62,6) | 26 (54,2) | 51 (68) | 1,79 | 0,85-3,79 | 0,122 |
| Aminoglucósidos | 17 (13,8) | 5 (10,4) | 12 (16) | 1,63 | 0,53-4,98 | 0,381 |
| Glucopéptidos | 13 (10,6) | 4 (8,3) | 9 (12) | 1,50 | 0,43-5,17 | 0,519 |
| TMP-SMX | 45 (36,6) | 8 (16,7) | 37 (49,3) | 4,86 | 2,01-11,78 | <0,001 |
| Linezolid | 11 (8,9) | 1 (2,1) | 10 (13,3) | 7,23 | 0,89-58,43 | 0,049 |
| Tratamiento antifúngico previo | ||||||
| Nistatina/Fluconazol un mes previo | 44 (35,8) | 8 (16,7) | 36 (48) | 4,61 | 1,90-11,17 | <0,001 |
| Hospitalización y exacerbaciones previas | ||||||
| N.o días desde último ingreso | 88+96 | 135+110 | 62+79 | 0,002 | ||
| Hospitalización 3m previos | 60 (48,8) | 14 (29,2) | 46 (61,3) | 3,85 | 1,77-8,37 | <0,001 |
| Última hospitalización 1.er mes | 41 (33,3) | 8 (16,7) | 33 (44) | 3,92 | 1,62-9,52 | 0,002 |
| Última hospitalización 2.o mes | 14 (11,4) | 5 (10,4) | 9 (12) | 1,17 | 0,36-3,73 | 1,000 |
| Última hospitalización 3.er mes | 5 (4,1) | 1 (2,1) | 4 (5,3) | 2,64 | 0,28-24,43 | 0,647 |
| N.o exacerbaciones/año | 2,3+1,4 | 2,2+1,5 | 2,4+1,4 | 0,451 | ||
| N.o días ingreso-aislamiento | 11+11 | 6+5 | 13+13 | 0,004 | ||
| Total | 123 | 48 | 75 | |||
AP: aspergilosis pulmonar; IC: intervalo de confianza; mg: miligramos; OR: odds ratio; TMP-SMX: trimetropin-sulfametoxazol; 3m: 3 meses; 1m: 1 mes.
En negrita se resaltan los valores significativos.
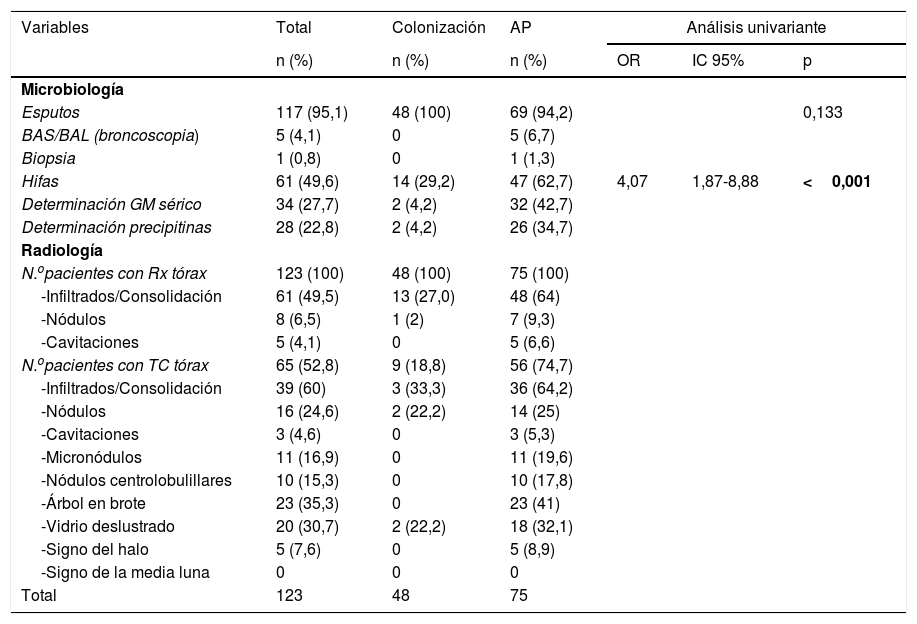
La tabla 3 recoge los estudios diagnósticos realizados. En cuanto a los parámetros analíticos se observó mayor leucocitosis (64 vs. 41,6%; p=0,020), elevación de VSG (42 vs. 24mm/h; p=0,091) e hiponatremia (29,3 vs. 12,5; p=0,034) en el grupo de AP sin diferencias en la hemoglobina, plaquetas, proteína C reactiva, creatinina, lactato deshidrogenasa y albúmina. La presencia de hifas fue mayor en AP (62,7 vs. 29,2%; OR: 4,07; IC 95%:1,87-8,88; p<0,001) y la coexistencia con otros microorganismos en el episodio fue similar en ambos grupos (53,3 vs. 43,8%; p=0,300) siendo los patógenos más frecuentemente aislados: Stenotrophomonas maltophilia, Pseudomonas aeruginosa, Staphylococcus aureus meticilin-resistente y Escherichia coli.
Procedimientos diagnósticos realizados
| Variables | Total | Colonización | AP | Análisis univariante | ||
|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | OR | IC 95% | p | |
| Microbiología | ||||||
| Esputos | 117 (95,1) | 48 (100) | 69 (94,2) | 0,133 | ||
| BAS/BAL (broncoscopia) | 5 (4,1) | 0 | 5 (6,7) | |||
| Biopsia | 1 (0,8) | 0 | 1 (1,3) | |||
| Hifas | 61 (49,6) | 14 (29,2) | 47 (62,7) | 4,07 | 1,87-8,88 | <0,001 |
| Determinación GM sérico | 34 (27,7) | 2 (4,2) | 32 (42,7) | |||
| Determinación precipitinas | 28 (22,8) | 2 (4,2) | 26 (34,7) | |||
| Radiología | ||||||
| N.opacientes con Rx tórax | 123 (100) | 48 (100) | 75 (100) | |||
| -Infiltrados/Consolidación | 61 (49,5) | 13 (27,0) | 48 (64) | |||
| -Nódulos | 8 (6,5) | 1 (2) | 7 (9,3) | |||
| -Cavitaciones | 5 (4,1) | 0 | 5 (6,6) | |||
| N.opacientes con TC tórax | 65 (52,8) | 9 (18,8) | 56 (74,7) | |||
| -Infiltrados/Consolidación | 39 (60) | 3 (33,3) | 36 (64,2) | |||
| -Nódulos | 16 (24,6) | 2 (22,2) | 14 (25) | |||
| -Cavitaciones | 3 (4,6) | 0 | 3 (5,3) | |||
| -Micronódulos | 11 (16,9) | 0 | 11 (19,6) | |||
| -Nódulos centrolobulillares | 10 (15,3) | 0 | 10 (17,8) | |||
| -Árbol en brote | 23 (35,3) | 0 | 23 (41) | |||
| -Vidrio deslustrado | 20 (30,7) | 2 (22,2) | 18 (32,1) | |||
| -Signo del halo | 5 (7,6) | 0 | 5 (8,9) | |||
| -Signo de la media luna | 0 | 0 | 0 | |||
| Total | 123 | 48 | 75 | |||
AP: aspergilosis pulmonar; BAL: lavado broncoalveolar; BAS: aspirado bronquial; GM: galactomanano; IC: intervalo de confianza; N.o: número; OR: odds ratio; Rx: radiografía; TC: tomografía computarizada.
En negrita se resaltan los valores significativos.
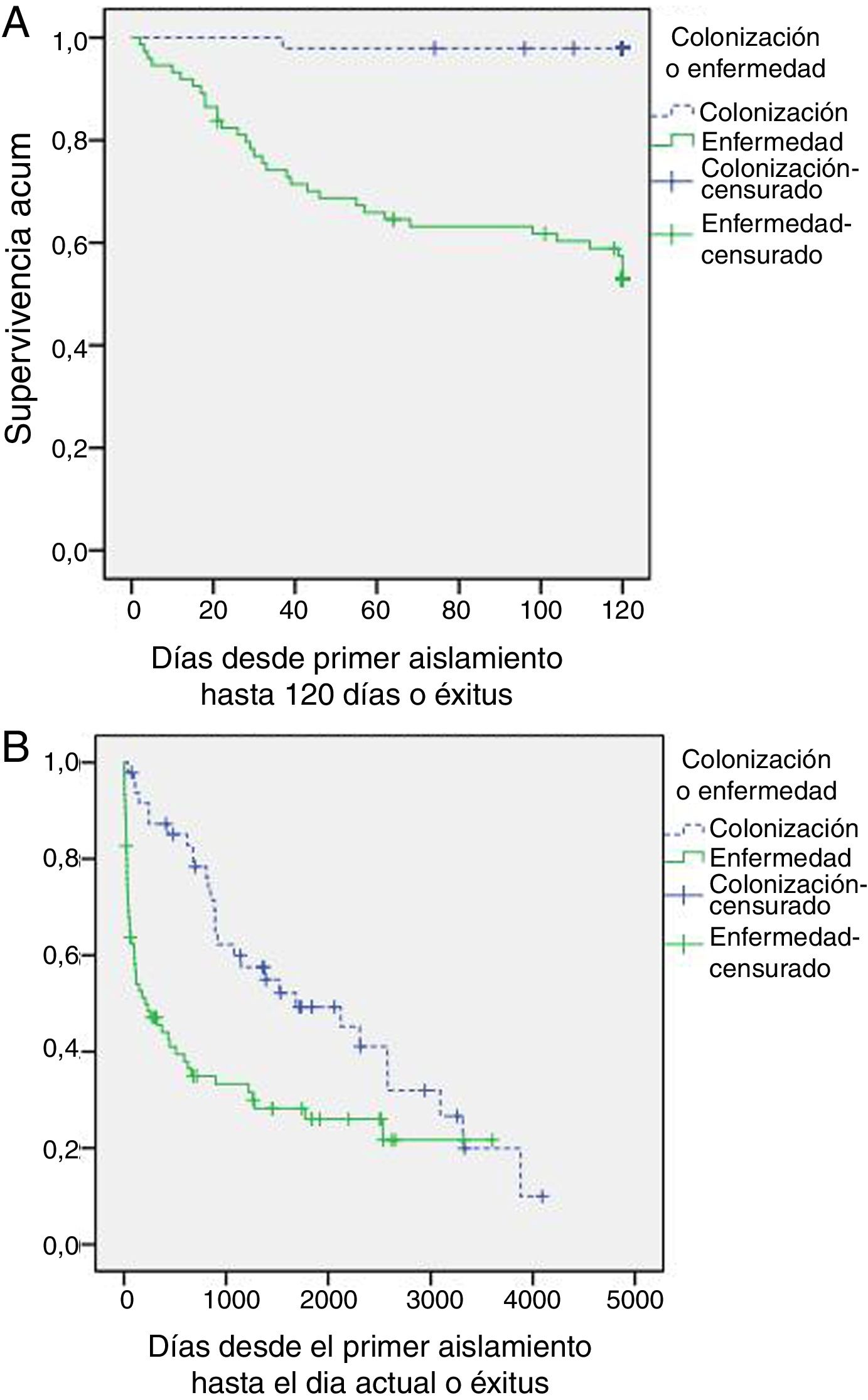
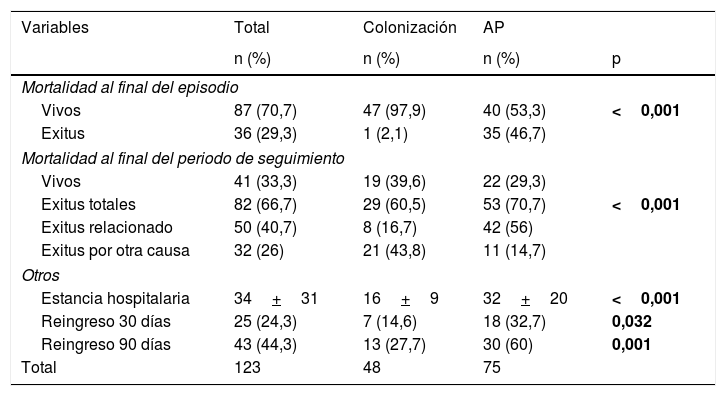
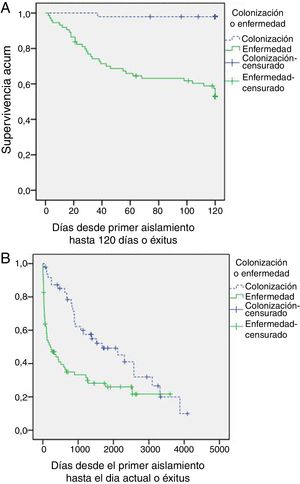
La tabla 4 muestra la evolución de los pacientes incluidos en el estudio. De los pacientes con AP, no se realizó tratamiento antifúngico en 11 pacientes (6 errores diagnósticos, 4 resultados postmorten y una decisión de no tratamiento); todos ellos fallecieron. El resto recibieron voriconazol en monoterapia (39 pacientes; 52%), voriconazol con cambio a itraconazol (10 pacientes; 13,3%), caspofungina o anfotericina con cambio a voriconazol (4 pacientes; 5,4%) o itraconazol en monoterapia (11 pacientes; 14,7%). El retraso en el inicio del tratamiento fue de 11+17 días (mediana 5 días). En la figura 1 se muestran las curvas de supervivencia a 120 días y al final del periodo de seguimiento. La mortalidad relacionada con Aspergillus spp. al final del episodio fue superior en el grupo de AP (46,7 vs. 2,1%; p<0,001) igual que la estancia hospitalaria y los reingresos en los 3 meses posteriores al alta.
Evolución de los pacientes incluidos en el estudio
| Variables | Total | Colonización | AP | |
|---|---|---|---|---|
| n (%) | n (%) | n (%) | p | |
| Mortalidad al final del episodio | ||||
| Vivos | 87 (70,7) | 47 (97,9) | 40 (53,3) | <0,001 |
| Exitus | 36 (29,3) | 1 (2,1) | 35 (46,7) | |
| Mortalidad al final del periodo de seguimiento | ||||
| Vivos | 41 (33,3) | 19 (39,6) | 22 (29,3) | |
| Exitus totales | 82 (66,7) | 29 (60,5) | 53 (70,7) | <0,001 |
| Exitus relacionado | 50 (40,7) | 8 (16,7) | 42 (56) | |
| Exitus por otra causa | 32 (26) | 21 (43,8) | 11 (14,7) | |
| Otros | ||||
| Estancia hospitalaria | 34+31 | 16+9 | 32+20 | <0,001 |
| Reingreso 30 días | 25 (24,3) | 7 (14,6) | 18 (32,7) | 0,032 |
| Reingreso 90 días | 43 (44,3) | 13 (27,7) | 30 (60) | 0,001 |
| Total | 123 | 48 | 75 | |
AP: aspergilosis pulmonar.
En negrita se resaltan los valores significativos.
Durante el seguimiento de los pacientes colonizados se evidenció AP en un 21,2% (9 API probable y una AP necrosante crónica) con una mortalidad atribuida a esta causa del 70%, siendo el tiempo medio desde el episodio índice de 648 días (rango 394-3.347 días).
Factores asociados a enfermedad pulmonar por Aspergillus spp.: análisis multivarianteEn nuestro estudio hemos encontrado que la OCD (OR: 4,39; IC 95%: 1,60-12,01; p=0,004), las bronquiectasias (OR: 3,61; IC 95%: 1,40-9,30; p=0,008), la hospitalización en los 3 meses previos al ingreso (OR: 3,12; IC: 95% 1,24-7,87; p=0,016) y la terapia antifúngica frente a Candida spp. en el mes previo (OR: 3,18; IC 95%: 1,16-8,73; p=0,024) se asocian de forma estadísticamente significativa e independiente a la presencia de enfermedad pulmonar por Aspergillus spp. (tabla 5).
Variables incluidas en el análisis multivariante para predecir aspergilosis pulmonar
| Análisis bivariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| Variables | OR | IC 95% | p | OR | IC 95% | p |
| Bronquiectasias | 3,83 | 1,32-11,06 | 0,009 | 3,61 | 1,40-9,30 | 0,008 |
| Oxigenoterapia continua domiciliaria | 5,13 | 2,12-12,42 | <0,001 | 4,39 | 1,60-12,01 | 0,004 |
| Hospitalización 3 meses preingreso | 3,85 | 1,77-8,37 | <0,001 | 3,12 | 1,24-7,87 | 0,016 |
| Corticoides 3 meses preingreso | 2,93 | 1,29-6,69 | 0,009 | |||
| Antibioterapia 3 meses preingreso | 3,44 | 1,31-9,02 | 0,009 | |||
| Terapia antifúngica frente a Candida spp. | 4,61 | 1,90-11,17 | <0,001 | 3,18 | 1,16-8,73 | 0,024 |
| Sexo | 1,14 | 0,46-2,84 | 0,767 | |||
| Edad | 0,395 | |||||
IC: intervalo de confianza; OR: odds ratio.
En negrita se resaltan los valores significativos.
Las infecciones pulmonares por Aspergillus spp. en pacientes con EPOC pueden ser graves, alcanzando cifras de mortalidad similares a pacientes neutropénicos según las series18. Por otro lado, el significado de un aislamiento de Aspergillus spp. en muestra respiratoria sigue siendo controvertido. La elevada comorbilidad y la situación frágil de los pacientes con EPOC hace difícil la realización de pruebas invasivas y ello nos obliga a buscar otros factores que nos ayuden a diferenciar entre colonización y AP para poder hacer un diagnóstico precoz. En nuestro estudio la OCD, las bronquiectasias, la hospitalización en los 3 meses previos al ingreso y el uso de nistatina o fluconazol en el mes previo son factores de riesgo independientes de AP.
Estudios recientes han demostrado que las muestras de esputo o secreciones bronquiales son igual de útiles para demostrar API que las obtenidas por BAL19. Bouza et al. observaron que la probabilidad de API aumentaba con el número de muestras en las que se aislaba el hongo11. En nuestro estudio la mayoría de las muestras fueron esputos siendo la media de 2,6 muestras positivas.
Otro aspecto importante es saber qué pacientes con EPOC tienen un mayor riesgo. La existencia de una alteración estructural pulmonar puede ser un sustrato importante para Aspergillus spp. Hemos observado que la presencia de bronquiectasias es mayor en pacientes con AP, con un riesgo 3,6 veces mayor. Estudios previos también han indicado que pacientes con mayor severidad de la EPOC tienen una mayor susceptibilidad para desarrollar AP20,21. Sin embargo nosotros no hemos observado estas diferencias al utilizar la clasificación GOLD 2017, basada en la espirometría, pero sí es más frecuente el uso de OCD entre los que se diagnostican de AP. Esto podría explicarse porque en las clasificaciones anteriores la insuficiencia respiratoria crónica se incluía directamente en el estadio iv, independientemente del FEV1. Es posible que coexistan otras indicaciones de oxigenoterapia, que supongan un factor de confusión, por lo que consideramos que son necesarios estudios específicos.
Sobre este sustrato, paciente con EPOC con patología estructural, pueden actuar otros factores que favorecen la proliferación del Aspergillus spp. como los esteroides. Algunos autores han descrito que el tratamiento con esteroides se asocia a un mayor riesgo de AP8,22,23. En nuestro estudio esto es así cuando se consideran los 3 meses previos al ingreso; sin embargo, durante el ingreso previo al aislamiento no hay diferencias entre los grupos y dicha variable no se sostiene en el análisis multivariante. Creemos que esto puede ser debido a la alta frecuencia de administración de esteroides en pacientes con exacerbación de EPOC. Las dosis acumuladas en ambos periodos son también mayores en pacientes con AP. Otro factor de riesgo discutido es el uso de antibioterapia previa8,23. Hemos visto que los pacientes con AP han recibido antibióticos con mayor frecuencia en los 3 meses previos al ingreso. En cambio, durante el episodio índice no se observan diferencias en cuanto al uso global de antibióticos, pero sí en cuanto al tipo, siendo más frecuente en los pacientes con AP haber recibido antibioterapia de amplio espectro. Resulta complejo interpretar estos datos, pues no podemos atribuir causalidad, y podría ser un reflejo de la mala evolución clínica del enfermo, que lleva a la escalada antibiótica previa al aislamiento de Aspergillus spp.
Otros factores como la hospitalización en los 3 meses previos al ingreso o el empleo de nistatina o fluconazol en el mes previo han mostrado diferencias significativas, con un riesgo 3 veces mayor de presentar AP. Estos pacientes requieren a menudo hospitalizaciones prolongadas y un uso frecuente de corticoides y antibióticos. Esto puede originar la aparición de infecciones por Candida spp. y consecuentemente la utilización de nistatina o fluconazol, ambos sin actividad frente a Aspergillus spp. El uso de estos fármacos podría originar una disminución de la colonización por Candida spp. favoreciendo así la proliferación de Aspergillus spp., como se ha mostrado en otros estudios24,25.
Las alteraciones radiológicas típicas de la API son poco frecuentes en estos pacientes. Stergiopoulou et al. han descrito las lesiones histológicas que explican las alteraciones radiológicas (infiltrados y nódulos sin signo del halo) observadas en los pacientes con EPOC que reciben corticoides26. En nuestro estudio las alteraciones radiológicas más frecuentes fueron los infiltrados y los nódulos; solo encontramos signo del halo en 5 pacientes.
Otro aspecto importante a destacar es la alta frecuencia de asociación con otros patógenos ya descrita por otros autores8. En 40 (53,3%) de los 75 pacientes con AP fue aislado otro patógeno, estando con antibiótico apropiado y mala respuesta clínica.
La mortalidad en nuestra serie alcanza cifras del 46,7% a los 120 días, aumentando hasta el 56% cuando prolongamos el seguimiento. Es de destacar que todos los casos que no han recibido tratamiento antifúngico han fallecido y que el 21,2% de los colonizados han desarrollado AP en los años posteriores con una mortalidad atribuible del 70%. Por ello creemos que es importante en estos pacientes un inicio precoz del tratamiento con fármacos eficaces como el voriconazol una vez establecida la sospecha y un seguimiento de los pacientes colonizados sobre todo si se añaden otros factores de riesgo para AP.
Fortalezas y limitacionesNuestro estudio presenta las limitaciones propias de un estudio retrospectivo donde los resultados dependen de la calidad de los datos recogidos. Quizás la limitación más importante es que la mayoría de los pacientes no tienen confirmación histológica y el aislamiento fue hecho en muestras de esputo. Esto podría originar errores en la categorización de los pacientes. Otra de las limitaciones es que no todos los pacientes tienen realizados TC y galactomanano durante el episodio, lo cual dificulta poder hacer especulaciones sobre el valor de estos en el diagnóstico de la AP.
Como fortalezas cabrían destacar que son pacientes con EPOC, una población de riesgo que adquiere cada vez más importancia y poco estudiada, siendo el tamaño de la serie considerable. Además los factores encontrados son factores clínicos fáciles de obtener por la historia clínica sin necesidad de realizar procedimientos invasivos en pacientes con alta comorbilidad.
ConclusionesEn pacientes con exacerbación de EPOC y aislamiento de Aspergillus spp. en muestra respiratoria que no mejoran a pesar de un tratamiento antibiótico y esteroideo adecuado, la OCD, las bronquiectasias, la hospitalización en los 3 meses previos al ingreso y el uso de antifúngicos frente a Candida spp. en el mes previo se asocian a un mayor riesgo de presentar AP. Así, ante un paciente en estas circunstancias, debemos sospechar infección por dicho hongo y plantearnos iniciar un tratamiento antifúngico de forma precoz.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses