La coinfección de virus de la hepatitis C (VHC) y B (VHB) es común en la práctica clínica. Comunicamos un caso de fallo hepático fulminante por reactivación de VHB en un paciente con infección por el virus de la inmunodeficiencia humana (VIH) tras el tratamiento del VHC.
Se trata de un varón de 53 años diagnosticado en 1998 de infección por VIH a raíz de una tuberculosis pulmonar, con buena respuesta actual al tratamiento antirretroviral. Además, presentaba infección crónica VHC genotipo 1a y antecedente de infección previa por VHB con anticuerpo del core IgG (anti-HBc IgG) positivo, con antígeno de superficie (HBsAg) y anticuerpo (anti-HBs) negativos y niveles de ADN-VHB indetectables, previo inicio de tratamiento con antivirales de acción directa (DAA).
Con respecto a la infección por VIH, el paciente había realizado varios esquemas de tratamiento previo con múltiples fracasos y desarrollo de resistencias. En 2011 se pauta tratamiento con tenofovir (TDF), abacavir y atazanavir potenciado con ritonavir. Posteriormente, dado un discreto empeoramiento de la función renal, se retira TDF y se simplifica a monoterapia darunavir/cobicistat, con carga viral indetectable y cifras de linfocitos T CD4 entre 500-800/mm3 desde entonces (800/mm3 linfocitos T CD4 en el último control realizado, previo inicio de tratamiento VHC).
En octubre de 2013 se inicia tratamiento para VHC según esquema interferón pegilado alfa-2a, 180μg, una inyección semanal y ribavirina 1.000mg al día (3-0-2), con lo que la carga viral VHC desciende 3 logaritmos en la semana 4 de tratamiento. Se planteó añadir antivirales directos de primera generación (telaprevir), pero el paciente rechaza continuar con el tratamiento por mala tolerancia al interferón.
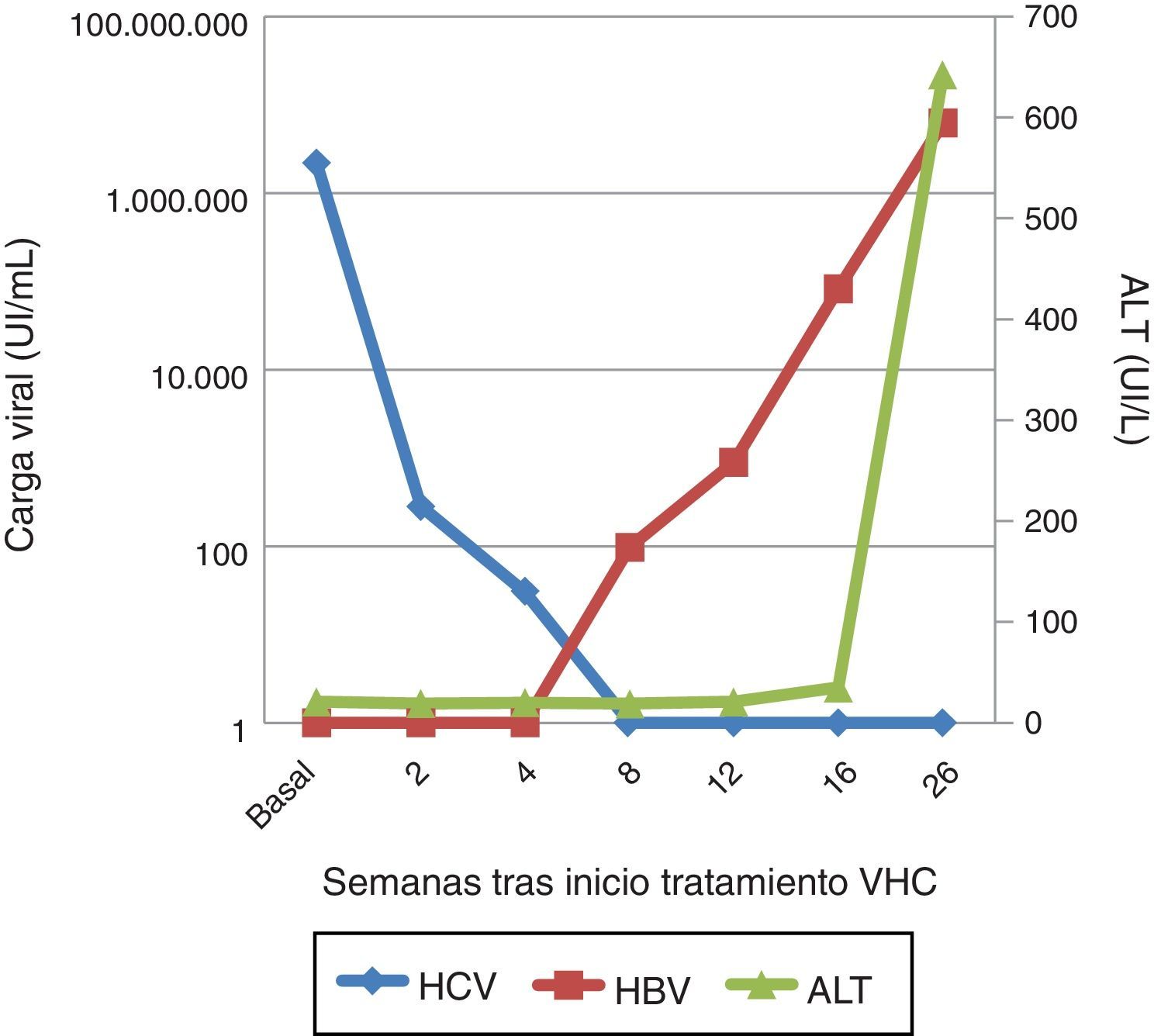
En diciembre de 2015 presenta carga viral VHC de 2.181.330,11UI/ml con elastometría hepática 12Kpa. Dado que ya disponíamos de DAA, se inicia tratamiento con sofosbuvir y ledipasvir durante 12 semanas1. En la semana 2 la carga viral había descendido a 284,51Ul/ml, 30,45UI/ml en la semana 4 y menos de 15UI/ml a partir de la semana 8, alcanzándose respuesta viral sostenida en la semana 4 postratamiento.
Un mes más tarde el paciente consulta por dolor abdominal, náuseas e ictericia, con bilirrubina total 10,98mg/dl, bilirrubina directa 8,75mg/dl, GOT 1.025,40UI/l, GPT 642UI/l e INR 1,30. Se evidenció una carga viral VHB de 6.193.455,96UI/ml, con un patrón serológico HBsAg, anti-HBc IgM y HBeAg positivos. La carga viral VHC permanecía indetectable, y el virus de la hepatitis D fue negativo. Por lo tanto, nos encontramos ante un cuadro de hepatitis aguda por VHB.
Se inicia tratamiento con entecavir (ya se había suspendido previamente el TDF por alteración de la función renal); sin embargo, la evolución clínica fue desfavorable y es incluido en estudio de pretrasplante hepático. A pesar del tratamiento el paciente empeora, por lo que se traslada a la Unidad de Cuidados Intensivos, donde continúa con mala evolución clínica y fallece a consecuencia de la insuficiencia hepática aguda.
Se solicitó la carga viral del VHB a partir de las muestras almacenadas durante el tratamiento del VHC, que resultó indetectable al inicio del tratamiento y en la semana 2, pero que progresivamente asciende a 98,80UI/ml en la semana 8 de tratamiento y hasta 82.700UI/ml en la semana 4 postratamiento (fig. 1).
Hasta el momento, el riesgo de reactivación del VHB es bien conocido en el contexto de la terapia inmunosupresora2. Sin embargo, se están comunicando varios casos de reactivación del VHB después del tratamiento con DAA en pacientes coinfectados VHC-VHB, la mayoría de ellos sin repercusión clínica, con buena respuesta al tratamiento con análogos nucleótidos/nucleósidos3,4, excepto una paciente de 59 años con genotipo 1b, que desarrolló en la semana 11 de tratamiento una hepatitis aguda fulminante por VHB que requirió trasplante hepático5.
En pacientes coinfectados VHC-VHB, el ADN VHB suele estar bajo o indetectable6, aunque puede fluctuar, siendo el VHC la causa principal de actividad hepática crónica. Se han postulado diferentes teorías para explicar la inhibición de la replicación del VHB en pacientes coinfectados7. La primera de ellas es que parece existir una interacción directa entre ambos virus, de forma que el VHC inhibe la replicación del VHB, inhibición que desaparece al tratar el VHC. También se ha planteado un aumento del espacio disponible para la replicación del virus B después del tratamiento de VHC. La teoría más aceptada por el momento es que la replicación crónica de VHC produce una situación inmune en el organismo favorable para controlar la replicación de VHB, situación que se ve interrumpida por el tratamiento con DAA.
En conclusión, este es el primer caso descrito de fallo hepático fulminante por VHB en el contexto de tratamiento con los nuevos DAA en un paciente con VIH. El paciente había realizado tratamiento previo con IFN durante 4 semanas sin haberse evidenciado reactivación del VHB, por lo que podría plantearse que, debido a su acción contra el VHB, las terapias basadas en IFN podrían mostrarse más seguras en este sentido, a costa de un mayor número de efectos adversos. Además, tampoco se evidenció reactivación al retirar TDF, lo que refuerza la existencia de una relación entre el tratamiento con DAA y dicha reactivación del VHB. Desconocemos si la infección por VIH guarda relación con esta reactivación o con la mala evolución clínica, en concreto en pacientes que no realizan tratamiento con 3TC/TDF. Hay que tener en cuenta que una gran cantidad de pacientes coinfectados realiza tratamiento con análogos de nucleósidos/nucleótidos, lo que podría prevenir la reactivación del VHB. Además, en el caso que presentamos, el paciente no tenía anti-HBs, por lo que sería interesante valorar el riesgo aislado en personas con anti-HBs negativo. A día de hoy, el manejo óptimo de estas situaciones es desconocido7–9, por lo que consideramos necesarios unos protocolos para una monitorización muy estrecha de los pacientes que reciben AAD para VHC y presentan infección antigua o activa por VHB (HBcAb aislado o HBsAg), independientemente del estadio, el genotipo o el tipo de DAA, para evitar el riesgo potencial de reactivación del VHB en estas situaciones.