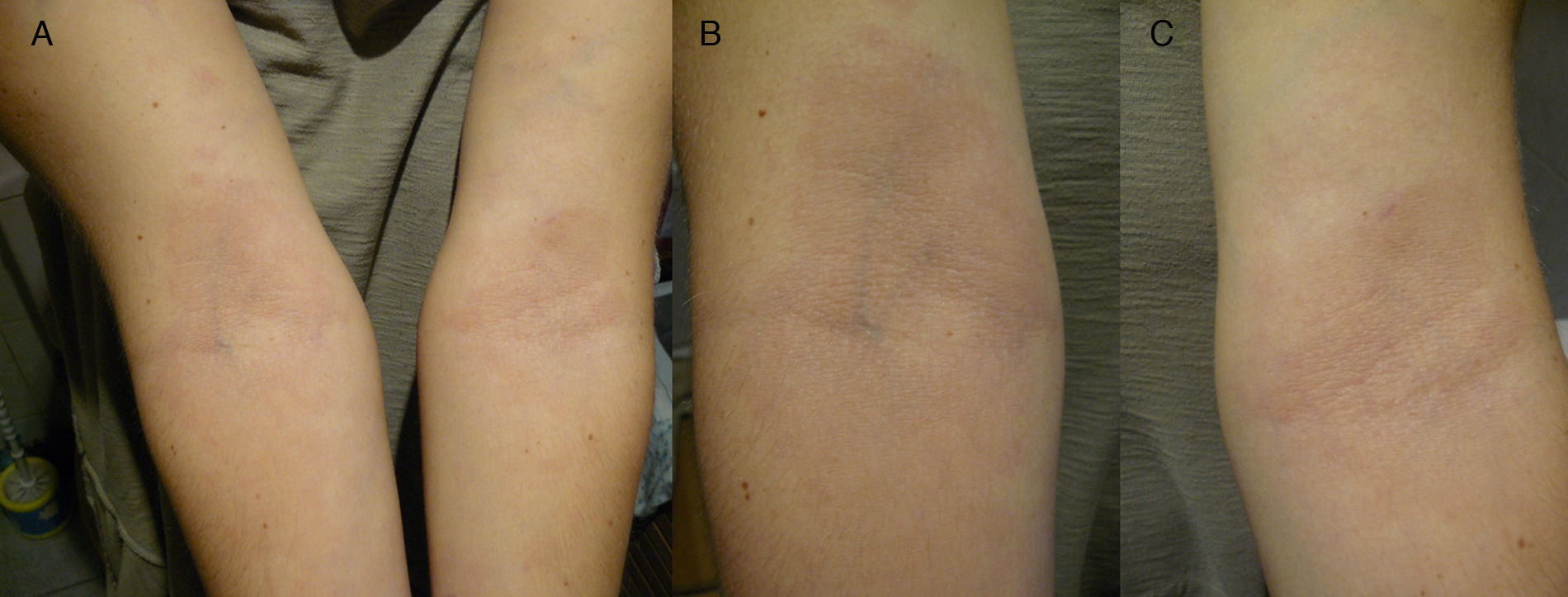
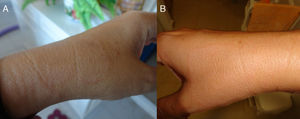
Mujer española de 44 años de edad, que en mayo de 2011 acude a consulta de dermatológica por presentar 2 máculas hipocrómicas de borde ligeramente eritematoso, en ambos antebrazos, que se iban extendiendo centrífugamente y no presentaban clínica de alteración de la sensibilidad, ni prurito (fig. 1). La paciente acude a consulta dermatológica, siendo diagnosticada de eczema y tratada con hidrocortisona. En este momento se le realiza histopatología cuya descripción anatomo-patológica (AP) a nivel microscópico muestra atrofia epidérmica con hiperqueratosis ortoqueratósica y presencia de un pequeño tapón infundibular. Degeneración vacuolar de la capa basal con presencia de algunos queratinocitos necróticos. En dermis se observa abundante depósito de mucina en el intersticio. Algunos linfocitos y células plasmáticas de distribución perivascular superficial. Aislados melanófagos. Con la técnica del PAS de observan 2 pequeñas esporas de hongos en superficie de las láminas de queratina. Finalmente, el diagnóstico AP se presentó como: compatible con lupus, con presencia de hongos en superficie. Siendo la analítica de anticuerpos antinucleares (Anti-Ro/SS-A) negativa. Posteriormente, fue tratada durante 2 meses con itraconazol 400mg/día.
EvoluciónLa paciente acude al Sanatorio Fontilles en noviembre de 2011 (visita 1). En ese momento, persisten en ambos antebrazos las hipocromías con borde ligeramente eritematoso, sin alteración de la sensibilidad. Sin antecedentes patológicos de interés, salvo que vivió en Calcuta (India) durante los años 1996 a 1999 donde colaboró en una leprosería realizando curas a enfermos activos de lepra en el desempeño de su función de enfermera. Se le toman 2 muestras de linfa; lóbulo de la oreja izquierda y borde de una lesión activa (antebrazo izquierdo) para estudios microscópicos (Ziehl-Neelsen) y una biopsia del antebrazo1. La biopsia se dividió en 2 partes; una mitad se conservó en formalina 10% (estudios histopatológicos) y otra en etanol al 70% (estudios moleculares; PCR). No se observaron bacilos ácido alcohol resistentes (BAAR) en ambas baciloscopias y el estudio anatomo-patológico resultó inespecífico (escasos cambios de los espongiocitos y escasa pigmentación basal) compatible con pitiriasis alba sin observación de BAAR. Paralelamente, se realizó PCR del ADN obtenido de las muestras de linfa (hisopo)1,2, y no se observó amplificación del ADN de Mycobacterium leprae (M. leprae) en las mismas (tabla 1). Sin embargo, se obtuvo amplificación del ADN de M. leprae en la muestra de ADN obtenida de la biopsia cutánea. Sin una clínica concluyente y basándose en los criterios histopatológicos se decide no poner en tratamiento a la paciente.
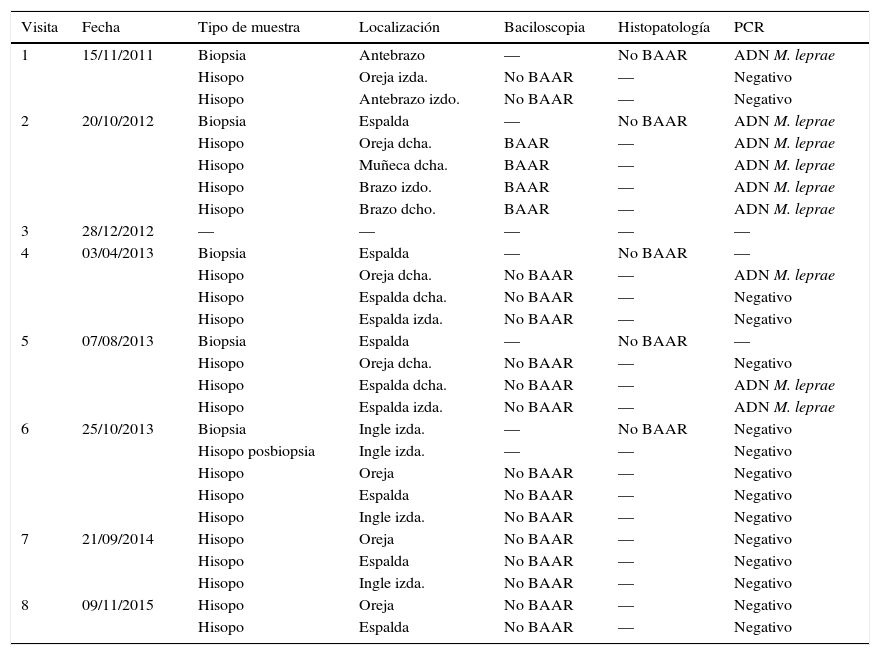
Pruebas realizadas a la paciente en el Sanatorio Fontilles
| Visita | Fecha | Tipo de muestra | Localización | Baciloscopia | Histopatología | PCR |
|---|---|---|---|---|---|---|
| 1 | 15/11/2011 | Biopsia | Antebrazo | — | No BAAR | ADN M. leprae |
| Hisopo | Oreja izda. | No BAAR | — | Negativo | ||
| Hisopo | Antebrazo izdo. | No BAAR | — | Negativo | ||
| 2 | 20/10/2012 | Biopsia | Espalda | — | No BAAR | ADN M. leprae |
| Hisopo | Oreja dcha. | BAAR | — | ADN M. leprae | ||
| Hisopo | Muñeca dcha. | BAAR | — | ADN M. leprae | ||
| Hisopo | Brazo izdo. | BAAR | — | ADN M. leprae | ||
| Hisopo | Brazo dcho. | BAAR | — | ADN M. leprae | ||
| 3 | 28/12/2012 | — | — | — | — | — |
| 4 | 03/04/2013 | Biopsia | Espalda | — | No BAAR | — |
| Hisopo | Oreja dcha. | No BAAR | — | ADN M. leprae | ||
| Hisopo | Espalda dcha. | No BAAR | — | Negativo | ||
| Hisopo | Espalda izda. | No BAAR | — | Negativo | ||
| 5 | 07/08/2013 | Biopsia | Espalda | — | No BAAR | — |
| Hisopo | Oreja dcha. | No BAAR | — | Negativo | ||
| Hisopo | Espalda dcha. | No BAAR | — | ADN M. leprae | ||
| Hisopo | Espalda izda. | No BAAR | — | ADN M. leprae | ||
| 6 | 25/10/2013 | Biopsia | Ingle izda. | — | No BAAR | Negativo |
| Hisopo posbiopsia | Ingle izda. | — | — | Negativo | ||
| Hisopo | Oreja | No BAAR | — | Negativo | ||
| Hisopo | Espalda | No BAAR | — | Negativo | ||
| Hisopo | Ingle izda. | No BAAR | — | Negativo | ||
| 7 | 21/09/2014 | Hisopo | Oreja | No BAAR | — | Negativo |
| Hisopo | Espalda | No BAAR | — | Negativo | ||
| Hisopo | Ingle izda. | No BAAR | — | Negativo | ||
| 8 | 09/11/2015 | Hisopo | Oreja | No BAAR | — | Negativo |
| Hisopo | Espalda | No BAAR | — | Negativo |
ADN M. leprae: se detectó amplificación del fragmento diana de M. leprae; BAAR: bacilos ácido-alcohol resistentes (Ziehl-Neelsen); dcha.: derecha; izda.: izquierda; Negativo: no se detectó amplificación mediante PCR; —: prueba no realizada.
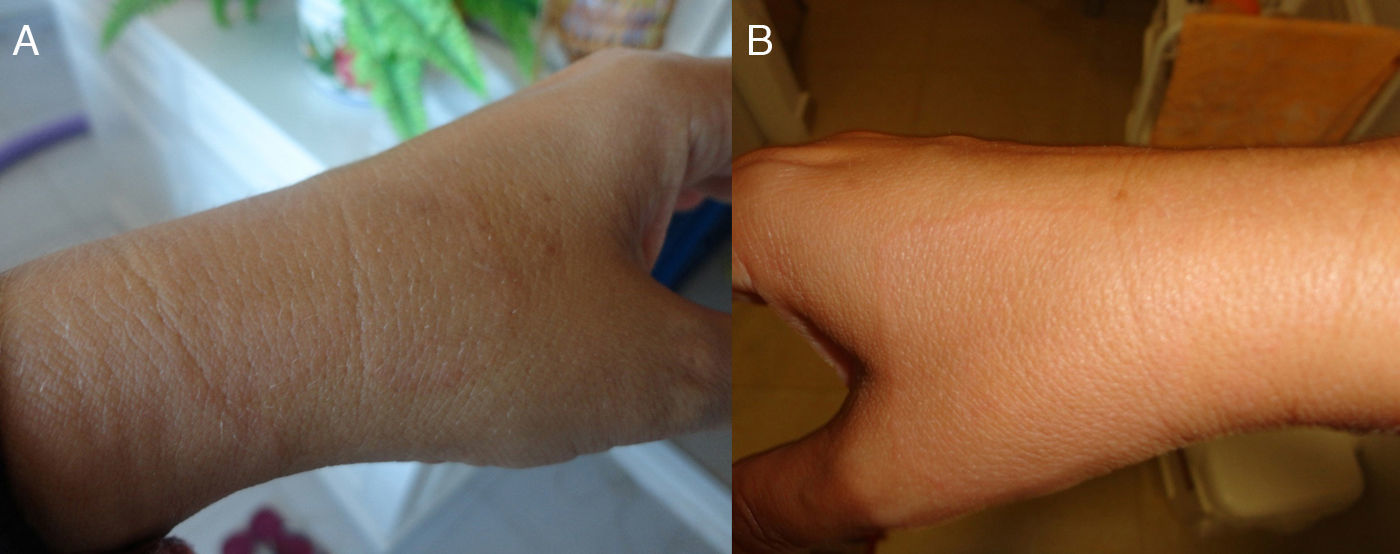
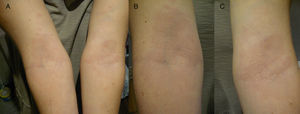
En octubre de 2012 (visita 2), la paciente acude de nuevo al centro, y a la exploración clínica se observan múltiples máculas hipocrómicas de idénticas características a las observadas en la anterior visita en ambos antebrazos y muñecas (simétricas), así como en espalda (fig. 2). La histopatología resulta inespecífica (dermatitis de interfase con apoptosis focal) apuntando a una lesión de tipo toxicodérmico. Se vuelve a realizar baciloscopia y PCR, que resultan positivas tanto a la visualización de BAAR y ADN de M. leprae, respectivamente en todas las muestras realizadas (tabla 1). La paciente es diagnosticada de lepra multibacilar (dimorfa), y se pauta inicialmente tratamiento con dapsona (100mg/día), clofazimina (50mg/día) y rifampicina (600mg/mes) durante un año.
Dos meses después (visita 3), se observa una buena evolución clínica, el borde eritematoso va desapareciendo, aunque persiste la hipocromía. A los 6 meses del inicio del tratamiento (visita 4) la paciente se encuentra pigmentada por la clofazimina, las hipocromías en miembros superiores han desaparecido casi completamente. La baciloscopia e histopatología resultan negativas, y la PCR ha negativizado en algunas muestras, detectándose ADN de M. leprae en la muestra de linfa de la oreja. En la revisión a los 10 meses (visita 5) se observa la aparición de lesiones hipocrómicas simétricas en la espalda. Se le realiza baciloscopia e histopatología que resultan negativas, detectándose ADN de M. leprae en la muestra de linfa del borde de una lesión nueva en la espalda. En el siguiente control al año del inicio del tratamiento (visita 6), las máculas hipocrómicas en ambos antebrazos han desaparecido, persisten lesiones en la espalda, y aparecen lesiones hipocrómicas nuevas en ambos muslos. Todas las pruebas realizadas resultaron negativas. Se le realiza electroneurografía que se encuentra dentro de la normalidad. Se suspende la terapia. En la revisión al año de finalizar el tratamiento (visita 7), y tras valoración clínica (ha desaparecido la clínica dermatológica), se le da de alta terapéutica. Baciloscopia, histopatología y PCR negativas. Dos años después de la finalización del tratamiento (visita 8) la paciente continúa con muestras negativas tanto para la visualización de BAAR (baciloscopia) como para la detección de ADN de M. leprae (PCR), y sin secuelas de la enfermedad.
Comentario finalLa lepra es una enfermedad infecciosa crónica, causada por una micobacteria intracelular obligada denominada Mycobacterium leprae, que afecta al sistema nervioso periférico, piel y otros órganos3. La aparición o no de la enfermedad y el tipo de clínica, va a depender de diferentes factores: geográficos, socio-económicos, edad, sexo, vacunaciones previas y, sobre todo, de la predisposición genética del individuo que condicionará su respuesta inmunitaria frente a la infección4. Dada la imposibilidad de cultivar in vitro y la ausencia de métodos serológicos fiables5,6, el diagnóstico clínico sigue recayendo en la observación de los síntomas (cutáneos y/o neurológicos) y en los análisis bacteriológicos (baciloscopia e histopatología). Aunque recientemente, las técnicas moleculares han emergido como soporte a los métodos tradicionales7. La clasificación de los pacientes es importante a la hora de determinar el tratamiento apropiado y orientar el manejo de los mismos a la hora de predecir posibles complicaciones8. La observación de algún tipo de compromiso neural como hipostesia en una lesión cutánea es el primer signo clínico de sospecha de lepra. Este hallazgo junto a la visualización de bacilos acido-alcohol resistentes en la lesión, son confirmatorios de la enfermedad9. En ningún momento se observó alteración de la sensibilidad a nivel superficial, táctil o motora en la paciente. Y a pesar de que la afectación neurológica es uno de los signos cardinales de lepra, es posible que no se observe en algunos pacientes borderline lepromatosos o lepromatosos polares, así como en los casos de lepra indeterminada3,10.
Aunque presumiblemente la exposición tuvo lugar de 12 a 15 años antes, en el plazo de un año y medio desde la aparición de las 2 primeras máculas (lepra indeterminada) hasta la generalización de las mismas, siendo estas numerosas y simétricas a fecha de octubre de 2012. La paciente estaba evolucionando rápidamente hacia un polo lepromatoso y gracias al seguimiento exhaustivo se han evitado lesiones en otros órganos y sistemas, así como la aparición de discapacidades típicas de este tipo de lepra. En estos casos, en los que no se observan los signos patognomónicos de lepra, y dada la baja sensibilidad de las técnicas tradicionales11,12, la excelente sensibilidad y especificidad de las técnicas moleculares pueden ser la clave para el diagnóstico etiológico de M. leprae7. Los pacientes con baciloscopia negativa pueden diseminar la infección, las técnicas moleculares ofrecen una alternativa para identificarlos e interrumpir la cadena de transmisión y prevenir la aparición de discapacidades12,13.
Aunque España no se encuentra entre los países endémicos de lepra, se siguen reportando nuevos casos tanto endémicos como importados14. En el caso de lesiones cutáneas inespecíficas particularmente, se hace imprescindible no descartar en la anamnesis del paciente exposiciones acontecidas muchos años antes a fin de iniciar el tratamiento con la mayor premura posible, incluso sin una clínica totalmente compatible.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.