En pacientes menores de 3 meses con sospecha de tosferina se recomienda ingreso y tratamiento con azitromicina debido a su mayor morbimortalidad, por lo que muchos pacientes con tos sin otros signos de alarma ingresan con antibioterapia hasta obtener el resultado de la PCR de Bordetella. La realización de esta técnica de forma urgente proporciona el diagnóstico en pocas horas. Nuestro objetivo fue determinar si su introducción en los servicios de Urgencias mejoraba el manejo de estos pacientes.
MétodosEstudio de cohortes histórico de pacientes menores de 3 meses a los que se realizó en Urgencias la PCR de Bordetella de secreciones respiratorias desde marzo de 2011 hasta diciembre de 2017. A partir de diciembre de 2015 era procesada de forma urgente.
ResultadosSe realizaron 158 PCR, 16 (10%) de las cuales resultaron positivas para B. pertussis. Los resultados negativos (142; 90%) se dividen en 2 grupos de estudio: PCR-convencional, con 74 casos, y PCR-urgente, con 68 casos. Los 2 grupos son homogéneos en cuanto a características clínicas y analíticas. En el grupo PCR-urgente se realizaron un 18% menos de radiografías de tórax (p=0,008) e ingresaron 33 pacientes (48,5%), frente a 49 (66,2%) en el grupo PCR-convencional (p=0,042). Recibió tratamiento antibiótico el 32% en el grupo PCR-urgente frente al 67% en el PCR-convencional (p=0,000047), sin aumento significativo de las reconsultas en Urgencias ni peor evolución.
ConclusionesLa PCR urgente de Bordetella es una herramienta útil en los servicios de Urgencias para el manejo de los lactantes menores de 3 meses con sospecha de tosferina, ya que puede evitar ingresos, pruebas y tratamientos antibióticos innecesarios.
Whooping cough in patients aged under 3 months has higher rates of morbimortality. Hospitalization and treatment with azithromycin is generally recommended. Many patients with cough without other signs of alarm, are admitted and started antibiotic therapy until a result of Bordetella-PCR is available. This technique, when performed urgently, can provide the diagnosis in a few hours. The objective of this study is to determine if its generalisation in the Emergency Department allows to improve patient management.
MethodsRetrospective cohort study of patients aged under 3 months who underwent Bordetella-PCR testing from upper respiratory tract secretions since March 2011 to December 2017. From December 2015 the test was performed urgently.
ResultsOne hundred and fifty-eight PCR were performed, 16 (10%) were positive for B. pertussis. Negative results (142; 90%) were divided in 2 cohorts: conventional-PCR, with 74 cases, and urgent-PCR, with 68 cases. The 2 groups were homogeneous in terms of clinical and analytical characteristics. In the urgent-PCR group there was 18% reduction in chest X-rays performed (P=.008). There were 33 (48.5%) patients admitted in the urgent-PCR group, compared to 49 (66.2%) in the conventional-PCR (P=.042). Antibiotic treatment was initiated in 32% of the patients in the urgent-PCR group compared to 67% in the conventional-PCR group (P=.000047), without observing any significant increase in the number of visits to the Emergency Department or worse clinical performance.
ConclusionsThe introduction of urgent PCR in the Emergency Department is a useful tool in the management of infants under 3 months of age with suspected pertussis, since it can avoid unnecessary admissions, diagnostic tests and antibiotic treatments.
La tosferina es una enfermedad endémica a nivel mundial, causada por la infección aguda del tracto respiratorio superior por Bordetella pertussis (85-95%) y Bordetella parapertussis (5-15%)1. La declaración por la Organización Mundial de la Salud como enfermedad «reemergente»2 y la alarma social generada tras los últimos picos epidémicos3 han provocado un aumento en el número de pacientes que acuden o son derivados a los servicios de Urgencias para confirmar o descartar el diagnóstico. Los criterios clínicos son insuficientes para diferenciarla de los llamados «síndromes pertusoides», cuadros en general más leves, producidos por un grupo de agentes bacterianos y virales como Mycoplasma pneumoniae, adenovirus o el virus respiratorio sincitial, entre otros4,5, siendo necesario el estudio microbiológico para el diagnóstico definitivo. Actualmente, la técnica de elección es la reacción en cadena de la polimerasa (PCR) para especies de Bordetella en aspirado nasofaríngeo (ANF). Esta prueba permite un diagnóstico rápido en pocas horas (2-24h según la técnica utilizada), además de ser altamente sensible (90,7-97%) y específica (93-100%) frente al cultivo (sensibilidad 58-64%, especificidad 100%)6–8. Sin embargo, la PCR tiene el inconveniente de que necesita una infraestructura, así como recursos humanos y técnicos, para poder ser realizada de forma urgente, y en la mayoría de los centros hospitalarios de nuestro medio no existe la posibilidad de que la muestra sea procesada en el momento de su recogida. Esto representa una demora en la obtención de resultados y, por lo tanto, de un diagnóstico definitivo de hasta 48-72h4.
Aunque la tosferina puede afectar a todos los grupos de edad, los pacientes menores de 3-4 meses son el principal grupo de riesgo, ya que suelen presentar una clínica más inespecífica y una mayor morbimortalidad. Ante la sospecha de tosferina en este rango de edad, se recomienda ingreso hospitalario e inicio de tratamiento antibiótico con macrólidos, debido a la rápida evolución y a la aparición de complicaciones potencialmente letales que pueden presentar4,5,9. Este hecho ha provocado que muchos pacientes de menos de 3 meses de edad, con clínica de tos pertusoide y sin otros datos de alarma, sean ingresados con antibioterapia hasta obtener el resultado de la PCR de Bordetella.
En el año 2015 se introdujo en nuestro centro la posibilidad de procesar la muestra de ANF y realizar la PCR de Bordetella inmediatamente tras su recogida, para pacientes en este rango de edad, con la obtención del diagnóstico definitivo por PCR en aproximadamente 4h.
El objetivo de este estudio es determinar si la introducción de la PCR procesada de forma urgente es capaz de evitar ingresos, pruebas complementarias y tratamientos antibióticos innecesarios en pacientes menores de 3 meses con sospecha clínica de tosferina.
MétodosSe trata de un estudio de cohortes histórico, donde se han incluido los pacientes menores de 3 meses a los que se les solicitó desde el Servicio de Urgencias Pediátricas una PCR de Bordetella de ANF, desde marzo de 2011 hasta diciembre de 2017. Se han considerado criterios de exclusión: la existencia de patología previa (cardiopatía, enfermedad respiratoria crónica, síndrome polimalformativo o prematuridad<37 semanas) y la instauración de tratamiento antibiótico previamente a la consulta en Urgencias.
La técnica empleada para el procesamiento de las muestras de ANF fue la PCR a tiempo real. Entre los años 2011-2015 la prueba se realizó de manera diferida en todos los casos, obteniendo el resultado en 24-48h. Posteriormente, se introdujo la posibilidad de realizar la PCR de forma urgente para los pacientes menores de 3 meses, por lo que en el lapso de tiempo entre 2015 y 2017 la mayoría de las muestras fueron analizadas inmediatamente tras su recogida, obteniendo el resultado definitivo en 3-4h. Así, podemos diferenciar 2 grupos de estudio: un primer grupo de pacientes, en los que se procesó la muestra de forma convencional (PCR-c), y un segundo grupo, en los que se procesó de forma urgente (PCR-u). Los 4 pacientes en los que el resultado fue indeterminado por inhibición de la muestra en un primer momento se incluyen en el grupo de PCR-c, pues finalmente el resultado fue obtenido de forma diferida a las 24h tras la repetición de la prueba de forma convencional con una nueva muestra. Repetir la prueba de forma urgente implicaría una estancia de lactantes de muy corta edad en Urgencias durante al menos 9-10h, lo cual retrasaría el inicio de la antibioterapia si se tratase de un caso real de tosferina y se expondría al paciente a un mayor riesgo de contagio por otros microorganismos, por lo que, en estos casos, se consensuó con el Servicio de Microbiología que la nueva muestra sería procesada de forma rutinaria evitando además sobrecargar al microbiólogo de guardia. Generalmente estos pacientes son ingresados con tratamiento antibiótico hasta obtener el resultado de la PCR.
En ambos grupos se realizó la PCR de Diagenode (Diagenode Diagnostics, Lieja, Bélgica) en el sistema BD Max (Becton Dickinson, Franklin Lakes, NJ, EE. UU.), una PCR automatizada multiplex a tiempo real con diana en la secuencia de inserción 481 para el diagnóstico de B. pertussis y en la secuencia de inserción 1001 para la detección de B. parapertussis. La técnica tiene una duración aproximada de 2,5h, con una primera etapa manual de preparación de la muestra y la master-mix de unos 15-20min. Tanto el proceso de extracción como el de amplificación son realizados de forma automática, lo que reduce significativamente el riesgo de contaminación10.
Todas las muestras fueron cultivadas de forma inmediata en agar Charcoal e incubadas a 35-37°C en ambiente húmedo durante 7-10 días. Las colonias susceptibles de ser Bordetella spp. fueron identificadas por MALDI-TOF MS (Bruker Daltonik GmbH, Bremen, Alemania).
Los resultados han sido analizados mediante el programa de procesamiento de datos IBM SPSS Statistics versión 20. En el análisis descriptivo los resultados se presentan con medidas de centralización y de dispersión (media y desviación estándar, mediana y rango intercuartílico [RIC]) en el caso de variables cuantitativas y mediante frecuencias absolutas (n) y relativas (%) para variables cualitativas. Se utilizan los contrastes de hipótesis chi-cuadrado o test exacto de Fisher para estudiar la asociación de las variables cualitativas, y para muestras independientes cuantitativas se emplea el test t-Student y la U de Mann-Whitney.
ResultadosSe realizaron un total de 175 PCR de Bordetella spp. de 175 pacientes menores de 3 meses con sospecha de tosferina, de las cuales se analizan 158. Los 17 casos restantes fueron excluidos porque la información de las historias clínicas era incompleta, no cumplían los criterios de inclusión o cumplían alguno de los criterios de exclusión.
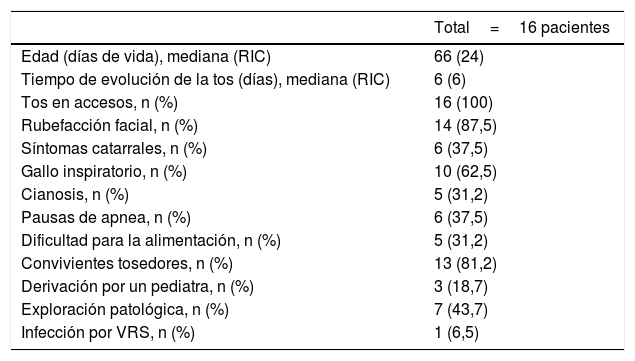
De las 158 PCR analizadas, 16 (10%) resultaron positivas para B. pertussis y 142 (90%) negativas. El 100% de los resultados positivos corresponden al grupo PCR-c. Las características clínicas de estos pacientes se describen en la tabla 1.
Características clínicas de los pacientes con PCR de Bordetella spp. positiva
| Total=16 pacientes | |
|---|---|
| Edad (días de vida), mediana (RIC) | 66 (24) |
| Tiempo de evolución de la tos (días), mediana (RIC) | 6 (6) |
| Tos en accesos, n (%) | 16 (100) |
| Rubefacción facial, n (%) | 14 (87,5) |
| Síntomas catarrales, n (%) | 6 (37,5) |
| Gallo inspiratorio, n (%) | 10 (62,5) |
| Cianosis, n (%) | 5 (31,2) |
| Pausas de apnea, n (%) | 6 (37,5) |
| Dificultad para la alimentación, n (%) | 5 (31,2) |
| Convivientes tosedores, n (%) | 13 (81,2) |
| Derivación por un pediatra, n (%) | 3 (18,7) |
| Exploración patológica, n (%) | 7 (43,7) |
| Infección por VRS, n (%) | 1 (6,5) |
PCR: reacción en cadena de la polimerasa; RIC: rango intercuartílico; VRS: virus respiratorio sincitial.
En cuanto a los resultados de los cultivos, 9 fueron positivos (56,2% de los casos con PCR positiva). El 100% de los casos con PCR negativa fueron negativos. De todas las PCR analizadas, 11 (6,9%) fueron indeterminadas en un primer momento por inhibición de la muestra, 4 en el grupo PCR-u y 7 en el grupo PCR-c, todas con resultado negativo tras el estudio de una nueva muestra. Las pruebas indeterminadas se incluyen para el análisis estadístico en el grupo PCR-c, como se explica en el apartado de materiales y métodos.
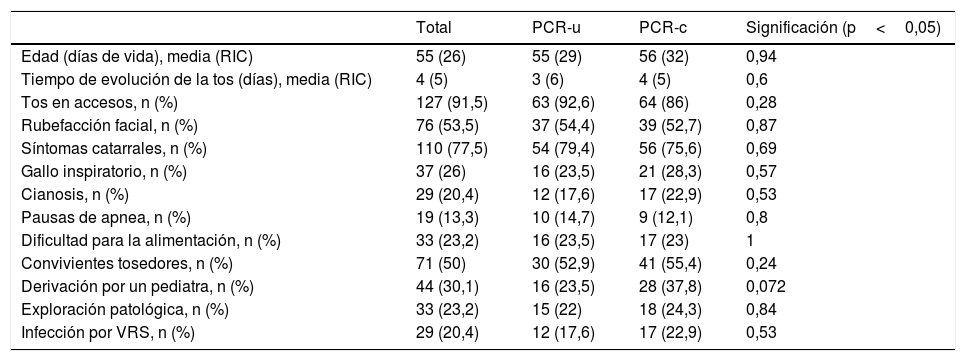
En el análisis del total de resultados negativos, 74 casos pertenecían a la cohorte PCR-c y 68 casos a la PCR-u, y correspondían a 72 varones y 70 mujeres con una mediana de edad de 55 días de vida (RIC 26), sin diferencias significativas entre ambos grupos de estudio (p=0,94).
En la tabla 2 se observan las características clínicas de los pacientes con PCR negativa, incluyendo aquellas variables que podrían suponer un sesgo a la hora de analizar diferencias en tasas de hospitalización y de inicio de antibioterapia. Ambos grupos fueron homogéneos respecto a todas las variables analizadas.
Características clínicas de los pacientes con PCR de Bordetella spp. negativa
| Total | PCR-u | PCR-c | Significación (p<0,05) | |
|---|---|---|---|---|
| Edad (días de vida), media (RIC) | 55 (26) | 55 (29) | 56 (32) | 0,94 |
| Tiempo de evolución de la tos (días), media (RIC) | 4 (5) | 3 (6) | 4 (5) | 0,6 |
| Tos en accesos, n (%) | 127 (91,5) | 63 (92,6) | 64 (86) | 0,28 |
| Rubefacción facial, n (%) | 76 (53,5) | 37 (54,4) | 39 (52,7) | 0,87 |
| Síntomas catarrales, n (%) | 110 (77,5) | 54 (79,4) | 56 (75,6) | 0,69 |
| Gallo inspiratorio, n (%) | 37 (26) | 16 (23,5) | 21 (28,3) | 0,57 |
| Cianosis, n (%) | 29 (20,4) | 12 (17,6) | 17 (22,9) | 0,53 |
| Pausas de apnea, n (%) | 19 (13,3) | 10 (14,7) | 9 (12,1) | 0,8 |
| Dificultad para la alimentación, n (%) | 33 (23,2) | 16 (23,5) | 17 (23) | 1 |
| Convivientes tosedores, n (%) | 71 (50) | 30 (52,9) | 41 (55,4) | 0,24 |
| Derivación por un pediatra, n (%) | 44 (30,1) | 16 (23,5) | 28 (37,8) | 0,072 |
| Exploración patológica, n (%) | 33 (23,2) | 15 (22) | 18 (24,3) | 0,84 |
| Infección por VRS, n (%) | 29 (20,4) | 12 (17,6) | 17 (22,9) | 0,53 |
PCR: reacción en cadena de la polimerasa; PCR-c: reacción en cadena de la polimerasa convencional; PCR-u: reacción en cadena de la polimerasa urgente; RIC: rango intercuartílico; VRS: virus respiratorio sincitial.
En la mayoría de los pacientes el tiempo de evolución de los síntomas fue corto, con una mediana de 4 días (RIC 5). Un 77% presentaba clínica catarral y el 91,5% tos en accesos; el 20% había presentado cianosis durante los episodios de tos y el 13%, pausas de apnea. Tan solo la mitad de los pacientes presentaban ambiente epidémico con convivientes tosedores, y el 30% había sido derivado por su pediatra para descartar tosferina.
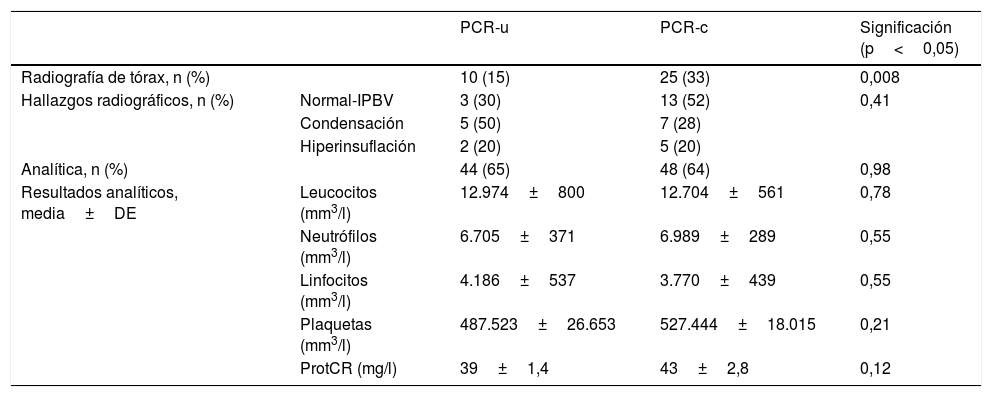
En la tabla 3 se presentan las pruebas diagnósticas realizadas a los pacientes con PCR negativa. Se realizó analítica sanguínea a 48 pacientes (64%) en el grupo PCR-c y a 44 (65%) en el grupo PCR-u, sin observarse diferencias significativas entre ambos grupos en cuanto a la tasa de realización de la prueba ni en los resultados analíticos. Sin embargo, se realizaron significativamente menos radiografías de tórax en el grupo PCR-u, con 10 radiografías (15%) frente a 25 (33%) en el grupo PCR-c (p=0,008), sin diferencias significativas entre los hallazgos radiológicos encontrados.
Pruebas complementarias de los pacientes con PCR de Bordetella spp. negativa
| PCR-u | PCR-c | Significación (p<0,05) | ||
|---|---|---|---|---|
| Radiografía de tórax, n (%) | 10 (15) | 25 (33) | 0,008 | |
| Hallazgos radiográficos, n (%) | Normal-IPBV | 3 (30) | 13 (52) | 0,41 |
| Condensación | 5 (50) | 7 (28) | ||
| Hiperinsuflación | 2 (20) | 5 (20) | ||
| Analítica, n (%) | 44 (65) | 48 (64) | 0,98 | |
| Resultados analíticos, media±DE | Leucocitos (mm3/l) | 12.974±800 | 12.704±561 | 0,78 |
| Neutrófilos (mm3/l) | 6.705±371 | 6.989±289 | 0,55 | |
| Linfocitos (mm3/l) | 4.186±537 | 3.770±439 | 0,55 | |
| Plaquetas (mm3/l) | 487.523±26.653 | 527.444±18.015 | 0,21 | |
| ProtCR (mg/l) | 39±1,4 | 43±2,8 | 0,12 |
IPBV: infiltrados peribroncovasculares; PCR: reacción en cadena de la polimerasa; PCR-c: reacción en cadena de la polimerasa convencional; PCR-u: reacción en cadena de la polimerasa urgente; ProtCR: proteína C reactiva; RIC: rango intercuartílico.
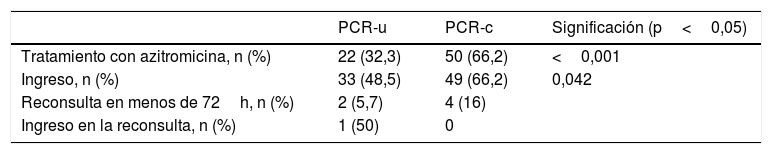
De los pacientes con resultado negativo, recibieron tratamiento antibiótico con azitromicina 72 pacientes, con grandes diferencias entre un grupo y otro: 22 casos tratados (32%) en el grupo PCR-u y 50 (67%) en el PCR-c, con un grado de significación de p=0,000047. Existen también diferencias significativas en cuanto al ingreso hospitalario, con 33 ingresos (48,5%) en el grupo PCR-u frente a 49 ingresos (66,2%) en el grupo PCR-c (p=0,042). De los 33 pacientes ingresados con PCR negativa urgente, los ingresos podrían justificarse por: pausas de apnea en 10 pacientes (30%), cianosis en 12 (36%), dificultad para la alimentación en 9 (27%), exploración física alterada en 8 (24%) o la combinación de varios síntomas.
La duración del ingreso fue la misma en ambos grupos, con una mediana de 3 días (RIC 3), p=0,79. Precisaron ingreso en Cuidados Intensivos por bronquiolitis 3 pacientes, todos pertenecientes al grupo PCR-c. De los pacientes dados de alta, 4 volvieron a acudir a Urgencias en el grupo PCR-c y 2 en el PCR-u; un paciente ingresó durante 24h por bronquiolitis (tabla 4).
Ingreso y tratamiento antibiótico de los pacientes con PCR de Bordetella spp. negativa
| PCR-u | PCR-c | Significación (p<0,05) | |
|---|---|---|---|
| Tratamiento con azitromicina, n (%) | 22 (32,3) | 50 (66,2) | <0,001 |
| Ingreso, n (%) | 33 (48,5) | 49 (66,2) | 0,042 |
| Reconsulta en menos de 72h, n (%) | 2 (5,7) | 4 (16) | |
| Ingreso en la reconsulta, n (%) | 1 (50) | 0 |
PCR: reacción en cadena de la polimerasa; PCR-c: reacción en cadena de la polimerasa convencional; PCR-u: reacción en cadena de la polimerasa urgente.
Este trabajo representa, con base en nuestra revisión bibliográfica, el primer estudio que evalúa la utilidad de la PCR procesada de forma urgente en los pacientes menores de 3 meses con sospecha de tosferina.
A pesar de la amplia cobertura vacunal en la población pediátrica, la tosferina sigue siendo un problema de salud pública, en especial para los pacientes menores de 3 meses, que no solo presentan una mayor morbimortalidad al padecer la enfermedad, sino que también tienen más riesgo de iatrogenia ante su sospecha. No existe un protocolo basado en criterios clínicos capaz de establecer el diagnóstico de tosferina con una sensibilidad y especificidad suficientes4, si bien la PCR de Bordetella spp. es considerada actualmente por muchos autores el gold standard para el diagnóstico11. Esta técnica, realizada de forma urgente, en nuestro estudio es capaz de reducir significativamente el número de ingresos en pacientes con falsa sospecha de tosferina en este rango de edad del 66,2 al 48,5% (p<0,05). Creemos que esta diferencia podría ser mayor, pues en algunas historias clínicas, los pediatras justificaban el ingreso de los pacientes con PCR urgente negativa, a la espera del resultado del cultivo, probablemente desconociendo que este presenta una sensibilidad menor que la PCR. Asimismo, es capaz de reducir el número de pacientes que recibieron tratamiento antibiótico con azitromicina, siendo tratados un 35% menos de niños tras el resultado negativo urgente (p<0,001), sin por ello aumentar la tasa de reconsultas en Urgencias ni conllevar una peor evolución.
En cuanto a las pruebas complementarias, la PCR urgente es capaz de disminuir en nuestro estudio la realización de radiografías de tórax hasta un 18% (p=0,008), pero no la realización de analíticas sanguíneas. Probablemente esto es debido a que durante el tiempo de espera del resultado de la PCR, muchos pediatras prefieren realizar analítica sanguínea para descartar linfocitosis o trombocitosis como datos de gravedad e iniciar un tratamiento inmediato en caso de presentarse.
Los pacientes adultos también pueden contraer la tosferina y comportarse como transmisores de la misma, por ello los servicios de urgencias generales deben conocer la enfermedad para poder realizar el diagnóstico diferencial ante cualquier enfermo con tos duradera, instaurar un tratamiento precoz y adoptar las medidas preventivas necesarias para evitar su transmisión12. De cara a establecer medidas de aislamiento, la PCR urgente de Bordetella spp. también podría ser una medida útil no analizada en nuestro estudio.
En noviembre de 2015 se introdujo la vacunación en las mujeres embarazadas en nuestra comunidad autónoma, y desde 2016 se realiza en todo el país3, con el objetivo de proteger a los lactantes más vulnerables, los menores de 3 meses. En España, a partir de 2010 se está observando que la enfermedad se encuentra en una situación de epidemia sostenida3,13, sin embargo, no hemos encontrado trabajos que recojan únicamente población menor de 3 meses. En nuestro estudio, todas las PCR positivas para B. pertussis son anteriores al inicio de la vacunación en el embarazo, siendo la última PCR positiva, dentro de este grupo de edad, en diciembre de 2015, un mes después del inicio de la vacunación, lo cual podría significar un éxito en el programa de vacunación, como se ha demostrado en otros trabajos14,15.
Como limitación, al ser un estudio retrospectivo, no hemos podido recoger los datos acerca de la vacunación de los pacientes o de sus madres durante el embarazo al no estar recogidos en muchas de las historias clínicas, pero se estima que en 2016 la cobertura nacional fue de 81,6%3. Debido a la epidemiología cíclica de la tosferina habría que analizar futuros picos de incidencia para evaluar la efectividad del programa de vacunación.
Otra limitación de nuestro estudio es el hecho de que, al tratarse de un estudio retrospectivo, no se ha podido constatar fehacientemente si el resultado urgente de la PCR cambió la decisión de ingreso o de inicio de antibioterapia en cada caso en particular.
De manera conceptual, los 4 resultados indeterminados de la PCR realizada de forma urgente se han analizado en el grupo PCR-c, por el hecho de que la información que recibe el médico que toma las decisiones está basada en un resultado desconocido hasta la repetición de la prueba de forma convencional y, por tanto, se comportaría como un paciente de este grupo; sin embargo, esto podría suponer una limitación a la hora de analizar los beneficios de esta prueba, ya que en un 5,5% de los casos (4/72), según nuestra serie, no se podrían tomar decisiones con base en su resultado.
En conclusión, la PCR de Bordetella spp. solicitada de forma urgente por los servicios de urgencias es una herramienta útil en el manejo de los pacientes menores de 3 meses con sospecha de tosferina, ya que puede evitar ingresos, radiografías de tórax y tratamientos antibióticos innecesarios. Los pediatras debemos conocer el valor de esta prueba, sus limitaciones y hacer un adecuado uso de ella. Disponer de una técnica automatizada, de un Servicio de Microbiología con atención continuada durante 24h y de protocolos de actuación ante la sospecha clínica de tosferina en el menor de 3 meses podría suponer una forma de ahorro tanto económico como de las pérdidas intangibles que supone un ingreso para las familias. Sería interesante realizar estudios prospectivos y de coste-beneficio en el futuro para valorar la eficiencia de esta medida.
Conflicto de interesesLos autores declaran no presentar ningún tipo de conflicto de intereses para llevar a cabo este trabajo.