Este estudio se ha centrado en las actuaciones a nivel político y administrativo que se han realizado en España en relación con la implementación de la profilaxis preexposición (PrEP) al VIH. Se ha analizado todo tipo de iniciativas formales por parte de los actores políticos y administrativos implicados. Las fuentes utilizadas son las fuentes oficiales públicas. Hasta febrero de 2018, la PrEP no ha sido implementada. La decisión depende de los niveles estatal y autonómico. El Ministerio de Sanidad y algunas Comunidades Autónomas trabajan en diversas intervenciones sin establecer un calendario de implementación. Los partidos políticos por su parte han promovido escasas iniciativas relacionadas con la implementación de la PrEP. En el terreno jurídico, se han producido vaivenes legales relacionados con la extensión de la patente. El papel de los órganos intergubernamentales e interdepartamentales es vital para la implementación de la PrEP.
This study focuses on actions at the political and administrative level in Spain in relation to the implementation of pre-exposure prophylaxis (PrEP). We analysed a whole range of different formal initiatives taken by the political and administrative actors involved. The information was obtained from official public data sources. As of February 2018, PrEP had not been implemented. The decision is dependent on both state and regional governments. The Ministry of Health and some Autonomous Regions are working on different interventions, but without providing an implementation timetable. The political parties have kept a very low profile in terms of initiatives related to the implementation of PrEP. From a legal point of view, proceedings are passing back and forth with the extension of the patent. The role of intergovernmental and interdepartmental institutions is very important for the implementation of PrEP in Spain.
La profilaxis preexposición (PrEP) al VIH es una intervención biomédica para la prevención de la infección por VIH que está recomendada por la Organización Mundial de Salud1 y autorizada por la Comisión Europea tras la recomendación de la Agencia Europea del Medicamento en agosto de 20162. Es una indicación del medicamento denominado Truvada® de la empresa Gilead compuesto por tenofovir disoproxilo fumarato y emtricitabina. Siguiendo la pauta de adherencia, previene que una persona VIH negativa se infecte por VIH3,4, demostrando ser una medida de prevención eficaz y coste-efectiva.
En España en 2016, la tasa global de nuevas infecciones por VIH fue superior a la media de la Unión Europea y de Europa Occidental (7,22 por cada 100.000 habitantes sin corregir por el retraso de notificación)5. En este contexto, GeSIDA emitió un documento6 adaptando las recomendaciones internacionales al caso español para grupos con una incidencia superior a 2/100 personas-año. Al contrario que en ciertos países europeos, y a pesar de estar registrada en la Agencia Española de Medicamentos y Productos Sanitarios en España la PrEP no está disponible dentro de las prestaciones del Sistema Nacional de Salud (SNS). Sin embargo, Truvada® sí está disponible7 para el tratamiento de la infección por VIH, siendo un medicamento que sigue una clasificación de uso hospitalario y dispensado exclusivamente con receta médica por un médico especialista en VIH8.
Por su parte, el SNS es uno de los productos de la descentralización del sistema político y administrativo español, con distintos niveles de gobierno obligados por la normativa9 a cooperar para alcanzar sus fines. Esta investigación tiene el objetivo de analizar el proceso de implementación de la PrEP en España a nivel estatal y autonómico. Asimismo, se ha revisado la situación legal del medicamento Truvada® y sus genéricos.
MetodologíaSe ha realizado un análisis de las relaciones formales de los actores políticos y administrativos. Las fuentes de datos son fuentes oficiales públicas: los boletines oficiales, la jurisprudencia, el portal web del Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI) y el Derecho de Acceso a la Información Pública. Dentro de las actuaciones políticas, se ha estudiado el conjunto de iniciativas que la Constitución Española y los Estatutos de Autonomía confieren a las Cámaras Legislativas y sus Reglamentos para desarrollar su actividad. Se clasifican en iniciativas legislativas, de control de la acción del Gobierno, de impulso a la acción del Gobierno, y otros tipos de iniciativas sin clasificación determinada, como las declaraciones institucionales. Dentro de las actuaciones administrativas, se han analizado los documentos emitidos por las Administraciones Públicas (resoluciones, convenios de colaboración, documentos de consenso, informes y notas informativas). También se han revisado las resoluciones judiciales relacionadas con la patente y su extensión, así como las respuestas dadas al Derecho de Acceso a la Información Pública (Ley 19/2013, de 9 de diciembre, de transparencia, acceso a la información pública y buen gobierno). Se ha llevado a cabo un análisis de contenido con la asistencia de la herramienta Open Code, segmentando la información para poder interpretar el contenido de las mismas. El enfoque temporal se enmarca desde el año 2008 con la IX Legislatura hasta la XII Legislatura a nivel estatal y en las respectivas legislaturas en las autonomías comenzadas en 2015, con las excepciones de Euskadi y Galicia (2016). Se ha fijado el 28/02/2018 como fecha de fin de recogida de información. Los términos empleados para las búsquedas de la actividad parlamentaria fueron: «VIH», «sida», «PrEP» y «profilaxis».
ResultadosSituación administrativaA nivel administrativo estatal, el MSSSI publicó en enero de 2018 un documento de consenso10 sobre la PrEP en donde se recoge la evidencia científica y se fijan los criterios de selección, elegibilidad, dispensación y monitorización. Fue elaborado por un grupo de expertos compuesto por las administraciones, profesionales, las sociedades científicas y organizaciones de la sociedad civil. Asimismo, el MSSSI ha impulsado un estudio de factibilidad (DIR-TRU-2017-01) gracias a un convenio de colaboración11 firmado con la compañía farmacéutica Gilead que implica la cesión gratuita del medicamento Truvada®. Dicho estudio busca evaluar el impacto económico y organizativo, así como posibles interferencias en los circuitos asistenciales de cara a una hipotética implementación de la PrEP en España. Dicho estudio fue formulado para la participación de las Comunidades Autónomas (CC. AA.).
Finalmente, participaron dos de las cuatro CC. AA. propuestas (Cataluña y Euskadi), ya que con otras dos finalmente no se acordó su incorporación (Comunidad de Madrid y Andalucía). Asimismo, el MSSSI, en el marco de la convocatoria para el año 2017 de subvenciones destinadas ha financiado programas de prevención del VIH y ha concedido subvenciones a dos programas relativos a la PrEP12 realizados por entidades sociales.
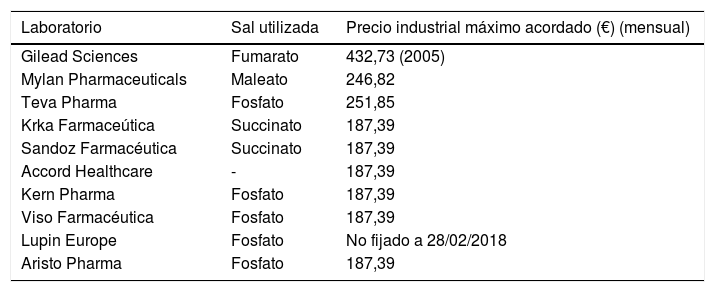
Existen actuaciones pendientes de cara a una implementación real de la PrEP en España. Una vez registrado y autorizado por la Agencia Europea del Medicamento y la Agencia Española de Medicamentos y Productos Sanitarios, el proceso de introducción de la PrEP se ha de atravesar dos procedimientos: el de fijación de precio13, coordinado por el MSSSI a través de la Comisión Interministerial de Precios de los Medicamentos14, que es un órgano interdepartamental e intergubernamental encargado de fijar el precio industrial máximo de los medicamentos candidatos a entrar en la Cartera de Servicios del SNS; y el de actualización de la cartera de servicios comunes15. Hasta la fecha de estudio, el proceso se encuentra detenido en la fijación de precios, sin ser posible conocer el estado concreto de la tramitación, en función del artículo 14 de la Ley 19/2013, de 9 de diciembre, de transparencia. Entre las nuevas indicaciones favorables para financiación publicadas hasta febrero de 2018, el medicamento para PrEP no figura entre las mismas19, como tampoco figura en la Consulta pública para actualizar la Cartera Básica de Servicios del SNS20. Tampoco hay emitido un Informe de Posicionamiento Terapéutico21 respecto de la PrEP, informe que es elaborado durante el proceso de fijación de precios y que es tenido en cuenta por la Comisión Interministerial de Precios de los Medicamentos. Sí se han publicado los precios industriales máximos (el precio de venta del laboratorio) de versiones genéricas (tabla 1)22.
Precios industriales máximos y sal utilizada para los medicamentos genéricos de tenofovir disoproxilo/emtricitabina
| Laboratorio | Sal utilizada | Precio industrial máximo acordado (€) (mensual) |
|---|---|---|
| Gilead Sciences | Fumarato | 432,73 (2005) |
| Mylan Pharmaceuticals | Maleato | 246,82 |
| Teva Pharma | Fosfato | 251,85 |
| Krka Farmaceútica | Succinato | 187,39 |
| Sandoz Farmacéutica | Succinato | 187,39 |
| Accord Healthcare | - | 187,39 |
| Kern Pharma | Fosfato | 187,39 |
| Viso Farmacéutica | Fosfato | 187,39 |
| Lupin Europe | Fosfato | No fijado a 28/02/2018 |
| Aristo Pharma | Fosfato | 187,39 |
A nivel político estatal, la PrEP no ha entrado en el debate político hasta finales de 2016, con iniciativas del Partido Socialista Obrero Español (PSOE) y el Partido Demócrata Europeo Catalán (PDeCAT) a nivel estatal y autonómico, en Cataluña (tabla 2).
Número de iniciativas presentadas por los partidos políticos en donde se hace referencia a la PrEP a 28/02/2017
| Estado | CC. AA. | |
|---|---|---|
| Partido Popular (PP) | 0 | 0 |
| Partido Socialista Obrero Español (PSOE) | 2 | 3 |
| Podemos | 0 | 1 |
| Ciudadanos | 0 | 3 |
| Esquerra Republicana de Catalunya (ERC) | 0 | 1 |
| Partido Nacionalista Vasco (PNV) | 0 | 0 |
| Partido Demócrata Europeo Catalán (PDeCAT) (Grupo Mixto del Congreso) | 1 | 1 |
| Compromís (Grupo Mixto del Congreso) | 0 | 1 |
Fuente: Buscadores de iniciativas de las Cortes Generales y Parlamentos autonómicos.
Entrando en el contenido de las iniciativas, es destacada la Proposición No de Ley sobre la estrategia de Prevención PrEP del VIH presentada por el PSOE en enero de 2017 (161/001191). Además, a nivel estatal hay dos preguntas al Gobierno presentadas por el PDeCAT (184/005117) y el PSOE (184/006151) en donde se cuestiona su intención acerca de la implementación de la medida. En sendas respuestas, el Gobierno enumera las actuaciones que realiza a través del MSSSI.
En lo relativo a la actividad autonómica, Cataluña es la CC. AA. en donde más iniciativas se han impulsado tanto desde una vertiente política como administrativa. Así, la PrEP está establecida como una de las acciones a desarrollar dentro del objetivo de reducción de nuevas infecciones por VIH del Plan de Acción contra el VIH y otras ITS 2016-202023, siendo un objetivo concreto dentro de la estrategia general de prevención frente al VIH. En línea con esto, se puede citar la participación en desarrollo durante 2018 junto con Euskadi en el estudio de factibilidad propuesto por el MSSSI, así como el programa PrEP-Ara 2017-2019 en el marco del Plan Estratégico de investigación e Innovación en Salud 2016-2020 (PERIS)24. PrEP-Ara es un estudio de implementación impulsado por el Departament de Salut. A nivel parlamentario, hay que destacar la Propuesta de Resolución 250-00469/11 del Partido Socialista de Catalunya (PSC) en donde, entre otros asuntos, se insta al Gobierno catalán a implementar la PrEP, así como la invitación (356-00293/11) del Gobierno catalán de Junts pel Sí a una ONG para abordar la situación de la epidemia de VIH en Cataluña, siendo la PrEP uno de los temas centrales del debate. Por último, cabe señalar la enmienda 641 al Proyecto de Presupuestos de la Generalitat para 2017 que pide incorporar la PrEP como tratamiento preventivo. Dicha enmienda no fue aprobada finalmente. En lo relativo a la Comunidad de Madrid, la PrEP ha sido tratada en varias iniciativas: en la pregunta al Gobierno con respuesta escrita PE-711/2017 (X) realizada por Podemos acerca del acceso a medicamentos preexposición al VIH en centros no médicos así como en las preguntas con respuesta oral en pleno PCOP 853/2016 (X) y PCOP 1066/2017 (X), impulsadas por Ciudadanos, donde se recogen intervenciones parlamentarias donde se hace mención a la PrEP. De manera general, la respuesta del Gobierno madrileño, extrapolable al resto de autonomías, menciona la evidencia científica y las recomendaciones y coordinación dadas por el MSSSI y su Plan Nacional sobre el sida, por lo que la PrEP no consta entre las actuaciones realizadas en materia de prevención (pregunta escrita 1274/2017, del PSOE). Al igual que en Cataluña, destacan las invitaciones a entidades sociales en las que se alude a la necesidad de implementar la PrEP (C-164/2016, de Ciudadanos). En lo relativo a la Comunidad Valenciana, hay que señalar la PNL 739/69332 impulsada por Compromís acerca de la implementación de la PrEP, así como el programa piloto de implantación de PrEP en trabajadores del sexo anunciado realizado en el Hospital General de Valencia. Como resultado del conflicto intergubernamental, se pueden citar los motivos administrativos de la Comunidad de Madrid y la falta de acuerdo entre la Consejería de Salud de Andalucía y el MSSSI para articular la participación de ambas autonomías en el citado estudio de factibilidad coordinado por el MSSSI. En el caso de Andalucía, se hace alusión también a la adaptación del estudio de factibilidad a las características del Sistema Andaluz de Salud y a problemas de bioética en la formulación del estudio por garantizar únicamente la dispensación del medicamento durante el estudio así como conflicto de intereses por parte de la empresa farmacéutica que cede gratuitamente el medicamento. Además, cabe destacar un posicionamiento contrario de la PrEP en agosto de 2017 por parte de la Administración de la Comunidad Foral de Navarra que niega la idoneidad de implementar la PrEP debido a la evidencia científica es insuficiente para incorporarla al arsenal de medidas preventivas. Para más información sobre las actuaciones administrativas y posicionamientos de las Administraciones implicadas, en el apéndice (material suplementario en versión electrónica) se recogen extractos de todas las respuestas dadas al Derecho de Acceso a la Información Pública en relación con la PrEP.
Situación legal del fármaco Truvada® y sus formas genéricasRespecto de la situación legal, tras ser denegado en primera instancia por la Oficina Española de Patentes y Marcas, se ha concedido por Sentencia Judicial el Certificado Complementario de Protección que otorga a Gilead una ampliación de la patente tras un proceso judicial. Dicha figura ampliaría hasta un máximo de 5 años la protección de la patente25, es decir, hasta el 24 de febrero de 202026. El proceso de implementación de los medicamentos genéricos está siendo complejo debido a los recursos judiciales que Gilead inició contra la comercialización de los genéricos de las empresas Teva27 y Mylan28. Bajo el amparo del mencionado certificado, en mayo de 2017 se concedió provisionalmente mediante Auto judicial la petición de Gilead de impedir la comercialización de los medicamentos genéricos. Sin embargo, esta decisión fue revocada en octubre de 201729, con lo que la comercialización de genéricos es posible.
DiscusiónEl proceso de implementación de la PrEP en España se encuentra abierto desde septiembre de 2016, fecha en la que el MSSSI realizó la propuesta de aprobación en la reunión de la Comisión de Salud Pública del Consejo Interterritorial del SNS30. En el ámbito político, todo el espectro se ha mostrado favorable o al menos no contrario explícitamente a su implementación. Sin embargo, ha habido escasa actividad política relacionada con el impulso de la medida y la que ha habido o bien no tiene la transmisión oportuna en lo que a actuaciones reales se refiere, o se encuentra en trámite durante un prolongado periodo de tiempo. Como máximo ejemplo de esto último podemos citar la PNL 161/001191 que presentó el PSOE en el Congreso de los Diputados, iniciativa para la cual no existe reglamentariamente un plazo fijo de tramitación, dependiendo de la prioridad que dé a cada una de ellas el grupo parlamentario proponente. Dicha iniciativa no es relevante en cuanto a su trascendencia normativa sino más bien por su explícita reivindicación de implementar la medida y financiarla públicamente, permitiendo a los grupos parlamentarios la presentación de enmiendas y su debate, y, en definitiva, permitiéndoles un posicionamiento político. Además del PSOE, destaca la actividad del PDeCAT, Compromís y Podemos como partidos que han presentado iniciativas políticas concretas. Ciudadanos se ha mostrado favorable a poner sobre la mesa el estudio de su implementación, especialmente en el ámbito de la Comunidad de Madrid. El PP, como partido en el Gobierno estatal durante los años de aprobación de la PrEP a nivel europeo, ha impulsado las actuaciones administrativas realizadas en el MSSSI. Recurriendo a conceptos del Análisis de Políticas Públicas31, se puede establecer que no tomar decisiones o que estas no ocupen puestos elevados en la agenda, es uno de los cursos de acción posibles que los decisores políticos pueden tomar de cara a enfrentarse a los problemas públicos.
Respecto de la situación legal del medicamento y su patente, en otros países europeos también se están produciendo procesos judiciales similares a los de España; a este respecto y debido a su influencia directa sobre la situación del Certificado Complementario de Protección en España, hay que citar la cuestión prejudicial C-121/1732 planteada a principios de 2017 por la High Court of Justice (Chancery Division) al Tribunal de Justicia de la Unión Europea en relación con la duración de la patente. El pronunciamiento del Tribunal permitirá una interpretación unificada en la Unión Europea respecto de la patente del medicamento. A este respecto, el 25 de abril de 2018 se dio a conocer la opinión33 del Abogado General Sr. M. Wathelet sobre la cuestión prejudicial. De forma abreviada, se da la razón a las reclamaciones de las empresas de medicamentos genéricos frente a las pretensiones de Gilead con el Certificado Complementario de Protección, por lo que es de prever que el Tribunal de Justicia de la Unión Europea tenga en cuenta las conclusiones del Abogado General, a pesar de que estas conclusiones no tengan fuerza vinculante. De esta manera, la respuesta sería vinculante para todos órganos jurisdiccionales de la Unión Europea, incluyendo los tribunales españoles.
En cualquier caso, parece necesario mejorar la transparencia en el proceso de fijación de precios, y relacionado con esto, establecer una situación clara de la situación legal de la patente. Los cambios en la vigencia de la patente han podido influir en el proceso de fijación de precio, ya que el coste de las nuevas indicaciones es uno de los criterios básicos a partir de los cuales los medicamentos son estudiados por la Comisión Interministerial de Precios, si bien no es posible establecer una relación causal entre ambas. En todo caso, en la normativa citada se cita explícitamente el coste e impacto presupuestario para el SNS de los medicamentos que se someten a la evaluación para su inclusión en la cartera de prestaciones (artículo 92 del Real Decreto Legislativo 1/2015). Asimismo, es interesante el concepto «bottom-up»34 en el sentido de que los agentes que más en contacto están con el problema a resolver, son los que proponen a los decisores las soluciones a adoptar. En este caso, al igual que en gran parte de políticas públicas relacionadas con la Sanidad, existe una gran cantidad de agentes implicados con la implementación PrEP, así se atestigua en los documentos públicos emitidos. Existe consenso en la necesidad de frenar el constante número de nuevas infecciones por VIH, pero no así en la respuesta a dar, ya que por parte de los agentes científicos y sociales se reclama una implementación urgente de la medida basada en la evidencia existente, y por parte de los actores político-administrativos se ha propuesto el desarrollo de nuevos estudios locales que adapten las conclusiones internacionales a la situación de España, y en definitiva, actuaciones conducentes a su implementación, pero no a corto plazo, al contrario que en otros países europeos.
Por otra parte, una limitación de esta investigación es la circunscripción del objeto de estudio al área de las actuaciones formales. Otras técnicas de investigación cualitativa, como las entrevistas en profundidad, permitirían abordar el problema de la implementación de la PrEP desde la dimensión no formalizada de las relaciones lo cual permitiría obtener un enfoque integrado.
En conclusión, la implementación de la PrEP en España es un proceso que comenzó a mediados de 2016 que es resultado de un interés político contenido unido a ciertas actuaciones administrativas que se están impulsando desde la Administración, de corte interdepartamental (varios Ministerios), intergubernamental (dos niveles de Gobierno) e interorganizacional (Administraciones, sociedades científicas, centros clínicos y centros comunitarios). En cualquier caso, se trata de un proceso inconcluso en el que se esperan nuevas actuaciones a corto y medio plazo en España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Comunidad de Madrid (Expediente EPY-100/17 [PEJ16/SAL/AI-0867]). Ayudas para la contratación de Ayudantes de Investigación y Técnicos de Laboratorio).
A la Red de Investigación de SIDA (RD16CIII/0002/0006).
Al Centro de Investigación Biomédica en Red de Epidemiología y Salud Pública (CIBERESP).