La cervicitis es un cuadro de inflamación del cuello uterino. Suele ser causada por un agente infeccioso, generalmente de transmisión sexual. Frecuentemente es asintomática, y la infección silente puede originar complicaciones del tracto genital superior. Los síntomas suelen ser inespecíficos, y los más significativos son aumento del flujo vaginal y/o sangrado intermenstrual. Para su diagnóstico existen sistemas comerciales basados en técnicas moleculares que incluyen la casi totalidad de los patógenos conocidos asociados a cervicitis, aunque los cultivos no deben abandonarse por la necesidad de realizar estudios de sensibilidad a los antibióticos. Se recomienda iniciar un tratamiento empírico que incluya C.trachomatis y N.gonorrhoeae en el caso de mujeres con elevado riesgo de infección por dichos patógenos, sobre todo si el seguimiento no está asegurado o no se dispone de pruebas diagnósticas adecuadas. En mujeres con bajo riesgo el tratamiento deberá ajustarse a los resultados de las pruebas microbiológicas.
Cervicitis is the inflammation of the cervix. It is usually caused by an infectious agent, usually sexually transmitted. Cervicitis is frequently asymptomatic and silent infection can cause complications of the upper genital tract. The symptoms are usually nonspecific, the most significant being an increase in vaginal discharge and/or intermenstrual bleeding. For its diagnosis, there are commercial systems based on molecular techniques that include almost all of the known pathogens associated with cervicitis, although cultures should not be abandoned due to the need to conduct studies of susceptibility to antibiotics. It is recommended to initiate an empirical antibiotic therapy that covers C.trachomatis and N.gonorrhoeae in the case of women at high risk of infection by these pathogens, especially if the follow-up is not assured or adequate diagnostic tests are not available. In women with low risk of sexually transmitted infection, antibiotic therapy should be adjusted to the results of the microbiological results.
La cervicitis es un proceso caracterizado por inflamación del cuello uterino. Fue reconocida por primera vez como una entidad clínica importante en 1984, descrita como «la contrapartida en mujeres de la uretritis en los hombres»1. La inflamación se localiza principalmente en las células del epitelio columnar de las glándulas endocervicales, pero puede afectar también al epitelio escamoso del ectocérvix.
Suele estar causada por un agente infeccioso, generalmente de transmisión sexual.
En muchas ocasiones no produce síntomas apreciables y la importancia de su detección y del tratamiento correcto radica en que la infección silente puede originar complicaciones como salpingitis, endometritis y enfermedad pélvica inflamatoria (EPI) y graves consecuencias en gestantes.
A pesar de que no son muchos los estudios que han evaluado la frecuencia de cervicitis, se estima que se trata de una entidad frecuente, con prevalencias tan elevadas como del 20-40% en mujeres atendidas en consultas de infecciones de transmisión sexual (ITS)2.
Anatomía y fisiología del cuello uterinoEl cuello uterino consiste en una matriz de tejido conectivo recubierto por dos tipos diferentes de epitelio: columnar y escamoso. Las células del epitelio columnar tapizan el canal endocervical y constituyen la diana para los patógenos más frecuentemente asociados con la cervicitis, como Chlamydia trachomatis y Neisseria gonorrhoeae. Por el contrario, el ectocérvix está recubierto por epitelio escamoso que es contiguo a la mucosa vaginal y, por lo tanto, susceptible a los patógenos asociados con la vaginitis, incluyendo Trichomonas vaginalis y Candida spp. Ambos epitelios difieren no solo en la susceptibilidad a determinados microorganismos, sino también en los mecanismos de defensa endógenos, su respuesta a los cambios hormonales, su capacidad secretora y su vulnerabilidad al VIH2.
Las hormonas tienen múltiples efectos sobre la mucosa cervicovaginal. Así, los estrógenos (tanto endógenos como exógenos) promueven la ectopia cervical, es decir, la protrusión del epitelio columnar del endocérvix hacia el ectocérvix visible, presente en adolescentes, embarazadas y mujeres que toman contraceptivos estrogénicos. Además, resultan fundamentales para el mantenimiento de un grosor adecuado del epitelio escamoso cervicovaginal. La progesterona, por el contrario, puede causar un adelgazamiento de este epitelio. También la calidad del moco endocervical se ve influida por estas hormonas, e incluso se ha propuesto para ellas un papel directo modulador en la respuesta inmune humoral y celular. Por otra parte, el moco endocervical posee una considerable actividad antimicrobiana intrínseca proporcionada por el ácido láctico, un bajo pH y la presencia de péptidos antimicrobianos3.
ClínicaDesde el punto de vista clínico, la cervicitis suele clasificarse como aguda o crónica, siendo esta última la responsable de un gran número de casos. La inflamación del cuello del útero es frecuentemente asintomática, y en mujeres sintomáticas a menudo los síntomas son inespecíficos, siendo los más significativos la presencia de un aumento del flujo vaginal y/o hemorragia intermenstrual, habitualmente relacionada con el coito.
En el examen ginecológico la cervicitis típicamente se manifiesta por la presencia de un exudado endocervical mucopurulento en el canal endocervical («cervicitis mucopurulenta») y/o sangrado fácilmente inducible mediante el roce ligero con un hisopo de algodón a través del orificio cervical externo («friabilidad»). Ambos signos pueden estar presentes o existir uno solo de ellos, y la friabilidad es tan frecuente, o incluso más, que la presencia de exudado. Así, aunque los trabajos más antiguos hacen referencia al término «cervicitis mucopurulenta», esta terminología resulta imprecisa y las guías de práctica clínica adoptaron desde 2006 el término «cervicitis» para incluir todos los casos4.
La cervicitis crónica, generalmente asintomática, es muy común en mujeres adultas (al menos la evidenciable solo a nivel microscópico) y su importancia radica en el hecho de que la infección subclínica puede extenderse al tracto genital superior, dando lugar a complicaciones como endometritis, salpingitis y EPI. También puede ser causante de efectos adversos en la gestante y en el recién nacido. Las secuelas de la EPI incluyen dolor abdominopélvico crónico, infertilidad y aumento del riesgo de embarazo ectópico. Además, la inflamación crónica del cuello del útero podría favorecer el desarrollo de una neoplasia cervical5.
EtiologíaSon múltiples los agentes potencialmente implicados en la cervicitis, tanto infecciosos como no infecciosos. La actual disponibilidad de técnicas moleculares está incrementando el número de microorganismos reconocidos como potenciales agentes etiológicos.
Agentes infecciososPatógenos de transmisión sexual- •
Chlamydia trachomatis y Neisseria gonorrhoeae. Son los patógenos típicamente asociados con cervicitis, aunque ambos microorganismos son detectados en menos de la mitad de los casos. El resto pueden estar producidos por otros patógenos, por agentes no infecciosos y, ocasionalmente, por procesos inflamatorios sistémicos.C.trachomatis es la causa más frecuentemente identificada en mujeres con cervicitis, con una frecuencia de aislamiento que varía del 10 al 50% en los estudios publicados1,6, dependiendo de la población estudiada, de los criterios empleados en la definición de caso y de los métodos utilizados para el diagnóstico. No obstante, únicamente del 10 al 20% de los casos de infección por C.trachomatis en mujeres se asocian con signos clínicos de cervicitis, lo que podría ser debido tanto a diferencias en la susceptibilidad del huésped como a variabilidad en la patogenicidad de las cepas7. El porcentaje de casos de cervicitis debida a N.gonorrhoeae es muy variable en relación con las marcadas diferencias en la prevalencia de esta infección en las poblaciones estudiadas8.
- •
Trichomonas vaginalis. Otros patógenos habitualmente productores de ITS pueden ser también causantes de cervicitis. Entre ellos, T.vaginalis se ha asociado con inflamación cervical2,9 y con incremento del riesgo de transmisión del VIH. T.vaginalis puede originar una inflamación erosiva del epitelio ectocervical que puede dar lugar a un amplio rango de alteración epitelial, desde pequeñas petequias a grandes hemorragias. La patogenia de dichas lesiones podría ser debida, al menos en parte, a factores citotóxicos elaborados por T.vaginalis, como las proteasas capaces de degradar algunos factores endógenos que protegen la integridad del epitelio cervicovaginal, principalmente el denominado inhibidor de la proteasa secretora de los leucocitos10. Análogamente a lo que sucede con C.trachomatis, se desconoce la razón por la que la tricomoniasis origina evidentes signos inflamatorios en el cuello del útero solo de algunas mujeres. Entre las posibles causas podrían estar la mayor patogenicidad de algunas cepas, la cantidad de microorganismo presente o factores intrínsecos del huésped que podrían incrementar su susceptibilidad11.
- •
Mycoplasma genitalium. Otro posible agente etiológico implicado en la cervicitis es M.genitalium. Este microorganismo fue identificado por primera vez en 1980 en la uretra de dos pacientes con uretritis no gonocócica. La frecuencia de M.genitalium como patógeno causante de ITS no es todavía bien conocida, debido sobre todo a la dificultad de su detección, puesto que se trata de una bacteria que no crece en los medios de cultivo convencionales y para su diagnóstico es necesario recurrir a las técnicas de amplificación de ácidos nucleicos (AAN). No obstante, se estima que es uno de los microorganismos más frecuentes asociados con infecciones del tracto genital, con una prevalencia en hombres con uretritis de hasta el 30-40%12. Su potencial como patógeno de transmisión sexual ha sido confirmado en estudios que demuestran la presencia del microrganismo en las parejas sexuales de pacientes infectados13 y la concordancia de los genotipos presentes en ambos miembros de la pareja14. La mayoría de los estudios de prevalencia han sido llevados a cabo en poblaciones de riesgo, principalmente en pacientes de clínicas de ITS, lo que implica un sesgo y limita las conclusiones respecto a la frecuencia de infección por M.genitalium en la población general. Algunos autores han estimado su prevalencia global en mujeres entre el 1 y el 6,4%15,16, y en estudios realizados en mujeres atendidas en consultas de ITS la frecuencia varía desde el 0,1% hallado en mujeres asintomáticas17 hasta el 20% del trabajo de Gaydos et al.18, en el que casi un 70% de las pacientes presentaba síntomas o signos de cervicitis.Tras el descubrimiento de M.genitalium se puso de manifiesto la capacidad de esta bacteria para infectar la mucosa del tracto genital femenino, originando una respuesta inflamatoria, mediante su inoculación en pequeños simios. La infección aguda de la mucosa endocervical es capaz de causar una destrucción de los microvilli y un incremento en la formación de vesículas secretoras19. Además, la infección de células endocervicales in vitro por M.genitalium origina una respuesta proinflamatoria con secreción de diversas interleucinas y otras sustancias relacionadas con la inflamación20. Los niveles de citoquinas proinflamatorias están elevados en las mujeres con infección crónica por M.genitalium, lo que podría llevar a pensar que, análogamente a lo que ocurre con C.trachomatis, la infección persistente, no tratada, podría dar lugar a una inflamación crónica, con efectos nocivos para el aparato reproductor femenino21.Respecto a su papel patógeno en mujeres, Manhart et al.22 analizaron mediante PCR un total de 719 muestras endocervicales de colección procedentes de pacientes que habían sido atendidas en una consulta de ITS y encontraron que las mujeres infectadas por M.genitalium tenían una probabilidad tres veces mayor de presentar cervicitis mucopurulenta. Estudios posteriores han confirmado esta asociación18. Además, la infección por M.genitalium en mujeres puede producir complicaciones que afectan al tracto genital superior, como endometritis y EPI, infertilidad y efectos adversos en el embarazo y el parto12,23.Recientemente Lis et al.24 llevaron a cabo un metaanálisis en el que analizaron la asociación de la infección por M.genitalium y diversos síndromes del tracto genital femenino. El estudio concluyó que la infección por M.genitalium se asociaba significativamente con cervicitis, EPI, embarazo pretérmino y aborto espontáneo. También se encontró elevado el riesgo de infertilidad en las mujeres infectadas.Por otra parte, en mujeres con cervicitis y EPI se ha documentado coinfección de M.genitalium con C.trachomatis. En el estudio de Bjartling et al.25, el 5% de las pacientes infectadas por C.trachomatis lo estaban también por M.genitalium. Resultados similares fueron hallados por Gaydos et al.18, quienes encontraron un alto porcentaje de coinfecciones en mujeres con cervicitis, siendo las más frecuentes M.genitalium con C.trachomatis (5,3%) y M.genitalium con T.vaginalis (4,5%).
- •
Virus herpes simple. La infección genital por los virus herpes simple (VHS) tipos1 y2 puede ser causante de cervicitis, más frecuentemente en mujeres con aparentes síntomas clínicos de infección primaria por VHS-2. En estas pacientes la cervicitis típicamente se caracteriza por la presencia de lesiones erosivas y hemorrágicas difusas, usualmente en el epitelio ectocervical, que con frecuencia se acompañan de ulceración. Se estima que se produce cervicitis en aproximadamente el 15 al 20% de las mujeres con infección genital primaria por VHS-2 con sintomatología clínicamente evidente26. En estos casos, las manifestaciones de la infección primaria por VHS-2 suelen ser visibles en el epitelio vulvar y/o en el introito. También puede producirse cervicitis durante las recurrencias clínicas de la infección genital por VSH-2, pero con manifestaciones menos graves que las producidas durante la infección primaria. La excreción asintomática de VHS-2 no parece estar directamente relacionada con cervicitis. También VHS-1 puede ser causante de cervicitis, aunque las manifestaciones clínicas son menos graves y generalmente se producen solo durante la infección genital primaria26.
- •
Mycoplasma hominis. Este microorganismo se encuentra frecuentemente en el tracto genital femenino de mujeres sexualmente activas, y algunos trabajos sugieren un papel patógeno para este microorganismo en algunos cuadros de cervicitis y EPI27. En un estudio realizado en mujeres embarazadas se encontró que la detección de M.hominis se asociaba significativamente con la presencia de cervicitis28. Otros autores han encontrado una alta prevalencia de M.hominis (26%) en mujeres con cervicitis29. No obstante, dado que este microorganismo está presente frecuentemente en la población sana, así como en cuadros de vaginosis bacteriana, resulta difícil determinar su papel patógeno en este contexto.
- •
Ureaplasma spp. Tanto Ureaplasma parvum como Ureaplasma urealyticum se detectan con frecuencia en el cérvix de pacientes con cervicitis de causa desconocida, pero su papel etiológico es controvertido. Es posible que una alta carga bacteriana pueda contribuir al desarrollo de cervicitis30. No obstante, parece que al menos U.urealyticum tiene un escaso papel como patógeno en el tracto genital femenino31.
- •
Bacterias asociadas con la vaginosis bacteriana (VB). Una posible asociación entre la VB y la cervicitis ha sido objeto de estudio en algunos trabajos. La VB constituye una causa frecuente de infección vaginal y se caracteriza por un desequilibrio en la microbiota vaginal, con un sobrecrecimiento de las bacterias anaerobias y una disminución de las especies de Lactobacillus productoras de peróxido de hidrógeno (H2O2), que en condiciones normales constituyen la flora vaginal predominante. Existe evidencia de la asociación de la VB con la infección por N.gonorrhoeae y C.trachomatis, lo que dificulta la demostración de una posible relación entre VB y cervicitis con independencia de otros copatógenos. Por otra parte, la VB ha sido asociada con un incremento del riesgo de complicaciones ginecológicas que implican el tracto genital superior, incluyendo EPI, y las bacterias que caracterizan la VB pueden atravesar la barrera de la mucosa endocervical y dar lugar a una respuesta inflamatoria local. Marrazzo et al.32 estudiaron 424 mujeres con VB y encontraron que 63 (15%) de ellas presentaban cervicitis. Solo en 8 de las 63 (13%) pudo evidenciarse una infección concomitante con C.trachomatis o gonococo. Los autores concluyeron que en mujeres con VB es frecuente encontrar cervicitis, y que esta se asocia con factores de riesgo distintos a los existentes en la infección cervical por N.gonorrhoeae o C.trachomatis. Un aspecto a resaltar de este estudio es la conclusión de que la ausencia de Lactobacillus productores de H2O2 puede contribuir al desarrollo de cervicitis32. Por otra parte, en otro trabajo llevado a cabo en mujeres que presentaban VB y cervicitis, la adición de metronidazol en forma de gel vaginal al tratamiento convencional de la cervicitis con doxiciclina y ofloxacina mejoró las tasas de curación33. Todos estos datos sugieren que algunas bacterias asociadas a la VB pueden contribuir al desarrollo de inflamación cervical.Mageeibacillus indolicus es una bacteria del orden Clostridiales que se ha asociado con fracasos en el tratamiento de mujeres con VB y recientemente ha sido detectada en hombres con uretritis no gonocócica34. Los datos disponibles hasta la fecha sugieren la hipótesis de que esta bacteria podría ser un agente de transmisión sexual, pudiendo desempeñar un papel patógeno tanto en el tracto genital femenino como en el masculino. En un trabajo reciente, Gorgos et al.35 analizan las bacterias asociadas con VB como causas potenciales de cervicitis. Estudiando las muestras de una cohorte de mujeres los autores encuentran que M.indolicus podía ser detectado en un porcentaje significativamente mayor en el cuello del útero (42,9% vs 11,9%) y en la vagina (42,9% vs 16,7%) de las mujeres con cervicitis, respecto a las mujeres sin cervicitis. Por tanto, concluyen que la colonización del endocérvix por M.indolicus puede contribuir a las manifestaciones de cervicitis35. En este estudio se encontró además una relación inversa entre la detección de Lactobacillus jensenii y la presencia de signos de cervicitis (52,4% en el cérvix de mujeres sin cervicitis frente al 14,3% en mujeres con cervicitis). Dicha relación había sido ya comunicada en trabajos previos36. Dado que la cepa L.jensenii TL2937ha demostrado tener un papel atenuante de la respuesta inflamatoria en un modelo animal, el potencial efecto beneficioso de L.jensenii en la cervicitis podría derivar de la capacidad de algunas cepas de esta especie presentes en la microbiota vaginal para desactivar la respuesta inmune, reduciendo así la inflamación cervical. Otra explicación posible sería que esta bacteria actuara simplemente promoviendo la resistencia a la colonización vaginal por bacterias productoras de VB35. Por otra parte, las glucosidasas y proteinasas producidas en abundancia por la flora asociada a la VB pueden degradar el moco cervicovaginal, alterando su papel protector, tanto físico como inmunológico, contribuyendo así a la patogénesis de la cervicitis.
Existen otros microorganismos que han sido potencialmente asociados con cervicitis pero hay poca evidencia disponible hasta la fecha de esta asociación. Citomegalovirus puede ser transmitido sexualmente y ha sido detectado en un limitado número de pacientes con cervicitis. También se ha descrito la presencia del virus linfotrópico de célulasT humano tipo1 (HTLV-1) en secreciones cervicales de mujeres con cervicitis. No obstante, resulta difícil establecer el papel etiológico de ambos virus en este contexto.
Se han publicado casos aislados de cervicitis atribuidos a especies del género Streptococcus (principalmente S.agalactiae y S.pyogenes), pero no hay disponibles datos concretos de su frecuencia o de si existe una clara relación causal.
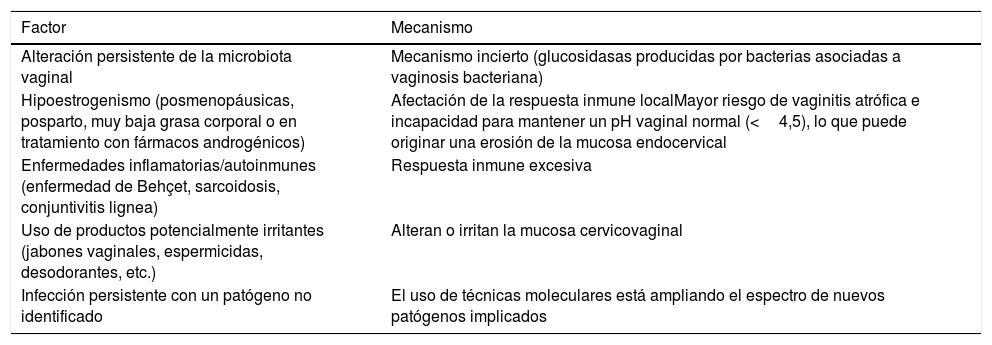
Agentes no infecciososSigue siendo desconocida la etiología en un alto porcentaje de mujeres en las que no se encuentra ninguno de los patógenos conocidos. La inflamación endocervical puede ser mediada a través de numerosas vías metabólicas. Un proceso inflamatorio local podría ser inducido o mantenido a través de diferentes caminos, incluyendo los efectos de una infección persistente por un patógeno no conocido, una microbiota vaginal persistentemente alterada o una exagerada respuesta inmune (tabla 1). Tales procesos probablemente son modulados por el efecto de las hormonas, endógenas y exógenas, incluyendo los cambios hormonales que ocurren durante el ciclo menstrual y con el uso de anticonceptivos. Las hormonas endógenas, como ya se ha mencionado, tienen un claro papel en el mantenimiento de la integridad de la mucosa cervicovaginal. La respuesta inmune local es regulada por los estrógenos (aumentan la respuesta) y la progesterona (la disminuye). Las mujeres con bajos niveles de estrógenos (posmenopáusicas, posparto, muy baja grasa corporal o en tratamiento con fármacos androgénicos) tienen mayor riesgo de vaginitis atrófica, y su incapacidad para mantener un pH vaginal normal (<4,5) puede originar una erosión gradual de la mucosa endocervical. La progesterona ha demostrado en modelos animales aumentar la susceptibilidad a la infección por el virus de la inmunodeficiencia simio y puede incrementar el riesgo de cervicitis en mujeres, como parece concluirse de algunos estudios en mujeres que la usaban como contraceptivo37.
Factores potencialmente implicados en las cervicitis con estudios microbiológicos negativos y posibles mecanismos
| Factor | Mecanismo |
|---|---|
| Alteración persistente de la microbiota vaginal | Mecanismo incierto (glucosidasas producidas por bacterias asociadas a vaginosis bacteriana) |
| Hipoestrogenismo (posmenopáusicas, posparto, muy baja grasa corporal o en tratamiento con fármacos androgénicos) | Afectación de la respuesta inmune localMayor riesgo de vaginitis atrófica e incapacidad para mantener un pH vaginal normal (<4,5), lo que puede originar una erosión de la mucosa endocervical |
| Enfermedades inflamatorias/autoinmunes (enfermedad de Behçet, sarcoidosis, conjuntivitis lignea) | Respuesta inmune excesiva |
| Uso de productos potencialmente irritantes (jabones vaginales, espermicidas, desodorantes, etc.) | Alteran o irritan la mucosa cervicovaginal |
| Infección persistente con un patógeno no identificado | El uso de técnicas moleculares está ampliando el espectro de nuevos patógenos implicados |
Además de los agentes etiológicos mencionados, existe una variedad de procesos inflamatorios sistémicos, infecciosos y no infecciosos, así como algunos agentes o factores locales que pueden causar inflamación endocervical, dando lugar a la aparición de signos clínicos de cervicitis. Entre los procesos de base inflamatoria o inmune que pueden cursar con cervicitis están la enfermedad de Behçet, la sarcoidosis y la conjuntivitis lignea. Entre los agentes locales que pueden ser causa de irritación y/o erosión de la mucosa cervicovaginal se incluyen los jabones utilizados en los lavados vaginales, los desodorantes químicos y algunos espermicidas (tabla 2).
Etiología microbiana y no microbiana de la cervicitis
| Causas microbianas | Causas no microbianas | ||
|---|---|---|---|
| Patógenos productores de infecciones de transmisión sexual | Otros patógenos posiblemente implicados | Procesos inflamatorios e inmunes | Agentes químicos, hormonas |
| C.trachomatisN.gonorrhoeaeM.genitaliumT.vaginalisVHS 1 y 2 | Bacterias asociadas con vaginosis bacterianaM. hominisUreaplasma spp.CMVHTLV-1Streptococcus spp. | SarcoidosisEnfermedad de BehçetConjuntivitis lignea | Jabones y desodorantes vaginalesEspermicidasHormonas sexuales endógenas y exógenas |
CMV: citomegalovirus; HTLV-1: virus linfotrópico humano de célulasT tipo1; VHS1 y2: virus herpes simple tipos1 y2.
Las principales complicaciones de la cervicitis son endometritis, EPI y posibles efectos adversos en el embarazo. Los signos clínicos de cervicitis y/o endometritis pueden ser los únicos presentes en pacientes con EPI. En mujeres con infecciones del tracto genital inferior el riesgo de desarrollar una EPI se estima entre el 20 y el 80% dependiendo del retraso en el diagnóstico, la presencia de coinfección y otros factores dependientes del huésped6.
Por otra parte, se acepta que la presencia de inflamación cervical puede jugar un papel en la transmisión del VIH, incrementando tanto la susceptibilidad a la infección por el virus como la excreción del mismo. Los mecanismos por los que la cervicitis puede favorecer la transmisibilidad del VIH incluyen un aumento de la replicación viral en el contexto de infección o inflamación, particularmente en presencia de elevación de citoquinas proinflamatorias, la disrupción de la mucosa cervical y el mayor número de células infectadas por el VIH en las secreciones cervicales. Se ha demostrado una correlación entre la presencia de genoma del VIH en las secreciones cervicales y la evidencia de cervicitis. Además, la expresión del VIH en el tracto genital podría verse alterada de forma diferente según la etiología de la cervicitis38.
También existe evidencia de la implicación de la inflamación crónica del cuello del útero en la patogénesis del cáncer cervical. Algunos genotipos del papilomavirus humano (VPH), particularmente el 16 y el 18, están implicados en el desarrollo de la mayor parte de los carcinomas genitales. El papel de estos virus en la cervicitis es más incierto. En algunos estudios se ha encontrado una relación directa entre el grado de inflamación cervical y la presencia de lesiones intraepiteliales escamosas.
Complicaciones en mujeres embarazadasLas repercusiones que la cervicitis puede tener en el embarazo y los posibles efectos adversos en el neonato son aún objeto de controversia. La mayor parte de los trabajos publicados que han evaluado dichos efectos incluyen únicamente los casos de cervicitis producidos por los patógenos clásicos (gonococo y Chlamydia). En mujeres embarazadas la infección por C.trachomatis se ha asociado con un aumento del riesgo de embarazo ectópico, parto prematuro, rotura prematura de membranas, aborto espontáneo y morbilidad infantil39,40. Sin embargo, algunos estudios no encuentran diferencias estadísticamente significativas entre el riesgo de parto prematuro o la rotura prematura de membranas en mujeres con cervicitis por Chlamydia y gonococo y las gestantes sin infección41, mientras que otros hallan una asociación estadísticamente significativa entre la infección por C.trachomatis y el riesgo de aborto espontáneo en una población con una alta prevalencia de infección por esta bacteria (17,4%)42.
En el caso de M.genitalium se ha encontrado una asociación significativa entre la infección por esta bacteria y el riesgo de aborto espontáneo y parto prematuro24.
DiagnósticoEl diagnóstico clínico de cervicitis se ha hecho tradicionalmente en base a la presencia de hallazgos sugestivos en la exploración clínica con espéculo: un cuello uterino edematoso y friable con presencia de secreción cervical de aspecto mucopurulento8. No obstante, tanto el grado de inflamación cervical como los signos y síntomas acompañantes pueden ser muy variables, y además el valor predictivo de los signos cervicales sugestivos de cervicitis puede variar en función de la edad y de otros factores de riesgo relacionados con ITS. Para confirmar la existencia de inflamación cervical puede realizarse también un examen microscópico mediante tinción de Gram, cuantificando los leucocitos polimorfonucleares (PMN) en la secreción endocervical. Se considera significativo un recuento >30PMN/campo22,28.
Existe la necesidad de consensuar unos criterios diagnósticos de cervicitis que permitan establecer una definición de caso uniforme que pueda ser aplicable en la práctica clínica y en los estudios epidemiológicos. Los criterios más utilizados para la definición de caso en los estudios publicados en los últimos años han sido la existencia de flujo mucopurulento o la presencia de >30PMN/campo en la secreción endocervical. En un amplio estudio realizado recientemente se evaluaron tres posibles definiciones de caso: una «clínica» (presencia de flujo mucopurulento), otra «microscópica» (>30 leucocitos/campo de gran aumento) y una definición combinada «microscópica y clínica». La definición exclusivamente «clínica» y la «combinada» resultaron ser las de mayor utilidad para la predicción de infección43. Con la definición de caso combinada «microscópica y clínica» se obtuvo el valor predictivo positivo más alto y la especificidad más elevada, aunque con menor sensibilidad para predecir infección por los patógenos más comunes43.
El diagnóstico etiológico debe realizarse mediante el estudio de una muestra de exudado endocervical cuidadosamente obtenida con ayuda de un espéculo durante el examen ginecológico. Deben eliminarse las secreciones vaginales utilizando una torunda seca, que se desecha. Posteriormente debe comprimirse con suavidad el cuello del útero con el espéculo e introducir una torunda fina en el canal endocervical. No deben emplearse torundas de alginato cálcico o con el vástago de madera, ya que pueden inhibir tanto el crecimiento en cultivo celular como las técnicas de AAN44. Es conveniente impregnar al menos dos torundas para destinar una de ellas al examen microscópico y los cultivos y la otra a las pruebas de AAN.
La tinción de Gram del exudado endocervical puede ser de utilidad en el diagnóstico de la cervicitis gonocócica (presencia de diplococos gramnegativos), aunque tiene una baja sensibilidad y especificidad y sus resultados pueden verse influidos tanto por la experiencia del observador como por la posible interferencia con la microbiota o leucocitos propios de la vagina y no del moco cervical.
La muestra del exudado endocervical debe ser cultivada en los medios habituales, incluyendo un medio selectivo para N.gonorrhoeae (Thayer-Martin o Martin-Lewis) y T.vaginalis. También deben utilizarse medios generales, como el agar-sangre y el agar-chocolate, para la recuperación de bacterias menos habituales, ya que existen algunas cepas de N.gonorrhoeae que pueden inhibirse en los medios selectivos.
Para el diagnóstico de C.trachomatis deben utilizarse técnicas de ANN, puesto que, al ser una bacteria intracelular, requiere cultivos celulares y las técnicas de detección antigénica carecen de suficiente sensibilidad45. Existen en el mercado distintas plataformas para la detección conjunta, en la misma muestra, de C.trachomatis y N.gonorrhoeae mediante técnicas de AAN. Estos sistemas difieren en sus métodos de amplificación y en las secuencias utilizadas como diana, y en general todos ellos ofrecen una alta sensibilidad (>90%) y muy alta especificidad (>99%). Debido a su elevada sensibilidad, es importante adecuar las condiciones de trabajo para evitar las contaminaciones.
A pesar de las ventajas ofrecidas por las técnicas de AAN, es recomendable no prescindir de los cultivos, ya que la detección de N.gonorrhoeae puede tener importantes connotaciones, incluso de índole judicial, y porque la recuperación de las cepas permite estudiar sus perfiles de resistencia a los antibióticos.
Los cultivos celulares para Chlamydia también deberían mantenerse en centros de referencia, tanto para monitorizar la aparición y la evolución de resistencias a lo largo del tiempo como para poder estudiar y caracterizar las cepas con fines epidemiológicos y de investigación (p.ej., cepas asociadas al linfogranuloma venéreo y a otras infecciones raras causadas por variantes o cepas mutadas)46.
Las muestras vaginales muestran una sensibilidad y una especificidad equiparables a las endocervicales cuando se utilizan técnicas de AAN, y por lo tanto pueden ser una alternativa válida para el diagnóstico de cervicitis en mujeres que no pueden tener una completa exploración ginecológica. En estos casos el exudado vaginal puede ser obtenido por la misma paciente (autotoma) con buenos resultados. Por el contrario, la fracción uretral de la orina constituye una muestra de menor utilidad para el diagnóstico de la cervicitis por C.trachomatis y N.gonorrhoeae por proporcionar una inferior sensibilidad46.
Las pruebas serológicas para detectar una respuesta inmune no resultan de utilidad en el diagnóstico de infecciones activas por C.trachomatis46.
La infección por T.vaginalis puede diagnosticarse mediante el examen microscópico en fresco de la secreción cervical, pero la sensibilidad de esta técnica es baja, por lo que para su diagnóstico es necesario realizar cultivo en los medios apropiados o utilizar una técnica de AAN.
Las técnicas de AAN son las de elección para el diagnóstico de M.genitalium y los VHS1 y2. Algunas de las técnicas moleculares actualmente comercializadas permiten la detección conjunta de M.genitalium y de las mutaciones asociadas con la resistencia a los macrólidos. Están disponibles varios sistemas comerciales basados en técnicas de AAN (generalmente PCR multiplex) que incluyen la casi totalidad de los patógenos conocidos asociados a cervicitis y otras ITS47. En algunos de estos equipos puede emplearse la muestra cervical recogida en medio de transporte para citología líquida (p.ej., ThinPrep® o Surepath®), lo que resulta ventajoso cuando debe hacerse simultáneamente la detección del VPH.
TratamientoLa decisión de realizar un tratamiento empírico o dirigido de las mujeres con cervicitis deberá tomarse después de considerar factores como la edad, el contexto epidemiológico y la disponibilidad de pruebas de diagnóstico rápido. Se recomienda iniciar un tratamiento empírico que incluya C.trachomatis y N.gonorrhoeae en el caso de mujeres con un elevado riesgo de infección por dichos patógenos (edad <25años y aquellas con una pareja sexual nueva o con una pareja diagnosticada de ITS), sobre todo si el seguimiento no está asegurado o no se dispone de pruebas diagnósticas adecuadas (p.ej., pruebas de AAN no disponibles). Para mujeres con bajo riesgo de ITS el tratamiento puede diferirse, a la espera de los resultados de las pruebas diagnósticas48.
La pauta de tratamiento empírico recomendada en la mayoría de las guías es azitromicina, 1g por vía oral (v.o.) en dosis única, o bien doxiciclina, 100mg v.o., dos veces al día durante 7días. Si la paciente tiene un elevado riesgo de infección gonocócica debe cubrirse también este patógeno, preferentemente con ceftriaxona 500-1.000mg, intramuscular, en dosis única.
Azitromicina constituye también el tratamiento de elección si el patógeno identificado es M.genitalium, pero se han descrito cepas resistentes asociadas a fallo clínico. En estos casos el tratamiento recomendado es moxifloxacino, 400mg/día durante 7-14días48. La realización de un test de curación (repetición de las pruebas diagnósticas al mes de concluir el tratamiento) no es necesaria a menos que persistan los síntomas o en las pacientes embarazadas48.
En el seguimiento de las pacientes en las que el agente etiológico es un patógeno de transmisión sexual debe realizarse un cribado para VIH y sífilis y un estudio de contactos.
El manejo de las pacientes con cervicitis en los que no puede identificarse ningún agente patógeno es controvertido. Para estos casos no existe suficiente evidencia científica que justifique una alternativa de tratamiento, y cada caso debe ser evaluado según el contexto clínico y la presencia de otros factores no infecciosos.
Manejo de los contactos (parejas sexuales)Los contactos sexuales de los últimos 60días de las mujeres con cervicitis deben ser evaluados y tratados con la misma pauta antibiótica recomendada para el patógeno de transmisión sexual identificado o sospechado.
Para minimizar el riesgo de contagio y de reinfección debe aconsejarse a las pacientes que se abstengan de mantener relaciones sexuales hasta que los síntomas se hayan resuelto y su(s) pareja(s) sexual(es) haya(n) sido también debidamente tratada(s).
Consideraciones especiales para el tratamientoInfección por VIHLas mujeres con cervicitis e infección por el VIH deben ser tratadas con el mismo régimen antibiótico que las no infectadas. Se ha sugerido que la inflamación cervical incrementa la eliminación del VIH; en consecuencia, el tratamiento adecuado de la cervicitis en pacientes infectadas por el VIH podría reducir la excreción del virus y disminuir el riesgo de su transmisión a las parejas sexuales.
EmbarazoEl diagnóstico y el tratamiento de la cervicitis en mujeres embarazadas no difieren de los de las no gestantes48.
Cervicitis crónica (persistente o recurrente)La cervicitis puede persistir o recurrir después de completar uno o varios ciclos de tratamiento antibiótico. En estos casos se recomienda reevaluar a las pacientes para descartar una posible re-exposición o un fallo del tratamiento48.
Como ya se ha comentado en apartados anteriores, la importancia de la cervicitis crónica radica en el hecho de que puede dar lugar a complicaciones como endometritis, salpingitis, EPI, corioamnionitis y otros efectos adversos en el embarazo. También puede tener un papel en la iniciación o promoción de una neoplasia cervical5.
En estos casos deben descartarse los posibles microorganismos implicados menos frecuentemente y no cubiertos por el tratamiento administrado (p.ej., Trichomonas o agentes de la VB). La mayor parte de las guías recomiendan una completa revisión ginecológica para descartar signos de malignidad y considerar agentes no infecciosos, como algunas sustancias químicas que pueden erosionar la mucosa cervicovaginal o causar una mucositis irritativa (duchas vaginales, espermicidas y desodorantes químicos).
En los casos de cervicitis crónica en los que no es posible encontrar un agente etiológico puede considerarse una terapia ablativa, aunque son escasos los trabajos que avalan su efectividad. Esta opción debería considerarse como el último recurso, y antes de su aplicación es necesario excluir siempre una posible neoplasia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-formacion.