El aumento de las infecciones de transmisión sexual (ITS) producidas por Neisseria gonorrhoeae (NG) a nivel mundial, junto con la disminución de la susceptibilidad antibiótica, obliga a profundizar en la epidemiología de la infección gonocócica (IG).
MétodosEl proyecto GONOvig analizó, comparativamente siguiendo criterios CLSI y EUCAST, la sensibilidad antibiótica de 227 cepas de NG recogidas en trece hospitales representativos de la Comunidad Valenciana (CV) entre los años 2013 y 2018. Adicionalmente, se pudo realizar la tipificación molecular de 175 cepas mediante la técnica NG multi-antigen sequence typing (NG-MAST).
ResultadosSe detectaron elevadas tasas de resistencia a tetraciclina (38,2% por CLSI y 50,9% por EUCAST) y ciprofloxacino (49,1% CLSI y 54% EUCAST), y bajos porcentajes de resistencia a espectinomicina (0%), cefixima (0,5% CLSI pero 5,9% EUCAST) y ceftriaxona (1,5% CLSI y 2,4% EUCAST). La resistencia a azitromicina fue de 6% (tanto CLSI como EUCAST). El análisis molecular reveló la presencia de 86 secuenciotipos (ST) distintos, destacando el ST2992 (7,4%), ST3378 (6,9%), ST2400 (4,6%) y ST13288 (6,9%) el cual presentaba asociación con resistencia a cefixima (p = 0,031). Los genogrupos (G) mayoritarios fueron el G1407 (13,1%), G2992 (10,3%), G2400 (6,3%) y G387 (3,4%); G1407 y G2400 mostraron asociación con resistencia a ciprofloxacino (p < 0,03).
ConclusiónSe ha detectado una baja resistencia a ceftriaxona, una preocupante resistencia a azitromicina y una gran variedad de ST circulantes, algunos de los cuales presentan correlación con determinados perfiles de resistencia.
The increase in sexually transmitted infections (STI) caused by Neisseria gonorrhoeae (NG) worldwide, together with the decrease in antibiotic susceptibility, forced us to understand the epidemiology of gonococcal infection.
MethodsThe GONOvig project analyzed, comparatively following CLSI and EUCAST criteria, the antibiotic susceptibility of 227 NG strains collected in thirteen representative hospitals of the Valencia Community (CV) between 2013 and 2018. Additionally, molecular typing of 175 strains using the NG multi-antigen sequence typing technique (NG-MAST) was performed.
ResultsHigh rates of resistance to tetracycline (38.2% by CLSI and 50.9% by EUCAST) and ciprofloxacin (49.1% CLSI and 54% EUCAST), and low percentages of resistance to spectinomycin (0%), cefixime (0.5% CLSI but 5.9% EUCAST), and ceftriaxone (1.5% CLSI and 2.4% EUCAST) were detected. Azithromycin resistance was 6% (both CLSI and EUCAST). Molecular analysis revealed the presence of 86 different sequence types (ST), highlighting ST2992 (7.4%), ST3378 (6.9%), ST2400 (4.6%) and ST13288 (6.9%), which was associated with resistance to cefixime (p = 0.031). The main genogroups (G) were G1407 (13.1%), G2992 (10.3%), G2400 (6.3%) and G387 (3.4%). G1407 and G2400 were associated with resistance to ciprofloxacin (p < 0.03).
ConclusiónLow resistance to ceftriaxone, a worrying resistance to azithromycin and a wide variety of circulating sequence types have been detected, some of which show correlation with certain resistance profiles.
Las infecciones causadas por Neisseria gonorrhoeae (NG) suponen un grave problema de salud pública1. A nivel europeo, los datos reportados por el European Centre for Disease and Control (ECDC) indican una marcada y progresiva incidencia2. El rápido diagnóstico y tratamiento adecuado, junto con medidas preventivas y educacionales, constituyen factores fundamentales en el control de la infección gonocócica (IG). A partir del año 2012, las principales sociedades científicas recomendaron el tratamiento empírico dual de la gonorrea combinando una cefalosporina de tercera generación -generalmente ceftriaxona- junto con un macrólido de segunda generación, la azitromicina. La aparición en el año 2018 de la primera cepa resistente a dicha pauta junto con el cambio en los patrones de susceptibilidad a antimicrobianos ha condicionado la reevaluación de dicho régimen terapéutico3–5.
La epidemiología molecular constituye una herramienta imprescindible para conocer la dinámica poblacional6, ya que permite establecer relaciones entre los patrones locales de susceptibilidad antibiótica y las cepas circulantes7, resultando de gran utilidad en la identificación de cepas con alta resistencia y su posible diseminación entre la población8. El constante aumento de los casos de IG a nivel mundial, la ausencia de vacunas efectivas y la emergencia de cepas resistentes a una gran variedad de potenciales opciones terapéuticas (recientemente la Organización Mundial de la Salud [OMS] la ha clasificado como superbacteria9), acentúa la necesidad de implementar programas de vigilancia y control de la infección.
El objetivo principal del proyecto denominado GONOvig fue analizar la sensibilidad antibiótica de cepas de NG aisladas en muestras genitales de pacientes de la Comunidad Valenciana (CV), así como llevar a cabo la tipificación molecular de los aislados con el fin de detectar los clusters epidemiológicos presentes y su posible asociación con los perfiles de resistencia detectados.
MétodosAislados de NGSe realizó un estudio prospectivo y multicéntrico en el que se analizaron 227 cepas de NG obtenidas, mediante toma uretral o endocervical, de pacientes atendidos en trece hospitales representativos de la CV durante enero-2013 y diciembre-2018. Con el objeto de disponer de cierta representación geográfica, se requirió un mínimo de cinco aislados por cada centro participante, correspondiendo una única cepa por paciente y episodio. No entraron a estudio muestras consideradas de colonización (exudados faríngeos o anales) debido a la menor prevalencia de NG en estos especímenes biológicos. Asistencialmente, cada centro participante identificó y realizó el estudio de sensibilidad antibiótica de los aislados mediante métodos disponibles en su laboratorio. Posteriormente, dichos centros enviaron al Hospital Universitario de La Ribera (HULR) el hisopo original y cultivo primario, a temperatura de refrigeración (2-8oC) y en un tiempo menor de 24-48 horas desde la identificación del aislado, junto con datos demográficos del paciente y el estudio de sensibilidad antibiótica realizado en origen. El HULR, centro referente, resembró los aislados en agar chocolate y medio selectivo Thayer-Martin (bioMerieux, Marcy-l’Étoile, France), y los aislados fueron nuevamente reidentificados atendiendo a la morfología de las colonias, resultado positivo en las pruebas de oxidasa y catalasa, y un elevado grado de fiabilidad (> 95%) en la galería bioquímica utilizando el sistema Vitek-210 (bioMerieux, Marcy-l’Étoile, France).
Estudios de susceptibilidad antibióticaLos aislados recolectados durante el proyecto GONOvig se analizaron siguiendo indicaciones internacionales del Clinical and Laboratory Standards Institute (CLSI)11 y European Committee on Antimicrobial Susceptibility Testing (EUCAST)12. Se utilizaron tiras Etest (bioMerieux, Marcy-l’Étoile, France) y se determinó la Concentración Mínima Inhibitoria (CMI), en agar GC suplementado con 1% isovitalex (BD, New Jersey, Estados Unidos) e incubación 20-24 horas en estufa a 37oC con 5% de CO2, frente a los siguientes antibióticos: penicilina, cefixima, ceftriaxona, azitromicina, ciprofloxacino, espectinomicina y tetraciclina. Como control de calidad se utilizó la cepa de NG ATCC 49226.
Para minimizar las posibles discrepancias en la lectura de las elipses de inhibición, el valor de CMI fue determinado por dos especialistas. La interpretación se realizó, comparativamente, según criterios CLSI y EUCAST. Adicionalmente, se calculó la CMI capaz de inhibir a 50% (CMI50) y 90% (CMI90) de los aislados. Se estudió la producción de β-lactamasa (PPNG) utilizando la prueba de cefinasa (BD, New Jersey, Estados Unidos).
Tipificación molecularLa caracterización molecular se centralizó en la Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunidad Valenciana (FISABIO). Se utilizó la técnica NG multi-antigen sequence typing (NG-MAST), basada en la secuenciación de fragmentos internos de los genes hipervariables porB y tbpB, los cuales codifican para una porina y una transferrina de la membrana externa de NG. Se utilizó el sistema QIAamp® DNA Mini Kit (Qiagen, Hilden, Alemania). La amplificación de las secuencias alélicas se realizó según protocolo ya descrito13, utilizando termociclador Mastercycler® (Eppendorf, Hamburg, Alemania), reactivos MasterMix (Biotools, Madrid, España) y primers específicos (Metabion, Munich, Alemania). Las secuencias alélicas obtenidas fueron introducidas en la base de datos (www.ng-mast.net) y los secuenciotipos (ST) resultantes fueron registrados. A su vez, los ST obtenidos se agruparon en asociaciones mayores, denominadas genogrupos (G), atendiendo a similitudes alélicas14. Para ello, se alinearon las secuencias y se establecieron asociaciones mediante el programa MEGA (https://www.megasoftware.net).
Análisis estadístico de los datosLas variables cuantitativas se representaron como media y desviación estándar. Se utilizó la prueba de Anderson-Darling para verificar la normalidad de la distribución de las variables cuantitativas, considerándose como estadísticamente significativo, con un nivel de confianza de 95%, cuando p < 0,05. Para establecer relaciones entre variables cualitativas, como la sensibilidad antibiótica y los ST/genogrupos, se realizaron tablas de contingencia y la prueba exacta de Fisher. Los cálculos estadísticos se desarrollaron con el programa SPSS Statistics 23 (IBM, Armonk, Estados Unidos).
ResultadosDe las cepas, 100% fueron reidentificadas como NG en el centro que actuó como de referencia. De los 227 aislados analizados, el 70% procedían de hospitales de Valencia, 15% de Alicante y 15% de Castellón. Por sexos, 216 de los aislados fueron obtenidos en hombres (94%) y 11 en mujeres (6%). La edad media de la población estudiada fue de 30,7 (±9,4) años, con un intervalo comprendido entre 17 y 79 años.
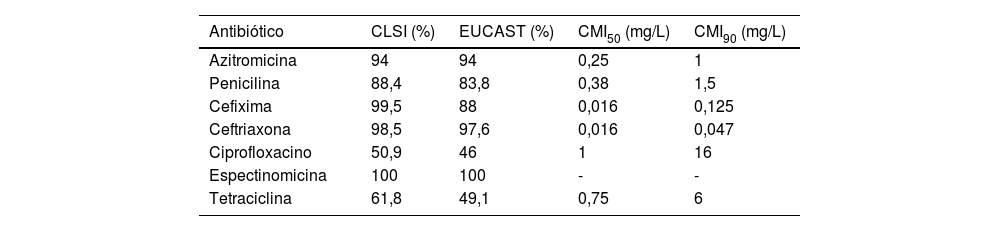
Los principales resultados obtenidos tras los estudios de susceptibilidad antibiótica se muestran en la tabla 1. De los pacientes aislados, 6% presentaron una CMI > 1 mg/L a azitromicina y fueron clasificados como fenotipos non-wild-type portadores de mecanismos de resistencia15. El porcentaje de cepas categorizadas como sensibles a penicilina fue de 4,1% (tanto en CLSI y EUCAST), mientras que 84,3% (CLSI) y 79,7% (EUCAST) resultaron de sensibilidad intermedia, y 11,6% (CLSI) y 16,2% (EUCAST) fueron resistentes. De los gonococos, 5,6% presentaron resistencia plasmídica a la penicilina (PPNG). El porcentaje de cepas resistentes a cefalosporinas de tercera generación fue de 0,5% (CLSI) y 5,9% (EUCAST) para cefixima, y de 1,5% (CLSI) y 2,4% (EUCAST) para ceftriaxona. Aproximadamente el 50% de los aislados fueron resistentes a ciprofloxacino (CLSI y EUCAST), y el 38,2% (CLSI) y 50,9% (EUCAST) lo fueron a tetraciclina. Todas las cepas analizadas resultaron sensibles a espectinomicina.
Porcentajes de sensibilidad a diversos antibióticos en aislados de Neisseria gonorroheae: comparativa según criterios CLSI y EUCAST
| Antibiótico | CLSI (%) | EUCAST (%) | CMI50 (mg/L) | CMI90 (mg/L) |
|---|---|---|---|---|
| Azitromicina | 94 | 94 | 0,25 | 1 |
| Penicilina | 88,4 | 83,8 | 0,38 | 1,5 |
| Cefixima | 99,5 | 88 | 0,016 | 0,125 |
| Ceftriaxona | 98,5 | 97,6 | 0,016 | 0,047 |
| Ciprofloxacino | 50,9 | 46 | 1 | 16 |
| Espectinomicina | 100 | 100 | - | - |
| Tetraciclina | 61,8 | 49,1 | 0,75 | 6 |
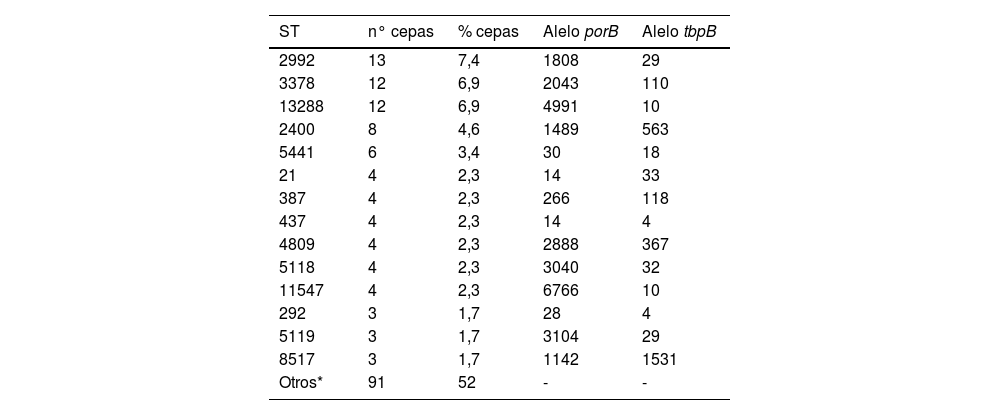
Por cuestiones técnicas y presupuestarias, la caracterización molecular se realizó en 175 cepas (77% del total). Estos estudios de tipificación revelaron la existencia de 86 ST distintos, conformados por 73 alelos porB y 36 alelos tbpB diferentes. Nueve aislados no pudieron ser ST-clasificados por corresponder a secuencias nuevas o combinaciones alélicas no incluidas en la base de datos NG-MAST. Los ST más prevalentes fueron el ST2992 (n = 13), ST3378 (n = 12), ST13288 (n = 12), ST2400 (n = 8) y ST5441 (n = 6). Los ST detectados en ≥ 3 aislados y sus alelos se recogen en la tabla 2.
Principales secuenciotipos detectados y alelos (porB y tbpB) constituyentes
| ST | n° cepas | % cepas | Alelo porB | Alelo tbpB |
|---|---|---|---|---|
| 2992 | 13 | 7,4 | 1808 | 29 |
| 3378 | 12 | 6,9 | 2043 | 110 |
| 13288 | 12 | 6,9 | 4991 | 10 |
| 2400 | 8 | 4,6 | 1489 | 563 |
| 5441 | 6 | 3,4 | 30 | 18 |
| 21 | 4 | 2,3 | 14 | 33 |
| 387 | 4 | 2,3 | 266 | 118 |
| 437 | 4 | 2,3 | 14 | 4 |
| 4809 | 4 | 2,3 | 2888 | 367 |
| 5118 | 4 | 2,3 | 3040 | 32 |
| 11547 | 4 | 2,3 | 6766 | 10 |
| 292 | 3 | 1,7 | 28 | 4 |
| 5119 | 3 | 1,7 | 3104 | 29 |
| 8517 | 3 | 1,7 | 1142 | 1531 |
| Otros* | 91 | 52 | - | - |
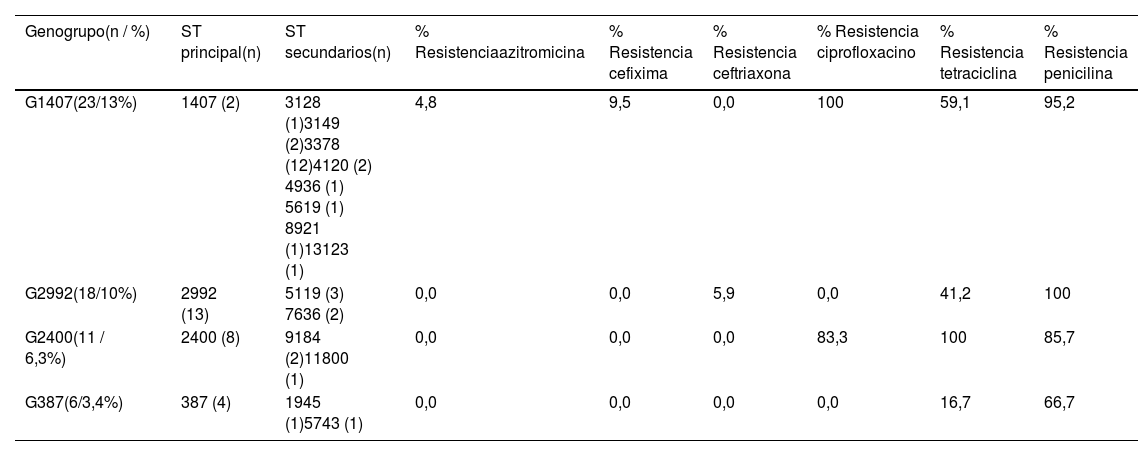
En la tabla 3 se describen los cuatro genogrupos mayoritariamente identificados, junto con sus ST (principal y secundarios) y porcentajes de resistencia asociada a antibióticos (según criterios EUCAST), destacando el G1407 (13,1%), seguido del G2992 (10,3%), G2400 (6,3%) y G387 (3,4%). Las 23 cepas incluidas en el mayoritario G1407 mostraron resistencia a ciprofloxacino (p > 0,02), genogrupo compuesto principalmente por trece aislados del ST3378 y tan solo dos con ST1407. Dos aislados (ST1407 y ST3378) fueron resistentes a cefixima (CMI 0,19 mg/L en ambos casos) y un tercer aislado (ST3378) presentó una CMI > 1 mg/L frente azitromicina. Una cepa perteneciente al G2992 (ST2992) fue resistente a ceftriaxona (CMI 0,75 mg/L). El G2400, mayoritariamente constituido por cepas con ST2400, se relacionó con resistencia a ciprofloxacino (p = 0,017) y tetraciclina (p = 0,048).
Genogrupos más prevalentes y porcentajes de resistencias antibióticas asociados
| Genogrupo(n / %) | ST principal(n) | ST secundarios(n) | % Resistenciaazitromicina | % Resistencia cefixima | % Resistencia ceftriaxona | % Resistencia ciprofloxacino | % Resistencia tetraciclina | % Resistencia penicilina |
|---|---|---|---|---|---|---|---|---|
| G1407(23/13%) | 1407 (2) | 3128 (1)3149 (2)3378 (12)4120 (2) 4936 (1) 5619 (1) 8921 (1)13123 (1) | 4,8 | 9,5 | 0,0 | 100 | 59,1 | 95,2 |
| G2992(18/10%) | 2992 (13) | 5119 (3) 7636 (2) | 0,0 | 0,0 | 5,9 | 0,0 | 41,2 | 100 |
| G2400(11 / 6,3%) | 2400 (8) | 9184 (2)11800 (1) | 0,0 | 0,0 | 0,0 | 83,3 | 100 | 85,7 |
| G387(6/3,4%) | 387 (4) | 1945 (1)5743 (1) | 0,0 | 0,0 | 0,0 | 0,0 | 16,7 | 66,7 |
Se calcula que cada año se producen más de 376 millones de nuevas infecciones de transmisión sexual (ITS), representando un grave problema de salud pública a nivel mundial. La IG constituye la segunda ITS de etiología bacteriana más prevalente ocasionando, tan solo en el año 2016, un total de 86 millones de nuevos contagios16, cifra notablemente superior a los 78 millones reportados por la OMS en el año 2012. Además del incremento en su incidencia, NG ha demostrado una excepcional capacidad en el desarrollo de mecanismos que le han permitido evadir la acción de gran parte de los agentes antimicrobianos utilizados para su erradicación. La aparición de cepas resistentes a azitromicina15,17 y los cambios en el perfil de resistencia de NG han motivado modificaciones en la pauta farmacológica. Las actuales recomendaciones de la guía americana (CDC)3, inglesa (BSHH)5 y europea4 proponen duplicar la dosis de ceftriaxona y, en el caso del CDC y del BSHH, abandonar el uso de azitromicina, constituyendo la ceftriaxona en monoterapia el tratamiento empírico más aconsejado.
El informe del programa europeo de vigilancia del gonococo (Euro-GASP) del año 2017 destaca España como uno de los países con mayor tasa de resistencia a la cefixima oral (5,5%) durante el periodo 2009-201718, dato concordante con el observado en nuestro análisis (5,9%). A nivel nacional, en el año 2011 Pladevall analizó cepas aisladas en Barcelona que presentaron una resistencia de 10% a cefixima y de 3% a ceftriaxona19. Un estudio posterior del mismo grupo con un mayor número de cepas determinó una resistencia de 8,3% a cefixima y de 2,8% a ceftriaxona20. Cobo et al. informaron de tasas de resistencia a cefixima de 6,1 y 4,6% a ceftriaxona tras analizar muestras recogidas en el sur de España21, porcentajes que disminuyeron hasta 3,7% (cefixima) y 2,9% (ceftriaxona) en sus posteriores trabajos22. El estudio desarrollado en Valencia durante el periodo 2013-2019 por Castaño et al. detectó 3% de aislados resistentes a cefixima y 0,4% a ceftriaxona23.
A pesar de las ligeras discrepancias geográficas y temporales, estos datos constatan una resistencia de NG cercana a 5% para cefixima y de 2% para ceftriaxona según criterios EUCAST. Sin embargo, al aplicar criterios CLSI dichos porcentajes resultan inferiores, discordancia especialmente evidente en el caso de la cefixima (0,5 vs. 5,9%) motivada por los diferentes breakpoints establecidos por ambas instituciones. Esto puede ocasionar problemas en la clasificación de los aislados, siendo deseable la estandarización de los puntos de corte en base a criterios clínicos, microbiológicos y farmacocinéticos.
En el caso de azitromicina, antimicrobiano considerado la piedra angular en el tratamiento de distintas ITS, ambas sociedades establecen un punto de corte epidemiológico (ECV) de 1 mg/L, siendo esta la CMI que diferencia a las cepas wild-type11,12. Recientes estudios suscitan que NG ha adquirido en los últimos años mutaciones cromosómicas en el ARN 23S15 que, junto con otros mecanismos de resistencia, le permiten evadir la acción de macrólidos. A nivel europeo, el ECDC24 reportó en el año 2018 una resistencia a azitromicina de 7,6%, constituyendo un importante incremento respecto a 3,7% del año 2017. Las resistencias a azitromicina detectadas en otros estudios nacionales22,23 han sido de 9 y 9,7%.
La caracterización molecular de los aislados reveló que gran parte (59,3%) de los 86 ST identificados estuvieron presentes en una sola cepa. Los ST mayoritarios detectados en nuestro estudio han sido también identificados a nivel europeo14,25 a excepción del ST13288, ST en el que se incluyeron tres cepas con resistencia a cefixima y que nos alerta de la posible aparición de un clon, tan solo descrito en Italia26, con capacidad potencial de evadir el tratamiento empírico de elección en la IG.
La literatura científica destaca el genogrupo G1407 como mayoritario en España y Europa, estrechamente asociado a fracaso terapéutico en Francia27, España28 y Reino Unido29 entre otros países. En nuestro análisis, su alta prevalencia vino principalmente definida por las 12 cepas pertenecientes al ST3378, una de las cuales resultó resistente a cefixima y otra a azitromicina, así como una asociación estadísticamente significativa con aislados resistentes a ciprofloxacino (p = 0,02).
Chisholm et al. realizaron la tipificación molecular de 1.066 cepas de NG obtenidas en 21 países europeos participantes en el European Gonococcal Antimicrobial Surveillance Programme (Euro-GASP) durante los años 2009-201014 concluyendo que, en nuestro país, el G1407 fue el más prevalente seguido del G2992, coincidiendo con los resultados obtenidos en nuestro estudio. Adicionalmente el ECDC también comunicó que el G1407 fue el genogrupo más común en Europa en el año 2009 (23,3%) disminuyendo su presencia en el 2013 (14,8%)26, seguidos de los genogrupos G2992 y G2400, el cual presentó asociación con cepas resistentes a ciprofloxacino (p = 0,017) y tetraciclina (p = 0,048). El incremento del G2400 es un hallazgo también constatado por Pladevall, así como su facilidad para el desarrollo de mecanismos de resistencia antimicrobiana20. Finalmente, el G387 presentó en nuestro análisis tasas similares a las reportadas en los estudios europeos mencionados14,26.
El establecimiento de asociaciones entre ST y/o genogrupos y fenotipos de resistencia específicos requiere análisis de tipificación molecular paralelos a los estudios de sensibilidad antibiótica de los aislados. Este hecho acentúa la utilidad de la técnica molecular NG-MAST como método complementario para el conocimiento de las resistencias antimicrobianas. El cultivo convencional sigue siendo indispensable para conocer, lo antes posible, el perfil de sensibilidad antibiótica in vitro y establecer el tratamiento más adecuado en cada caso.
Una limitación del presente estudio reside en que las cepas analizadas pertenecieron únicamente a pacientes de la CV, siendo necesaria la vigilancia, tanto epidemiológica como molecular, en áreas y países de nuestro entorno con el objeto de comparar resultados. Otra restricción, a pesar de su menor prevalencia, radica en no haber incluido aislados de muestras faríngeas y anales, los cuales se ha documentado que pueden presentar perfiles de resistencia distintos, debido a que las cepas colonizadoras de estas zonas anatómicas están sometidas a una menor presión antibiótica y una mayor adquisición de genes de resistencia procedentes de otras especies saprófitas de NG30. Por otro lado, no se recogió la orientación sexual de los pacientes englobados en el proyecto GONOvig, información que podría resultar de interés a la hora de establecer relaciones clínico-epidemiológicas.
Como conclusión hay que destacar que los datos moleculares obtenidos revelan que la población de NG circulante en la CV muestra similitudes con cepas aisladas en otras zonas geográficas, destacando la alta prevalencia del ST2992 y ST2400. Nuestra investigación demuestra que existe correlación entre determinados ST y/o genogrupos y resistencias antibióticas, especialmente a ciprofloxacino y tetraciclina. Finalmente, la resistencia a cefalosporinas de tercera generación se mantuvo baja, menor en el caso de ceftriaxona (2,4%) respecto a cefixima (5,9%), mientras que las cepas con altas CMIs de azitromicina se han incrementado en los últimos años (6%).
FinanciaciónEl proyecto GONOvig ha recibido dos becas de apoyo a la investigación por parte del HULR. Estas ayudas permitieron la compra del material y de los medios necesarios para la realización de la fase experimental del estudio.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
A la Fundación FISABIO así como al personal técnico y facultativo que colaboró en el Proyecto GONOvig.