La tuberculosis (TB) es una de las infecciones más importantes en pacientes inmunodeprimidos debido a su elevada frecuencia y alta morbimortalidad. La TB es la principal causa de muerte entre pacientes infectados por VIH. El diagnóstico y tratamiento precoz de la infección tuberculosa latente es clave para evitar su progresión a enfermedad. Del mismo modo, el diagnóstico precoz de la TB es clave para mejorar el pronóstico de los pacientes y evitar su transmisión. La expresión clínica de la TB en pacientes inmunodeprimidos está condicionada por el grado de inmunodepresión de los pacientes. Es importante tener presente esta peculiaridad para no retrasar el diagnóstico de sospecha de TB. Las bases del tratamiento de la TB en inmunodeprimidos son las mismas que en la población general. Sus peculiaridades derivan principalmente de las interacciones farmacológicas. Examinamos las bases de diagnóstico y tratamiento de la TB y la infección tuberculosa latente en pacientes inmunodeprimidos.
Tuberculosis (TB) is one of the most significant infections in immunosuppressed patients due to its high frequency and high morbidity and mortality. TB is the leading cause of death among HIV-infected patients. The diagnosis and early treatment of latent tuberculosis infection is vital to preventing it progression to disease. Similarly, the early diagnosis of TB is key to improving the prognosis of patients and preventing its transmission. The clinical expression of TB in immunosuppressed patients is conditioned by the patient's degree of immunosuppression. It is important to keep this peculiarity in mind so as not to delay the diagnosis of suspected TB. TB treatment is basically the same in immunosuppressed patients as in the general population and any differences mainly derive from pharmacological interactions. We examined the diagnosis and treatment of TB and latent tuberculosis infection in immunosuppressed patients.
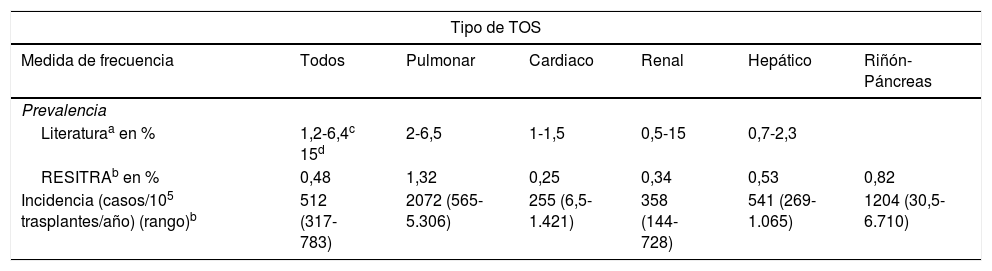
La tuberculosis (TB) es una de las infecciones oportunistas más importantes que pueden afectar a los receptores de un trasplante de órgano sólido (TOS) por su elevada morbimortalidad. La frecuencia de la TB en TOS oscila en un rango entre 1,2 y 15%1, es decir, entre 20 y 74 veces más alta que en la población general. En la tabla 1 se muestra la prevalencia e incidencia de la TB en TOS en la mayoría de las series de la literatura1,2 en comparación con la información disponible en la Red Española de Infección en Trasplante (RESITRA)2.
Prevalencia e incidencia de la tuberculosis en TOS (8)
| Tipo de TOS | ||||||
|---|---|---|---|---|---|---|
| Medida de frecuencia | Todos | Pulmonar | Cardiaco | Renal | Hepático | Riñón-Páncreas |
| Prevalencia | ||||||
| Literaturaa en % | 1,2-6,4c 15d | 2-6,5 | 1-1,5 | 0,5-15 | 0,7-2,3 | |
| RESITRAb en % | 0,48 | 1,32 | 0,25 | 0,34 | 0,53 | 0,82 |
| Incidencia (casos/105 trasplantes/año) (rango)b | 512 (317-783) | 2072 (565-5.306) | 255 (6,5-1.421) | 358 (144-728) | 541 (269-1.065) | 1204 (30,5-6.710) |
Aunque todos los receptores de un TOS deberían ser considerados un grupo de alto riesgo para TB, dicho riesgo varía entre los distintos tipos de trasplante. La incidencia de TB es especialmente elevada en los receptores de un trasplante pulmonar. Los trasplantados pulmonares tienen 5,6 veces más riesgo de desarrollar TB que los receptores de otros tipos de trasplante y 73,3 veces más riesgo que los pacientes no inmunodeprimidos2.
Cronología y peculiaridades clínicasLa mayoría de los casos de TB en los TOS son causados por reactivación de una infección latente en el receptor al iniciar el tratamiento inmunosupresor. Suele ocurrir en el primer año después del trasplante, con una mediana de 9 meses. Sin embargo, hasta en un tercio de los pacientes puede desarrollarse más tardíamente. Se ha observado que los trasplantados renales desarrollan los síntomas de forma más tardía que otros tipos de trasplantados; esto puede deberse, en parte, a la menor intensidad de la inmunosupresión recibida en comparación con los trasplantados pulmonares o cardiacos, por ejemplo2. Por otra parte, los pacientes con historia previa de TB tienen mayor riesgo de reactivación durante los primeros meses postrasplante, con independencia del tipo de inmunosupresión recibida.
La TB pulmonar es el tipo más frecuente de enfermedad en el contexto del trasplante. Sin embargo, el número de pacientes que desarrollan formas extrapulmonares o diseminadas es más alto que en la población general. Dichas formas extrapulmonares o diseminadas son más frecuentes en los primeros 6 meses postrasplante, lo que coincide con el periodo de máxima inmunosupresión.
A diferencia de lo que sucede en la población general, la TB en los receptores de un TOS puede ser asintomática y el diagnóstico en estos casos se establece mediante cultivos de vigilancia; no es infrecuente que el diagnóstico se haga en la necropsia. Además, hasta un tercio de los pacientes puede tener una radiografía de tórax normal.
ProfilaxisLa profilaxis debe iniciarse idealmente antes del trasplante. Si no fuera posible finalizarla antes del trasplante, debe completarse después de este. El fármaco de elección es la isoniazida (INH) (300mg/día) suplementada con vitamina B6 durante 9 meses1,3. Hay que tener presente la posibilidad de hepatotoxicidad por INH; se recomienda monitorizar las enzimas hepáticas y suspender la profilaxis si estas se elevan 3 veces y el paciente está sintomático o si se elevan 5 veces en pacientes asintomáticos.
Otras alternativas de profilaxis incluyen INH (900mg máximo) 2veces a la semana durante 9 meses en tratamiento directamente observado, rifampicina (RF) (máximo 600mg/día) durante 4 meses (con o sin INH) y rifapentina (RP) (750mg si<50 kg; 900mg si> 50 kg) con INH semanal durante 3 meses por tratamiento directamente observado4. La asociación de RF con pirazinamida (Z) durante 2 meses se ha asociado a casos de hepatotoxicidad grave y, por lo general, no se recomienda4,5. Los regímenes que incluyen RF o RP solo se aconsejan para realizar la profilaxis antes del trasplante, debido a las interacciones entre estos fármacos y el tratamiento inmunosupresor.
Es prudente retrasar la administración de INH hasta después del trasplante en los candidatos a trasplante hepático4,5. Levofloxacino previo al trasplante podría ser una alternativa a la INH, aunque se han descrito efectos adversos, fundamentalmente tenosinovitis6.
TratamientoLas recomendaciones del tratamiento de la TB en pacientes trasplantados son similares a las indicadas en la población general4,5,7,8; solo hay 2aspectos diferenciales: a) la interacción de rifamicinas (RF, rifabutina [RB] o RP) con los fármacos inmunosupresores de la familia de los inhibidores de la calcineurina (ciclosporina, tacrolimus), con rapamicina y con esteroides y b) la duración del tratamiento.
Utilización de rifamicinas en el paciente trasplantadoLa inclusión de rifamicinas, sobre todo RF, en las pautas de tratamiento de la TB en los pacientes trasplantados es el aspecto más controvertido del tratamiento de estos pacientes. La RF reduce las concentraciones séricas de ciclosporina, tacrolimus, rapamicina (sirolimus), everolimus y corticoides. Esto se ha asociado con un riesgo de rechazo elevado. Por tanto, se recomienda aumentar la dosis de inhibidores de la calcineurina aproximadamente de 3 a 5 veces cuando se utilice simultáneamente RF en estos pacientes y realizar un control estrecho de las concentraciones de los inmunosupresores5.
La RB podría ser una alternativa, dado que es un inductor más débil del citocromo P450 que la RF, pero los datos sobre su uso son limitados.
Utilización de otros fármacos antituberculosos en el paciente trasplantadoLa INH y la Z se han utilizado ampliamente en los pacientes trasplantados con TB. Dado el riesgo de hepatotoxicidad, es necesario un especial seguimiento de las enzimas hepáticas, en especial en los trasplantados hepáticos.
La administración de aminoglucósidos debe sopesarse con prudencia, dado el riesgo de potenciación de nefrotoxicidad de estos fármacos con los inhibidores de la calcineurina.
Las fluorquinolonas pueden ser una alternativa, sobre todo en pacientes que desarrollan hepatotoxicidad o tienen disfunción hepática. Sin embargo, el uso indiscriminado de estos fármacos en la población general se ha asociado a un aumento de resistencia de Mycobacterium tuberculosis (M. tuberculosis) a fluorquinolonas en los últimos años.
Se ha observado un aumento de la incidencia de efectos adversos asociados al tratamiento prolongado con fluorquinolonas, en especial, artralgias y tendinopatía6. La utilización conjunta y prolongada de levofloxacino con Z se ha asociado a una pobre tolerancia, sobre todo digestiva, en pacientes receptores de TOS.
En casos especiales de resistencia o toxicidad, linezolid ha sido eficaz en pacientes con TB9. Sin embargo, el uso prolongado de este fármaco se asocia con el dasarrollo frecuente de trombocitopenia y anemia y, en algunos casos, de polineuropatía, en especialen pacientes con otras comorbilidades, como diabetes o enfermedad renal.
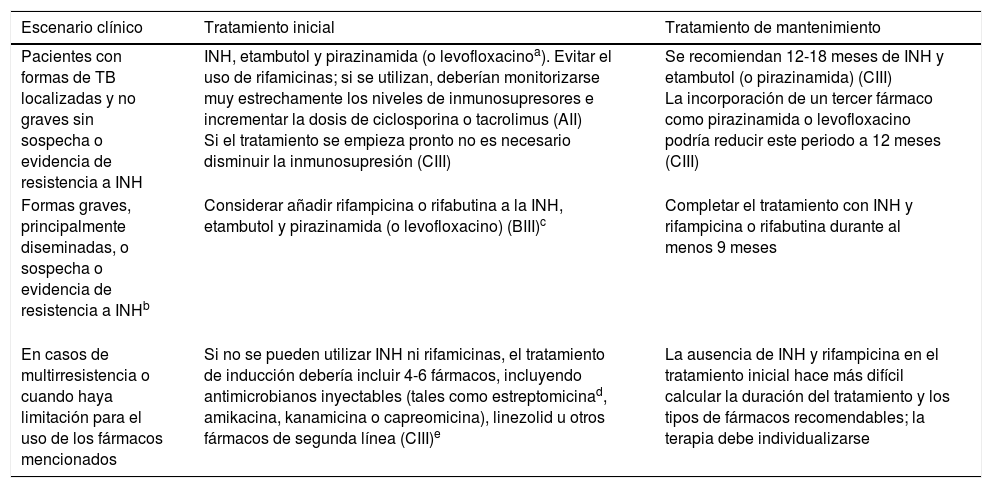
En la tabla 2 se recogen las recomendaciones para el tratamiento de la TB en pacientes trasplantados basadas en el documento de consenso del Grupo de Estudio de la Infección en el Trasplante (GESITRA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica7.
Tratamiento de la TB en receptores de TOS de acuerdo con las recomendaciones de GESITRA, de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica
| Escenario clínico | Tratamiento inicial | Tratamiento de mantenimiento |
|---|---|---|
| Pacientes con formas de TB localizadas y no graves sin sospecha o evidencia de resistencia a INH | INH, etambutol y pirazinamida (o levofloxacinoa). Evitar el uso de rifamicinas; si se utilizan, deberían monitorizarse muy estrechamente los niveles de inmunosupresores e incrementar la dosis de ciclosporina o tacrolimus (AII) Si el tratamiento se empieza pronto no es necesario disminuir la inmunosupresión (CIII) | Se recomiendan 12-18 meses de INH y etambutol (o pirazinamida) (CIII) La incorporación de un tercer fármaco como pirazinamida o levofloxacino podría reducir este periodo a 12 meses (CIII) |
| Formas graves, principalmente diseminadas, o sospecha o evidencia de resistencia a INHb | Considerar añadir rifampicina o rifabutina a la INH, etambutol y pirazinamida (o levofloxacino) (BIII)c | Completar el tratamiento con INH y rifampicina o rifabutina durante al menos 9 meses |
| En casos de multirresistencia o cuando haya limitación para el uso de los fármacos mencionados | Si no se pueden utilizar INH ni rifamicinas, el tratamiento de inducción debería incluir 4-6 fármacos, incluyendo antimicrobianos inyectables (tales como estreptomicinad, amikacina, kanamicina o capreomicina), linezolid u otros fármacos de segunda línea (CIII)e | La ausencia de INH y rifampicina en el tratamiento inicial hace más difícil calcular la duración del tratamiento y los tipos de fármacos recomendables; la terapia debe individualizarse |
El uso prolongado de fluorquinolonas puede asociarse a artralgias; la combinación de pirazinamida y levofloxacino no es bien tolerada por los efectos secundarios gastrointestinales.
Si no se puede utilizar INH, se recomienda un tratamiento inicial y de mantenimiento que incluya 4 fármacos durante al menos 18 meses (CIII).
El uso de rifampicina o rifabutina requiere el incremento de las dosis de ciclosporina o tacrolimus y la monitorización estrecha de los niveles de estos fármacos (AII). La resistencia a rifampicina se asocia a resistencia cruzada a rifabutina y rifapentina; por tanto, no son alternativas que considerar (DII).
En casos de resistencia a estreptomicina, no hay resistencia cruzada con otros fármacos inyectables (amikacina, kanamicina o capreomicina); sin embargo, la resistencia cruzada entre amikacina y kanamicina es universal. No se recomienda la combinación de fármacos inyectables por su intolerancia y efectos secundarios (DII).
Hay 2motivos de controversia en estos pacientes: la duración del tratamiento y el tipo de fármacos que se deben utilizar tras los primeros 2 meses, sobre todo si no se utiliza RF en los 2 primeros meses o si esta debe suspenderse debido a sus efectos adversos. Algunos autores recomiendan un régimen de tratamiento diario durante 6 meses en los pacientes trasplantados4, aunque el tratamiento inferior a 9 meses se ha asociado a una mayor mortalidad1. La duración del tratamiento debería extenderse en pacientes con enfermedad osteoarticular (de 6 a 9 meses), afectación del sistema nervioso central (de 9 a 12 meses), enfermedad grave diseminada (de 6 a 9 meses), TB pulmonar cavitada con cultivos de esputo positivos después de 2 meses de tratamiento (9 meses) y en pacientes con fármacos de segunda línea o regímenes libres de RF, dado que las rifamicinas tienen una potente actividad bactericida contra M. tuberculosis4. En estos casos, el tratamiento inicial debería ser de 2 meses, pero el tratamiento de mantenimiento debería ser más largo.
Tuberculosis en trasplantados de progenitores hematopoyéticosAunque la TB es aproximadamente 10 veces menos frecuente en los trasplantados de progenitores hematopoyéticos (TPH) que en los TOS, la frecuencia es de 10 a 40 veces mayor en TPH que en la población general10. La incidencia de la TB en TPH autógenos oscila entre 0,05 y 0,26%, lo cual es comparable a la población general. Los TPH alogénicos, sin embargo, tienen una mayor incidencia: entre el 0,1 y el 5,5%11.
Se estima que una cuarta parte de los casos se deben a la reactivación de una infección latente por M. tuberculosis. La mediana de aparición de la TB es de 257 días post-TPH.
Presentación clínicaLa TB en TPH tiene un curso típicamente indolente. La TB pulmonar es la manifestación más frecuente y los síntomas son similares a los de la población general. Sin embargo, los hallazgos pulmonares clásicos como el infiltrado o cavitación apical suelen estar ausentes. Los hallazgos radiológicos pueden ser inespecíficos, infiltración difusa lobar y segmentaria, neumonitis intersticial, síndrome de distrés respiratorio del adulto, nódulos pulmonares periféricos o, incluso, hemorragia alveolar difusa. Las manifestaciones clínicas y radiológicas pueden recordar a una infección fúngica invasiva.
Más de un 15% de los pacientes pueden tener una TB extrapulmonar que afecte al hígado, bazo, riñón, hueso, médula ósea, sistema nervioso central y articulaciones.
ProfilaxisLas indicaciones y recomendaciones del tratamiento de la infección tuberculosa latente (ITL) son las mismas que para los TOS. El tratamiento debería iniciarse, si es posible, antes de la terapia de acondicionamiento o bien al finalizar esta, cuando el riesgo de enfermedad sea alto12.
TratamientoEl manejo de la TB activa en los TPH es el mismo que en los TOS.
Tuberculosis en pacientes con terapias biológicasLos agentes biológicos, incluidos los antagonistas del factor de necrosis tumoral (TNF), se utilizan para el control de algunas enfermedades reumáticas y autoinmunes. El uso de terapias biológicas genera inquietud, debido a los efectos a largo plazo del bloqueo o inhibición persistente de citocinas o sus receptores (TNF, IL-1, IL-6R) o de células (linfocitos B y T) que desempeñan un papel primordial en los mecanismos inmunitarios de defensa contra la infección o contra el cáncer. Hasta la fecha, 5 anti-TNFα se utilizan en la práctica clínica: etanercept, adalimumab, infliximab, golimumab y certolizumab pegol. Con la finalidad de conocer la seguridad a largo plazo de las terapias biológicas han ido creándose distintos registros nacionales. En el año 2000, la Sociedad Española de Reumatología creó BIOBADASER, el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas13. El problema principal asociado al uso de las terapias biológicas es un aumento moderado en el riesgo de infecciones graves con respecto al observado con las terapias convencionales. La infección en la que la aportación del BIOBADASER ha sido fundamental es la TB. En el año 2000 se detectó en los pacientes españoles tratados con anti-TNFα una alta incidencia de TB en comparación con la población general. El riesgo relativo (RR) de TB en pacientes con artritis reumatoide tratados con infliximab en comparación con pacientes no expuestos a esta terapia fue 19,9 (IC 95%: 16,2-24,8) en el año 2000 y 11,7 (IC 95%: 9,5-14,6) en 200114, incluidas formas extrapulmonares y diseminadas en el 65% de los casos. La alerta generó que se dictaran en marzo de 2002 las recomendaciones oficiales sobre prevención de la TB en pacientes con ITL que iniciaban tratamiento con anti-TNFα, con lo que se consiguió una reducción del 80% de nuevos casos15. La validez de estas recomendaciones fue ratificada posteriormente, al comprobar un riesgo 7 veces mayor de TB si no se cumplían16.
ProfilaxisEn pacientes con ITL se recomienda tratamiento con INH 5mg/kg/día (máximo 300mg/día) durante 9 meses. En caso de alergia o intolerancia a la INH se podría utilizar RF (10mg/kg/día; máximo 600mg) durante 4 meses. En cualquier caso, se recomienda no empezar la terapia biológica hasta pasado un mes de iniciada la profilaxis anti-TB17.
TratamientoEl manejo de la TB activa en los pacientes tratados con terapias biológicas es el mismo que en la población general.
Tuberculosis en pacientes con corticoterapia crónicaSe ha descrito un aumento de la incidencia de TB en pacientes en tratamiento con corticoides de forma crónica18. En un estudio retrospectivo de casos y controles, la odds ratio para TB fue 2,8 (IC 95%: 1,0-7,9) para dosis menores de 15mg/día de prednisona y 7,7 (IC 95%: 2,8-21,4) para dosis mayores de 15mg/día19. Por otra parte, el uso de dosis altas de corticoides inhalados (superior al equivalente a la dosis de 500μg/día de fluticasona), una dosis ≥ 10mg/día de prednisolona y una TB pulmonar previa se han asociado a un incremento del riesgo de TB pulmonar en pacientes con enfermedad pulmonar obstructiva crónica20.
Por tanto, dado el riesgo de desarrollo de TB en pacientes en tratamiento crónico con corticoides, se recomienda descartar ITL antes de iniciarlo.
La profilaxis en pacientes con ITL y el tratamiento de la TB activa en pacientes con corticoterapia crónica son los mismos que en la población general.
Tuberculosis en pacientes con infección por virus de la inmunodeficiencia humanaEpidemiologíaEn año 2015 el número estimado de nuevos casos de TB en el mundo en personas infectadas por virus de la inmunodeficiencia humana (VIH) fue de 1,2 millones, lo que suponía el 11% de los casos de TB en el mundo. En el mismo año, 0,4 millones de pacientes con VIH fallecieron por TB en el mundo (el 22% de las muertes por TB: 1,8 millones de personas)21. De tal forma que, en la actualidad, la TB continúa siendo la principal causa de muerte en pacientes infectados por el VIH21. El riesgo anual de reactivación de TB entre personas con VIH sin tratamiento antirretroviral (TAR) es 3-16% por año, lo que supone aproximadamente el mismo riesgo (∼5%) de desarrollar TB a lo largo de toda la vida de personas no infectadas con ILT22. A diferencia de otras infecciones oportunistas, y aunque su incidencia es mayor a medida que aumenta la inmunodepresión, la TB puede ocurrir en cualquier paciente infectado por VIH, con independencia de su cifra de linfocitos CD422. Por otro lado, aunque el TAR reduce la incidencia de TB en pacientes con VIH, el riesgo de TB entre estos continúa siendo mayor que en la población general. Además, el desarrollo de TB supone un factor independiente de aumento del riesgo de progresión de la enfermedad y muerte en pacientes infectados por el VIH. Por todo ello, la TB, pese a ser una enfermedad prevenible y curable, continúa siendo en la actualidad uno de los principales problemas de salud en pacientes infectados por VIH.
Profilaxis antituberculosa en pacientes infectados por el virus de la inmunodeficiencia humanaEn personas con VIH, la ILT ha sido tradicionalmente definida por la presencia de positividad (≥5mm de induración a las 48-72 h) al test de la tuberculina (TT) en ausencia de evidencia de enfermedad tuberculosa23–25. Se debe realizar cribado de ILT en toda persona con VIH en el momento de su diagnóstico. En personas con TT negativo y cifras de CD4+<200 céls/mL se debe repetir el TT tras iniciar el TAR y alcanzar cifras de T4>200 céls/mL. En personas con alto riesgo de exposición a TB activa se recomienda repetir anualmente el TT23. La experiencia con el TT en pacientes infectados por el VIH es muy alta y numerosos ensayos clínicos han demostrado el beneficio del tratamiento de personas con TT positivo. Sin embargo, el diagnóstico de ILT mediante TT tiene al menos 3 limitaciones26: 1) para su determinación se requieren 2 visitas, 2) su especificidad disminuye en pacientes que han sido vacunados con BCG, al originar falsos positivos, y 3) su sensibilidad es baja en pacientes con inmunodepresión avanzada, lo que provoca falsos negativos. Estas limitaciones han motivado el desarrollo del interferon-γ release assays (IGRA) para el diagnóstico de la ILT. En comparación con TT, el IGRA tiene mayor especificidad y menor reactividad cruzada con la BCG, aunque su sensibilidad también disminuye en situaciones de grave inmunodepresión24,25,27. En cambio, no disponemos de pruebas suficientes que demuestren que el tratamiento de ILT con diagnóstico basado en IGRA disminuye el riesgo de TB en pacientes infectados por el VIH, y ello supone una importante limitación para su uso. No se recomienda el uso conjunto de ambos procedimientos para el cribado de ILT en pacientes infectados por VIH, ya que resulta una estrategia más cara y dificultosa y se desconoce su beneficio23,28.
Se debe indicar profilaxis anti-TB en todo paciente con ILT23,25. Además, se debe indicar profilaxis, con independencia del resultado del TT o IGRA, a todo paciente infectado por el VIH en estrecho contacto con pacientes con TB bacilífera23,25. No se ha demostrado el beneficio de la profilaxis anti-TB en pacientes con TT negativo ni en pacientes con anergia cutánea23,24,29. En un estudio realizado en un área de alta prevalencia de TB (Sudáfrica), se demostró que el tratamiento con isoniazida disminuyó el riesgo de TB, con independencia del resultado del TT o IGRA30. Sin embargo, este hallazgo no puede ser extrapolable a áreas con menor prevalencia de TB.
Isoniazida durante 9 meses es el régimen de elección en profilaxis anti-TB en pacientes infectados por el VIH, por la alta evidencia disponible sobre su eficacia y por su perfil de seguridad23,25. Se recomienda la administración concomitante de piridoxina a dosis de 25-50mg/día para prevenir el desarrollo de neuropatía periférica23,25. La principal limitación de este régimen es su duración. Se han desarrollado regímenes de duración más cortos, pero de los que se dispone de menor experiencia y nivel de evidencia. En la tabla 3 se muestran los regímenes de uso preferente y alternativo en profilaxis anti-TB en pacientes infectados por el VIH.
Indicaciones y regímenes en pacientes infectados por el VIH
| Indicaciones: |
| TT o IGRA (+), ausencia de evidencia de TB activa, sin tratamiento o profilaxis anti-TB (AI) |
| Contacto estrecho con personas con TB bacilífera, con independencia del resultado de TT e IGRA (AII) |
| Regímenes de uso preferente: |
| INH (300mg/día)+piridoxina (25-50mg/día), 9 meses (AII) |
| Regímenes de uso alternativo: |
| INH (900mg/2 veces por semana) con supervisión directa+piridoxina (25-50mg/día), 9 meses (BII) |
| RIF (600mg/día), 4 meses (BIII) |
| RFB (con ajuste de dosis según TAR), 4 meses (BIII) |
| RPT (900mg/semana si>50kg o 750mg/semana si peso <50kg)+INH (15mg/kg seminal; 900mg máxima dosis)+piridoxina (50mg/semana), 12 semanas. Solo se puede valorar su uso en pacientes con TAR compatible (2 ITIAN+EFV o RAL) (BIII) |
| Regímenes no recomendados: |
| RIF+PIR, 2 meses |
Lo señalado en negrita hace referencia a la evidencias de las recomendaciones a partir de los criterios de la «Infectous Diseases Society of America» (IDSA). 2001.
FUERZA DE LA RECOMENDACIÓN:
A: Buena evidencia para sostener una recomendacio¿n de uso.
B: Evidencia moderada para sostener una recomendacio¿n de uso.
C: Poca evidencia para sostener una recomendacio¿n.
D: Evidencia moderada para sostener una recomendacio¿n en contra del uso.
E: Buena evidencia para sostener una recomendacio¿n en contra del uso
CALIDAD DE LA EVIDENCIA:
I: Evidencia de ≥ 1 estudio controlado, debidamente aleatorizado.
II: Evidencia de ≥ 1 estudio cli¿nico bien disen¿ado, sin asignacio¿n aleatoria, de estudios anali¿ticos de cohortes o caso-control (preferentemente de > 1 centro), de mu¿ltiples series temporales o de resultados drama¿ticos de experimentos no controlados.
III: Evidencia de opiniones de autoridades respetadas, basadas en la experiencia cli¿nica, estudios descriptivos o informes de comite¿s de expertos.
El tratamiento de la ILT reduce en un 62% el riesgo de desarrollo de TB y en un 26% el riesgo de muerte entre pacientes infectados por el VIH31. Tanto el TAR como el tratamiento con isoniazida reducen de forma independiente el riesgo de TB, la mortalidad y el desarrollo de eventos de sida32. Se ha demostrado que, entre pacientes que reciben TAR, el tratamiento con isoniazida reduce el riesgo de TB frente al placebo en un 37%30. Por lo tanto, el cribado de ILT y su adecuado tratamiento suponen una estrategia esencial para la mejora de las expectativas y calidad de vida de los pacientes infectados por el VIH.
Peculiaridades clínicas de la tuberculosis en pacientes infectados por el virus de la inmunodeficiencia humanaLa expresión clínica de la TB en pacientes infectados por el VIH está condicionada por el grado de inmunodepresión de los pacientes. De este modo, aquellos pacientes con inmunodepresión grave (<200 y, especialmente, <50 linfocitos CD4+/mL) tienden a presentar formas de TB extrapulmonar o diseminada, mientras que aquellos pacientes con buena situación inmunológica (>200 y, especialmente,>500 linfocitos CD4+/mL) presentan con mayor frecuencia formas pulmonares localizadas de la enfermedad, similares a las de los pacientes sin VIH33. En el caso de TB pulmonar, también la expresión radiológica está muy correlacionada con el grado de inmunodepresión de los pacientes, de tal forma que la presencia de un infiltrado pulmonar o cavitación son menos frecuentes conforme la inmunodepresión es mayor34. Esta anergia radiológica, cuya mayor expresión es la radiología de tórax normal en presencia de baciloscopias y cultivos de esputo positivos, no es infrecuente entre pacientes con inmunodepresión grave. En pacientes infectados por el VIH, la TB puede adoptar un curso subclínico u oligosintomático. Sin embargo, en pacientes gravemente inmunodeprimidos, la TB puede presentarse en forma de cuadro séptico con un curso grave y rápidamente progresivo. Por tanto, en pacientes infectados por el VIH, la sensibilidad de los síntomas o signos radiológicos clásicos sugestivos de TB (tos, fiebre, infiltrado pulmonar cavitado en lóbulos superiores, sudoración nocturna y pérdida de peso) es más baja y disminuye conforme la inmunodepresión aumenta. Es de gran importancia tener presentes estas peculiaridades clínicas de la TB en pacientes con VIH para establecer de forma adecuada, y no retrasarlo, el diagnóstico de sospecha de TB y permitir un tratamiento precoz. Las manifestaciones clínicas de la TB extrapulmonar no son sustancialmente diferentes a las de la población general35. En general y como norma, en pacientes infectados por el VIH, el diagnóstico de sospecha de TB debe ser tenido en cuenta ante cualquier enfermedad, con independencia del órgano o sistema al que afecte24,35.
Diagnóstico de tuberculosisLa evaluación inicial de un paciente infectado por VIH con sospecha de TB debe incluir siempre la realización de una radiografía de tórax, incluso en ausencia de síntomas respiratorios24,33,34. Del mismo modo, en todo paciente con sospecha de TB se debe realizar tinción y cultivo de esputo específicos, incluso en los casos en los que la radiografía sea normal24,34. La sensibilidad de la tinción de esputos en pacientes infectados por VIH es menor que en la población general y puede resultar falsamente negativa, sobre todo, en pacientes con grave inmunodepresión. En cambio, la sensibilidad del cultivo de esputo no se ve afectada ni por la infección VIH ni por el grado de inmunodepresión36. En pacientes infectados por el VIH, la realización de 3 tinciones y cultivos de esputo en muestras diferentes aumenta la sensibilidad diagnóstica24,37.
Por otro lado, al igual que ocurre con la expresión clínico-radiológica, los hallazgos histopatológicos de la TB están condicionados por el grado de inmunodepresión de los pacientes33. Así, es importante tener en cuenta que en pacientes infectados por VIH con inmunodepresión grave la típica reacción granulomatosa observada en pacientes sin VIH puede estar ausente. Por tanto, en pacientes infectados por VIH y con sospecha de TB, se debe realizar cribado mediante las tinciones y técnicas apropiadas en toda muestra histológica, con independencia de la presencia o ausencia de granulomas.
En la TB extrapulmonar la rentabilidad de las tinciones y cultivos es menor que en los esputos. En estos casos, la rentabilidad combinada de tinción, cultivo y análisis histopatológico del material obtenido por punción con aguja fina o biopsia es alta. La rentabilidad del hemocultivo y cultivo de orina de micobacterias depende de la experiencia de cada laboratorio y puede ser relativamente alta en pacientes con inmunodepresión grave y TB diseminada. Dada la facilidad para obtener estas muestras, ambos procedimientos deben ser realizados de forma rutinaria en estos pacientes.
La utilidad de los test de amplificación de ácidos nucleicos (AAN) en el diagnóstico de la TB es alta, debido a que resultan más rápidos que los cultivos de micobacterias, tienen mayor sensibilidad que las tinciones y permiten la detección rápida de resistencias a fármacos anti-TB. Así, en muestras con tinción negativa/cultivo positivo, la positividad de un solo AAN es de un 50-80% y la de 3 AAN aumenta hasta el 90%24. Por otro lado, permiten diferenciar de forma rápida (2 h) y directamente en esputo M. tuberculosis de otras micobacterias, lo que resulta muy útil en pacientes infectados por VIH con grave inmunodepresión, en los que las infecciones por micobacterias no tuberculosas son frecuentes. Por último, permiten detectar en el esputo mutaciones asociadas a resistencia a RF con una sensibilidad y especificidad en pacientes infectados por el VIH del 80 y 89%, algo menor que la observada en pacientes no infectados por VIH (88 y 98%, respectivamente).
El lipoarabinomanano (LAM) es un polisacárido de la pared celular de M. tuberculosis que puede ser detectado en la orina de pacientes con TB. En pacientes infectados por el VIH con CD4 <100 céls/mL tiene una sensibilidad del 35-56% y una especificidad del 95%37.
Se debe realizar un estudio basal de resistencia a fármacos anti-TB en todos los pacientes infectados por el VIH con TB.
Tratamiento de la tuberculosis en pacientes infectados por el virus de la inmunodeficiencia humanaEn España se recomienda iniciar el tratamiento anti-TB en pacientes infectados por el VIH con una combinación de 4 fármacos23-25,38 que incluya H, RF, Z y E. Se ha postulado el uso de RB como alternativa a RF con objeto de minimizar las posibles interacciones con algunos antirretrovirales (inhibidores de la proteasa, principalmente). Sin embargo, la evidencia de su eficacia en pacientes infectados por VIH es baja, su uso incrementa la complejidad del tratamiento anti-TB al impedir el uso de combinaciones coformuladas y, por último, requeriría un ajuste de la dosis de RB que, en ausencia de control de los niveles plasmáticos del fármaco, podría facilitar la selección de resistencia a las rifamicinas38. Por ello, la utilización de RB en lugar de RF se debe considerar para casos en los que sea absolutamente imprescindible el uso de inhibidores de proteasa38. El uso de RP en lugar de RF tiene los mismos inconvenientes comentados para RB y tampoco es recomendado38.
Una vez completados 2 meses de tratamiento y una vez confirmada la mejoría clínica, la correcta adherencia al tratamiento y el perfil de resistencias basal, se suspenderá la administración de Z y E, y se continuará el tratamiento con H y RF (fase de mantenimiento) durante 4-7 meses más. Por otro lado, E puede ser retirado una vez que haya sido confirmada la susceptibilidad de la cepa a RF y H. Hay que tener en cuenta que cuando se use H es necesario asociar piridoxina (vitamina B6) a dosis de 10-50mg/día para evitar el desarrollo de neuropatía periférica38.
El tratamiento anti-TB debe administrarse a diario (7 días por semana) siempre que sea posible38. Las pautas intermitentes durante el periodo de inducción del tratamiento han sido asociadas con mayor riesgo de recidivas y fracaso; por lo tanto, solo deberían ser utilizadas una vez completada la fase de inducción, cuando existan problemas para la administración diaria y esté garantizada la supervisión de la toma de medicación38.
La duración óptima del tratamiento de la TB sensible en pacientes infectados por VIH sigue siendo controvertida. Un ensayo clínico aleatorizado llevado a cabo en EE. UU. mostró una excelente y equiparable eficacia de regímenes de 6 y 9 meses de duración39. Sin embargo, el diseño del estudio carecía del poder suficiente para obtener conclusiones firmes. Por otro lado, en 2 ensayos clínicos llevados a cabo en áreas de alta incidencia de TB, el riesgo de recurrencias entre pacientes tratados durante 6 meses fue mayor que en tratados durante 9 o 12 meses40,41. Sin embargo, en estos estudios los pacientes no recibían TAR, ni se distinguía entre recidivas y reinfecciones, y en uno de ellos se utilizaron pautas intermitentes desde el inicio del tratamiento. Por tanto, no es posible extrapolar estos resultados a áreas con situaciones sanitarias y epidemiológicas diferentes. En esta situación, en España y otros países occidentales se recomienda tratar durante 6 meses a la mayoría de los pacientes con infección por VIH con TB, y ampliar a 9 meses en caso de persistencia en la positividad del esputo a los 2meses24,38, recuento de linfocitos CD4+ por debajo de 100 cél/μl y en pacientes con adherencia al tratamiento dudosa38. En los casos de TB que afecte al sistema nervioso central (meningitis, tuberculoma), se recomienda prolongar el tratamiento al menos hasta completar 9-12 meses38. No se dispone de información generada en ensayos clínicos que permita precisar más la duración del tratamiento en este escenario. En casos de TB con afectación pericárdica o del sistema nervioso central, se debe considerar el uso de corticosteroides24,38.
El tratamiento de la TB resistente a fármacos se especifica en otro capítulo de esta monografía.
¿Cuándo comenzar tratamiento antirretroviral en pacientes infectados por el virus de la inmunodeficiencia humana con tuberculosis?Establecer el tiempo óptimo para iniciar el TAR en pacientes infectados por el VIH con TB ha sido durante largo tiempo motivo de controversia. En la actualidad, la información procedente de ensayos clínicos con un diseño adecuado ha arrojado luz sobre esta cuestión.
En el estudio SAPIT42 se incluyeron 642 pacientes con cifras de T4 <500 céls/mL, que fueron distribuidos aleatoriamente a iniciar TAR durante el tratamiento de la TB (TAR integrado, precoz o diferido) o tras finalizarlo (TAR secuencial). Se observó una mayor mortalidad en el grupo de TAR secuencial que en el de TAR integrado (5,4 versus 12,1 muertes/100 pacientes al año; p=0,003), con independencia del recuento de linfocitos CD4+. Posteriormente43, se compararon las ramas de TAR integrado precoz (en las 4 primeras semanas del tratamiento) y diferido (tras finalizar la fase intensiva) y se observó una reducción del 68% de la mortalidad (8,5 versus 26,3 muertes/100 pacientes al año; p=0,06) en el grupo de TAR precoz en el subgrupo de pacientes con cifras basales de linfocitos CD4+ inferiores a 50 céls/μL.
En el estudio CAMELIA44, se incluyeron 661 pacientes con cifras de linfocitos CD4+inferiores a 200 céls/μL, que fueron distribuidos aleatoriamente a iniciar TAR a las 2semanas de haber iniciado el tratamiento de la TB (TAR precoz) o tras la finalización de la fase intensiva del tratamiento anti-TB (TAR diferido). La mediana de linfocitos CD4+fue de 25 céls/μL. El TAR de inicio temprano redujo en un 34% el riesgo de muerte respecto al TAR de inicio tardío (8,28 versus 13,77 muertes/100 pacientes al año; p=0,002).
En el estudio STRIDE (ACTG-5221), se incluyeron 806 pacientes con cifras basales de linfocitos CD4+ inferiores a 250 céls/μL, que fueron distribuidos aleatoriamente a iniciar TAR a las 2semanas del tratamiento anti-TB (TAR precoz), o tras la finalización de la fase intensiva del tratamiento (TAR diferido). Se observó una reducción del 68% de la mortalidad (15,5 versus 26,6 muertes/100 pacientes al año; p=0,02) en el grupo de pacientes que recibió TAR precoz en el subgrupo de pacientes con cifras basales de linfocitos CD4+ inferiores a 50 céls/μL45.
Por último, en el estudio TB-TAR46, se incluyeron 1.538 pacientes con TB pulmonar y con cifras basales de linfocitos CD4+≥220 céls/μL que fueron distribuidos aleatoriamente a iniciar TAR a las 2semanas del tratamiento anti-TB (TAR precoz), o tras la finalización del tratamiento de la TB (TAR secuencial). Se observó una reducción del 68% de la mortalidad (15,5 versus 26,6 muertes/100 pacientes al año; p=0,02) en el grupo de pacientes que recibió TAR precoz en el subgrupo de pacientes con cifras basales de linfocitos CD4+ inferiores a 50 céls/μL. La variable desenlace compuesta del estudio (fallo del tratamiento de la TB, recurrencia o muerte) se observó en el 8,5% del grupo de TAR precoz y en el 9,2% del grupo de TAR secuencial (RR 0,91; IC 95%: 0,64-1,30; p=0,9). Por estos resultados, y a diferencia de los estudios SAPIT, STRIDE y CAMELIA, el estudio TB-TAR concluyó que el TAR, en pacientes con cifras de linfocitos CD4+>220 céls/μL, podría ser diferido hasta finalizar el tratamiento de la TB. Para valorar la implicación de estos resultados, es necesario tener en cuenta que la recomendación de iniciar TAR en todo paciente infectado por VIH con independencia de la cifra de linfocitos CD4+ tiene como objetivo no solo evitar la progresión de la enfermedad sino también disminuir la transmisión del virus y limitar el efecto nocivo sobre posibles morbilidades coexistentes47.
De todo ello se pueden inferir las siguientes conclusiones: 1) Iniciar el TAR durante el tratamiento de la TB reduce el riesgo de muerte en pacientes infectados por el VIH. 2) Este beneficio se observa en todos los estratos de linfocitos CD4+. 3) En pacientes con cifras de linfocitos CD4+ inferiores a 50 céls/μL iniciar el TAR en las 4primeras semanas del tratamiento de la TB reduce el riesgo de muerte. 4) En pacientes con cifras de linfocitos CD4+ superiores a 50 céls/μL, iniciar el TAR una vez finalizada la fase de inducción del tratamiento de la TB reduce el riesgo de efectos adversos y síndrome de reconstitución inmune (SRI) sin comprometer la supervivencia48.
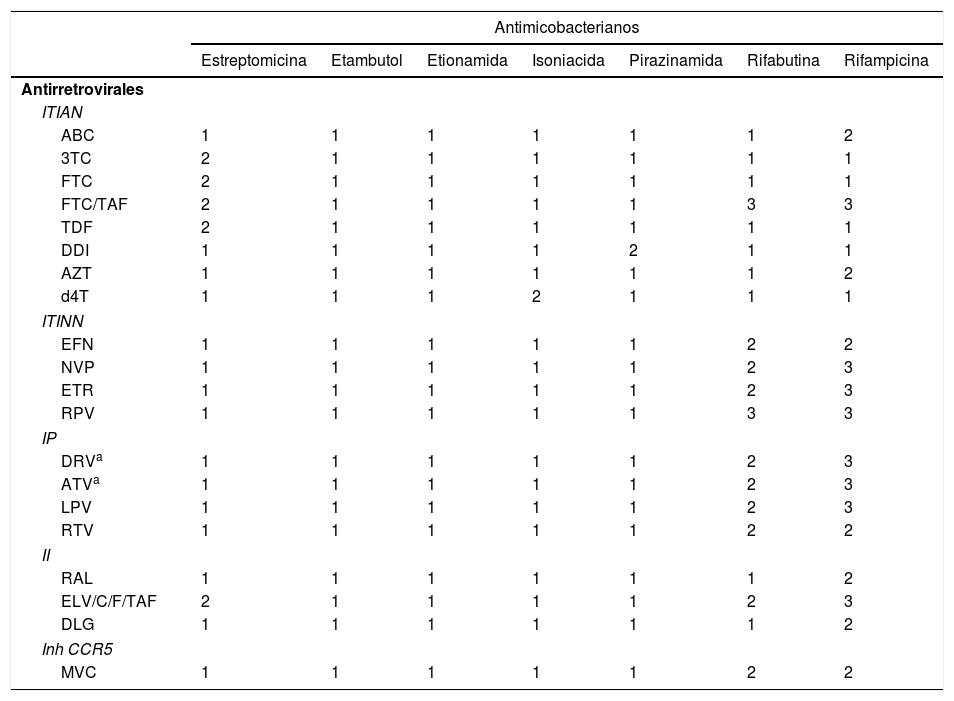
Interacciones medicamentosas entre los fármacos antirretrovirales y los antituberculososLa interacción farmacológica más relevante entre el TAR y el tratamiento anti-TB es motivada porque las rifamicinas son potentes inductores del CYP3A4, un sistema enzimático muy importante para el metabolismo de la mayoría de las familias de fármacos antirretrovirales38,47 (ver tabla 4). La interacción entre rifamicinas e inhibidores de la transcriptasa inversa análogos de los nucleósidos (ITIAN) 3TC, FTC, TDF y abacavir no resulta clínicamente significativa y, por tanto, su uso concomitante no requiere ajuste de la dosis38,47. Sin embargo, las rifamicinas pueden disminuir la absorción de TAF y sus niveles plasmáticos, lo que podría ocasionar la pérdida de su eficacia y la aparición de resistencias47. No existen estudios clínicos que hayan evaluado el significado clínico de esta potencial interacción47. RF induce el metabolismo de los inhibidores de la transcriptasa inversa no análogos de los nucleósidos y provoca una disminución de sus concentraciones plasmáticas. Entre los inhibidores de la transcriptasa inversa no análogos de los nucleósidos, efavirenz y nevirapina son los fármacos cuya farmacocinética es menos afectada por RF. De ellos, efavirenz, a dosis de 600mg/día, es el fármaco del que se dispone de un mayor nivel de evidencia42-45 y, por tanto, es considerado como el fármaco de uso preferente en el tratamiento de la infección por VIH en pacientes con TB38. En cambio, RF provoca una reducción significativa de los niveles de rilpivirina y etravirina que impide su uso concomitante. El uso combinado de IP/r con RF se encuentra contraindicado38.
Interacción medicamentosa entre los fármacos antirretrovirales y los antimicobacterianos
| Antimicobacterianos | |||||||
|---|---|---|---|---|---|---|---|
| Estreptomicina | Etambutol | Etionamida | Isoniacida | Pirazinamida | Rifabutina | Rifampicina | |
| Antirretrovirales | |||||||
| ITIAN | |||||||
| ABC | 1 | 1 | 1 | 1 | 1 | 1 | 2 |
| 3TC | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| FTC | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| FTC/TAF | 2 | 1 | 1 | 1 | 1 | 3 | 3 |
| TDF | 2 | 1 | 1 | 1 | 1 | 1 | 1 |
| DDI | 1 | 1 | 1 | 1 | 2 | 1 | 1 |
| AZT | 1 | 1 | 1 | 1 | 1 | 1 | 2 |
| d4T | 1 | 1 | 1 | 2 | 1 | 1 | 1 |
| ITINN | |||||||
| EFN | 1 | 1 | 1 | 1 | 1 | 2 | 2 |
| NVP | 1 | 1 | 1 | 1 | 1 | 2 | 3 |
| ETR | 1 | 1 | 1 | 1 | 1 | 2 | 3 |
| RPV | 1 | 1 | 1 | 1 | 1 | 3 | 3 |
| IP | |||||||
| DRVa | 1 | 1 | 1 | 1 | 1 | 2 | 3 |
| ATVa | 1 | 1 | 1 | 1 | 1 | 2 | 3 |
| LPV | 1 | 1 | 1 | 1 | 1 | 2 | 3 |
| RTV | 1 | 1 | 1 | 1 | 1 | 2 | 2 |
| II | |||||||
| RAL | 1 | 1 | 1 | 1 | 1 | 1 | 2 |
| ELV/C/F/TAF | 2 | 1 | 1 | 1 | 1 | 2 | 3 |
| DLG | 1 | 1 | 1 | 1 | 1 | 1 | 2 |
| Inh CCR5 | |||||||
| MVC | 1 | 1 | 1 | 1 | 1 | 2 | 2 |
3TC: lamivudina; ABC: abacavir; ATV: atazanavir; AZT: zidovudina; d4T: estavudina; DDI: didanosina; DLG: dolutegravir; DRV: darunavir; EFV: efavirenz; ETR: etravirina; EVG: elvitegravir; FTC: emtricitabina; FTC/TAF: emtricitabina/tenofovir alafenamida; II: inhibidores de la integrasa; IP: inhibidores de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósidos, incluimos en este grupo tenofovir; ITINN: inhibidores de la transcriptasa inversa no análogos de nucleósidos; LPV: lopinavir; MVC: maraviroc; NVP: nevirapina; RAL: raltegravir; RPV: rilpivirina; RTV: ritonavir; TDF: tenofovir.
1. Sin interacción clínicamente significativa.
2. Interacción potencial clínicamente significativa, quizá se requiera una monitorización adicional, una alteración de la dosis del fármaco o del momento de administración.
3. Contraindicada la coadministración.
RF tiene un efecto inductor sobre la enzima responsable de la degradación de raltegravir, la UDP-glucuronosiltransferasa que reduce el AUC de raltegravir en un 40%. En un ensayo clínico en fase ii48, se incluyeron 155 pacientes infectados por el VIH sin TAR previo diagnosticados de TB y tratados con un régimen que incluyó RF. Los pacientes fueron aleatorizados a recibir tenofovir/emtricitabina junto a efavirenz (600mg/día), raltegravir (400mg cada 12/h) o raltegravir (800mg cada 12/h). A las 24 semanas de inicio del TAR, el 67, el 78 y el 76% de los pacientes alcanzaron ARN-VIH indetectable, respectivamente. Por tanto, raltegravir puede ser una alternativa a EFV en pacientes VIH con TB38,47. Los resultados de un ensayo clínico en fase i indican que, dolutegravir, a dosis de 50mg cada 12 h, puede ser coadministrado con RF49. No se recomienda el uso conjunto de RF con elvitegravir/cobicistat38,47.
El uso de RB en lugar de RF para permitir el uso de IP/r es una estrategia no exenta de problemas38. En primer lugar, el uso concomitante de RB e IP/r aumenta los niveles de RB, por lo que se requieren ajustes de dosis. La dosis óptima de RB en combinación con IP/r no ha sido claramente establecida: 150mg cada 2 días o 3veces por semana es la dosis más habitualmente recomendada. Se han descrito fracasos de tratamiento con aparición de resistencias a rifamicinas en pacientes con inmunodepresión avanzada tratados con IP/r y RB, lo que plantea serias dudas sobre la eficacia de la combinación. También hay que tener en cuenta que los niveles de RB son muy «sensibles» a la omisión de alguna dosis de IP/r por el paciente. Por último, el uso de RB incrementa la complejidad del tratamiento anti-TB al impedir el uso de coformulaciones. Por todos estos motivos, se recomienda evitar el uso simultáneo de RB e IP/r y, si es posible, valorar otras alternativas terapéuticas38.
Tuberculosis y síndrome de reconstitución inmuneEl SRI es el resultado de la restauración de la capacidad del sistema inmunitario para poner en marcha mecanismos inflamatorios después de iniciar el TAR y se manifiesta comúnmente en 2escenarios. El primero de ellos es el llamado SRI desenmascarador, situación en la que la mejora de la inmunidad pone clínicamente de manifiesto una TB subclínica y aún no identificada. El segundo de ellos es el llamado SRI paradójico. En esta situación en un paciente infectado por VIH, diagnosticado y tratado de forma adecuada de TB, se produce un empeoramiento clínico de la TB tras el inicio del TAR. Se han identificado diversos factores predictivos de SRI en pacientes con TB, entre ellos: recuento de linfocitos CD4 <50 céls/μL, aumento del recuento de linfocitos CD4+tras el inicio del TAR, alta carga viral basal del VIH, gravedad de la TB e inicio precoz del TAR38. La mayor parte de los casos de SRI son autolimitados y ocurren dentro de los 3 primeros meses desde el inicio del tratamiento anti-TB. En presencia de SRI no debe interrumpirse ni el tratamiento anti-TB ni el TAR. Las formas leves de SRI deben manejarse con antiinflamatorios no esteroideos. En un ensayo clínico aleatorizado controlado con placebo realizado en pacientes con SRI paradójico moderado-grave, el tratamiento con prednisona (1,5mg/kg al día durante 2 semanas seguido de 0,75mg/kg al día otras 2 semanas) redujo el tiempo de hospitalización de los pacientes y la necesidad de procedimientos invasivos50. Se debe evitar el uso de esteroides en pacientes con sarcoma de Kaposi.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Este trabajo ha sido respaldado por la Red de Investigación en Sida de España ISCIII-RETIC (RD 16/0025/0034), por el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 y por el Instituto de Salud Carlos III, Subdirección General de Redes y Centros de Investigación Cooperativa, Ministerio de Economía, Industria y Competitividad, Red Española de Investigación en Patología Infecciosa (REIPI RD16/0016/0008), cofinanciadas por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa», Programa Operativo Crecimiento Inteligente 2014-2020.