Las recurrencias de la infección por Clostridium difficile ocasionan reingresos hospitalarios y costes elevados, además de sufrimiento y frustración para los pacientes que las padecen. Recientemente se ha incorporado fidaxomicina, un nuevo antibiótico con cuya utilización se ha demostrado una reducción significativa de las recurrencias de esta infección. A pesar de esta superioridad, su elevado coste ha ocasionado políticas muy restrictivas en su utilización hasta el punto de que en muchas instituciones solo se emplea para pacientes con múltiples episodios. En espera de herramientas clínicas predictivas, proponemos el desarrollo de sistemas de puntuación que permitan tratar más precozmente a pacientes de alto riesgo.
Recurrences of Clostridium difficile infections lead to hospital readmissions and high costs, in addition to the suffering and frustration for the patients. Fidaxomicin has recently been introduced as a new antibiotic that has been shown to significantly reduce the recurrence of this infection. Despite this superiority, its high cost has led to very restrictive policies in its use, as such that many institutions only use it in patients with multiple recurrences. While waiting for new predictive clinical tools, we propose the development of scoring systems that allow the more high-risk patients to be treated earlier.
Las recurrencias de la enfermedad constituyen uno de los retos más importantes de la infección por Clostridium difficile (C. difficile) –ICD–. Condicionan una mayor morbilidad, reingresos hospitalarios, aumento de los costes y disminución en la calidad de vida de los pacientes, además de una nueva oportunidad para la transmisión de la enfermedad1.
A pesar de un tratamiento adecuado con vancomicina o metronidazol hasta un 25% de los pacientes experimentan recurrencias de la enfermedad, generalmente en los 30 primeros días posteriores al tratamiento2. Los ensayos clínicos pivotales que compararon fidaxomicina con vancomicina mostraron una eficacia similar (88 vs. 86%) en la resolución del episodio inicial. Sin embargo, las tasas de recurrencia fueron significativamente inferiores (26 vs. 14%) en los tratados con fidaxomicina3.
El empleo de fidaxomicina se ha visto, sin embargo, restringido por su elevado coste y, en la práctica, está limitado a pacientes con múltiples episodios de recurrencia. Sin embargo, la experiencia publicada hasta el momento se limita a pacientes con una primera recurrencia, y apenas hay datos en pacientes con recurrencias múltiples4. La limitación del uso en primeros episodios impide que se beneficien pacientes con elevado riesgo de recurrencia, ya que implica esperar al fracaso con los tratamientos convencionales. Es probable, no obstante, que el empleo sistemático de fidaxomicina a todos los pacientes, no sea coste-eficaz5,6. Por tanto, lo óptimo sería poder identificar a pacientes con un riesgo elevado de recurrencia con objeto de emplear selectivamente el fármaco. En nuestro hospital se acordó un sistema de puntuación basado en datos de la literatura que, aunque no había sido validado, permitía una prescripción ordenada de fidaxomicina de una forma no tan restrictiva.
El objetivo de este estudio es analizar la experiencia en nuestro centro con la implantación de este sistema de selección y aportar información sobre el uso de fidaxomicina en nuestro país, fuera del contexto de ensayos clínicos.
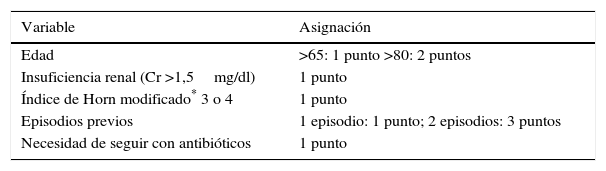
MétodosDurante el periodo del estudio (mayo de 2013 a marzo de 2015), los pacientes con ICD sintomática, confirmada microbiológicamente, fueron evaluados de manera rutinaria por un miembro del Servicio de Enfermedades Infecciosas. Cuando los pacientes alcanzaban 4 o más puntos en el sistema de puntuación descrito en la tabla 1, se consideraba el tratamiento con fidaxomicina.
Criterios para el uso de fidaxomicina
| Variable | Asignación |
|---|---|
| Edad | >65: 1 punto >80: 2 puntos |
| Insuficiencia renal (Cr >1,5mg/dl) | 1 punto |
| Índice de Horn modificado* 3 o 4 | 1 punto |
| Episodios previos | 1 episodio: 1 punto; 2 episodios: 3 puntos |
| Necesidad de seguir con antibióticos | 1 punto |
Por valoración clínica: 1: leve (único y leve), 2 moderado (enfermedad más grave pero sin complicaciones, se espera curación), 3: severo (complicaciones y varias condiciones que requieren tratamiento), 4: fulminante (catastrófico).
Índice de gravedad de Horn, según Hu et al.8 (gravedad del paciente mediante valoración clínica): 1, leve (enfermedad leve); 2, moderada (enfermedad más grave pero sin complicaciones, se espera curación); 3, severa (complicaciones y varias condiciones que requieren tratamiento), y 4, fulminante (situación clínica catastrófica).
Se recogieron datos sobre las características demográficas y clínicas de los pacientes. El diagnóstico de la ICD se realizó mediante la detección de toxina directa en las heces o el cultivo de C.difficile toxigénico hasta mayo de 2014. A partir de esa fecha se implementó un algoritmo en tres pasos mediante la detección de GDH y toxina directa en las heces, realizando PCR en los casos discordantes. Se definió como recurrencia de la ICD la presencia de síntomas sugestivos (diarrea de más de tres deposiciones no formes al día) en los 60 días siguientes a la finalización del tratamiento con fidaxomicina, con confirmación microbiológica de C. diffícile toxigénico en las heces.
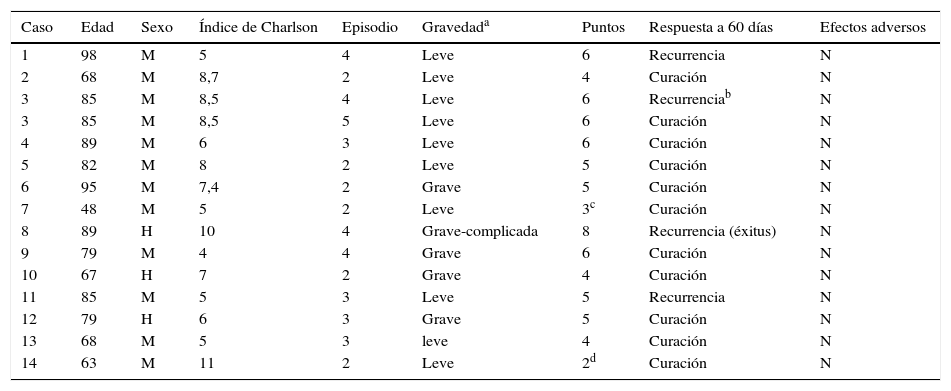
ResultadosQuince pacientes (16 episodios) recibieron fidaxomicina durante el periodo del estudio. Representan el 4,9% del total de pacientes diagnosticados de ICD durante este periodo. Dos de los pacientes no han sido analizados porque fallecieron antes de 48 h tras el inicio de fidaxomicina. Por otra parte, dos pacientes con puntuación menor a 4 en el sistema acordado recibieron fidaxomicina debido a circunstancias especiales no previstas en el sistema de puntuación. Se trataba de un paciente con trasplante renal reciente y una enferma con cáncer que debía seguir con quimioterapia.
La mediana de edad de los 13 pacientes analizados fue de 80,5 años y la mayoría (84,6%) eran mujeres. Seis pacientes (43%) se trataron en su segundo episodio y el resto a partir del tercer o más episodios. Cinco de los episodios eran graves y 9 leves. Fidaxomicina se prescribió durante 10 días en todos los casos, y una paciente recibió dos ciclos de tratamiento. Durante el tratamiento con fidaxomicina no se describieron efectos adversos atribuibles al fármaco. Solo uno de los pacientes falleció durante el seguimiento por complicaciones relacionadas directamente con la ICD. Las características de los pacientes se describen en la tabla 2.
Características de los pacientes y resultados
| Caso | Edad | Sexo | Índice de Charlson | Episodio | Gravedada | Puntos | Respuesta a 60 días | Efectos adversos |
|---|---|---|---|---|---|---|---|---|
| 1 | 98 | M | 5 | 4 | Leve | 6 | Recurrencia | N |
| 2 | 68 | M | 8,7 | 2 | Leve | 4 | Curación | N |
| 3 | 85 | M | 8,5 | 4 | Leve | 6 | Recurrenciab | N |
| 3 | 85 | M | 8,5 | 5 | Leve | 6 | Curación | N |
| 4 | 89 | M | 6 | 3 | Leve | 6 | Curación | N |
| 5 | 82 | M | 8 | 2 | Leve | 5 | Curación | N |
| 6 | 95 | M | 7,4 | 2 | Grave | 5 | Curación | N |
| 7 | 48 | M | 5 | 2 | Leve | 3c | Curación | N |
| 8 | 89 | H | 10 | 4 | Grave-complicada | 8 | Recurrencia (éxitus) | N |
| 9 | 79 | M | 4 | 4 | Grave | 6 | Curación | N |
| 10 | 67 | H | 7 | 2 | Grave | 4 | Curación | N |
| 11 | 85 | M | 5 | 3 | Leve | 5 | Recurrencia | N |
| 12 | 79 | H | 6 | 3 | Grave | 5 | Curación | N |
| 13 | 68 | M | 5 | 3 | leve | 4 | Curación | N |
| 14 | 63 | M | 11 | 2 | Leve | 2d | Curación | N |
Fuente: Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 Update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol. 2010; 31 (5): 431-455.
Tres pacientes recurrieron tras ser tratados con fidaxomicina en el cuarto episodio y una paciente que recurrió en su tercer episodio tratado con fidaxomicina, se curó mediante una transferencia de microbiota fecal. Por tanto, el 71,4% de los episodios no recurrieron después del empleo de fidaxomicina en el periodo estudiado. Los seis pacientes que se trataron en el segundo episodio estuvieron libres de ICD tras 60 días de seguimiento, mientras que 4 de los nueve episodios tratados en tercera o posterior recurrencia presentaron una nueva recurrencia.
DiscusiónEl riesgo de recurrencia se incrementa considerablemente después del segundo episodio de ICD6. La recurrencia es también más frecuente en mayores de 64 años, en pacientes con enfermedades de base descompensadas (índice de Horn modificado de 3 o 4 puntos), en los que padecen enfermedad renal crónica y en los que precisan continuar con antibióticos tras tratar la ICD7–9. Otros factores de riesgo están relacionados con la respuesta del sistema inmune a las toxinas de C. diffícile y la infección por la cepa hipervirulenta 02710,11. El conocimiento de los factores de riesgo de recurrencia puede ser útil para seleccionar a pacientes para ser tratados con fármacos que reduzcan el riesgo de recurrencia pero no permite cuantificar bien la probabilidad de recurrencia real de cada paciente. Por ello surge el interés de obtener modelos predictivos o herramientas de decisión clínica.
Empleando la cohorte de pacientes incluidos en los ensayos pivotales de fidaxomicina, D’Agos-tinho et al.12 publicaron un modelo predictivo de recurrencia en el que la probabilidad de esta viene determinada por la edad mayor o menor de 75 años), el número de deposiciones no formadas en las últimas 24 h (superior o inferior a 10), el valor de la creatinina (mayor o menor de 1,2mg/dl) y el antecedente de episodios previos. En función de que el paciente hubiera recibido fidaxomicina o vancomicina y estos cuatro factores, la probabilidad de recurrencia se sitúa, según el modelo resultante entre el 10 y 18% y el 37 y el 54% para la puntuación menor y mayor en los tratados con fidaxomicina y vancomicina respectivamente. El inconveniente de este modelo es que está basado en pacientes incluidos en ensayos clínicos, con los sesgos que ello puede suponer, y no se ha validado externamente después. Anteriormente Hu et al.8 habían descrito un modelo a partir del análisis multivariante de una cohorte. Las variables que lo integraban fueron la edad, el índice de Horn y la necesidad de continuar con antibióticos. Lamentablemente, el número de pacientes era muy escaso.
Otra aproximación para seleccionar a qué pacientes administrar fidaxomicina son los estudios farmacoeconómicos. Un reciente estudio en el ámbito español ha encontrado que el tratamiento con fidaxomicina es dominante frente a vancomicina en los pacientes con cáncer, con insuficiencia renal o en aquellos que precisan continuar con antibióticos13.
En un estudio de coste-efectividad realizado en Canadá, los autores concluyen que el trasplante fecal mediante colonoscopia se muestra como la estrategia más coste-eficaz para la infección reccurrente por C. difficile, mientras que fidaxomicina sería la opción dominante cuando el trasplante fecal no está disponible14. No obstante otros aspectos como la comodidad y sencillez deben ser tenidos en cuenta en la toma de decisiones terapéuticas.
En espera de herramientas de predicción más robustas, una aproximación pragmática consiste en implementar sistemas de puntuación de riesgo que, aunque no estén validados, permitan a las instituciones ordenar y protocolizar las prescripciones. De acuerdo con esta estrategia tomamos la decisión en nuestra institución. Nuestro sistema de puntuación se ha revelado muy restrictivo, ya que tan solo hemos administrado fidaxomicina al 4,9% de los pacientes diagnosticados de ICD. La tasa de éxito es elevada, teniendo en cuenta el número de episodios previos antes de recibir fidaxomicina. Llama la atención el hecho de que ninguno de los pacientes tratados después de la primera recidiva presentara recurrencia en el seguimiento, mientras que 4 de los 9 que habían sufrido dos o más recurrencias fracasó con fidaxomicina. En nuestra opinión, estos datos sugieren que fidaxomicina no debería emplearse de manera tardía en el manejo de la enfermedad.
Con una aproximación similar, pero menos restrictiva, Edward H.15 et al. trataron con fidaxomicina a 60 pacientes, obteniendo un elevado éxito clínico, bajas tasas de recurrencia y de reingresos. Su sistema de puntuación, menos restrictivo, seleccionó a 60 pacientes (15% de los diagnosticados de ICD), de los cuales 34 (56,7%) recibieron fidaxomicina en su primer episodio. Más recientemente un estudio multicéntrico ha mostrado que la introducción de fidaxomicina se asocia a unos mejores resultados clínicos en varios hospitales ingleses16.
Nuestra experiencia es, obviamente, muy limitada, no podemos asegurar que no haya habido pacientes con 4 puntos que no fueron finalmente tratados con fidaxomicina, dado que no se registró la puntuación en todos los pacientes diagnosticados de ICD. A pesar de estas limitaciones pensamos que nuestra experiencia podría ser útil a otras instituciones interesadas en gestionar la prescripción de este fármaco, incorporando sistemas de puntuación parecidos que vayan más allá del mero recuento de episodios previos.
En nuestra opinión es urgente disponer de herramientas predictivas validadas que ayuden a seleccionar mejor a los pacientes para recibir tratamientos costosos pero más eficaces. En su ausencia, mientras tanto, los clínicos debemos establecer algún tipo de criterio que permita acceder a determinados pacientes a un tratamiento mejor sin esperar a un fracaso anunciado, asumiendo sufrimiento, riesgos y costes para el sistema.
Conflicto de interesesJavier Cobo ha recibido honorarios como consultor y como ponente de Astellas y MSD. El resto de autores declaran no tener conflicto de intereses.