La toma de decisiones compartida entre pacientes y profesionales de la salud implica la participación activa y disponer de toda la información necesaria a partir de la mejor evidencia científica. En este contexto las revisiones sistemáticas (RS) se han convertido en una pieza fundamental para el engranaje de la síntesis del conocimiento científico en la toma de decisiones clínicas1,2. No obstante, no todas las enfermeras disponen del tiempo, de las habilidades y de los recursos para identificar, evaluar e interpretar esta evidencia e incorporarla a las decisiones compartidas en cuidados. Para que las revisiones cumplan adecuadamente con su papel debemos asegurarnos de que tienen los requisitos fundamentales. De lo contrario estaríamos frente a revisiones narrativas o de expertos, basadas fundamentalmente en la opinión y, por tanto, no contrastables. Solo una RS es capaz de integrar toda la evidencia empírica que cumple con unos criterios de selección previamente establecidos para responder a una pregunta específica de investigación. Para ello se utilizan métodos y criterios sistemáticos y explícitos que ayuden a contrastar los resultados, extraer conclusiones y tomar decisiones3. En consecuencia, resulta imprescindible adquirir las habilidades y las destrezas para juzgar su calidad, analizando con sentido crítico sus fortalezas y sus debilidades para interpretar adecuadamente sus resultados y valorar su utilidad práctica para los pacientes. Las RS pueden ser de estudios observacionales, de pruebas diagnósticas o pronósticas o de estudios cualitativos, pero su uso más generalizado es en estudios de intervención o tratamiento; es decir, ensayos clínicos.
Cuando es posible y adecuado se combinan los datos de las RS con métodos estadísticos en forma de metaanálisis, permitiendo una síntesis cuantitativa de los resultados de la revisión, así como su representación gráfica, además de permitir explorar la consistencia y las diferencias de los datos4.
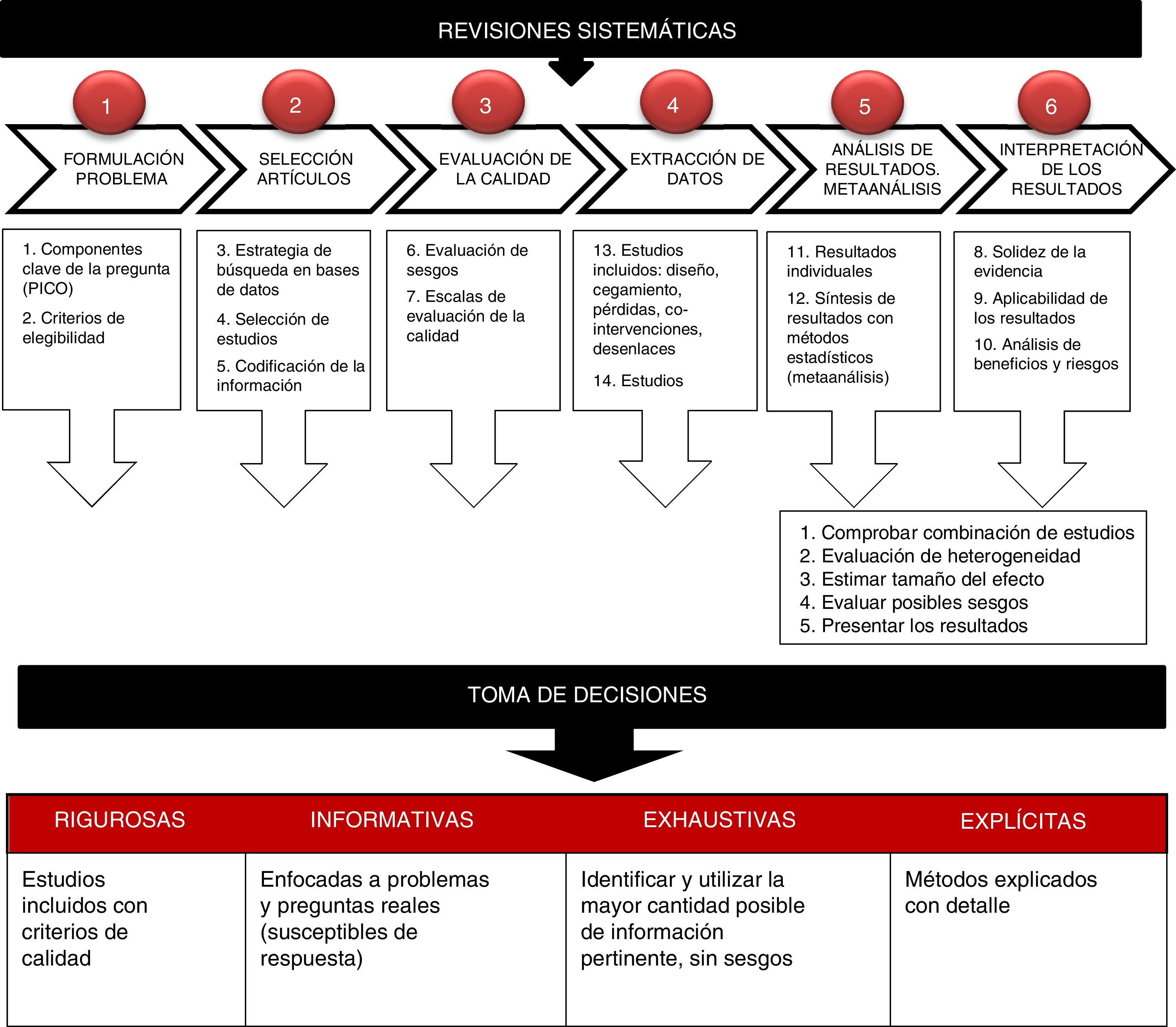
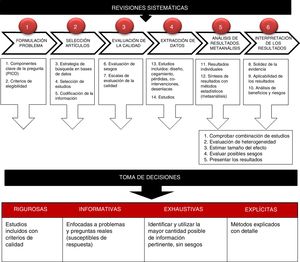
Los elementos fundamentales de una RS son: un conjunto de objetivos claramente establecidos, con criterios de elegibilidad de los estudios previamente definidos, una metodología explícita y reproducible y una búsqueda sistemática que identifique todos los estudios que pueden ser elegibles; una valoración explícita de la validez de los resultados de estudios incluidos, mediante la evaluación del riesgo de diferentes sesgos; una síntesis sistemática de las características y resultados de los estudios incluidos y su interpretación (fig. 1)5.
Pasos para la preparación de una revisión sistemática.
Fuente propia. Adaptada de Gisbert y Bonfill5.
Tras la búsqueda exhaustiva de información en las diferentes bases de datos y su codificación es necesaria y recomendable la evaluación de la calidad de la evidencia y del riesgo de sesgo mediante herramientas bien fundamentadas que ayuden a generar recomendaciones. Se han identificado multitud de escalas y listas para evaluar la validez y la calidad de los estudios Todas ellas necesitan entrenamiento e identifican tres aspectos básicos a evaluar: la validez interna, los resultados (magnitud, dirección y precisión) y la validez externa6,7.
La validez interna se refiere a la capacidad de evitar errores sistemáticos (sesgos) mediante el diseño y la realización del estudio, mientras que la validez externa se relaciona con la generalización o la aplicabilidad de los resultados de una población específica a otra.
Los principales tipos de sesgos son: el sesgo de selección, relacionado con el proceso de obtención de los grupos a comparar (asignación aleatoria a tratamientos, ocultación); el sesgo de realización, relacionado con las diferencias en la atención proporcionada; el sesgo de desgaste o pérdida, relacionado con las pérdidas de participantes durante el estudio, y el sesgo de detección, relacionado con las diferencias sistemáticas entre los grupos de comparación en la evaluación de resultados.
La evaluación del riesgo de sesgo debe ser realizada por dos investigadores de manera independiente y ciega. En el caso de los estudios de intervención, una de las herramientas de evaluación de riesgo de sesgo más habituales es la de la Colaboración Cochrane. Esta herramienta incluye variables como la aleatorización, la secuencia de ocultamiento, el cegamiento de los participantes y de los evaluadores, las pérdidas durante el seguimiento, el manejo en el análisis de datos y el reporte de resultados, y clasifica el riesgo de sesgo en alto, bajo y riesgo no claro3.
Para estudios no experimentales existen diferentes métodos de evaluación. Algunos autores sugieren la escala de Newcastle-Ottawa o la herramienta ACROBAT-NRSI, desarrollada por la Colaboración Cochrane. También existen listas de verificación útiles para mejorar la publicación de artículos; sin embargo, que esté bien escrito no asegura la calidad. Estas herramientas son: STROBE (estudios observacionales), STARD (estudios de métodos diagnósticos), CONSORT (estudios experimentales) y Preferred Reporting Items for Systematic reviews and Meta-analysis (PRISMA) para RS/metaanálisis4,8,9.
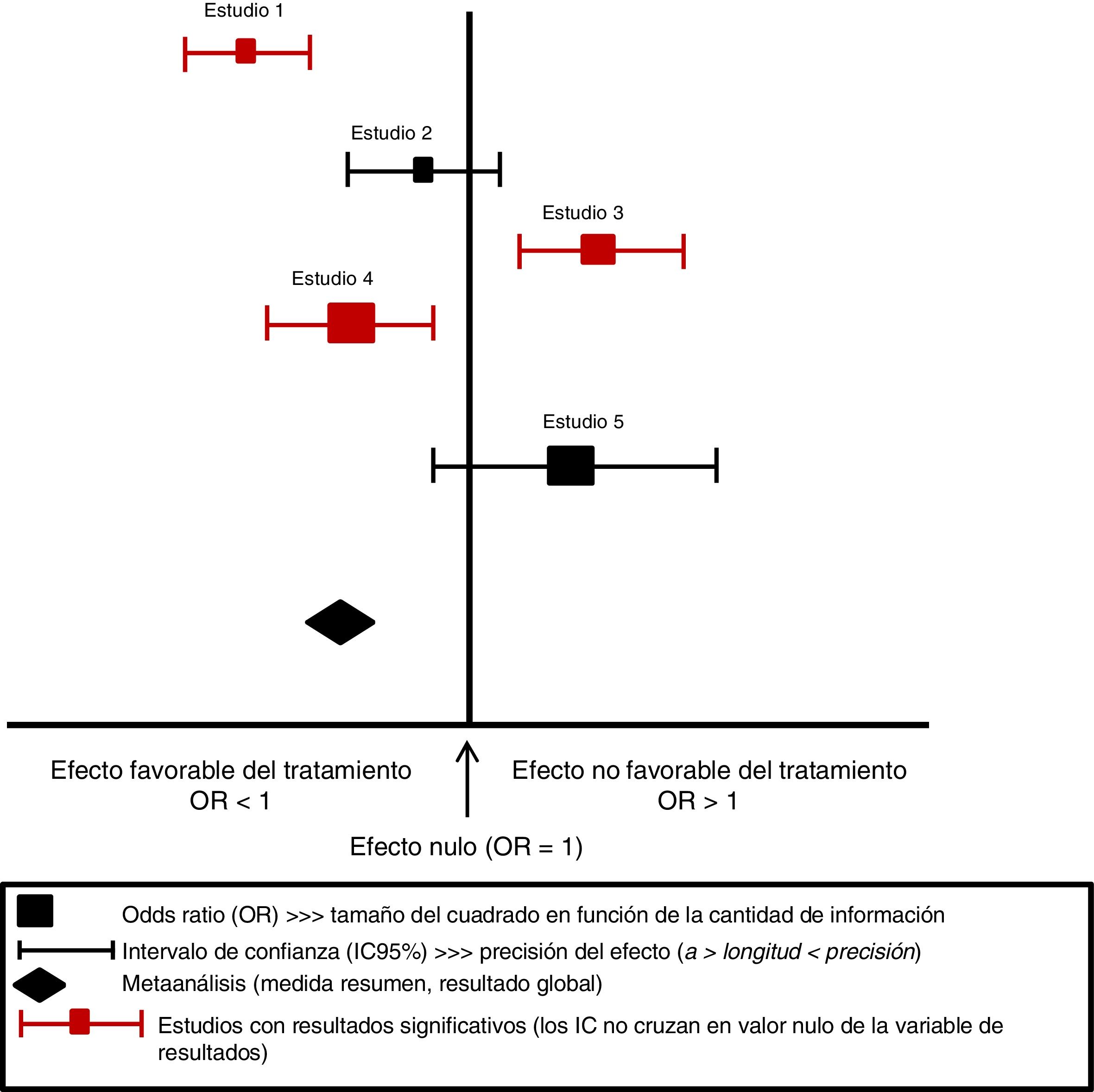
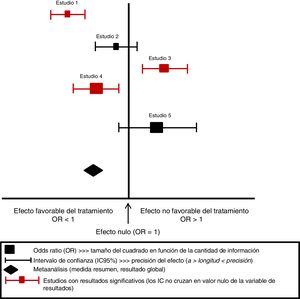
Extracción, análisis e interpretación de los resultadosLos datos de una RS utilizados de manera apropiada resultan una herramienta muy útil para llegar a conclusiones que nos ayuden a evitar errores de interpretación. En primer lugar se deben obtener datos de estudios individuales, y posteriormente se pueden utilizar métodos estadísticos para resumir esos datos3. Los hallazgos de los estudios incluidos están sistemáticamente organizados y se muestran en una tabla resumen, evitando incluir comparaciones o resultados de los que no haya datos. También se agregan los resultados para confeccionar una gráfica sobre la efectividad clínica de la intervención. La forma más habitual de presentar los datos es a través de una gráfica conocida como «forest plot» o diagrama de efectos, que muestra los resultados de un metaanálisis (fig. 2). En este gráfico, los resultados de cada estudio se representan por el OR (odds ratio o razón de disparidad) con un cuadrado (medida resumen del tamaño del efecto) y una línea horizontal (intervalo de confianza [IC] del 95%). El tamaño del cuadrado varía en función de la cantidad de información de cada estudio y la longitud de la línea representa la precisión del efecto del tratamiento; por tanto, a mayor longitud menor precisión del tamaño del efecto (normalmente, por tamaño pequeño de la muestra) y menos poder para detectar diferencias significativas. Cuando no hay diferencia entre los tratamientos, la OR es1, implica el valor de no efecto y se representa con una línea vertical; los valores menores de1 están a la izquierda y corresponden al efecto favorable del tratamiento. Si se realiza metaanálisis, el OR se representa con un rombo5,10,11.
Esquema de representación de los estudios primarios de un metaanálisis mediante forest plot o diagrama de efectos.
Fuente propia. Adaptada de Urrutia y Bonfill9.
Después de comprobar que los resultados se pueden combinar, se evalúa la heterogeneidad para preguntarse si los resultados de los estudios son similares u homogéneos y se pueden combinar entre sí. Para ello se evalúan los IC de cada estudio, y si no se superponen no se podrán combinar, porque las diferencias observadas no son explicadas por azar. Las pruebas estadísticas que valoran la heterogeneidad suelen tener baja potencia estadística3,8,10,11. El test de homogeneidad se puede realizar mediante la prueba del chi cuadrado, y si el resultado no es estadísticamente significativo se interpretará que los estudios son homogéneos y se pueden combinar; si por el contrario la prueba es significativa (p<0,01), se concluye que son heterogéneos y no combinables. En este caso los autores pueden decidir finalizar el estudio o continuar con el análisis para medir la magnitud del efecto.
Además de la OR, otro estadístico utilizado es el número necesario a tratar (NNT), que se obtiene a partir de la diferencia de riesgos, una forma útil de expresar los resultados.
A veces resulta interesante realizar un análisis de subgrupos para evaluar a un grupo muy concreto de participantes. Sin embargo, se debe intentar minimizar este tipo de análisis.
Existen diferentes programas estadísticos para evaluar las RS. Uno de los más utilizados es Review Manager (RevMan), un software estadístico de la Colaboración Cochrane para las RS y los metaanálisis que interactúa con GRADEpro para la generación de tablas de resumen y evaluación de la evidencia. Otros programas que ofrecen buenos resultados son Stata® y los programas R®4,7.
Aspectos como la solidez de la evidencia, la aplicabilidad de los resultados, el balance de riesgo-beneficio o los costes de la intervención pueden ser de ayuda en la toma de decisiones y deben discutirse.
ConclusionesUno de los aspectos más importantes de las RS es conocer la información primaria de la que se han obtenido los resultados y decidir hasta qué punto estos resultados pueden aplicarse a determinados pacientes. Sin embargo, solo desde la asistencia los profesionales pueden decidir si los resultados son clínicamente relevantes para ser aplicados a pacientes concretos de diferentes ámbitos.
El volumen y la capacidad de lo que sabemos exceden nuestra capacidad individual para aprovechar correctamente sus beneficios de una manera segura y fiable.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.