Evaluar la eficacia de la higiene diaria con esponjas impregnadas con clorhexidina al 4% para disminuir la contaminación de hemocultivos en pacientes ingresados en UCI.
Material y métodoEstudio prospectivo, cuasi experimental, longitudinal, unicéntrico. Durante 24 meses (de abril de 2013 a marzo de 2015) fueron analizados 237 pacientes que cumplieron los criterios de inclusión, y fueron divididos en 2grupos: uno recibió higiene corporal diaria con jabón común (grupo control, n= 118) y el otro con clorhexidina (grupo intervención, n= 119). Fueron incluidas variables demográficas, tipo de enfermedad, nivel de gravedad, estancia y mortalidad en UCI y hospitalaria, y tiempo trascurrido (minutos) desde el baño hasta la extracción de los hemocultivos.
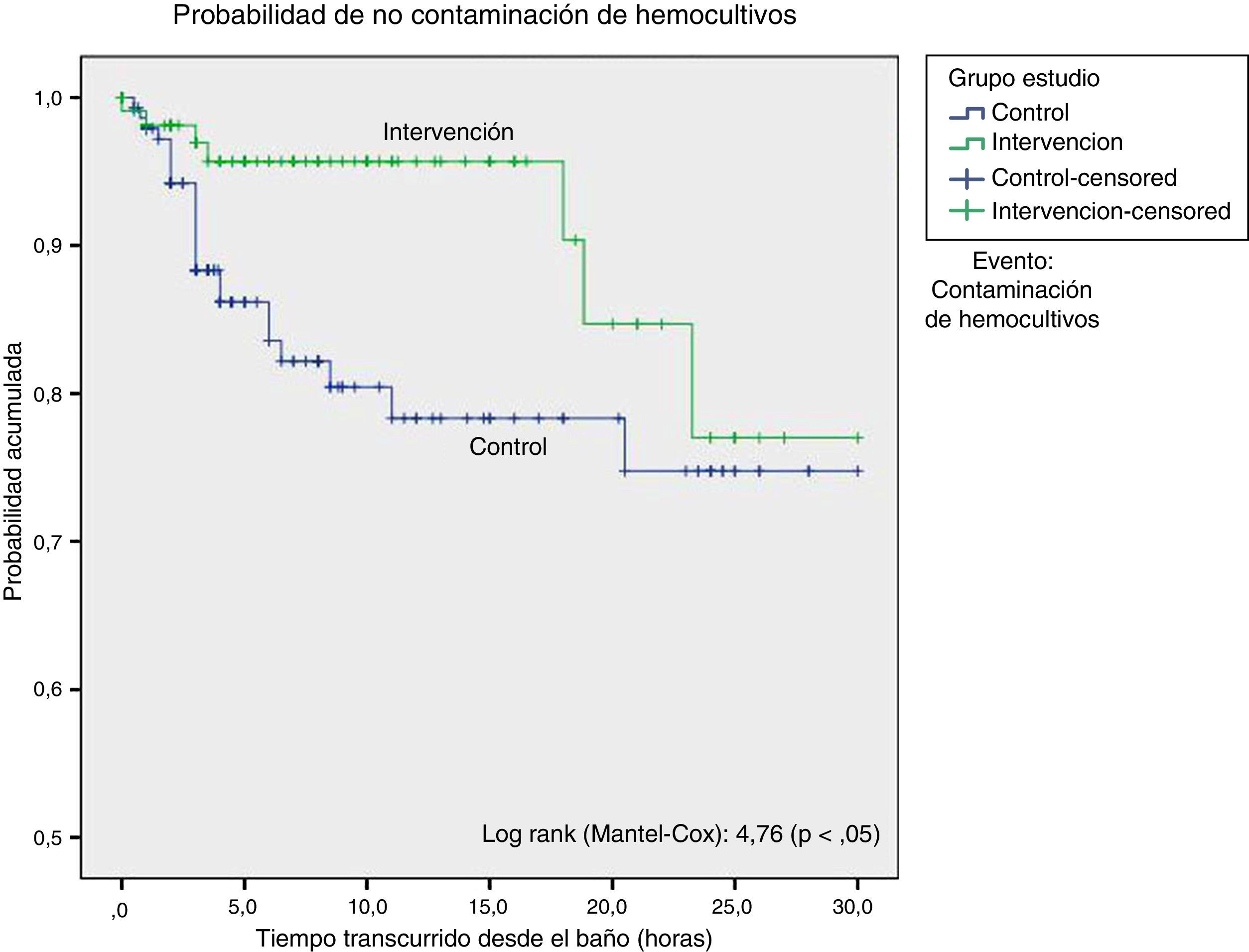
ResultadosEl análisis estadístico mostró una mayor proporción de contaminación de los hemocultivos durante el período control con respecto al de intervención (15,5 vs. 6,3%); con una diferencia significativa: 9,23% (IC 95%: 1,34-16,7%), odds ratio de 2,73 (IC 95%: 1,13-6,63). El análisis de supervivencia mostró una menor probabilidad de contaminación de los hemocultivos hasta las 18 h desde el baño. El baño sin clorhexidina aumentó el riesgo de contaminación de los hemocultivos (HR: 3,05; IC 95%: 1,14-8,12).
ConclusionesEl empleo de jabón con clorhexidina al 4% en la higiene diaria de los pacientes críticos disminuyó la incidencia de contaminaciones de hemocultivos y su efecto perduró al menos 18 h.
To evaluate the efficacy of daily cleaning with 4% chlorhexidine-impregnated sponges in decreasing contamination of blood cultures in critically-ill patients.
Material and methodsProspective, quasi-experimental, longitudinal, single-centre trial. During 24 months (April 2013 to March 2015), we analysed 237 patients who fulfilled the inclusion criteria, divided into 2groups: one underwent daily cleaning with common soap (control group, n= 108), and the other with chlorhexidine (intervention group, n= 109). Demographic variables, pathology group, severity scores, ICU and hospital length of stay and mortality, and time passed since cleaning to blood culture extraction were included.
ResultsStatistical analysis showed a higher proportion of contaminated blood cultures during the control group period in contrast with the intervention group period (15 vs. 6.3%), with a significant difference: 9.23% (CI95%: 1,34-16,7%), with an odds ratio of 2,73 (CI95%: 1,13-6,63). Surveillance analysis showed lower probability of blood culture contamination within the 18hours following daily cleaning. Cleaning without chlorhexidine increased contamination of blood cultures (HR: 3,05; CI95%: 1,14-8,12).
ConclusionsThe use of 4% chlorhexidine-impregnated sponges for daily cleaning of critically-ill patients decreases blood culture contamination incidence and its protection lasts for almost 18h.
Una elevada incidencia de falsos positivos en hemocultivos obtenidos de pacientes críticos supone un incremento de los costes sanitarios. El empleo de técnicas asépticas en la extracción de hemocultivos da lugar a una disminución de las contaminaciones, frecuentemente debidas a gérmenes colonizadores de la piel. No obstante, a veces puede ser necesaria la adopción de medidas complementarias si, a pesar de ser cuidadosos en el cumplimiento de los protocolos de extracción de hemocultivos, no se cumple el objetivo de mantener un nivel de contaminación inferior al 3%. La higiene diaria con clorhexidina en los enfermos ingresados en UCI puede reducir la posibilidad de contaminación de los hemocultivos.
El estudio demuestra la eficacia de la higiene diaria con clorhexidina en la disminución de la incidencia de contaminaciones de hemocultivos en pacientes críticos, y podría ser de utilidad especialmente en unidades con una alta tasa de contaminaciones.
¿Implicaciones del estudio?El empleo de esponjas con jabón de digluconato de clorhexidina al 4% en la higiene diaria de pacientes críticos ayuda a mantener una baja tasa de contaminaciones de hemocultivos, que, a su vez, es un indicador de calidad asistencial y supone un ahorro de costes sanitarios en forma de pruebas diagnósticas y tratamientos innecesarios.
La bacteriemia constituye una situación de gravedad con elevada morbimortalidad. Los hemocultivos son una herramienta diagnóstica y pronóstica muy valiosa para los clínicos. Sin embargo, los resultados falsos positivos debidos a contaminación por la introducción de organismos de la flora cutánea del paciente en la muestra de sangre recogida, principalmente estafilococos coagulasa negativos1, suponen un incremento de pruebas diagnósticas y tratamientos innecesarios2 con aumento de los costes sanitarios3. Las causas más frecuentes de contaminación son debidas a la preparación inadecuada de la piel, junto a una técnica inadecuada de extracción de las muestras.
Las intervenciones dirigidas a disminuir la contaminación se basan en reducir la carga bacteriana de la piel mediante el uso de desinfectantes y la optimización de los protocolos de extracción de muestras.
Hay estudios que demuestran que el lavado con soluciones antisépticas previo a la cirugía es eficaz para disminuir el recuento de microorganismos sobre la piel4, también para disminuir la incidencia de infecciones de herida quirúrgica en cirugía ortopédica55–7.
Los pacientes ingresados en UCI están especialmente expuestos a padecer infecciones por gérmenes pertenecientes a la flora cutánea y nosocomiales, debido al uso de dispositivos invasivos, antibioterapia, inmunodeficiencias y comorbilidad. Las medidas preventivas basadas en el lavado de manos, empleo de material desechable, e incluso aislamiento del paciente, son fundamentales para evitar la contaminación cruzada de estos gérmenes que frecuentemente colonizan la piel.
El gluconato de clorhexidina es un antiséptico catiónico del tipo biguanida que tiene una actividad de amplio espectro contra varios microorganismos, incluyendo el S. aureus y especies de enterococos, con actividad residual prolongada8 y, además, posee una baja toxicidad9.
Los estándares de calidad proponen un nivel de contaminación de hemocultivos inferior al 3%10, que es el margen considerado tolerable y, cuando es superado en la práctica, supone la existencia de un problema. La aplicación estricta de protocolos con énfasis en el empleo de técnicas de esterilidad en la extracción de hemocultivos da lugar a una disminución de las contaminaciones11, aunque a veces puede ser necesaria la adopción de otras medidas adicionales como el cambio del antiséptico empleado en la descontaminación de la piel o la higiene diaria con antisépticos, si a pesar de ser cuidadosos en el cumplimiento de los protocolos de extracción de hemocultivos no se aprecia una mejoría en los resultados buscados.
El objetivo de este trabajo es evaluar la eficacia de la higiene diaria con esponjas impregnadas de jabón de digluconato de clorhexidina al 4% para disminuir a los estándares de calidad la contaminación de hemocultivos en pacientes ingresados en UCI, para la extracción de hemocultivos se usó solución antiséptica de clorhexidina al 2% con base acuosa como descontaminante de la piel según nuestro protocolo.
Material y métodosEstudio prospectivo, cuasi experimental (no aleatorizado), diseño pre-post, longitudinal, unicéntrico. Periodo de estudio: 24 meses, comprendido entre abril del 2013 y marzo del 2015. Con ámbito de realización en una unidad de cuidados intensivos médico-quirúrgica de 12 camas, en el Hospital Universitari Sant Joan de Reus.
Selección de la poblaciónSe utilizó como criterios de inclusión: edad>18 años, estancia en la UCI>48 h, y como criterios de exclusión: disrupción de la piel >20% (ejemplo: quemados)12, embarazo y alergia a la clorhexidina.
Tamaño de la muestraEl tamaño de la muestra fue determinado teniendo en cuenta nuestra proporción de hemocultivos contaminados antes del estudio (16%) y los estándares de calidad aceptados (3%). Para detectar una disminución del 13% en la proporción de hemocultivos contaminados (del 16 al 3%), con un error tipo I del 5% y una potencia del 80%, eran necesarios 70 hemocultivos por grupo. Para el cálculo se utilizó la macro ¡NSize de Domenech–Granero para SPSS.
Reparto de la intervenciónEl estudio comprendió 3periodos y 2grupos de pacientes:
- a)
Primer periodo-grupo control. En este periodo la higiene del paciente fue realizada de forma diaria con agua tibia y jabón sin antiséptico CR-32 Dermatológico (José Collado S.A. Barcelona, España). Este periodo duró 11 meses.
- b)
Segundo periodo-descanso. Este periodo duró un mes y su función fue evitar el solapamiento de pacientes en los 2grupos de estudio. Durante este periodo fueron dados de alta los pacientes del grupo control y no se incluyó a pacientes del grupo intervención. Además, reforzamos la formación en los protocolos de higiene y de extracción de hemocultivos. Durante este periodo la higiene del paciente fue llevada a cabo con jabón sin antiséptico.
- c)
Tercer periodo-grupo intervención. En este periodo la higiene fue realizada con esponjas corporales impregnadas de digluconato de clorhexidina 4% (Dispomedic sponge C de CV Médica, Tarragona, España), aplicada sobre la piel del enfermo hasta cubrir toda la superficie cutánea excepto cara, para evitar el contacto con la mucosa bucal y los ojos (según recomendación del fabricante). Se dejaba actuar durante 3 min, posteriormente enjuagábamos con agua y finalmente secábamos con toallas limpias. El lavado del cuero cabelludo fue realizado cada 3 días. Este periodo duró 11 meses.
Previamente al inicio de los periodos 1 y 3, conjuntamente con enfermería y el personal auxiliar, fue protocolizada la técnica del baño corporal de los pacientes, enfatizando la limpieza secuencial desde las zonas ya limpias hacia las sucias. Las deposiciones de los pacientes incontinentes se higienizaron con agua y jabón o clorhexidina, dependiendo del grupo de estudio. La hidratación de la piel se llevó a cabo con soluciones que no provocan interferencia en la actividad bactericida de la clorhexidina. Se recomendó un estricto cumplimiento del protocolo de higiene de manos antes y después del contacto con los enfermos. Asimismo, antes de los periodos 1 y 3, llevamos a cabo programas de formación continuada enfatizando en el protocolo de extracción y procesamiento de hemocultivos (Anexo I: Técnica de extracción y procesamiento de hemocultivos).
Recogida de datos- a)
Basal. Recogimos, al ingreso a la UCI de cada paciente: edad, sexo, talla, peso, grupo de enfermedad (médico, quirúrgico y cardiológico), nivel de gravedad (APACHE II, SAPS II). Consideramos como paciente médico a todo aquel paciente no cardiológico cuya enfermedad no precisó intervención quirúrgica.
- b)
Seguimiento. Registramos fecha y hora de cada hemocultivo, fecha y hora del baño corporal, localización de la extracción de los hemocultivos, días de estancia y mortalidad en UCI, y días de estancia y mortalidad hospitalaria. También registramos la presencia de vía central, sonda vesical, la necesidad de ventilación mecánica, de terapia de reemplazo renal, de tratamiento antibiótico y la presencia de gérmenes multirresistentes (colonización o infección).
El personal de enfermería valoró diariamente la integridad de la piel de los pacientes, para ello se utilizó una escala de gradación SCORAD13, herramienta clínica empleada en la valoración de la extensión y gravedad del eccema en dermatitis atópica. En caso de apreciar alteraciones cutáneas como efecto secundario de la clorhexidina, el médico responsable o el Servicio de Dermatología propuso intervención terapéutica.
La solicitud de hemocultivos fue bajo criterio médico ante la sospecha de infección y temperatura corporal superior a 38°C. La solicitud de obtención de hemocultivos siempre fue en grupos de 2.
La distinción entre hemocultivos contaminados y la verdadera infección es difícil sin la existencia de un «gold standard». La valoración inicial y de forma independiente fue realizada por los médicos responsables del paciente, al cual le fueron extraídos los hemocultivos. Posteriormente fueron revisados por 2 médicos implicados en el estudio y se basaron para la distinción en el germen aislado, el número de frascos que presentaba crecimiento, el uso de antibióticos empleados empíricamente tras la extracción de los hemocultivos y la evolución clínica del paciente. Se definió como caso a todo hemocultivo que, tras ser extraído en UCI por orden médica ante la sospecha de infección, fue informado por el Laboratorio de Microbiología con crecimiento de gérmenes en al menos uno del par de hemocultivos, e interpretado por 2 facultativos de manera coincidente como germen con baja probabilidad de ser responsable de la infección sospechada.
El estudio fue ciego simple: los pacientes desconocían a qué grupo del estudio pertenecían. El personal sanitario fue consciente del producto utilizado en la higiene diaria de cada paciente que participó en el estudio.
Análisis de datosLa distribución normal de los grupos fue contrastada con el test de Shapiro-Wilk.
La comparación entre grupos de las variables continuas se llevó a cabo con la prueba de t de Student o la prueba no paramétrica de Mann-Whitney, según correspondencia, y de las variables categóricas, con χ2.
Para la comparación gráfica del tiempo de aparición de las contaminaciones en los hemocultivos tras la higiene corporal diaria entre grupos, realizamos curvas de Kaplan-Meier y calculamos el log-rank para cada una. En el análisis de supervivencia fue considerado como evento cada hemocultivo contaminado.
La diferencia de las tasas de densidad de incidencia de contaminación de los hemocultivos entre grupos fue determinada por regresión de Cox controlada por variables de confusión. Consideramos el tratamiento antibiótico previo y la presencia de gérmenes multirresistentes como variables de confusión. Además, controlamos la regresión según nivel de gravedad y días de internación en UCI, asumiendo que los pacientes con mayor gravedad y de ingreso prolongado se encuentran en mayor riesgo de colonización.
Ejecutamos el análisis estadístico con el programa estadístico IBM SPSS 20 (Chicago, EE. UU.). Consideramos estadísticamente significativas las diferencias con un valor de p < 0,05.
Aspectos éticosEl estudio se realizó de acuerdo con los principios éticos de la Declaración de Helsinki y fue aprobado por el Comité de Ética del hospital, considerando la necesidad de la obtención del consentimiento informado. Se solicitó consentimiento informado por escrito a los pacientes o a sus representantes legales, previa explicación de la finalidad y de los pormenores del estudio. Se comprobó que el paciente o sus familiares hubieran comprendido los riesgos y beneficios de su participación. Se respondió de forma sencilla a cualquier duda surgida.
Para asegurar la confidencialidad de los datos de cada individuo, como garantía de protección de la información personal, y para evitar su divulgación sin consentimiento, se utilizaron códigos alfanuméricos de identificación para su análisis informatizado con acceso restringido a los autores, y los registros en papel fueron custodiados en un lugar cerrado y protegido.
ResultadosEl número de pacientes admitidos durante el periodo abril de 2013-marzo de 2015 fue de 1.061; de ellos, cumplían criterios de inclusión y aceptaron participar en el estudio 237 pacientes, los cuales se distribuyeron de la siguiente manera: 118 en el grupo control y 119 en el grupo intervención.
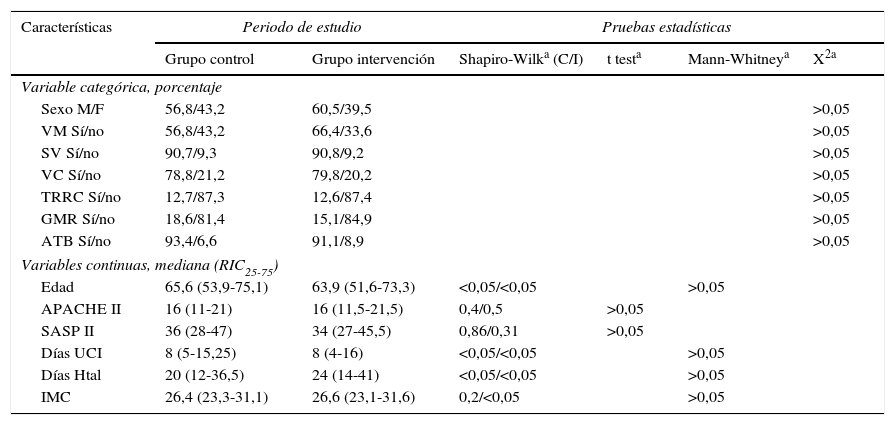
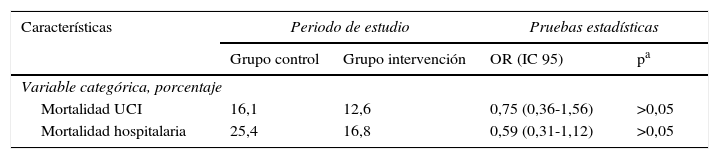
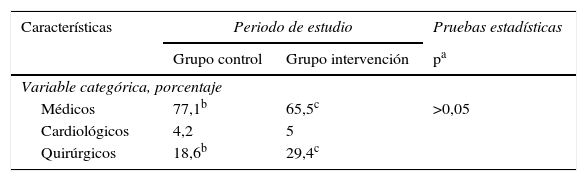
Las características de los pacientes en ambos grupos fueron similares en lo que respecta a sexo, edad, nivel de gravedad en las primeras 24 h (APACHE II, SAPS II), IMC, presencia de vía central, sondaje vesical, necesidad de ventilación mecánica o de terapia de reemplazo renal, presencia de gérmenes multirresistentes (colonización o infección) y tratamiento antibiótico, días de estancia en UCI y hospitalaria (tabla 1), así como en la mortalidad intra-UCI y hospitalaria (tabla 2). Con respecto al grupo de enfermedad se observó una mayor proporción de pacientes «médicos» en el grupo control y de pacientes «quirúrgicos» en el grupo intervención, pero sin alcanzar diferencias significativas (tabla 3). No hallamos ningún caso de alteración cutánea que fuera considerada como efecto secundario de la clorhexidina. No encontramos diferencias en la valoración de la escala SCORAD entre los 2grupos estudiados.
Comparación de las características de los pacientes entre los grupos de estudio
| Características | Periodo de estudio | Pruebas estadísticas | ||||
|---|---|---|---|---|---|---|
| Grupo control | Grupo intervención | Shapiro-Wilka (C/I) | t testa | Mann-Whitneya | X2a | |
| Variable categórica, porcentaje | ||||||
| Sexo M/F | 56,8/43,2 | 60,5/39,5 | >0,05 | |||
| VM Sí/no | 56,8/43,2 | 66,4/33,6 | >0,05 | |||
| SV Sí/no | 90,7/9,3 | 90,8/9,2 | >0,05 | |||
| VC Sí/no | 78,8/21,2 | 79,8/20,2 | >0,05 | |||
| TRRC Sí/no | 12,7/87,3 | 12,6/87,4 | >0,05 | |||
| GMR Sí/no | 18,6/81,4 | 15,1/84,9 | >0,05 | |||
| ATB Sí/no | 93,4/6,6 | 91,1/8,9 | >0,05 | |||
| Variables continuas, mediana (RIC25-75) | ||||||
| Edad | 65,6 (53,9-75,1) | 63,9 (51,6-73,3) | <0,05/<0,05 | >0,05 | ||
| APACHE II | 16 (11-21) | 16 (11,5-21,5) | 0,4/0,5 | >0,05 | ||
| SASP II | 36 (28-47) | 34 (27-45,5) | 0,86/0,31 | >0,05 | ||
| Días UCI | 8 (5-15,25) | 8 (4-16) | <0,05/<0,05 | >0,05 | ||
| Días Htal | 20 (12-36,5) | 24 (14-41) | <0,05/<0,05 | >0,05 | ||
| IMC | 26,4 (23,3-31,1) | 26,6 (23,1-31,6) | 0,2/<0,05 | >0,05 | ||
APACHE II: Acute Physiology And Chronic Health Evaluation II; C: control; Días Htal: días de internación hospitalaria; Días UCI: días de internación en unidad de cuidados intensivos; GMR: gérmenes multirresistentes; I: intervención; IMC: índice de masa corporal; SAPS II: Simplified Acute Physiology Score II; SV: sondaje vesical; TRRC: terapia de reemplazo renal continua; VC: vía central; VM: ventilación mecánica.
Comparación de la mortalidad de los pacientes entre los grupos de estudio
| Características | Periodo de estudio | Pruebas estadísticas | ||
|---|---|---|---|---|
| Grupo control | Grupo intervención | OR (IC 95) | pa | |
| Variable categórica, porcentaje | ||||
| Mortalidad UCI | 16,1 | 12,6 | 0,75 (0,36-1,56) | >0,05 |
| Mortalidad hospitalaria | 25,4 | 16,8 | 0,59 (0,31-1,12) | >0,05 |
UCI: unidad de cuidados intensivos.
Comparación de la patología de ingreso entre los grupos de estudio
| Características | Periodo de estudio | Pruebas estadísticas | |
|---|---|---|---|
| Grupo control | Grupo intervención | pa | |
| Variable categórica, porcentaje | |||
| Médicos | 77,1b | 65,5c | >0,05 |
| Cardiológicos | 4,2 | 5 | |
| Quirúrgicos | 18,6b | 29,4c | |
Recogimos 259 hemocultivos, 148 del grupo control y 111 del grupo intervención, de los cuales 30 se consideraron contaminados (23 y 7 respectivamente) (tabla 4), lo que evidencia una mayor proporción de contaminación de hemocultivos durante el periodo del grupo control con respecto al grupo intervención (15,5 y 6,3%, respectivamente). La diferencia de proporciones fue de 9,23% (IC 95%: 1,34,-16,7%), diferencia estadísticamente significativa, con un odds ratio de 2,73 (IC 95%: 1,13-6,63) (tabla 5).
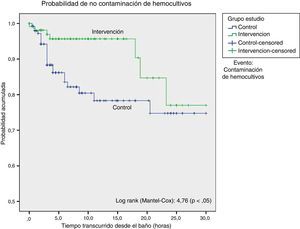
El análisis de supervivencia, considerando como evento la contaminación de los hemocultivos, mostró una diferencia estadísticamente significativa a favor del grupo intervención. Comprobamos que la probabilidad de contaminación de hemocultivos fue menor hasta las 18 h posteriores al baño en el grupo que recibió baño con clorhexidina, tras lo cual ambas curvas se aproximaban (fig. 1).
El estudio de regresión de Cox, tomando como variables de confusión la presencia de gérmenes multirresistentes, el tratamiento antibiótico previo, el nivel de gravedad y los días de ingreso en UCI, mostró que el baño sin clorhexidina aumentaba el riesgo de contaminación de los hemocultivos: HR 3,05 (IC 95%: 1,14-8,12; p < 0,05).
DiscusiónActualmente existe una preocupación creciente por mejorar la calidad de la asistencia sanitaria, a la vez que por contener el gasto sanitario. En el ámbito de los enfermos ingresados en unidades de críticos, las actuaciones como la higiene diaria con clorhexidina pretenden mejorar ambos aspectos.
Algunos estudios demuestran que la higiene diaria con clorhexidina en los enfermos ingresados en UCI provoca un efecto de descontaminación que previene el desarrollo de infecciones14–18 y reduce la posibilidad de su transmisión cruzada19.
Bleasdale et al.12 muestran una reducción significativa de las bacteriemias, así como una tendencia a disminuir la incidencia de hemocultivos contaminados. Popovich et al.18 encuentran que el baño con clorhexidina, además de reducir las bacteriemias por catéter, también disminuye la posibilidad de contaminación de hemocultivos en pacientes críticos médicos. Sin embargo, dichos autores en una publicación posterior20 vuelven a demostrar una disminución significativa en la incidencia de hemocultivos contaminados en pacientes quirúrgicos ingresados en UCI que recibieron higiene diaria con clorhexidina, aunque no hallan disminución de las bacteriemias por catéter. Noto et al.21 en un estudio reciente no demuestran una disminución de la incidencia de infecciones asociadas a cuidados sanitarios ni disminución de hemocultivos contaminados en pacientes que reciben baño diario con clorhexidina. Este trabajo presenta entre otros puntos débiles la falta de control a la adherencia de protocolos y una débil evidencia del efecto de la clorhexidina sobre la incidencia de infecciones nosocomiales.
Septimus et al.22, en otro reciente estudio que abarca una gran muestra de pacientes ingresados en UCI, pero sin poder asegurar un protocolo de desinfección cutánea ni un método de extracción de muestras uniforme, concluyen que el baño diario con clorhexidina junto al empleo de mupirocina nasal es eficaz para disminuir las bacteriemias y la contaminación de hemocultivos. El trabajo no discrimina el beneficio individual entre mupirocina y clorhexidina.
Los estudios publicados que demuestran la eficacia de la higiene diaria con clorhexidina en la disminución de contaminación de hemocultivos emplean toallitas de clorhexidina al 2%. En nuestro trabajo hemos empleado esponjas con jabón de digluconato de clorhexidina al 4%, lo que ha significado una drástica disminución de la tasa de contaminaciones, cuyo efecto persistió hasta 18 h tras la higiene. Aunque nuestro estudio no tenía como objetivo la comparación de los diferentes preparados comercializados de clorhexidina con distintas concentraciones, cabe pensar que una concentración mayor podría tener un mayor efecto protector contra las contaminaciones de hemocultivos.
La importancia de la concentración de clorhexidina queda demostrada en el estudio de Popovich et al.23 en el que analizan la concentración de dicho antiséptico por técnicas colorimétricas en zonas concretas de la piel de pacientes ingresados en UCI médica, y proceden a realizar cultivos microbiológicos cuantitativos de gérmenes procedentes de las mismas zonas de la piel. Así, llegan a establecer una relación inversa entre la densidad microbiana y la concentración de clorhexidina, cuya actividad persiste hasta 24h desde su aplicación.
Los resultados de nuestro estudio demuestran una alta incidencia de contaminación de hemocultivos en nuestra UCI a pesar de la revisión y difusión de protocolos de extracción de hemocultivos. La introducción de la higiene diaria con clorhexidina supone una buena relación coste eficacia, dada la disminución de costes derivados de la contaminación de hemocultivos.
No obstante, nuestro estudio presenta limitaciones metodológicas. Una de ellas es el hecho de ser un estudio realizado en un solo centro, con una muestra pequeña y con un diseño antes/después que puede atribuir inapropiadamente el efecto buscado a la intervención. Además, partimos de una tasa de contaminaciones de hemocultivos inaceptablemente alta, a pesar de revisar protocolos de extracción e implementar programas formativos. A pesar de estos condicionantes que pudieron debilitar los resultados por la inducción de sesgos, consideramos que era el tipo de estudio más práctico.
No se ha corroborado el desarrollo de microorganismos resistentes o la aparición de reacciones alérgicas asociadas al uso de la clorhexidina19. En nuestro caso, tampoco hemos observado reacciones cutáneas debidas al empleo de este antiséptico.
Existe un debate abierto sobre la eficacia de los diferentes antisépticos a la hora de evitar contaminaciones de los hemocultivos. Las soluciones alcohólicas ofrecen mayor eficacia como descontaminantes que las acuosas24,25. A pesar del empleo de solución antiséptica de clorhexidina al 2% sin base alcohólica como descontaminante de la piel en nuestro protocolo de extracción de hemocultivos, creemos que los resultados se deben a la utilidad de jabón de clorhexidina en la higiene diaria como responsable de la disminución de contaminaciones de hemocultivos. En futuros estudios habrá que valorar el efecto de antisépticos de base alcohólica como descontaminantes de la piel en pacientes bañados diariamente con clorhexidina.
ConclusiónEl empleo de jabón de clorhexidina al 4% en la higiene diaria de los pacientes críticos disminuye la incidencia de contaminaciones de hemocultivos y su efecto perdura en el tiempo. Una tasa baja de contaminaciones de hemocultivos es un marcador de calidad asistencial, supone un ahorro de costes derivados del uso de pruebas diagnósticas y tratamientos innecesarios, además de facilitar el manejo clínico de los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal de Enfermería del Servicio de Medicina Intensiva por su colaboración en la higiene del enfermo usando el material indicado según el estudio.
Clorhexidina acuosa 2%
Compresor venoso
Gasas
Paño estéril
Alcohol de 70°
Guantes de látex estériles
Máscara quirúrgica
Aguja iv
Jeringa de 20ml o palomita + holder
Frascos de hemocultivos (anaerobio/aerobio)
Lavado higiénico de las manos. Poner máscara quirúrgica.
Escoger lugar de extracción.
Desinfectar con clorhexidina acuosa al 2% la zona seleccionada para realizar la extracción y dejar que se seque. Una vez desinfectado, no puede tocar el punto de punción, a menos que sea de manera estéril. Colocar el campo estéril. Colocar los guantes estériles.
Retirar los tapones de plástico de los frascos.
El tapón de goma no es estéril y se debe desinfectar.
Desinfectar el tapón de goma con alcohol de 70°.
Dejar secar.
Extraer 20ml de sangre e inocular 10ml en el frasco anaerobio y 10ml en el frasco aerobio.
La extracción de sangre será por punción directa de vena o arteria.
La gasa no debe tocar la aguja en el momento de retirarla.
No hay que cambiar la aguja de la jeringa para inocular los frascos.
No tocar con los dedos la membrana del tapón del frasco una vez desinfectada con alcohol de 70°.
Registrar los datos del paciente en los frascos (etiqueta de la petición), sin tapar el código de barras ni el número de lote.
Enviar los frascos al laboratorio lo más pronto posible, donde estos serán incubados en una estufa integrada dentro de un sistema automatizado de procesamiento de hemocultivos (BacT/ALERT).