Añadir famotidina al tratamiento con bajas dosis de ácido acetilsalicílico reduce la incidencia de úlceras gastroduodenales y esofagitis
Taha AS, McCloskey C, Prasad R, et al. Famotidine for the prevention of peptic ulcers and oesophagitis in patients taking low-dose aspirin (FAMOUS): a phase III, randomised, double-blind, placebo-controlled trial. The Lancet. 2009;374:91-174.
Pregunta de investigación. ¿Reduce famotidina la aparición de úlceras gastroduodenales y esofagitis en pacientes tratados con ácido acetilsalicílico (AAS) en dosis bajas?
Método
Diseño. Ensayo clínico controlado aleatorizado.
Aleatorización. Secuencia generada informáticamente.
Enmascaramiento. Doble ciego.
Seguimiento. Doce semanas.
Ámbito. Hospitales del Reino Unido.
Pacientes. 404 pacientes.
Criterios de inclusión. Mayores de 18 años, con angina, infarto miocardio (12 o más semanas antes del reclutamiento), diabetes o enfermedad cerebrovascular o vascular periférica.
Criterios de exclusión. Enfermedad actual del esófago, estómago o duodeno, síndrome de Zollinger-Ellison, trastornos de la motilidad esofágica, embarazadas o lactantes. Pacientes en tratamiento con anticolinérgicos, análogos de prostaglandinas, warfarina, altas dosis de esteroides, fármacos citotóxicos, antiinflamatorios no esteroideos (AINE) o bifosfonatos.
Intervenciones. Famotidina 20 mg frente a placebo, dos veces al día.
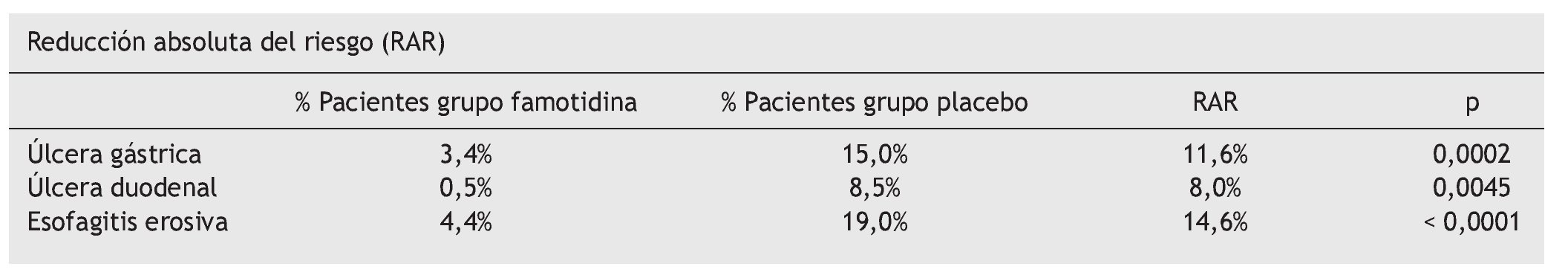
Pérdidas. 22,3% (n = 37 en famotidina y n = 53 en placebo). Variables resultado principal. Desarrollo endoscópico de úlceras gástricas, duodenales, esofagitis erosiva.
Diseño del análisis. Análisis por intención de tratar. Resultados. Ver tabla.
Conclusión de los autores. Famotidina previene las úlceras gastroduodenales y la esofagitis erosiva en pacientes tratados con AAS en dosis bajas. Estos resultados amplían las opciones terapéuticas para la prevención de lesiones gastrointestinales en pacientes antiagregados.
Fuente de financiación. Laboratorios Merck y Astellas Pharma.
Comentario
Actualmente, se ha generado un debate sobre cuál sería el tratamiento más efectivo en la prevención de complicaciones gastrointestinales asociadas al consumo de AAS en bajas dosis. El debate se suscita dadas las pocas opciones terapéuticas existentes.
Otro punto de debate procede de estudios recientes que sugieren una interacción significativa entre IBP y clopidogrel. La acción observada es una reducción significativa de la capacidad antiagregante y por tanto la reducción del beneficio clínico del clopidogrel cuando se administra con IBP. Dos estudios de cohortes1,2 y un caso control3 han demostrado unadisminución del beneficio clínico del clopidogrel por uso concomitante con inhibidores de la bomba de protones (IBP), en pacientes con enfermedad coronaria previa o reestenosis por infarto. Otro estudio de cohortes retrospectivo4, cuyo objetivo era evaluar resultados en pacientes que toman clopidogrel con o sin IBP después de la hospitalización por el síndrome coronario agudo, sugiere que el uso de IBP puede estar asociado con una disminución del efecto del clopidogrel.
Los resultados del estudio de Taha son consistentes con un metaanálisis5 que concluye que misoprostol, IBP y antagonistas del receptor H2 en dosis dobles son eficaces en la reducción del riesgo de úlceras endoscópicas gástricas y duodenales inducidas por AINE (los anti-H2 en doble dosis no tienen esta indicación autorizada en España).
La Agencia Europea del Medicamento (EMEA) y la Agencia Española del Medicamento (AEMPS)6 han desaconsejado eluso de IBP en pacientes en tratamiento con clopidogrel, a menos que se considere estrictamente necesario para prevenir el riesgo de hemorragia digestiva alta, debiendo realizarse una evaluación individualizada del balance beneficio/riesgo para cada paciente.
Mensaje para la práctica clínica. En pacientes que consumen AAS en dosis bajas se debe valorar el riesgo de complicaciones gastrointestinales y en caso de riesgo elevado se podría considerar la famotidina como alternativa al IBP.
Cumple 19 de los 22 criterios CONSORT.
Términos Mesh: peptic ulcers, esophagitis, anti-ulcer agents, histamine H2 antagonists, famotidine, aspirin.
Autores:
D. Palma Morgado, B. Merino Rico y M.O. Caraballo
Camacho Servicio Andaluz de Salud.
Bibliografía
1. Pezalla E, Day D, Pulliadath I. Initial assessment of clinical impact of a drug interaction between clopidogrel and proton pump inhibitors. J Am Coll Cardiol. 2008;52:1038-9.
2. SCAI statement on "A national study of the effect of individual proton pump inhibitors on cardiovascular outcomes in patients treated with clopidogrel following coronary stenting: The Clopidogrel Medco Outcomes Study". Disponible en: http://www. wcai.org/drlt1.aspx?PAGE ID=5870
3. Juurlink DN, Gomes T, Ko DT, Szmitko PE, Austin PC, Tu JV, et al. A population-based study of the drug interaction between proton pump inhibitors and clopidogrel. CMAJ. 2009;180: 713-8.
4. Ho PM, Maddox TM, Wang L, Fihn SD, Jesse RL, Peterson ED, et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA. 2009;301:937-44.
5. Delaney B, Ford AC, Forman D, Moayyedi P, Qume M. Estrategias de tratamiento inicial para la dispepsia (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, número 3, 2008. Oxford, Update Software Ltd. Disponible en: http://www.update-software.com
6. Public statement on possible interaction between clopidogrel and proton pump inhibitors. EMEA/328956/2009 (29/09/2009). Disponible en: http://www.emea.europa.eu/humandocs/DFs/ EPAR/Plavir/32895609en.pdf
Aspirina para diabéticos en prevención primaria: praxis sin evidencia científica
De Berardis G, Sacco M, Strippoli GF, et al. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials. BMJ. 2009;339:b4531 doi:10.1136/bmj.b4531.
Pregunta de investigación.¿Obtenemos algún beneficio dando aspirina a los pacientes diabéticos sin enfermedad cardiovascular previa?
Métodos
Diseño. Metaanálisis de ensayos clínicos controlados.
Fuente de datos. Medline y Cochrane Library.
Selección y valoración de artículos. Ensayos clínicos prospectivos, randomizados y controlados (abiertos o ciegos) -publicados entre 1966 y noviembre de 2008- en los que la aspirina se compara con un grupo control (placebo o no tratamiento) en pacientes diabéticos sin enfermedad cardiovascular establecida.
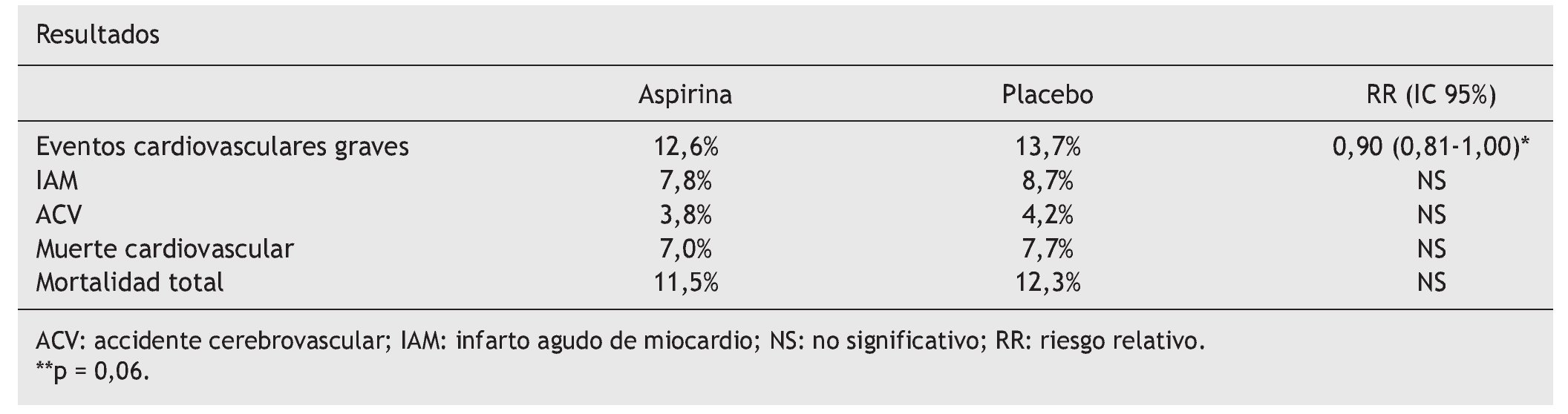
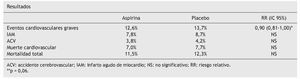
Variable resultado principal. Combinada de eventos cardiovasculares graves: muerte de causa vascular, infarto de miocardio (IAM) no fatal, accidente cerebrovascular (ACV) no fatal y mortalidad total.
Resultados. Seis ensayos clínicos (10.117 pacientes) fueron seleccionados de un total de 157.
Aspirina sólo reduce de forma significativa el infarto de miocardio en hombres: (95% IC 0,57[0,34-0,94]).
Es difícil extraer conclusiones claras sobre efectos adversos, por estar poco estudiados en los ensayos clínicos incluidos en el metaanálisis. No parecen observarse diferencias estadísticamente significativas en la incidencia de hemorragias,, síntomas gastrointestinales o cáncer.
Conclusión de los autores. Sigue sin ponerse de manifiesto el beneficio de la aspirina en la prevención primaria de eventos cardiovasculares graves en pacientes diabéticos. El género podría jugar un importante papel como factor modificador. La toxicidad debería ser evaluada.
Fuente de financiación. No existe financiación externa.
Comentario
Los antiagregantes plaquetarios, entre ellos la aspirina, han demostrado una gran eficacia en la reducción de procesos trombóticos arteriales (coronarios, cerebrovasculares o periféricos) en pacientes con enfermedad cardiovascular previa1.
La eficacia de la aspirina en prevención secundaria y la extrapolación de resultados obtenidos a partir de pacientes de alto riesgo sin enfermedad cardiovascular previa ha motivado que las recomendaciones se extiendan también a pacientes en prevención primaria como los diabéticos. Guías de práctica clínica como NICE2 o ADA3 recomiendan el uso de aspirina en dosis bajas para la prevención primaria de eventos cardiovasculares en diabéticos, aún a pesar de que las evidencias en este sentido son escasas.
Un metaanálisis llevado a cabo con anterioridad venía a sugerir un posible beneficio en la población diabética, pero el número de pacientes analizados no aportaba suficiente poder estadístico para dilucidar esta cuestión4. La aparición de dos nuevos ensayos clínicos en 2008 (POPAPAD y JPAD) tampoco han podido demostrar el beneficio de la aspirina en el paciente diabético5.
Los resultados del metaanálisis que nos ocupa, con más de 10.000 pacientes (más del doble de lo anteriormente publicado), vuelven a mostrar la falta de eficacia de la aspirina en la reducción de los eventos cardiovasculares en los pacientes diabéticos sin enfermedad cardiovascular establecida.
Son limitaciones importantes del estudio la falta de poder estadístico de varios de los ensayos clínicos seleccionados, la heterogeneidad detectada en algunos de ellos, así como la ausencia de información sobre el proceso de aleatorización llevado a cabo en otros. Todo ello confiere cierta incertidumbre a los resultados obtenidos.
España se caracteriza por presentar un índice de riesgo vascular hasta tres veces menor que poblaciones anglosajonas, por lo que deberíamos ser aún más cautos a la hora de asumir las recomendaciones que puedan darse sobre el uso de antiagregantes en pacientes diabéticos.
También es conveniente recordar que ningún antiagregante plaquetario (incluida la aspirina) tiene aprobada en ficha técnica la indicación de prevención primaria de eventos cardiovasculares y que no podemos descartar la posible aparición de cuadros hemorrágicos que no compensarían el escaso beneficio clínico.
Mensaje para la práctica clínica. No hay ninguna justificación para usar aspirina en pacientes diabéticos sin enfermedad cardiovascular establecida. Intervenciones sobre e hábito tabáquico, control glucémico, hipertensión y niveles de colesterol deben ser las priorizadas en este grupo de población.
Cumple 21 de los 27 criterios PRISMA.
Términos Mesh: aspirin, diabetes, primary prevention, cardiovascular disease.
Autores:
J. Rodríguez Castilla, M.C. Montero Balosa y D. Palma Morgado
Servicio Andaluz de Salud.
Bibliografía
1. Wong CK. The role of antiplatelet agents. BPJ 2009;19:32-37. Disponible en: www.bpac.org.nz2. NICE. Disponible en: http://www.nice.org.uk/
3. National Institute for Health and Clinical Excellence. Type 2 Diabetes. May 2009 American Diabetes Asociation Standars of medical care in diabetes-2008. Diabetes Care. 2008:31:S12-54.
4. Antitrombotic Trialists (ATT) Collaboration, Baigent C, Blackwell L, Collins R, Gumberson J, Godwin J, Peto R, et al. Aspirin in tye primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009;373-1849-60.
5. Muller PS. No benefit for Aspirin in diabetic patients without symtomatic CVD. Journal Wateh General Medicine. 2008. Disponible en: http://general-medicine.jwatch.org/
Dabigatrán y warfarina tienen similar eficacia y seguridad en pacientescon fibrilación auricular
Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarina in patients with atrial fibrillation. N Engl J Med. 2009;361:1139-51.
Pregunta de investigación. En pacientes con fibrilación articular (FA) ¿Dabigatrán es similar a warfarina para la prevención de ictus? ¿Es similar en seguridad?
Método
Diseño. Ensayo clínico aleatorizado. Estudio de no inferioridad.
Aleatorización. Sistema telefónico.
Enmascaramiento. Ciego para las dosis de dabigatrán, abierto para warfarina.
Seguimiento. Mediana de seguimiento de 2 años.
Pacientes. 18.113, edad media 71 años, 63,6% hombres. Con FA documentada y al menos una de las siguientes características: ictus previo o ataque isquémico transitorio, eyección ventricular izquierda menor del 40%, insuficiencia cardiaca clase II (NYHA), edad 75 años o entre 65-74 más diabetes, hipertensión o enfermedad coronaria. Se excluyeron los pacientes con riesgo aumentado de hemorragia, Clcr menor de 30 ml/min, enfermedad hepática, enfermedad valvular grave.
Intervención. Dabigatrán 110 mg o 150 mg dos veces al día.
Control. Warfarina, dosificado según el cociente normalizado internacional (INR).
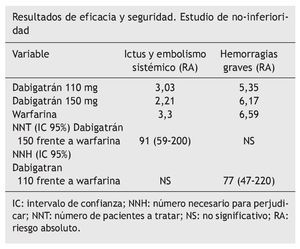
Variable principal. Ictus o embolismo sistémico y de seguridad, hemorragias graves.
Pérdidas/sujetos analizados. Análisis por intención de tratar. Seguimiento 99,9% pacientes. Tasas de discontinuación a los dos años para dabigatrán 110 mg; 150 mg y warfarina fue de 20,7%; 21,2% y 16,6% respectivamente.
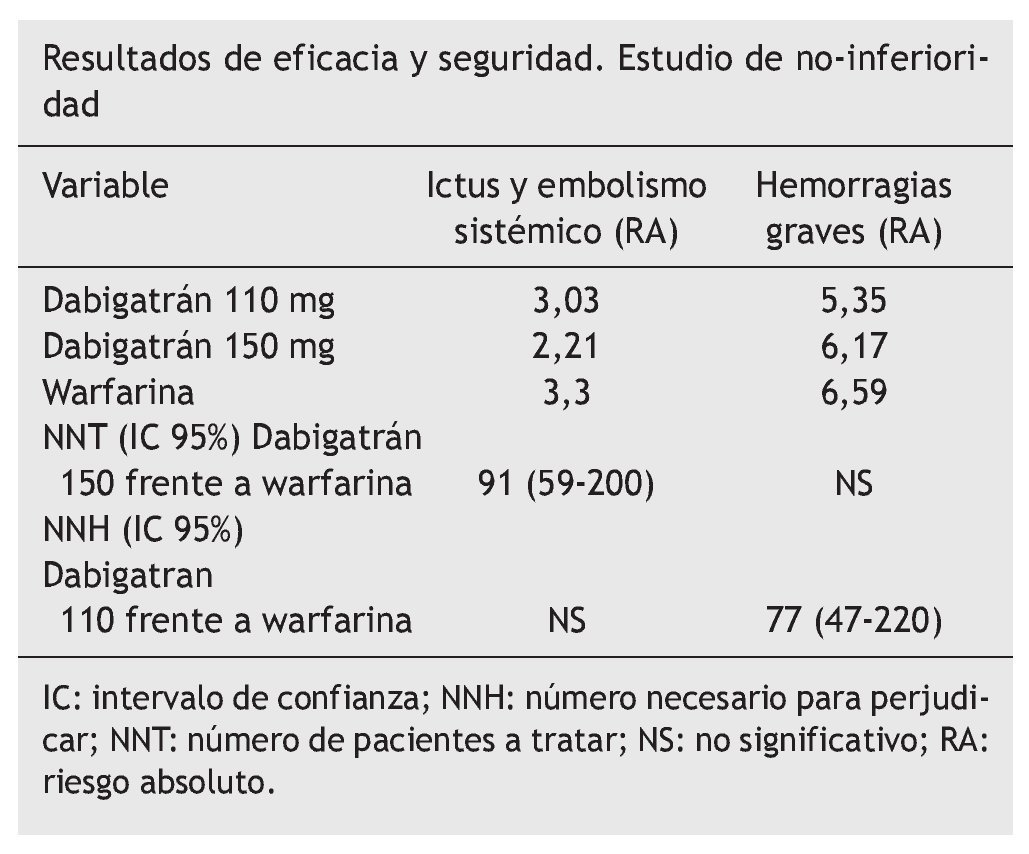
Resultados. Dabigatrán en dosis 110 mg demostró ser no inferior en la variable principal a warfarina con menor riesgo de hemorragia grave.
La tasa de infarto fue superior en el grupo tratado con dabigatrán (0,72% dabigatrán 110 mg, 0,74 dabigatrán 150 mg, 0,53% warfarina.
Conclusión de los autores. En pacientes con FA, dabigatrán en dosis de 110 mg dos veces al día se asoció con una tasa de eventos de ictus o embolia similar a warfarina y menor tasa de hemorragia grave. Dabigatrán en dosis de 150 mg dos veces al día se asoció a una tasa de ictus y embolismo menor pero similar tasa de hemorragia grave a warfarina.
Fuente de financiación. Boehringer Ingelheim.
Comentario
El tratamiento anticoagulante indicado en pacientes con FA y algún factor de riesgo adicional son los antagonistas de la vitamina K. Sin embargo, estos fármacos no están exentos de problemas1: interacciones farmacológicas, alimentarias, riesgos de sangrados, rangos terapéuticos estrechos con monitorización frecuente, etc. Por todo esto se buscan alternativas más seguras. Dabigatrán es un nuevo anticoagulante con un mecanismo de acción diferente que pretende mejorar seguridad y adherencia en estos pacientes.
En el estudio que nos ocupa, denominado RE-LY, en dosis de 150 mg presentó menor número de eventos en la variable principal y similares porcentajes de hemorragias graves. Con una dosis de 110 mg obtuvo resultados no significativos para la variable principal y menos hemorragias. Estos resultados hay que interpretarlos con cautela, puesto que el estudio es un ensayo de no inferioridad.
Respecto a dabigatrán 150 mg, su mayor eficacia con un número de pacientes a tratar (NNT) de 90 no parece justificarse con el número necesario para perjudicar (NNH) (100) que produce hemorragia gastrointestinal y el mayor número de infartos de miocardio, al que no le han encontrado explicación.
Como principales limitaciones metodológicas, reseñamos que el análisis se hizo por intención de tratar. En los estudios de no inferioridad es recomendable realizarlo también por protocolo, para evitar que se magnifiquen las diferencias entre tratamientos de forma artificiosa. Que el estudio sea abierto es un sesgo importante, disminuyendo la validez interna del ensayo. Además la tasa de abandonos fue mayor en los pacientes tratados con dabigatrán, principalmente por molestias gástricas y eventos adversos serios. Respecto a la seguridad del medicamento a largo plazo, difícilmente puede ser evaluada con un seguimiento de dos años.
Hay datos que no se discuten en el estudio. La variable principal es combinada, siendo la frecuencia de eventos muy distinta entre ambas. El estudio, en un principio, se diseñó para un seguimiento de tres años y medio2, y el periodo se redujo a dos años sin justificarlo en la discusión.
Dabigatrán por el momento sólo tiene indicación como tratamiento agudo para la prevención de tromboembolismo venoso en cirugía de prótesis de cadera y rodilla3.
Mensaje para la práctica clínica. En pacientes con FA y alto riesgo de ictus, los antagonistas de la vitamina K siguen siendo el tratamiento de elección. Se necesitan estudios a más largo plazo para conocer su perfil de seguridad y más evidencia de su eficacia comparada.
Cumple 15 de 22 criterios Consort no inferioridad Términos Mesh: atrial fibrillation, cerebrovascular accident warfarina, dabigatran etexilato.
Autores:
D. Palma Morgado, E. Hevia Álvarez y C. Fernández Oropesa
Servicio Andaluz de Salud.
Bibliografía
1. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med. 207;146:857-67.
2. Clinical rial.gov [Internet]. Randomized evaluation of long term anticoagulant therapy (RE-LY) with dabigatran etesilate-NCT00262600. Disponible en: http//:clinicaltrials.gov/ct2/ result?term=nct00262600
3. CIMA [Internet]. Ficha técnica Pradaxa. Disponible en: http:// www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/ human/medicines/000829/human_med_000981.jsp&murl= menus/medicines/medicines.jsp∣=wcobo1ac058001d124
En asma infantil no controlado con corticoides inhalados en dosis bajas, se debe individualizar el siguiente escalón
Lemanske RF Jr, Mauger DT, et al. Step-up therapy for children with uncontrolled asthma receiving inhaled corticosteroids. N Engl J Med. 2010;362(11):1042-3.
Pregunta de investigación. En niños y adolescentes con asma no controlado con corticoides inhalados (CI) en dosis bajas, ¿se obtiene diferente respuesta con los distintos tratamientos?
Métodos
Diseño. Ensayo clínico aleatorizado cruzado 3 u 3.
Aleatorización. Centralizada, computarizada. Enmascaramiento. Doble ciego.
Seguimiento. 48 semanas.
Ámbito. Atención Primaria.
Pacientes. Niños y adolescentes de 6-17 años de edad con asma de leve a moderada no controlada con fluticasona 100 mcg/12 horas inhalada.
Intervención. Diseño cruzado, 16 semanas cada tratamiento: añadir un beta-agonista de acción larga (BAAL) (salmeterol 50 mcg/12 horas), añadir un antileucotrieno (AL) (montelukast 5-10 mg/24 horas) o aumentar la dosis de fluticasona a 250 mcg/ 12 horas. Todos los pacientes pasaron por las tres pautas de tratamiento.
Control. Cada paciente fue comparado consigo mismo. Variable principal. Respuesta diferente a cada terapia de intensificación, según variable combinada que incluye: número de exacerbaciones que requieren corticoide oral, número de días de control del asma y variación del volumen espiratorio máximo por segundo (FEV1).
Pérdidas/sujetos analizados. 182 niños incluidos, de los cuales 165 completaron 2 ciclos de tratamiento y 157 completaron los 3 ciclos del estudio. En el análisis se incluyeron todos los niños que completaron 2 ciclos (165).
Resultados. Un 98% (161 de 165) de los niños evaluados obtuvieron respuestas diferentes según el régimen de intensificación (p < 0,001).
Como variable secundaria, una puntuación > 19 (control aceptable) en el Asthma Control Test y el Chilhood Asthma Control Test se consideró un factor predictor de mejor respuesta a BAAL.
Conclusión de los autores. La respuesta a la terapia de intensificación depende de la susceptibilidad individual. Añadir un BAAL obtiene mayor probabilidad de mejorar la respuesta comparado con aumentar la dosis de CI o añadir un AL, aunque es preciso individualizar la terapia, ya que muchos niños obtienen mejor respuesta con alguno de estos 2 últimos.
Fuente de financiación. Pública.
Comentario
El asma es una enfermedad crónica de elevada prevalencia en la edad infantil, que produce una disminución de la calidad de vida en un gran número de niños y adolescentes.
Cuando el asma no se controla con CI en dosis bajas, en el siguiente escalón las opciones son aumentar la dosis del CI o añadir un segundo fármaco, principalmente un BAAL o un AL. Las principales guías se dividen entre la adición de BAAL1 o aumentar el CI a dosis medias2.
La adición de un BAAL ha mostrado ser superior a la de un AL en la prevención de exacerbaciones que requirieron corticoides orales, mejoría de la función pulmonar, síntomas y uso de fármacos de rescate3.
En comparación con doblar la dosis de CI, la adición de un BAAL se asoció con una mejoría del PEF (flujo espiratorio máximo) y el crecimiento; sin embargo, no hubo diferencias en las variables clínicas importantes, como el riesgo de exacerbaciones4. Estas leves ventajas de los BAAL hay que sopesarlas con el mayor riesgo de exacerbaciones graves producidas observado en su utilización en monoterapia, aunque aún no existen datos suficientemente sólidos para determinar si este riesgo también existe cuando se combina BAALcon un CI. Tras la revisión completa de los datos de seguridad de los BAAL, la agencia del medicamento británica Medicines and Healthcare Regulatory Agengy [MHRA]) ha terminado que el balance beneficio/riesgo sigue siendo positivo en el tratamiento de mantenimiento del asma, siempre en combinación con CI1.
Este estudio fue diseñado para evaluar la frecuencia con la que aparecen diferentes respuestas entre los distintos tratamientos. Aunque se ha observado que la asociación de un BAAL al CI podría mejorar el control de los síntomas del asma con más frecuencia que con las otras alternativas, este resultado se ve condicionado por las características intrínsecas de los pacientes. La principal limitación de este estudio es que no permite extraer conclusiones acerca del perfil de seguridad de las tres terapias estudiadas, ni responde a la cuestión que suscita un reciente metaanálisis en el que se relacionó el uso de BAAL en asmáticos con el aumento de eventos adversos graves5.
Mensaje para la práctica clínica. En niños (mayores de 4 años) y adolescentes con asma que no se controlan con CI en bajas dosis, puede ser una buena opción añadir un BAAL o aumentar la dosis de CI. Es preciso individualizar el tratamiento y monitorizar su eficacia y seguridad una vez iniciado, suspendiéndolo si no se observa beneficio.
Cumple 20 de los 22 criterios Consort.
Términos Mesh: asthma, children, inhaled corticosteroid, long-acting β2-agonist, leukotriene antagonists.
Autores:
M.C. Vela Márquez1, A. Domínguez Recio1 y C. BarredaVelásquez2
1Servicio Andaluz de Salud. 2Servicio Madrileño de Salud.
Bibliografía
1. Scottish Intercollegiate Guidelines Network nd British thoracic Society. British guideline on the management of asma: a national clinical guideline. Mayo 2008. Disponible en: http://www. sign.ac.uk/pdf/sign101.pdf
2. Institute for Clinical Systems Improvement (ICSI), Health Care Guidelines: diagnosis and management of asthma. 8 ed. 2008.
3. Ducharme FM, Lasserson TJ, Cates CJ. Long-acting beta2-agonists versus anti-leukotrienes as add-on therapy to inhaled corticosteroids for chronic asthma. Cochrane Database Syst Rev. 2006;(4):CD003137.
4. Ni Chroinin M, Lasserson TJ, Greenstone I, Ducharme FM. Addition of long-acting beta-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane Database Syst Rev. 2009; (3):CD007949.
5. Cates CJ, Cates MJ, Lasserson TJ. Regular treatment with formoterol for chronic asthma: serious adverse events. Cochrane Database Syst Rev 2008;(4):CD006923
El uso de rosuvastatina reduce la aparición de tromboembolismo venoso en personas sanas y frente a placebo
Glynn RJ, Danielson E, Fonseca FAH, et al. A randomized trial of rosuvastatin in the prevention of venous thromboembolism. N Engl J Med. 2009;360:1851-61.
Pregunta de investigación. En personas aparentemente sanas, ¿previene el uso de rosuvastatina la aparición de síntomas de tromboembolismo venoso (TEV)?
Método
Diseño. Ensayo clínico aleatorizado, multicéntrico y controlado con placebo.
Aleatorización. Ratio 1:1.
Enmascaramiento. Doble-ciego.
Seguimiento. Por protocolo, el seguimiento se diseñó mediante visitas programadas a las 13 semanas de la aleatorización, y posteriormente cada 6 meses hasta completar 60 meses. Se realizó también una visita más completa tras la finalización del estudio. El estudio se interrumpió anticipadamente a una mediana de seguimiento de 1,9 años (máximo 5 años).
Ámbito. Estudio realizado en 1.315 centros de 26 países.
Pacientes. 17.802 personas aparentemente sanas. Hombres a partir de los 50 años y mujeres a partir de los 60.
Criterios de inclusión. No tener antecedentes de enfermedad cardiovascular, que en una primera visita presentaran niveles de colesterol LDL < 130 mg/dl, valores de proteína C reactiva de alta sensibilidad de 2,0 mg/l o mayor, y triglicéridos < 500 mg/dl.
Criterios de exclusión. Tratamiento hipolipidemiante 6 meses previo al estudio, tratamiento hormonal sustitutivo concomitante, diabetes mellitus, cáncer en los 5 años previos al estudio (excepto carcinoma basocelular y epidermoide de la piel), hipertensión arterial no controlada.
Intervenciones. Rosuvastatina 20 mg al día frente a placebo una vez al día.
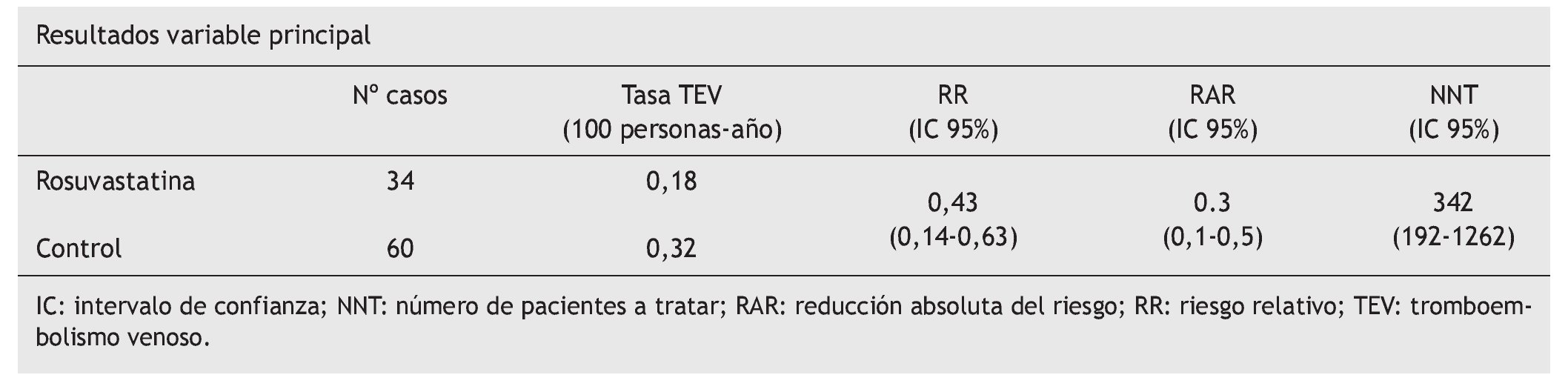
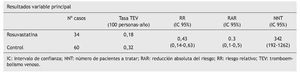
Variables resultado principal. Aparición de un primer TEV sintomático, medido en número de casos en los grupos de estudio.
Diseño del análisis. Análisis primario por "intención de tratar". Se utilizó el modelo de riesgo proporcional de Cox para calcular los hazard ratio e intervalos de confianza del95% para la comparación de tasas de eventos en los grupos.
Conclusión de los autores. Rosuvastatina, 20 mg al día, reduce de forma significativa la aparición de TEV sintomático en personas aparentemente sanas.
Fuente de financiación. Estudio financiado principalmente por AstraZeneca y por el National Institute on Aging.
Comentario
Rosuvastatina inhibe de forma competitiva y selectiva la HMG-CoA reductasa, siendo su principal lugar de acción el hígado. Es la sexta estatina que se comercializa en España. Sus indicaciones autorizadas son hipercolesterolemia primaria, dislipidemia mixta e hipercolesterolemia familiar homocigótica1. En España, la indicación para la prevención de enfermedad cardiovascular no se encuentra autorizada, siendo aprobada en la Food and Drug Administration (FDA)2 el pasado 8 de febrero.
Se han publicado numerosos estudios a corto plazo en los que se compara rosuvastatina con otras estatinas: simvastatina, pravastatina y atorvastatina3, donde ésta produjo mayores variaciones en la disminución de colesterol LDL, triglicéridos y aumento de colesterol HDL en dosis equivalentes, pero no mostró eficacia en la reducción de muerte por causa cardiovascular, infarto de miocardio o ACV.
En este análisis post hoc del estudio JUPITER, definidoen el protocolo inicial del estudio, es preciso destacar que aunque se observa una reducción relativa del riesgo frente a placebo del 43% en la incidencia de TEV sintomático, debido al bajo riesgo de los pacientes de padecer TEV, el número de pacientes que es necesario tratar (NNT) es alto (NNT = 342). El estudio JUPITER4, fue interrumpido anticipadamente en una mediana de 1,9 años. Esto hace que no se puedan valorar posibles efectos adversos a largo plazo. Por ejemplo, se detectó un incremento en la incidencia de diabetes en el grupo intervención, de la que se desconoce cómo podría influir el balance beneficio/riesgo. Debido a los criterios de inclusión, este estudio carece de validez externa, ya que ha sido realizado en personas sanas. Además, actualmente, el uso de los niveles de PCR no es de utilización habitual para valorar el riesgo cardiovascular5.
Si tenemos en cuenta el coste del tratamiento de rosuvastatina respecto al resto de las estatinas comercializadas observamos un coste por DDD de 0,92 euros de rosuvastatina frente a 0,23 euros de simvastatina.
Mensaje para la práctica clínica. No se recomienda el uso de rosuvastatina debido a la falta de datos de seguridad a largo plazo en la prevención primaria de enfermedad cardiovascular; a la existencia de otras estatinas comercializadas, que han demostrado disminución del riesgo CV, con un amplio conocimiento de eficacia y seguridad al alto coste que presenta el tratamiento de rosuvastatina respecto al resto de estatinas disponibles en el mercado.
Cumple 16 de los 22 criterios CONSORT.
Términos Mesh: rosuvastatin, venous thromboembolism, statin, prevention, cardiovascular disease.
Autores:
A. Rodríguez Terol, J. Cárdenas Gómez y D. Palma Morgado
Servicio Andaluz de Salud.
Bibliografía
1. Ficha técnica medicamento Crestor. Agencia Española del Medicamento y productos sanitarios. Disponible en: https://sinaem4.agemed.es/consaem/especialidad.do?metodo=verFich aWordPdf&codigo=70243&formato=pdf&formulario=FICHAS.
2. Food and Drug Administration. Internation for Healthcare Profesionals: Crestor (osuvastin calcium) 3/2/2005 NHS. New Drug Evaluation. Rosuvastatin.
3. New Drug Evaluation: rosuvastatin. NHS.
4. Rdker P, Danielson E, Fonseca F, Genest J, Gotto AM, Kastelein et al. JUPITER Study Group. Resuvastatin to prevent vascular evens in men and women with elevated C-reactive protein. N Eng J Med. 2008;359:2195-207.
5. Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO 3rd, Criqui M, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.