La presencia de lesiones mucosas papulares blancas con una disposición reticular es uno de los hallazgos más comunes en la patología bucal. Clásicamente, estas lesiones se han denominado genéricamente como liquen plano oral (LPO). Este proceso mucoso crónico tiene una etiología desconocida, un origen inmunológico y afecta más a las mujeres perimenopáusicas. El carácter precanceroso de estas entidades ha sido y es motivo de controversia, ya que en la mayoría de los casos la tasa de malignización no supera el 1% de los casos. En la actualidad, se considera que algunas lesiones, las denominadas lesiones liquenoides orales (LLO), tienen un mayor potencial de transformación maligna. Por ello es importante conocer los diferentes aspectos que presenta la enfermedad liquenoide oral (ELO) en sus diferentes vertientes. En esta revisión, actualizamos y analizamos los principales aspectos clinicopatológicos y pronósticos de esta común y controvertida enfermedad de la mucosa oral.
The presence of white papules with reticular pattern is one of the most common findings in oral pathology. Classically, these lesions have been generically called oral lichen planus (OLP). This entity is a chronic inflammatory disease with an immunological basis and unknown etiology that has a predilection for perimenopausal females. The premalignant potential of OLP has been –and still is– controversial. Most studies report that malignancy occurs in less than 1% of cases. Recently, certain lesions, called oral lichenoid lesions (OLL) are considered to be those with an increased risk of malignant transformation. Consequently, knowledge of the different features of oral lichenoid disease (OLD) and its distinct subtypes is essential. In this review, we provide an update of the main clinicopathological and prognostic features of this common and controversial oral mucosal disease.
Sare itxurako lesio papular zuriak izatea ahoko patologian sarrien agertzen den lesioetako bat da. Klasikoki, lesio horien izen generikoa ahoko liken zapala da (ALZ). Mukosaren prozesu kroniko horrek sorburu ezezaguna du, eta jatorri immunologikoa dauka; gainera menopausiatik gertu dauden emakumeek izaten dute gehienetan. Entitate horren aurreminbizi izaera beti izan da eztabaida sortu duen gaia; batez ere, gehienetan, malignizazio tasak ez duelako ehuneko bat gainditzen. Gaur egun, zenbait lesiok, ahoko liken antzerako lesioak (ALL) deiturikoek, txarrerantz transformatzeko joera handiagoa dutela uste da. Horregatik, garrantzitsua da liken antzerako ahoko gaixotasunaren (LAG) aspektuak ezagutzea, alderdi guztietan. Artikulu honetan, ahoko gaixotasun arrunt eta eztabaidatu honen alderdi klinikopatologikoak eta pronostikoak eguneratuko eta aztertuko ditugu.
Clásicamente, se ha considerado como liquen plano oral (LPO) a un proceso inflamatorio crónico de la mucosa oral que afecta principalmente a mujeres de mediana edad perimenopáusicas1–3. Recientemente hemos propuesto una nueva nomenclatura y clasificación para los procesos con pápulas blancas reticulares en la mucosa oral, agrupándolos como enfermedad liquenoide oral (ELO)4.
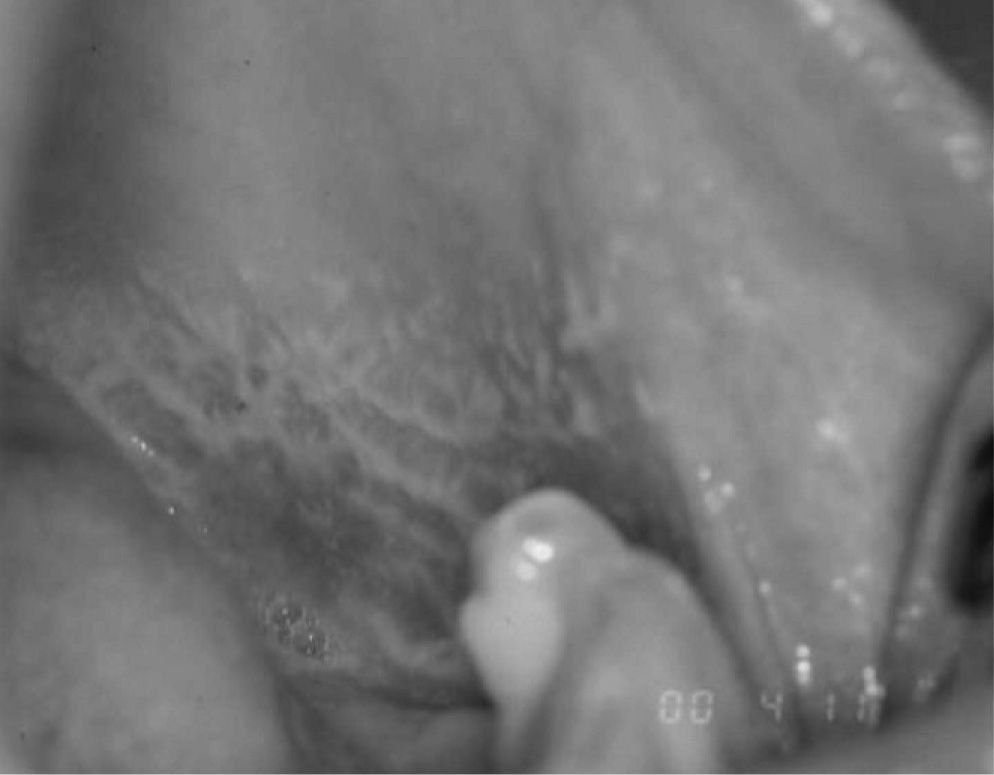
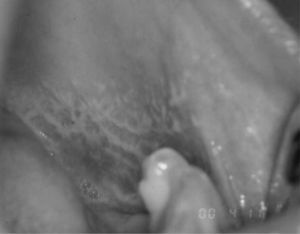
La lesión clínica característica de estos procesos es la pápula blanca lineal, con un patrón reticular y generalmente asintomática (fig. 1). No obstante, cuando se acompaña de lesiones atróficas y erosivas suele ser sintomática2,5. Las lesiones suelen presentar un patrón bilateral y simétrico, característico en los casos típicos de LPO1,2.
La etiología de la ELO es desconocida, aunque existe un acuerdo general en considerarlos procesos autoinmunitarios. Los linfocitos TCD8 citotóxicos y los TCD4 facilitadores se acumularían en la lámina propia y en la submucosa superficial. Estos linfocitos serían activados por diferentes mecanismos y producirían apoptosis celular, degeneración basal y destrucción de la membrana basal, dando lugar a las lesiones clínicas2,6–8.
Existen procesos similares al LPO, que no cumplen todos los requisitos clinicopatológicos típicos, denominados lesiones liquenoides orales (LLO), que suelen adoptar con frecuencia un patrón unilateral y/o asimétrico 9. Pueden ser reactivas cuando existe una causa reconocida (p. ej., amalgama de plata, o fármacos), o idiopáticas cuando no se identifica ningún factor causante4.
El tratamiento de estos procesos es sintomático antiinflamatorio y está indicado en los pacientes con sintomatología que presentan lesiones atróficas, erosivas y ulcerativas. Los fármacos más utilizados son los inmunosupresores e inmunomoduladores locales y sistémicos, preferentemente los corticoides3,5,10.
El elemento más importante de los procesos agrupados como ELO es su posible transformación maligna en un carcinoma oral de células escamosas2,7,11–16. Estos últimos años las LLO han sido objeto de un interés especial, ya que parecen presentar un mayor riesgo de transformación maligna que el LPO clásico3,13,17,18.
En esta revisión actualizamos y analizamos los principales aspectos clinicopatológicos y pronósticos de esta prevalente y controvertida enfermedad oral.
Aspectos etiopatogénicosEn la actualidad se considera que la ELO es un proceso inmunológico multifactorial con factores genéticos, psicológicos, infecciosos, etc., que podrían actuar como agentes causales o como precipitantes del proceso2,8,12.
En esta enfermedad autoinmunitaria los linfocitos T CD8 citotóxicos serían atraídos y activados por uno o más antígenos (aún desconocidos) asociados al complejo mayor de histocompatibilidad de clase I (CMH-I), expresados por los queratinocitos. Los linfocitos T CD4 colaboradores, a su vez, serían atraídos y activados por el complejo de histocompatibilidad de clase II (CMH-II) asociado a las células de Langerhans (cL) y/o a los queratinocitos (Lodi et al5). También participarían diferentes citocinas (interleucina 2 [IL-2], IL-12), el interferón gamma (IFN-γ) y el factor de necrosis tumoral alfa (TNF-α), moléculas involucradas en la respuesta inmunitaria. El TNF-a secretado por los linfocitos T CD8 citotóxicos provocaría apoptosis de los queratinocitos y estimularía la sobreexpresión de las moléculas de adhesión (moléculas de adhesión leucocitaria al endotelio-1, moléculas de adherencia intercelular, moléculas de adhesión celular vascular-1) por las células endoteliales del plexo vascular subepitelial, que participarían también en el proceso inflamatorio2,8. Es poco probable que estos procesos estén causados por un único antígeno. Estudios sobre las células T de la zona lesional no han demostrado alteraciones genéticas en este sentido19. Probablemente estos procesos sean el resultado de la implicación de diferentes antígenos que pueden ser extrínsecos o intrínsecos, o superantígenos. En una minoría de pacientes, se pueden identificar el o los factores precipitantes, entre los que se incluyen materiales dentales, sobre todo de restauración dental como la amalgama de plata, medicamentos como los antiinflamatorios no esteroideos o los inhibidores de la conversión de la angiotensina, el estrés, algunos agentes infecciosos como el virus de la hepatitis, etc.20.
Se cree que existen dos vías para el daño tisular, que explicarían en parte el carácter crónico del proceso inflamatorio6,21. La primera sería a través de un mecanismo antígeno específico donde los queratinocitos basales y las cL presentarían antígenos asociados a CMH-I y II. Los del CMH-I estimularían a los LTCD8 citotóxicos a secretar TNF-α y los del CMH-II a los linfocitos CD4 a secretar IL-2 e IFN-γ, que producirían un daño continuo en los queratinocitos8,6,21. La segunda vía sería a través de mecanismos no específicos, que provocarían degranulación de los mastocitos y posterior activación de metaloproteinasas (MMP), que degradarían componentes de la matriz extracelular y de la membrana basal21,22. Se ha señalado que más del 60 % de los mastocitos de las lesiones de LPO están degranulados en comparación con la mucosa no afectada8,23. La degranulación mastocitaria es una fuente importante de quimasa y triptasa, proteasas activadoras de MMP 1, 3 y 922. Además, algunos de los mediadores liberados por los mastocitos participan en la migración de linfocitos a través del epitelio8. Específicamente, el TNF-α estimula la sobreexpresión de algunas moléculas de adhesión (CD62E, CD54, CD106), necesarias para la adhesión de los linfocitos a la pared vascular para su posterior extravasación22. La quimasa y la triptasa activarían la MMP-9 derivada de los linfocitos T, provocando daño en el colágeno tipo IV y en la membrana basal8,22.
Aspectos histopatológicosEn el diagnóstico de estos procesos es fundamental unir los aspectos clínicos y los histopatológicos, tanto para confirmar la sospecha clínica como para excluir la existencia de displasia epitelial o de otro proceso similar, incluido el cáncer24. Sin embargo, se ha demostrado que la evaluación histopatológica puede ser muy subjetiva25 y que aproximadamente en la mitad de los casos la correlación clinicopatológica suele ser pobre9.
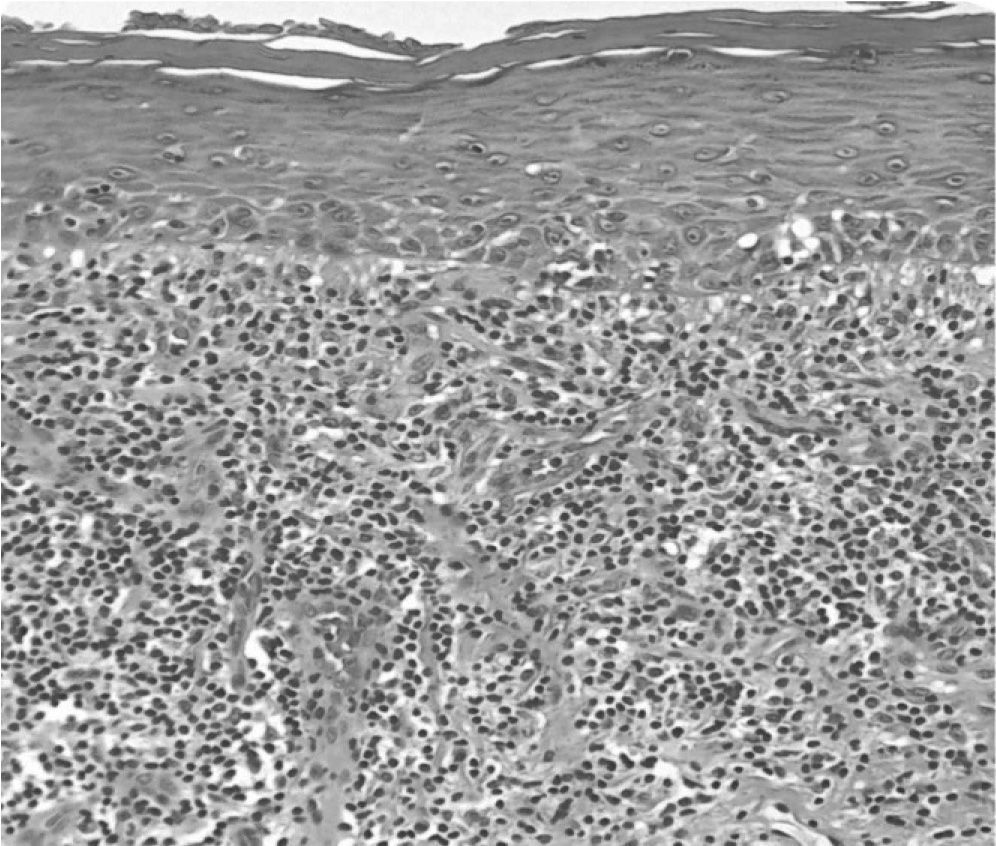
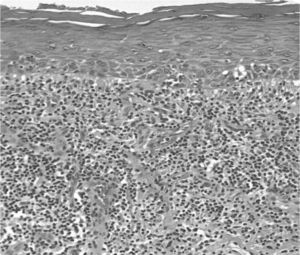
El LPO clásico se caracteriza histopatológicamente por la presencia de hiperqueratosis o atrofia, exocitosis, degeneración hidrópica de la capa basal, queratinocitos apoptóticos (cuerpos de Civatte) y un infiltrado inflamatorio crónico en la lámina propia con disposición “en banda” constituido principalmente por linfocitos T6 (fig. 2). No obstante, este aspecto histológico no es patognomónico del LPO y se puede observar en otros procesos mucosos, como el penfigoide mucoso, el lupus eritematoso discoide, etc.17.
Las LLO son entidades difíciles de diferenciar del LPO, ya que muestran características clínicas e histopatológicas similares, por lo que es imprescindible realizar un examen clínico minucioso, ya que la omisión de datos clínicos frecuentemente se asocia a errores en el diagnóstico histopatológico17. En 2003, van der Meij y van der Waal9 señalaban una serie de criterios clínicos e histopatológicos para diferenciar el LPO y las LLO (tabla 1). Estos autores9 consideran como LLO a todas aquellas lesiones que no cumplen los criterios clinicopatológicos típicos de LPO, a las que denominan “clínica y/o histopatológicamente compatibles con LPO”. Algunos autores17 señalan que es casi imposible diferenciar entre LPO y LLO basándonos sólo en las características histopatológicas. No obstante, existirían algunos datos sugestivos de la LLO, como un infiltrado inflamatorio más profundo desde el corion hasta la submucosa, bien en algunas áreas o en toda la muestra, y la existencia de inflamación perivascular con abundancia de células plasmáticas y neutrófilos. También es importante descartar la presencia de Candida en estas biopsias, así como evitar realizar la biopsia en las áreas ulceradas, ya que pueden provocar una acumulación secundaria de células plasmáticas y neutrófilos, y condicionar un diagnóstico erróneo17.
Criterios diagnósticos
|
LLO: lesión liquenoide oral; LPO: liquen plano oral.
En otras lesiones que recuerden al LPO, pero que no completen los criterios, deberá usarse “clínicamente compatible con”.
Cuando las características histopatológicas sean menos obvias, deberá usarse “histológicamente compatible con”. Modificado de van der Meij y van der Waal9.
En algunos casos puede resultar de ayuda la utilización de inmunofluorescencia directa, que demuestra un patrón lineal de fibrina y fibrinógeno o como depósitos globulares en la zona de la membrana basal, aunque no siempre se reconocen estos depósitos26.
Todas las biopsias de ELO que presenten datos histopatológicos de displasia epitelial en el momento del diagnóstico deben tratarse como cualquier lesión displásica oral, por lo que debe excluirse el diagnóstico de LPO o LLO, así como también el equívoco diagnóstico de “displasia liquenoide”9.
Aspectos clínicosEsta enfermedad afecta principalmente a las mujeres entre la quinta y sexta décadas de la vida. En el reciente amplio estudio de Carbone et al27, la edad media fue de 58,3 años para los varones y de 61,4 años para las mujeres.
Clínicamente, la ELO, para ser diagnosticada, debe presentar las típicas pápulas lineales blancas. En general, se consideran dos principales formas clínicas: la reticular, con pápulas blancas, y la erosivo-ulcerativa, con áreas de ulceración. Se han descrito otras presentaciones clínicas, como la forma en placa, la atrófica y la ampollar.
La forma reticular típica con pápulas blancas lineales es la más común y se caracteriza por la presencia de lesiones que forman como un encaje blanco formando una retícula (estrías de Wickham), por lo que se le denomina liquen reticular (fig. 1). Estas estrías suelen estar rodeadas por discretos halos eritematosos y constituyen un dato fundamental e imprescindible para poder hacer un diagnóstico de ELO, sea del tipo que sea4,9. La característica de las lesiones papulares lineales puede no ser evidente en algunos lugares, como el dorso de la lengua, y es común que éstas aparezcan como placas atróficas. La forma reticular generalmente no causa síntomas o una ligera sensación de tirantez en las zonas afectadas, preferentemente en la mucosa yugal o en la lengua. Es clásica la afectación de la cara dorsal de la lengua, así como los bordes, dejando la zona central sin afectación.
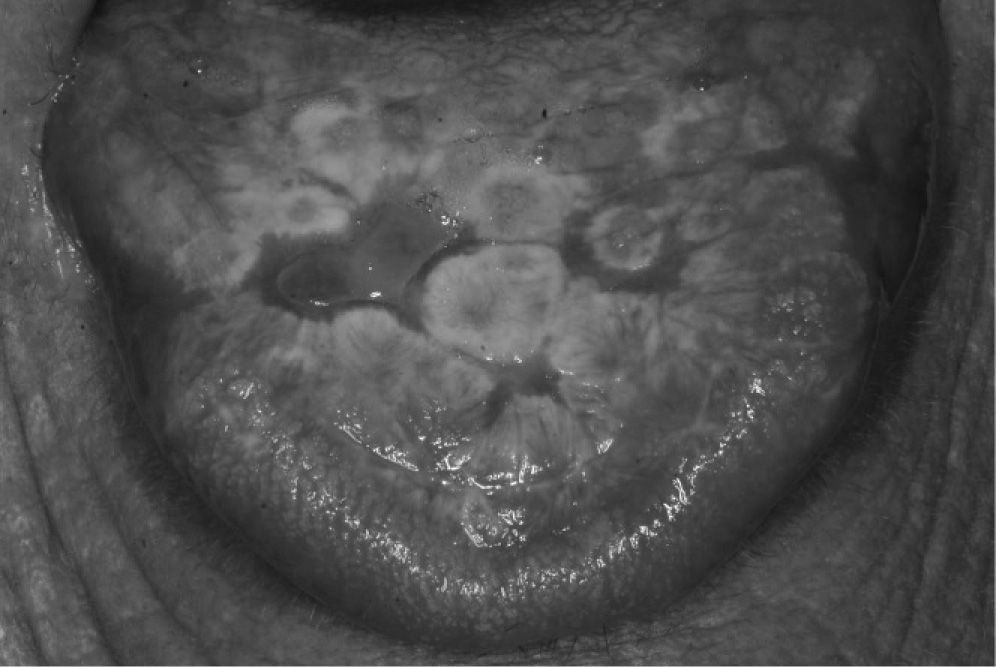
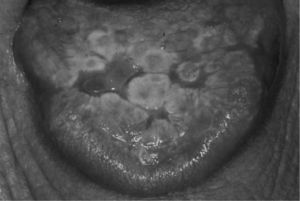
La forma erosiva-ulcerativa no es tan común como la reticular, pero es más importante para los pacientes, ya que por lo general es sintomática. Los síntomas que pueden relatar son variables y van desde una incomodidad ligera hasta un intenso dolor que interfiere con la funcionalidad bucal. Clínicamente, el liquen plano erosivo aparece como áreas maculares eritematosas y atróficas poco definidas, dispuestas en relación con pápulas blancas (fig. 3). En algunos casos se reconocen ulceraciones irregulares, preferentemente en áreas sometidas a traumatismo oclusal en la zona media yugal y en los márgenes linguales.
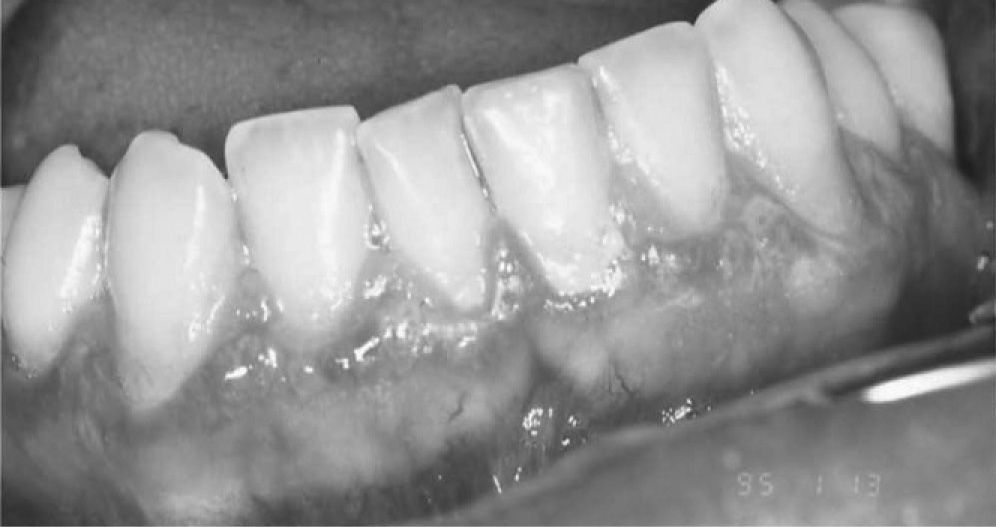
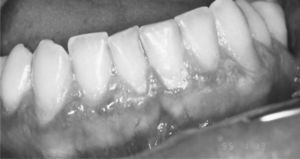
Hasta en el 50 % de los pacientes con ELO se observan lesiones atróficas y erosivas en la mucosa gingival, con un patrón clínico conocido como “gingivitis descamativa crónica” (GDC) (fig. 4)7,24. La GDC es un proceso inespecífico que puede aparecer en otras enfermedades mucocutáneas, algunas muy importantes como el penfigoide mucoso y el pénfigo vulgar28.
Los pacientes con ELO pueden presentar lesiones extraorales, como la vulvovaginal (25 % de las mujeres) o la cutánea (15 %)12. Estos casos constituirían las variantes de liquen mucoso y liquen mucocutáneo4.
Las lesiones en la piel son de pápulas de color púrpura, poligonales, pruriginosas, que por lo general afectan a la superficie de flexión de las extremidades. Un examen cuidadoso de la superficie de las pápulas cutáneas revela un reticulado fino blanco en encaje (estrías de Wickham). Otros lugares de afectación extraoral son las uñas, el cuero cabelludo, el glande y la mucosa esofágica24,29. También se han descrito casos aislados de afectación ocular, urinaria, nasal, laríngea, ótica, gástrica y de la mucosa anal29.
Las lesiones genitales del conocido como “síndrome vulvovaginal-gingival” pueden producir quemazón, dolor, secreción y dispareunia30,31. Se ha señalado que estas lesiones genitales pueden sufrir transformación maligna32. El “síndrome pene-gingival” sería el equivalente masculino de afectación plurimucosa y en el que también se ha descrito que se puede malignizar33.
Se debe realizar siempre un diagnóstico diferencial exhaustivo ante un caso de ELO, en primer lugar con el carcinoma oral de células escamosas. También debe diferenciarse del lupus eritematoso discoide, de la leucoplasia, la candidiasis crónica, el penfigoide mucoso, las lesiones de mordisqueo, el eritema multiforme, etc. Las formas en placa pueden parecerse a la leucoplasia, especialmente a la leucoplasia proliferativa24.
Un aspecto muy interesante de la ELO es su asociación a otras enfermedades sistémicas, aunque pocas hayan sido verdaderamente confirmadas. La infección por el virus de la hepatitis C (VHC) es una de las más documentadas34. Se considera incluso que los linfocitos T VHC específicos para la hepatitis C pueden tener un papel en la patogénesis de algunos casos de LPO35. La proporción de personas infectadas por el VHC fue mayor en el grupo de LPO que en el de los controles, de tal modo que los pacientes con LPO tenían alrededor de cinco veces más riesgo de estar infectados por el VHC que los controles36. La asociación con el antígeno de histocompatibilidad de clase II-DR6 en los pacientes italianos, que no aparece en los pacientes británicos, podría explicar en parte la peculiar heterogeneidad geográfica de esta asociación baja en el Reino Unido37.
Aspectos terapéuticos y pronósticosEl tratamiento de los pacientes con ELO, bien sea un LPO o una LLO, está indicado principalmente en las lesiones sintomáticas, atróficas, erosivas y ulcerativas. Aunque se han utilizado diversos tratamientos, los más usados son los agentes inmunosupresores e inmunomoduladores, tanto locales como sistémicos3,5,24. Los fármacos utilizados con mayor frecuencia para el control de las lesiones son los corticoides tópicos de mediana potencia, como el acetónido de fluocinolona y de triamcinolona en distintas concentraciones (0,1-0,5 %), o bien, en los casos más graves y recalcitrantes, los de alta potencia, como el propionato de clobetasol desde el 0,025 al 0,1 %, administrados en diferentes vehículos, como orabase, solución acuosa no alcohólica o inyecciones perilesionales3,5,38–40.
Algunos estudios5,38 señalan que los corticoides sistémicos, como la prednisona en concentraciones de 1 a 2 mg/kg/día, deberían reservarse para los brotes agudos y para los casos con lesiones múltiples extensas, ya que es más frecuente la aparición de efectos adversos asociados a la administración sistémica de estos fármacos. Además, no se ha demostrado que se obtengan mejores resultados que con los corticoides locales de alta potencia38.
El tiempo de tratamiento dependerá directamente de la efectividad de la terapia y de la evolución de las lesiones. Debido a que el control de las lesiones no se produce siempre de un modo rápido y que la recurrencia es frecuente, la administración suele ser prolongada. Una terapia mantenida con inmunosupresores se asocia a la aparición de infecciones provocadas por hongos como la candidiasis oral3,5. Por otro lado, se ha constatado en algunos estudios5 la presencia de Candida albicans hasta en un 37 % en pacientes con LPO, la cual también se asociaría a un empeoramiento de las lesiones en muchos casos. Por ello se hace imprescindible asociar a los corticoides un tratamiento antifúngico tópico, bien con nistatina o miconazol41.
La complicación más importante de todos los procesos diagnosticados como ELO es su posible transformación maligna, razón por la cual se les ha considerado como un estado precanceroso o condición premaligna2,3,42,43. Se han publicado varias series de casos en relación con la transformación maligna en esta controvertida patología. Aunque la tasa de transformación maligna varía ampliamente en la literatura científica desde un 0,4 a un 6,5 %, en la mayor parte de los estudios no supera el 1 %5,7,13,14,16,44. En la revisión realizada por Lodi et al5 sobre estudios publicados entre 1985 y 2004, con un seguimiento entre 4,5 y 7,5 años, la tasa de transformación maligna osciló entre el 0 y el 5,3 %. En el reciente trabajo de Carbone et al27, sobre 808 pacientes desarrollaron un carcinoma de células escamosas 15 pacientes, 3 varones y 12 mujeres, la mayoría en el borde lingual.
Clásicamente, se ha señalado un mayor riesgo de transformación maligna para las presentaciones clínicas llamadas “atípicas”, preferentemente las atróficas y las erosivo-ulcerativas14,45. Esta circunstancia podría estar relacionada con una mayor respuesta inflamatoria, al igual que en otras enfermedades inflamatorias crónicas asociadas al desarrollo de neoplasias malignas, como la enfermedad intestinal inflamatoria, la esofagitis crónica o la colecistitis crónica41,46,47. La inflamación crónica desempeñaría un importante papel en la posible carcinogénesis de este proceso, causando daño genético e induciendo proliferación tisular48. El aumento de citocinas y de factores de crecimiento promovería o facilitaría la carcinogénesis oral21,47,48. La inflamación crónica produciría daño oxidativo en el ADN por medio de productos derivados de enzimas inducibles por la inflamación, como la óxido nitroso sintetasa49. La ciclooxigenasa-2, enzima inducible por la inflamación, podría actuar como inhibidor de la apoptosis de los queratinocitos y por ello es facilitadora de la carcinogénesis50.
Se ha relacionando el proceso de malignización de las lesiones liquenoides con el fenómeno de “cancerización de campo”, ya que condicionaría un mayor riesgo de presentar eventos neoplásicos malignos múltiples o multifocales47.
Uno de los mayores problemas al interpretar los estudios de malignización en esta enfermedad es la inexistencia de criterios diagnósticos estrictos para diferenciar los procesos de liquen plano de los liquenoides9. En la mayoría de los estudios se han incluido tanto casos de LPO como de LLO o viceversa, por lo que es fundamental establecer criterios diagnósticos precisos clínicos e histopatológicos y poder conocer su verdadero potencial maligno4,9. El grupo holandés16 estudió 67 con LPO y 125 con LLO, siguiendo unos criterios diagnósticos previos para diferenciarlos, y durante un tiempo medio de 55,9 meses, y reconoció transformación maligna en 4 (2,1 %) pacientes, todos ellos diagnosticados como LLO. Previamente, este grupo9 había obtenido unos resultados similares, reconociendo transformación maligna en 3 pacientes diagnosticados como LLO. Estos resultados confirmarían la existencia de un mayor un riesgo en las denominadas “lesiones compatibles” diagnosticadas como LLO, lo que apoyaría la necesidad de realizar siempre una cuidadosa separación diagnóstica en estos procesos basada tanto en los datos clínicos como histopatológicos4. Al no existir todavía criterios definitivos y confiables que nos permitan determinar qué pacientes presentan un mayor riesgo de transformación maligna, los protocolos de vigilancia clínica pueden tener una gran importancia.
En la Comunidad Autónoma del País Vasco, las cifras de cáncer oral son mayores que las de otras comunidades de España, en especial entre la población masculina con una tasa de 24,1/100.00051,52 Algunos de estos carcinomas se desarrollarán desde condiciones precancerosas o premalignas como los procesos englobados en ELO. Por ello, reconocer esta patología y controlarla adecuadamente es una manera efectiva de realizar prevención efectiva del cáncer oral en nuestro medio.
FinanciaciónEste trabajo forma parte de la línea de investigación financiada por el Fondo de Investigación Sanitaria (ISCIII) PI051400 y el Departamento de Educación, Universidades e Investigación del Gobierno Vasco IT-192-07.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.